PM2.5通过TLR4/ROS途径促进多炎性小体生成诱导RAW264.7巨噬细胞凋亡和炎症反应*
王伟 黄秋阳 罗书 郑文武 冯健 叶强 郑舒展
(1.西南医科大学附属医院心血管内科 四川 泸州 646000;2.南充市中心医院心血管内科 四川 南充 637000;3.四川省泸州市生态环境监测中心站 四川 泸州 646000)
大气污染是全球性公共卫生问题,特别是直径小于或等于2.5微米的细颗粒物(Fine particulate matter,PM2.5),是大气中影响人类健康的主要物质。流行病学证据表明,PM2.5可增加心血管病的发病率和死亡率[1],大气PM2.5年平均暴露浓度每增加10 μg/m3,心血管疾病发病和死亡风险分别增加25%和16%[2],可能与其促动脉粥样硬化、破坏粥样斑块稳定性相关[3],但具体作用机制有待阐明。巨噬细胞是动脉粥样硬化过程的主要效应细胞,其在粥样斑块中的聚集数量以及分泌炎症因子是粥样斑块不稳定的主要因素[4]。已有研究显示PM2.5可直接进入循环系统,主要具有致炎效应,可被巨噬细胞的Toll样受体4(Toll like receptor 4,TLR4)识别[5],活化NF-κB途径引起炎症因子[6-7]。然而,炎症调控机制非常复杂,炎性小体以及活性氧(Reactive oxygen species, ROS)在其中扮演的角色不得而知。炎性小体是胞内多蛋白复合体,是天然免疫系统的重要组成部分,主要分为NOD样受体(NOD-like receptor,NLR)家族受体蛋白(包括不含PYD结构域的NLRC4)和非NLR家族受体蛋白AIM2等,其促进炎症因子分泌在炎症级联反应中具有重要作用[8]。由于PM2.5复杂复合物的理化特性,相关炎性小体是否参与PM2.5的致炎作用研究甚少,推测PM2.5可能通过增加巨噬细胞TLR4的表达,进而通过激活细胞内炎症小体的作用发挥促炎效应,影响巨噬细胞的凋亡,从而造成斑块的不稳定。另外,氧化应激在炎症反应中的调控作用已被证实,因此本研究将重点探讨多炎症小体及ROS在PM2.5对巨噬细胞炎症与凋亡作用中的具体影响,为阐明PM2.5在动脉粥样硬化中的致病机理提供理论基础。
1 材料与方法
1.1 主要材料与试剂 PM2.5样本采集于2020年3月~6月四川省泸州市茜草园艺路(泸州市生态环境监测中心站提供);RAW264.7细胞株(中乔新舟);ROS检测试剂盒(碧云天);ANNEXIN V- FITC/PI 凋亡检测试剂盒、TLR4抑制剂TAK242(索莱宝);胎牛血清(FBS)、高糖DMEM培养基(GIBCO);抗GAPDH、NLRC4 抗体(Abcam);抗NLRP3抗体(CST);抗NLRP1(Santa);抗AIM2抗体(Proteintech);抗Caspase1抗体(Affbiotech);Western blot实验相关试剂(ASPEN);IL-1β、IL-18、IL-10酶联免疫吸附(ELISA)检测试剂盒(ELK Biotechnology);ROS活性氧诱导剂、ROS活性氧抑制剂(Bestbio)。
1.2 方法
1.2.1 PM2.5混悬液制备 将PM2.5样本置于灭菌注射用水中,使用超声清洗器洗脱、溶解、震荡3次,每次持续40 min,将所得洗脱溶解液纱布过滤后取过滤液,12000 r/min下离心10 min,取沉淀物低温冷冻干燥获得PM2.5颗粒物,再将PM2.5颗粒超声波震荡溶于PBS溶液中,配成终浓度100 μg/mL溶液,高温蒸汽灭菌后放置于4℃冰箱中避光保存备用,使用时用PBS稀释至实验所需浓度。
1.2.2 细胞处理 使用DMEM高糖培养基+5%FBS+1%青链霉素作为RAW264.7巨噬细胞完全培养基,37℃,5%CO2孵箱中培养,当细胞贴壁长满90%时进行传代, PBS洗涤两次后使用一次性细胞刮刀将细胞轻轻刮离瓶底,1000 r/min离心3 min,取沉淀吹散混匀重置后进行传代培养。
1.2.3 实验分组 首先确定PM2.5在不同浓度和时间下对细胞活性和凋亡的影响,PM2.5浓度梯度设为0、25、50、75和100 μg/mL;时间梯度上设6、12、18、24、36和48 h。再将细胞分成空白对照组、PM2.5组、PM2.5+TKA242组、PM2.5+ROS(-)组、PM2.5+ROS(+)组,其中空白对照组按1∶1加入等量PBS,PM2.5组加入PM2.5悬液,PM2.5+TKA242组加入PM2.5悬液和TLR4抑制剂TKA242(40 μmol/L),PM2.5+ROS(-)组加入PM2.5悬液和ROS抑制剂(1∶500),PM2.5+ROS(+)组加入PM2.5悬液和ROS激动剂(1∶1000),培养适当时间。
1.2.4 CCK8细胞活性检测 取对数期细胞接种在96孔板上继续培养,每组予以相应干预后再向每孔加入10μL的CCK-8溶液,再在37℃,5%CO2孵箱中培养2 h,使用酶标仪测定在450 nm的吸光度。
1.2.5 细胞凋亡率检测 向24孔板中加入PBS洗涤细胞,一次性细胞刮刀将细胞轻轻刮离瓶底,300 r/min离心10 min弃上清,按照ANNEXIN V- FITC/PI 凋亡检测试剂盒说明书用Binding Buffer重悬2次并稀释细胞至1×106个/mL,Annexin V-FITC避光染色10 min,然后PI避光孵育5 min,1 h内流式细胞仪检测凋亡率。
1.2.6 ROS检测 取各组处理好的细胞用无血清细胞培养液洗涤后,按照ROS检测试剂盒说明书加入10 μmol/L的DCFH-DA,37℃下孵育20 min,再用无血清细胞培养液洗涤细胞3次,在488 nm波长下使用酶标仪检测样品吸光度。
1.2.7 Western blot检测蛋白表达 使用RIPA裂解液裂解细胞提取蛋白,用BCA蛋白浓度测定试剂盒测定蛋白浓度,SDS-PAGE凝胶分离后进行转膜,5% 脱脂牛奶封闭膜,加入一抗[TLR4、NLRP1(1∶500); NLRP3、NLRC4、AIM2、Caspase-1(1∶1000)],4℃侧摆摇床上缓慢摇动孵育过夜,再加入二抗稀释液室温孵育2 h,用电化学发光液对蛋白印迹条带进行显影,使用AlphaEase-FC软件分析目标条带的灰度值。
1.2.8 ELISA检测 取各组处理后的细胞培养上清液500 μL,4℃下3500 r/min离心10 min,取上清液,稀释后按照ELISA试剂盒说明书检测IL-1β、IL-18、IL-10浓度,首先梯度稀释标准品,以标准品浓度及对应OD值绘制标准曲线,然后检测样品并通过回归方程计算样本细胞因子浓度,并乘以稀释倍数,即得各组织样本浓度。
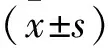
2 结果
2.1 PM2.5抑制RAW264.7巨噬细胞活性 实验证实PM2.5对RAW264.7巨噬细胞活性的影响呈时间、剂量依赖性,即暴露24 h后PM2.5的浓度越高RAW264.7细胞的活性越低(P<0.05),同时在相同的PM2.5浓度(50 μg/mL)作用下,细胞的活性随着PM2.5作用时间的延长而降低(P<0.05)。见图1。

图1 不同PM2.5浓度及干预时间对巨噬细胞活性的影响(n=4)
2.2 PM2.5促进巨噬细胞的凋亡 50 μg/mL的PM2.5刺激24 h后,PM2.5组较空白对照组有更高的凋亡率(P<0.05),表明PM2.5可促进巨噬细胞的凋亡,而在PM2.5+TKA242组抑制TLR4、PM2.5+ROS(-)组抑制ROS后凋亡率低于PM2.5组(P<0.05),而激活ROS的PM2.5+ROS(+)组凋亡率则比PM2.5组明显上升(P<0.05),提示PM2.5可能通过TLR4、ROS相关机制促进巨噬细胞凋亡。见图2。
2.3 PM2.5增加多炎性小体的表达以及促炎因子释放 Western blot 显示PM2.5组相较于空白对照组检测出NLRP1、NLRP3、NLRC4、AIM2四种炎性小体表达升高(P<0.05),Caspase-1表达也明显增高(P<0.05),同时ELISA显示PM2.5组相对于空白对照组促炎因子IL-1β、IL-18分泌增加(P<0.05),而抑炎因子IL-10则减少(P<0.05),提示PM2.5促进多炎性小体表达并促进炎性因子释放。见图3。
2.4 PM2.5通过TLR4激活多炎性小体促进炎性因子释放 相对于空白对照组,PM2.5组检测到TLR4的高表达 (P<0.05),而使用TLR4抑制剂TKA242抑制TLR4后NLRP1、NLRP3、NLRC4、AIM2四种炎性小体表达较PM2.5组下降,Caspase-1表达也降低 (P<0.05),ELISA显示PM2.5+TKA242组较PM2.5组促炎因子IL-1β、IL-18的分泌减少(P<0.05)。见图4。

图2 各组RAW264.7巨噬细胞凋亡率变化(n=3)

图3 PM2.5干预下炎性小体表达(A)以及细胞因子分泌(B)情况(n=3)

图4 PM2.5通过TLR4激活多炎性小体(A)促进炎性因子释放(B)(n=3)
2.5 ROS在PM2.5促巨噬细胞炎症反应和凋亡的作用 PM2.5组ROS水平明显高于空白对照组(P<0.05),抑制TLR4后ROS水平较PM2.5组降低(P<0.05)(图5),提示PM2.5可通过TLR4促进ROS的生成。与PM2.5组比较,加入ROS抑制剂的PM2.5+ROS(-)组NLRP1、NLRP3、NLRC4、AIM2四种炎性小体表达下降,TLR4、Caspase-1表达降低(P<0.05),促炎因子IL-1β、IL-18的分泌也减少,而PM2.5+ROS(+)组加用ROS激动剂后则表现出相反的结果,见图6。

图5 各组巨噬细胞内ROS相对水平(n=3)
3 讨论
当前大气环境污染备受全球关注,其中PM2.5与人类疾病密切相关,临床研究发现暴露于PM2.5中会导致心肌梗死发生率上升[9],动物实验也提示暴露于PM2.5会损伤心肌、增加粥样斑块的易损性[10-11],而在动脉粥样硬化斑块的形成和稳定过程中巨噬细胞来源的泡沫细胞在血管壁的堆积至关重要[4]。PM2.5经呼吸道通过肺毛细血管进入血液循环[12],可改变循环系统的氧化应激状态和炎性水平,引起系统性炎症反应[13]。
炎性小体激活后调节caspase-1的活化,促使多种细胞因子产生,可刺激巨噬细胞分泌促炎因子和趋化因子,因而具有炎症放大效应[14]。NLRP1、NLRP3、NLRC4、AIM2是目前研究最多的炎性小体,在调节炎症因子产生过程中具有独立或者协同的作用[8]。其中,NLRP3的活化可造成粥样斑块的不稳定,有研究发现NLPR3可被PM2.5激活[15],但是PM2.5成分复杂[16],除了NLRP3,PM2.5能否激活其他炎性小体尚无相关研究。本实验观察到PM2.5作用于巨噬细胞后四种炎性小体表达均增加,caspase-1表达增高,促炎因子IL-1β、IL-18分泌增加,炎症抑制因子IL-10减少,提示PM2.5可通过激活多种炎性小体从而促进巨噬细胞的炎症效应,但是在此过程中是否存在激活多炎性小体的共同位点需要进一步研究。

图6 ROS影响下各组炎性小体表达(A)以及细胞因子分泌(B)情况(n=3)
巨噬细胞凋亡贯穿于整个动脉粥样硬化病理过程[16],早期斑块中巨噬细胞凋亡的增加利于抑制泡沫细胞形成,而晚期粥样斑块中巨噬细胞凋亡则会促使坏死核心形成[17],并且触发NLRP3活化加速动脉粥样硬化发展[18]。本实验观察到PM2.5能够促进巨噬细胞的凋亡。TLR4是识别病原体高度保守结构基序的主要受体,在AS的发生发展中的作用极其重要。同时,氧化损伤与炎症反应都是引起内皮功能紊乱和促进动脉粥样硬化斑块发展的公认的重要因素[16],研究发现PM2.5可通过理化特性和经代谢生成的ROS影响细胞[19],而ROS也能引起炎性小体的激活、聚集[20],ROS的产生也会促进TLR4的表达,使TLR4介导的氧化应激反应效应增强[16]。目前关于PM2.5对二者的共同影响鲜有报道。本研究观察到PM2.5可刺激巨噬细胞ROS的产生,TLR4抑制剂可抑制PM2.5对ROS的升高作用,表明PM2.5通过TLR4介导巨噬细胞ROS的生成;另一方面,使用ROS抑制剂也可削弱PM2.5对TLR4的上调作用,而加入ROS激动剂则进一步增加TLR4的表达,表明ROS作为 PM2.5作用于TLR4后的产物分子可正反馈TLR4的表达,通过上调TLR4的表达进一步促进PM2.5的致炎作用。另外,ROS激动剂可进一步增加PM2.5促多炎症小体的表达和炎性因子的分泌作用,而ROS抑制剂则削弱PM2.5的致炎效应,说明PM2.5可能通过TLR4/ROS途径促进巨噬细胞炎症反应和凋亡过程。
由于不同区域的PM2.5在成分上可能存在区别,对机体的影响可能存在差异,没有采集多区域的PM2.5样本进行平行实验是本实验的不足之处,同时本实验为体外实验,未在原始细胞中进行实验,可能与人体内病理过程存在区别,因此下一步研究可观察PM2.5对体内动脉粥样硬化过程的影响及对巨噬细胞炎症反应的机制探讨。
4 结论
PM2.5可通过TLR4受体增加多炎性小体的表达,同时增加ROS的水平促进RAW264.7巨噬细胞凋亡和炎症反应。

