国产注射剂中注射用辅料使用现状及问题分析
王 萍, 陈新国, 高正松, 王保成, 宋民宪*, 张海燕*
(1.江西中医药大学现代中药制剂教育部重点实验室,江西 南昌 330004;2.南京威尔药业集团股份有限公司,江苏 南京 210009)
药智网(https://www.yaozh.com/)统计结果表明,国产注射剂中使用辅料约300种。本文对注射用辅料在2020年版《中国药典》和国家药品监督管理局药品审评中心药用辅料备案平台(https://www.cde.org.cn/)中的收载情况,以及国产注射剂有使用但无注射用标准的辅料品种进行归纳梳理,指出目前注射剂药品说明书中辅料标注存在的不足以及注射用辅料需要解决的问题,并针对这些问题依照相关法律法规要求提出思考与建议,以期促进注射用辅料行业的持续健康发展。
1 国产注射剂中使用辅料标准收载情况
1.1 2020年版《中国药典》收载的注射用辅料 2020年版《中国药典》四部收载药用辅料共335种,其中注射用辅料品种共13个,包括注明为“供注射用”的12个品种,分别为大豆油、大豆磷脂、甘油、丙二醇、丙交酯乙交酯共聚物(5050)、丙交酯乙交酯共聚物(7525)、丙交酯乙交酯共聚物(8515)、活性炭、蛋黄卵磷脂、氯化钠、聚乙二醇300、聚乙二醇400,名称未标注“供注射用”字样的聚山梨酯80(Ⅱ),也为注射级辅料,与2015年版《中国药典》收载的聚山梨酯80(供注射用)仅名称书写上的区别。
1.2 辅料备案平台收载的注射用辅料 截至2021年8月15日,在国家药品监督管理局药品审评中心药用辅料备案平台中查询到已登记注明为供注射用的辅料信息173条,品种总数共60种,参考辅料工具书[1-2]和文献[3-7]报道,将其按照药剂学用途进行归纳分类,结果见表1。
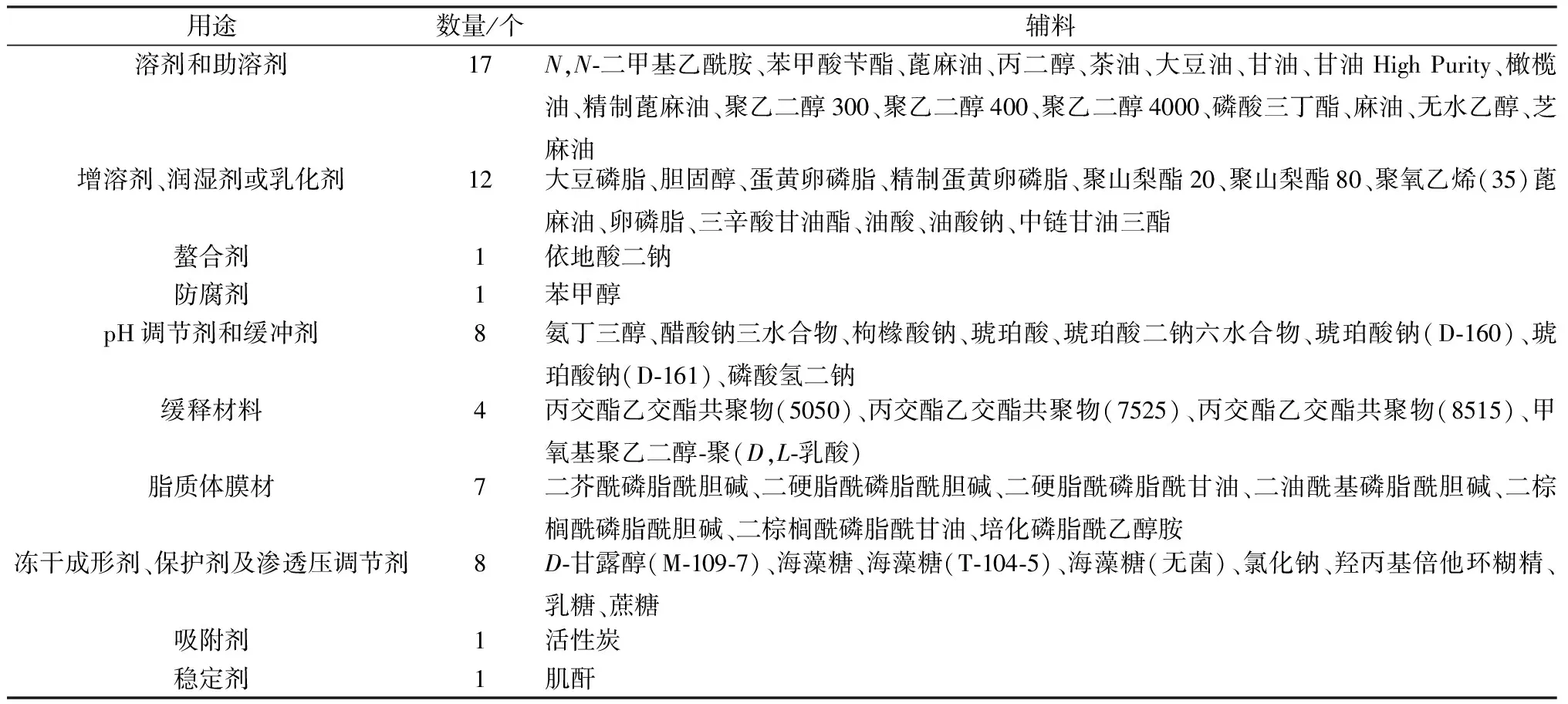
表1 备案注射用辅料信息
1.3 国产注射剂有使用但无注射用标准的辅料 将药智网上查询到的国产注射剂中使用的辅料,与药品审评中心辅料备案平台上已备案的注射用辅料以及2020年版《中国药典》中收载的注射用辅料进行对比分析,得到国产注射剂中有使用,但没有备案且药典未收载的辅料有170个,结果见表2。
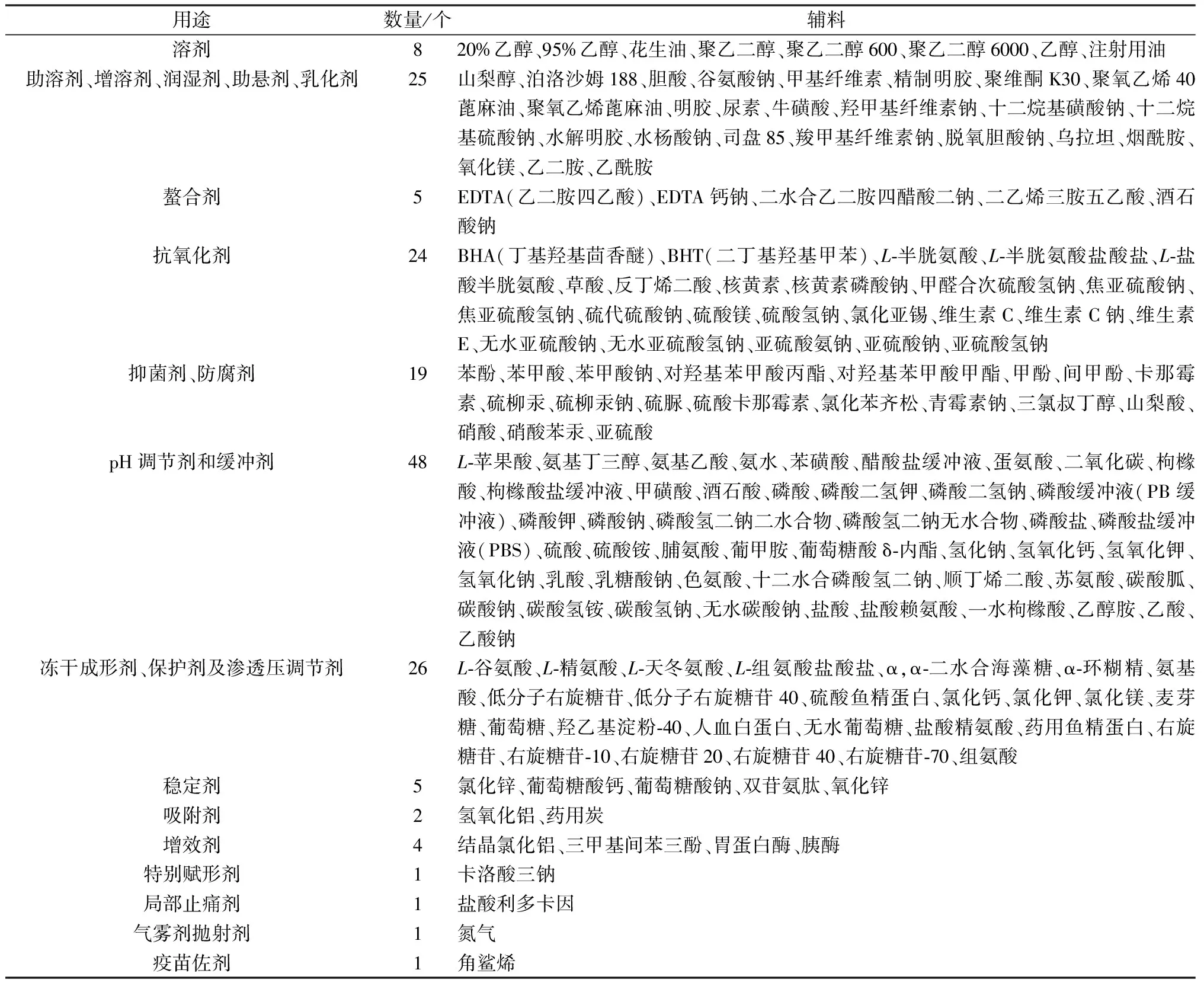
表2 国产注射剂有使用但无注射用标准的辅料
2 注射剂药品说明书辅料标注存在的问题
2.1 未反映出所使用辅料的级别 2020年版《中国药典》药用辅料通则[8]规定,《中国药典》收载的药用辅料标准是对其质量控制的基本标准,对于声称符合《中国药典》的药用辅料必须执行《中国药典》的相应标准。原国家食品药品监督管理局2008年1月发布的《化学药品注射剂基本技术要求(试行)》(国食药监注[2008]7号)[9]关于上市后药品改变辅料要求“注射剂经批准上市后,如需更改辅料的相关内容,例如生产商或质量标准等,应按补充申请进行申报”。药智网上查询到注射剂的药品说明书中,除注射用水以外,其他辅料几乎均未标明为注射用,例如依达拉奉注射液[海南先声药业有限公司(辅料为丙二醇,焦亚硫酸钠)]。2020年版《中国药典》及辅料备案平台上的名称为丙二醇(供注射用),而说明书为丙二醇,且在药品审评中也未查到辅料变更的补充申请。
既然有注射用的标准,就应当将非注射级的丙二醇变更为注射级,且注明为供注射用,才能体现注射用标准的意义。
2.2 同一品种辅料处方不同 同一注射剂品种不同企业所用辅料配方不同的情况普遍存在。如注射用水溶性维生素,20家生产企业中,有14家所用辅料为甘氨酸、乙二胺四醋酸二钠、对羟基苯甲酸甲酯,4家为甘氨酸、乙二胺四醋酸二钠,1家为盐酸半胱氨酸、甘氨酸、乙二胺四醋酸二钠、对羟基苯甲酸甲酯,1家为乙醇、甘露醇、聚山梨酯80。又如依达拉奉注射液,有34份批文,涉及药品上市许可持有人32个,检索到的药品说明书来自于17个药品上市许可持有人。除海南先声药业有限公司的依达拉奉注射液说明书中标注使用丙二醇,其他企业均未使用丙二醇,如吉林省博大制药股份有限公司,辅料为焦亚硫酸钠、盐酸半胱氨酸,无丙二醇,并且依达拉奉注射液原研厂是日本,辅料中也未使用丙二醇。按照《化学药品注射剂基本技术要求》关于辅料选用的基本原则为①应采用符合注射用要求的辅料;②在满足需要的前提下,注射剂所用辅料的种类及用量应尽可能少;③应尽可能采用注射剂常用辅料[9]。因此,海南先声药业有限公司在依达拉奉注射液中使用丙二醇的作用和依据理应说明。
2.3 未使用2020年版《中国药典》名称 许多药品说明书中标注的辅料名称未按2020年版《中国药典》名称统一规范化书写。如注射用水溶性维生素药品说明书中所示辅料乙二胺四醋酸二钠、对羟基苯甲酸甲酯,均未使用2020年版《中国药典》名称,应修改为对应的通用名依地酸二钠[10]、羟苯甲酯[11]。
2.4 未反映出质量区别 注射用水溶性维生素药品说明书中所用辅料聚山梨酯80,可分为聚山梨酯80和聚山梨酯80(Ⅱ),2020年版《中国药典》已明确区别,聚山梨酯80是以油酸山梨坦为原料合成,含油酸应不低于58.0%,含肉豆蔻酸、棕榈酸、棕榈油酸、硬脂酸、亚油酸、亚麻酸分别不得过5.0%、16.0%、8.0%、6.0%、18.0%、4.0%,无“细菌内毒素”检查项;而聚山梨酯80(Ⅱ)(2020年版《中国药典》)即为聚山梨酯80(供注射用)(2015年版《中国药典》)的更名,是以植物来源油酸山梨坦为原料合成,含油酸应不低于98.0%,含肉豆蔻酸、棕榈酸、棕榈油酸、硬脂酸、亚油酸、亚麻酸均不得超过0.5%,有“细菌内毒素”检查项,依法检查(通则1143),每l mg聚山梨酯80中含内毒素的量应小于0.012 EU[12]。在注射用水溶性维生素药品说明书中聚山梨酯80和聚山梨酯80(Ⅱ)未对作进行区分,没有反映出质量区别。
2.5 未标注辅料用量 大部分国产注射剂说明书中未注明辅料的用量。如注射用氯诺昔康,国产注射用氯诺昔康说明书中辅料为甘露醇、氨丁三醇、依地酸二钠,进口注射用氯诺昔康说明书中辅料为100 mg甘露醇、12 mg氨基丁三醇、0.2 mg乙二胺四乙酸钠。注明辅料的用量能更好的保障药品在临床使用的安全性。研究发现,过度注射含有丙二醇的注射剂会致使丙二醇蓄积,导致患者出现急性中毒及死亡[13]。所以药用辅料的使用量和浓度,不良反应和使用禁忌有必要在说明书中体现。
2.6 未对辅料不良反应予以警示 部分注射剂说明书未对辅料的不良反应予以警示。国家食品药品监督管理局令第24号《药品说明书和标签管理规定》[14]中第11条规定“药品处方中含有可能引起严重不良反应的成分或者辅料的,应当予以说明”。如注射用水溶性维生素,辅料为甘氨酸、依地酸二钠(乙二胺四醋酸二钠)、羟苯甲酯(对羟基苯甲酸甲酯)、盐酸半胱氨酸,说明书中警示内容为对本品中任何成分过敏的患者,使用时均可能发生过敏反应。又如复方盐酸阿替卡因注射液、阿替卡因肾上腺素注射液、盐酸甲哌卡因肾上腺素注射液中均使用相同的辅料焦亚硫酸钠,说明书中不良反应均指明,本品含有的焦亚硫酸盐可能引起过敏反应或加重过敏反应。
3 注射用辅料需要提高和解决的问题
3.1 进一步明确注射用辅料的要求 2020年版《中国药典》四部注射剂通则要求检查项包括“可见异物”“不溶性微粒”“无菌”“细菌内毒素”“热原”等[15],但关于注射用辅料的标准并不系统,如药用辅料通则中仅写道“药用辅料的残留溶剂应符合要求”“药用辅料的微生物限度应符合要求”“用于无除菌工艺的无菌制剂的药用辅料应符合无菌要求(通则1101)”“用于静脉用注射剂、冲洗剂等的药用辅料照细菌内毒素检查法(通则1143)或热原检查法(通则1142)检查,应符合规定”。各注射用辅料标注的检查项不相同,如聚山梨酯80(Ⅱ)中有细菌内毒素检查,无微生物限度检查;而蛋黄卵磷脂(供注射用)中既有细菌内毒素检查(每1 g中含内毒素的量应小于2.0 EU),也有微生物限度检查(每1 g供试品中需氧菌总数不得过102 cfu,霉菌和酵母菌总数不得过102 cfu,不得检出大肠埃希菌;每10 g供试品中不得检出沙门菌)[16]。蛋黄卵磷脂需要做微生物限度检查的原因是其易产生细菌,而例如氯化钠等无机物类辅料,不易产生细菌,则只需做重金属及有害元素残留量等检查。考虑到注射用辅料的特殊性和复杂性,应针对注射用辅料单独列1个通则,进一步明确注射用辅料的要求,注明哪些辅料需要进行哪类检查项目。
3.2 有注射用国家标准的必须使用,有备案的有条件使用 必须使用注射用辅料的条件为有药品标准、有备案信息且对备案企业审计符合要求。按《药品管理法》第45条[17]规定“生产药品所需的原料、辅料,应当符合药用要求、药品生产质量管理规范的有关要求。生产药品应当按照规定对供应原料、辅料等的供应商进行审核,保证购进、使用的原料、辅料等符合前款规定要求”。另外,《化学药品注射剂基本技术要求》[9]中规定“使用已批准上市的注射用辅料,应提供辅料来源及质量控制的详细资料,包括生产企业、执行的质量标准、检验报告、购买发票、供货协议等”。故并非备案,就一定要使用,还需进行供应商审核,生产条件、质量保证、产能保证也是必不可少的。
3.3 提高纯度、降低杂质 《化学药品注射剂基本技术要求》[9]中规定“对于注射剂中有使用依据,但尚无符合注射用标准产品生产或进口的辅料,可对非注射途经辅料进行精制使其符合注射用要求,并制定内控标准。申报资料中应提供详细的精制工艺及其选择依据、内控标准的制定依据。必要时还应进行相关的安全性试验研究”。例如氢氧化钠,在注射剂有使用但尚无注射用标准,作为常用的pH调节剂,其氯化物检查要求过高,“取本品0.50 g,依法检查(通则0801),与标准氯化钠溶液2.5 mL制成的对照液比较,不得更浓(0.005%)”[18],但一般药厂不具备该技术,难以纯化,对于酸碱这种难处理的无机物,是否可以考虑使用分析纯或化学纯作为辅料使用。
3.4 依法公开注射剂药品说明书 按照《药品说明书和标签管理规定》(局令第24号)[14]第11条中规定“药品说明书应当列出全部活性成分或者组方中的全部中药药味。注射剂和非处方药还应当列出所用的全部辅料名称。药品处方中含有可能引起严重不良反应的成分或者辅料的,应当予以说明”。
3.5 简化已上市注射剂使用注射级辅料的变更 现有管理制度下,注射用辅料的补充和变更的要求不够清晰,应尽快完善药用辅料变更相关管理制度,以促进制药企业的工艺优化[19]。对于已证明可行且处方一样的情况,如有注射用标准也被激活,在注射剂中有应用的辅料,可以简化辅料变更相关流程,提高企业改良的积极性,有利于促进辅料和制剂行业持续健康发展。
4 总结
目前,已有国家标准、备案的注射用辅料占国产注射剂中已经使用的辅料的比例不高,注射剂药品说明书中辅料标注也存在不足,包括未反映出所使用辅料的级别,同一品种辅料处方不同,未使用2020年版《中国药典》名称,未反映出质量区别,未标注辅料用量,未对辅料不良反应予以警示等。因此,需进一步加强注射用辅料的管理,明确注射用辅料的要求,依法公开注射剂药品说明书,简化已上市注射剂使用注射级辅料的变更,鼓励企业快速使用注射级辅料,形成全行业良性循环的发展态势。

