非编码RNA在胃癌糖酵解中作用的研究进展
凌晖, 李维, 熊逸苇, 颜丽莎, 张淑榆
(南华大学衡阳医学院 1.肿瘤研究所,2.2018级临床医学系,3.2019级临床医学系,湖南省衡阳市 421001)
胃癌是全球范围内的一种重要癌症,多数胃癌患者到晚期才能被确诊,且预后较差[1]。癌细胞较正常细胞代谢更活跃,增殖率更高,能抗凋亡。实体肿瘤的主要代谢表型,从线粒体氧化到糖酵解被称为有氧糖酵解。有氧糖酵解可促进肿瘤的发生、侵袭、血管生成和远处转移[2]。抑制有氧糖酵解可能是一种很有前途的抗肿瘤治疗方式。
非编码RNA(ncRNA)分为小核仁RNA(SnoRNA)、微小RNA(miRNA)、环状RNA(circRNA)和长链非编码RNA(lncRNA),其中主要是miRNA、lncRNA和circRNA在葡萄糖代谢重编程过程中起着关键作用[3-5]。研究表明,lncRNA、circRNA可直接或通过与miRNA竞争作为竞争性内源性RNA(ceRNA),调控靶基因的表达,进一步调节胃癌糖酵解[4-5]。本文重点综述了与糖酵解途径相关ncRNA在胃癌中的最新研究进展。
1 miRNA调控胃癌糖酵解
1.1 miRNA调控糖酵解相关酶
miR-513a3p调控己糖激酶2(HK2)抑制胃癌细胞增殖和糖酵解[3]。miR-646靶向6磷酸果糖激酶2(PFKFB2)调节胃癌细胞生长[6]。研究表明,丙酮酸激酶M2(PKM2)是miR-326-3p/miR-330-5p的靶点之一,PKM2作为有氧糖酵解途径中的限速酶,加速胃癌细胞的葡萄糖摄取,提高细胞活力[7]。丙酮酸脱氢酶激酶1(PDK1)是miR-4290的靶点,PDK1过表达增强有氧糖酵解和胃癌增殖[8]。研究发现,miR-34a可以调节乳酸脱氢酶A(LDHA)来控制糖酵解[4]。
1.2 miRNA调控转录因子
转录因子(HIF-1α)影响糖酵解过程,被鉴定为miR-138-5p的靶基因,可能参与调节低氧诱导的5-FU耐药[5]。miR-12116在胃癌细胞中通过与转录因子CMTM2相互作用,参与了LINC01391对细胞迁移、侵袭和有氧糖酵解的抑制作用[9]。miR-195通过转录因子CREB1对胃癌细胞糖酵解和凋亡起调控作用[10]。circUBE2Q2/miR-370-3p轴可通过STAT3促进胃癌恶性进展[11]。
1.3 其他
miRNA通过改变蛋白激酶如PRKAA1[12]、MAPK1[13]、肿瘤转移相关基因MYH9的表达来调节胃癌的糖酵解[14]。miR-139-5p通过调节PRKAA1的表达来抑制糖酵解[12]。抑制miR-665可通过负调节MAPK1以消除芍药醇对阿帕替尼耐药的胃癌细胞恶性表型的抑制作用[13]。胃癌组织中MYH9表达与miR-186-5p表达呈负相关,MYH9与细胞增殖和迁移能力、糖酵解酶密切相关[14]。
2 lncRNA调控胃癌糖酵解
2.1 lncRNA调节糖酵解相关酶
lncRNA H19通过microRNA-519d-3p/LDHA轴激活有氧糖酵解,进而促进胃癌细胞的增殖和免疫逃逸[15]。lncRNA-SNHG7干扰miR-34a上调LDHA的表达从而降低胃癌细胞对顺铂的敏感性[4]。lncRNA HAGLR海绵吸附miR-338-3p通过靶向LDHA-糖酵解途径促进胃癌的5-FU耐药[16]。lncRNA Dlx6反义RNA1(DLX6-AS1)在胃癌组织和胃癌细胞系中高表达,通过靶向miR-4290和PDK1调控胃癌糖代谢和细胞生长[8]。LINC00242通过调节miR-1-3p/G6PD轴,促进有氧糖酵解,从而诱导胃癌细胞增殖[17]。
2.2 lncRNA调节转录因子
lncRNA可通过调控转录因子如HIFs[18]、CMTM2[9]、CREB1[10]等的表达影响糖酵解途径和胃癌的进展。Xu等[18]发现,HIF-3A是HIF-1的靶基因,lncRNA HAND2-AS1通过调节miR-184/HIF3A信号通路抑制缺氧诱导的胃癌细胞增殖、迁移和侵袭能力及糖酵解过程。研究发现,LINC01391通过靶向miR-12116/CMTM2轴抑制胃癌有氧糖酵解和肿瘤形成[9]。Yan等[10]研究表明,IGF2-AS敲低作为miR-195的分子海绵调控CREB1表达,从而抑制糖酵解并促进胃癌细胞凋亡。
2.3 其他
lncRNA还能调节蛋白激酶如PRKAA1[12]、MAPK1[13]等,进而调控胃癌糖酵解过程。Sun等[12]揭示LINC00152/miR-139-5p通过靶向PRKAA1调控胃癌细胞的有氧糖酵解。Li等[13]表明LINC00665/miR-665靶向MAPK1参与丹皮酚逆转胃癌细胞帕替尼耐药的过程。
3 circRNA调控胃癌糖酵解
3.1 circRNA调节糖酵解相关酶
敲除CircBFAR通过调节miR-513a-3p/HK2轴抑制胃癌细胞增殖和糖酵解[3]。circATP2B1降低miR-326-3p/miR-330-5p对PKM2的抑制作用,从而促进胃癌细胞的有氧糖酵解和增殖[7]。CircFLNA作为miR-646的海绵通过靶向PFKFB2促进胃癌的增殖、转移、糖酵解和抑制凋亡[6]。
3.2 circRNA调节转录因子
circRNA可调节转录因子HIFs[5]、STAT3[11]等依赖的糖酵解。研究发现,circNRIP1作为miR-138-5p海绵,通过调节HIF-1α依赖的糖酵解来增强缺氧诱导的对5-FU的抗性[5]。Yang等[11]阐明circUBE2Q2通过调节STAT3介导的自噬和糖酵解,促进胃癌的恶性进展。
3.3 其他
circRNA通过调控蛋白激酶等依赖的糖酵解在胃癌中发挥促癌作用。Liu等[14]发现,circ-NRIP1通过miR-186-5p调节MYH9,加速糖酵解和胃癌进展。Chen等[19]表明,circC6orf132作为miR-873-5p海绵,上调PRKAA1表达从而发挥促癌作用。相反,有些circRNA通过调控抑癌基因、受体蛋白等发挥抑癌作用。蔡娟等[20]研究提示,circSMARCA5通过竞争性结合miR-4295上调PTEN表达,调控细胞糖酵解,从而抑制胃癌细胞的增殖和侵袭。Zheng等[21]揭示,circ_0003159通过直接结合miR-221-3p/miR-222-3p来富集LIFR的水平,从而发挥抑癌效果。
4 糖酵解相关的ceRNA网络
4.1 lncRNA-miRNA-mRNA功能网络
有些lncRNA-miRNA-mRNA功能网络调控糖酵解在胃癌中发挥促癌作用[4,16]。lncRNA SNHG7/miR-34a/LDHA-糖酵解轴介导顺铂耐药[4];lncRNA HAGLR海绵miR-338-3p靶向LDHA-糖酵解途径促进胃癌对5-FU耐药[16];lncRNA H19/microRNA-519d-3p/LDHA[15]、DLX6-AS1/miR-4290/PDK1[8]、LINC00242/miR-1-3p/G6PD[17]、LINC00152/miR-139-5p/PRKAA1[12]等lncRNA-miRNA-mRNA功能网络均通过刺激有氧糖酵解,从而诱导胃癌细胞的增殖;IGF2-AS靶向miR-195/CREB1轴促进糖酵解,抑制胃癌细胞凋亡[10](表1)。然而有些lncRNA-miRNA-mRNA功能网络调控糖酵解在胃癌中发挥抑癌作用,HAND2-AS1充当miRNA海绵作用抑制胃腺癌细胞增殖和有氧糖酵解[18];lncRNA LINC01391靶向miR-12116/CMTM2轴抑制有氧糖酵解,最终逆转胃癌发生[9];丹皮酚通过LINC00665/miR-665/MAPK1轴抑制阿帕替尼耐药胃癌细胞的恶性增殖[13](表1)。

表1 lncRNA作为胃癌糖酵解中ceRNA的作用机制
4.2 circRNA-miRNA-mRNA功能网络
胃癌中多数调节糖酵解的circRNA-miRNA-mRNA功能网络具有发挥促癌作用[3],如circBFAR/miR-513a-3p/HK2[3]、circFLNA/miR-646/PFKFB2[6]、circATP2B1/miR-326基因簇[7]、circ-NRIP1/miR-186-5p/MYH9[14]等可提高胃癌增殖能力;circNRIP1海绵miR-138-5p通过HIF-1α依赖的葡萄糖代谢维持缺氧诱导的对5-氟尿嘧啶的耐药[5];circ_0006089/miR-361-3p/TGFB1[22]等促进胃癌侵袭和转移。circRNA UBE2Q2/miR-370-3p/STAT3[11]、circC60rf132/miR-873-5p/PRKAA1[19]等加速了胃癌的进展(表2)。然而,也有些circRNA-miRNA-mRNA功能网络发挥着抑癌作用,如circSMARCA5通过miR-4295/PTEN轴调控糖酵解抑制胃癌细胞增殖和侵袭[20]。circ_0003159通过竞争性地与miR-221-3p/miR-222-3p结合,上调LIFR的表达,从而阻断胃癌的发生发展[21](表2)。
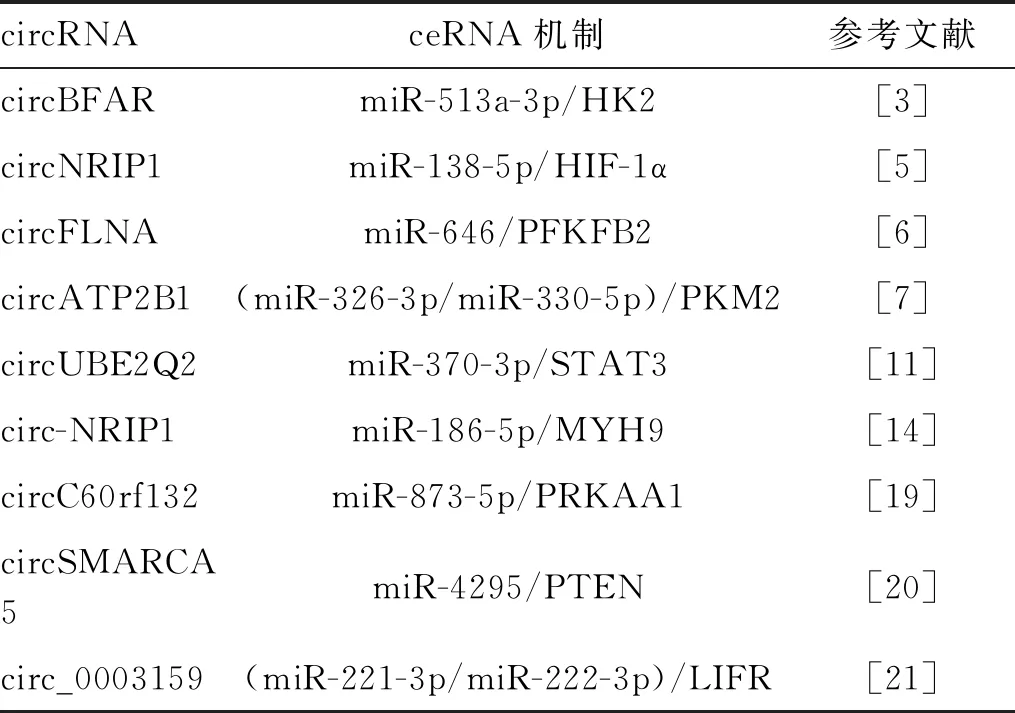
表2 circRNA作为胃癌糖酵解中ceRNA的作用机制
5 糖酵解相关ncRNA在胃癌中的临床应用前景
5.1 miRNA
miRNA在许多癌症类型中都存在失调状态,可能成为潜在的治疗靶点。研究发现,miR-34a[4]、miR-665[13]等参与lncRNA调控胃癌的化疗耐药。miR-30a-5p通过靶向URGCP基因抑制胃癌细胞生长和糖酵解,可作为未来胃癌治疗的新靶点[23]。
5.2 lncRNA
lncRNA SNHG7[4]、HAGLR[16]、LINC00665[13]等lncRNA参与胃癌糖酵解的化疗耐药调控。lncRNA SNHG7通过miR-34a/LDHA-糖酵解轴介导胃癌的顺铂耐药[4]。lncRNA HAGLR海绵miR-338-3p通过靶向LDHA-糖酵解途径促进胃癌对5-FU耐药[16]。丹皮酚可能是一种潜在的逆转胃癌阿替尼耐药的药物,其机制与LINC00665/miR-665/MAPK1轴密切相关[13]。LINC01391与胃癌患者预后相关,可成为胃癌的潜在治疗靶点[9]。H19[15]、DLX6-AS1[8]、LINC00242[17]、IGF2-AS[10]和LINC00152[12]在胃癌中起促癌作用,而HAND2-AS1[18]起抑癌作用,均有成为胃癌患者治疗靶标的潜力。
5.3 circRNA
研究circRNA与胃癌的关系,有助于进一步阐明胃癌的发生机制,有望为胃癌的靶向治疗提供新的思路。靶向circNRIP1联合5-FU治疗可显著改善胃癌患者的预后[5]。circUBE2Q2可能与胃癌预后有关[11],circBFAR[3]、circFLNA[6]、circATP2B1[7]、circ-NRIP1[14]、circC60rf132[19]、circ_0006089[22]等在胃癌中发挥了促癌作用,而circSMARCA5[20]、circ_0003159[21]等具有抑癌功能,以上circRNA都可能是胃癌治疗的潜在生物标志物和靶点。
6 总结与展望
葡萄糖是人体正常代谢时必需的营养成分,也是癌细胞的主要食物,癌细胞利用糖酵解以获得快速的增殖和扩散的能量。葡萄糖代谢的重编程是胃癌的标志之一,与胃癌的发生、发展和预后不良密切相关。阻止糖酵解途径能够有效抑制肿瘤细胞的增殖甚至杀伤肿瘤细胞,因此胃癌糖酵解相关酶可能成为潜在的治疗新靶点。
ncRNA在葡萄糖代谢重编程中的作用提供了肿瘤发生的新视角和潜在的治疗靶点。本文总结了ncRNA对糖酵解过程的调控机制,发现许多的miRNA、lncRNA、circRNA都可作用于胃癌的糖酵解,且有些lncRNA、circRNA通过作为miRNA诱饵或者海绵以调节靶基因表达来发挥作用。此外,ncRNA可能通过调节糖酵解影响胃癌细胞的耐药,或者成为胃癌患者的预后因子,也可能成为胃癌的潜在治疗靶点,具有较好的临床开发应用潜力。
目前对胃癌糖代谢相关的ncRNA的研究有限,尤其是lncRNA和circRNA的作用亟待探索。虽然RNA药物的应用前景非常广阔,但是RNA药物的研发也面临着巨大的挑战。

