梨幼果FWL1膜系统酵母双杂交三框cDNA文库构建及互作蛋白的筛选
赛静忆,温玥,郝志超,田嘉
(新疆农业大学园艺学院,乌鲁木齐 830052)
0 引言
【研究意义】果实大小为数量性状遗传,是由细胞大小和细胞数目共同决定的[1-3]。库尔勒香梨(PyrussinkiangensisYu)为蔷薇科(Rosaceae)梨亚科(Pomoideae)梨属(Pyrus.L)植物,是新疆特色水果之一[4]。库尔勒香梨皮薄肉脆、独特芳香、耐贮藏等,但果实偏小,平均单果重仅为100 g 左右,且可食部位较少。不同大小香梨果实经济价值差异较大。Fw2.2(fruit weight2.2)基因是影响果实大小中最重要的数量性状基因之一,在细胞分裂时期对细胞数目进行负调控,占整个果实大小变异的30%。但该基因为膜蛋白,不能直接行使其功能。分析研究梨FWL(fruit weight2.2-like)同源基因与其互作蛋白之间的关系,构建梨幼果FWL1 膜系统酵母双杂交三框cDNA 文库,对研究FWL1基因调节果实大小机理有重要意义。【前人研究进展】目前已经发现了多个与果实大小性状关联的基因,以不同方式影响植物生长发育,调控果实大小。目前,从番茄中分离的fw2.2 是目前已知调节果实大小最关键的基因。细胞分裂时期,在小果野生种表达量较高,在大果栽培品种中表达量较低,影响细胞数目,负调控果实大小,占整个果实大小变异的30%。fw2.2为细胞膜蛋白,不能直接行使其功能,通过酵母双杂交表明,与酪蛋白激酶II(CKII)调节亚基的同源蛋白相互作用[5],调节细胞周期,进一步影响果实质量与体积[6]。李志超等[7]从酸浆属中分离了fw2.2 的同源基因,命名为Physalis Organ Size2(POS2),POS2不但影响果实大小,对其他组织和器官大小也具有负调控作用。POS2 同样为细胞膜蛋白,与PhysalisfloridanCKⅡβ1(PfCKⅡβ1)和MADS-box转录因子PfAGAMOUS-like(PfAG2)等蛋白发生互作,而PfAG2 能抑制PhysalisfloridancyclinD2;1(PfCyclinD2;1)的表达,对细胞分裂起到调控作用[7]。除了番茄与酸浆属,fw2.2 同源基因在水稻、玉米、鳄梨、大豆等物种中相继被分离出[8-11],且皆具备调控细胞分裂、控制果实大小的作用。酵母双杂交技术是一种检测蛋白质互作的技术方法,目前已被应用在多个物种上。雷海英等[12]研究玉米中心蛋白(Zea maysL.centrin,ZmCEN)的生物学功能构建了玉米的酵母双杂交cDNA文库,筛出28个和ZmCEN有互作关系的蛋白质。王洋等[13]构建了番茄cDNA 酵母双杂交文库,筛选出了6个与Pti4 互作的转录因子。郑巧玲等[14]构建了山葡萄低温诱导酵母双杂三框cDNA 文库,筛选出VaPYL9 与VaCIPK18 有互作关系。【本研究切入点】前期从梨中分离出梨3个fw2.2 同源基因FWL[15-16],但其调控梨果实大小机理尚不明确。需研究梨FWL1基因与其互作蛋白作用机理。【拟解决的关键问题】以杜梨、库尔勒香梨、鸭梨、早美香果实细胞分裂关键时期果肉组织为材料,构建梨幼果FWL1 膜系统酵母双杂交三框cDNA 文库,筛选出与梨FWL1 互作的蛋白,为梨FWL1基因调节果实大小机理提供依据。
1 材料与方法
1.1 材料
1.1.1 梨
杜梨、库尔勒香梨、鸭梨、早美香由新疆库尔勒市香梨研究中心科研实验基地采摘。每个品种分别选取一棵树势适中、生长状况良好、管理水平一致的10年生树,在果肉细胞分裂关键时期(授粉后15 d),每个品种分别采摘30个果实,去皮将果肉部分切下后立即置于液氮中,置于-80℃冰箱中保存备用。
1.1.2 主要试剂
Oligotex mRNA Kits(Qiagen,德国)、DEPC 水(Beyotime,中国)、无水乙醇(国药,中国)、Normal-RunTMprestained 250 bp-I DNA ladder(上海捷瑞,中国)、NormalRunTMprestained 250 bp-II DNA ladder(上海捷瑞,中国)、Supscript double stand cDNA Kit(invitrogen,美国)、Trimmer-2 cDNA normalization Kit(Evrogen,俄 罗 斯)、µltraPureTM Phenol:Chloroform Isoamyl:Alcohol(25:24:1,v/v)(sigma,美国)、pBT3-SUC(DUALsystemsBioTech,瑞士)、pBT3-STE(DUALsystemsBioTech,瑞士)、真核表达菌株NMY51(DUALsystemsBioTech,瑞士)、YPDA(陕西普因特,中国)、SD/-Leu with Agar(陕西普因特,中国)、SD/-Leu/-Trp with Agar(陕西普因特,中国)、SD/-Ade/-His/-Leu/-Trp with Agar(陕西普因特,中国)、酿酒酵母感受态制备及转化试剂盒(陕西普因特,中国)、3AT(Sigma,美国)、X-a-gal(Goldbio,美国)、Cycle-Pure Kit(OMEGA,中国)、TransStartFastPfu DNA Polymerase(全式金,中国)、Quick-Cloning MIX(陕西普因特,中国)、TransFastTaq DNA Polymerase(全式金,中国)。
1.1.3主要仪器
台式高速冷冻离心机(eppendorf,德国)、移液器(eppendorf,德国)、各型号离心管(Axygen,美国)、PCR仪(东胜,中国)、电转化仪(eppendorf,德国)、精密生化培养箱(上海精宏,中国)、恒温摇床(上海知楚,中国)、高速冷冻离心机(湖南湘仪,中国)。
1.2 方法
1.2.1 RNA提取
将杜梨、库尔勒香梨、鸭梨、早美香的幼果果肉组织放入带有液氮的研钵中,充分研磨至粉末状。选择Trizol 法对细胞的总RNA 进行提取,将洗脱下的RNA 取5µL 用于琼脂糖凝胶电泳的检测,其余放置在-80℃贮存。经NanoDrop 2 000核酸分析仪对总RNA的质量及其浓度鉴定。
1.2.2 mRNA分离
参照Oligotex mRNA Kits 说明书对mRNA 进行分离。
1.2.3 cDNA合成
在预冷的0.5 mL 无菌离心管中加入2µL mRNA 样品、1µL 的SMART ⅣOligonucleotide 及1µL 的CDS-3M PCR Primer,将其混匀后放入离心机内进行离心,将混合物于管底聚集,之后72℃,2 min,接着置冰上2 min,再次瞬时离心,让其均聚集于管底,向每一个管中加入2 µL 的5×First-Strand Buffer、1µL 的DDT(20 mM)、1µL 的dNTP Mix(10 mM)、1 µL 的PowerScriptTMReverse Transcriptase,轻轻吹吸使其充分混合,瞬时离心,42℃保育1 h,将离心管搁至在冰上,合成cDNA第一链。取一个新的离心管(0.5 mL)预冷,转入2µL 反转录产物,将其搁至冰上,准备进行后续步骤。
采用LD PCR对cDNA扩增,获得双链cDNA,将PCR 仪预热至95℃。在0.5 mL 反应管中加入以下试剂。表1

表1 二链合成cDNA所需试剂Table 1 Reagents required for two strand cDNA synthesis
轻弹离心管,瞬时离心,将管内物质集中在离心管的底部,滴入2 滴矿物油,覆盖管内物质,PCR 95℃预热后扩增,扩增步骤为95℃1 min,95℃10 s,68℃6 min(每过1个循环延伸时间增加5 s),20个循环,68℃5 min,16℃10 min。取5µL的产物进行电泳鉴定。
1.2.4 均一化处理
1.2.4.1 二链PCR产物纯化
使用QIAquick PCR Purification Kit 对二链PCR 产物纯化。按照5:1 的体积比例将PBI 溶液加入到PCR反应物内,将体系混合后加入吸附柱的膜上,10 000 r/min,1 min,弃滤液,加入0.75 mL PE Buffer 于膜上,10 000 r/min,离心1 min,取一个新的收集管,加入12µL纯化水于膜上。
1.2.4.2 杂交
在0.2 mL 无菌离心管中加入12µL SMARTprepared ds cDNA(1 200 ng of dissolved cDNA)、4µL 4×Hybridization buffer,混匀后瞬时离心,将其平均分为4 份,各滴入2 滴矿物油,13 000 r/min,室温离心2 min,于98 ℃下温浴2 min,之后在68 ℃下温浴5 h。
1.2.4.3 DSN处理
将1/2 倍(1 µL DSN storage buffer 与1 µL DSN混匀)置于冰上,68℃预热DSN master buffer,在每个PCR 管中加入5 µL 预热的DSN master buffer,混合至均匀,瞬时离心,之后迅速置于68℃,保温10 min。在管1(DSN1)中加入1 µL DSN 酶液,管2(DSN1/2)中加入1 µL 1/2DSN 酶液,管4(Control)中加入1 µL DSN storage buffer,管3(DSN1/4)不添加试剂,将其分别置于68℃保温25 min,加入10µL stop solution于每个管中,充分混合后瞬间离心,68℃下保温5 min,将PCR 管置于冰上并添入20µL纯化水行充分混合。
1.2.4.4 第1次PCR扩增经DSN处理的样品
对每个样品,在无菌的PCR 管内加入第1 次扩增的试剂。
将管内混合物混匀后瞬间离心。开始第1次PCR扩增,步骤为95℃1 min,95℃15 s,68℃6 min(每过1个循环延伸时间增加5 s),7个循环,68℃5 min。经对照以判断PCR的最适循环数,将剩余的样品搁于冰上保存。表2

表2 PCR扩增所需试剂Table 2 Reagents required for PCR amplification
1.2.4.5 第2次PCR扩增经DSN处理的样品
加入20µL纯化水于1倍酶处理的2µL PCR样品中,混合均匀后加入第2 次扩增的试剂,混匀,PCR 程序:95℃1 min,12个循环,95℃15s,66℃20s,72℃3min,接着64℃15s,72℃3min,取5µL电泳测定。
1.2.5 PCR产物纯化及二链回收
用QIAquick PCR Purification Kit 进行纯化,加41µL无菌水至膜上溶解,离心,测定浓度。二链回收用1×TAE 配置1%琼脂糖胶,点上Marker,隔一个以上泳道点样品,70 V 电压2 h,将Marker切下用含EB的电泳液染色15 ~20 min,用牙签标上1K、3K 的位置,对照样品切下1 ~3K 的区域,称取胶的重量。用QIAquick Gel Purification Kit纯化,按照胶100 mg约等于100µL计算。加进3倍体积的QG buffer,至50℃水浴10 min,直到胶全部融解,每2 min 进行颠倒混合均匀1 次,将化开胶液加至柱子,10 000 r/min 离心1 min,弃过滤物,在柱子膜上加750µL PE buffer,10 000 r/min,离心1 min,弃过滤物,12 000 r/min 甩干1 min,在膜上加15µL无菌水,12 000 r/min,1 min,保留滤下液体,确认其浓度。
1.2.6 cDNA与载体的连接
利用同源重组的方法,将3µL酶切后的线性化三框载体pPR3-N(双杂交)与上步中7 µL 的cDNA混合,取5µLInfusion重组酶、5µL水,将其充分融合后放入50 ℃中1 h,取2µL 蛋白酶K 对重组酶灭活,再加入78µL无菌水,将总体积加至100µL,之后依次加入1µL Glycogen(20µg/µL)、50µL 7.5 M NH4OAC、375µL 100%ethanol,充分混合,将其放在-80℃中至少1 h,在4℃下16 000 r/min 离心30 min,弃上清,加入150 µL70%的乙醇,在4℃下,16 000 r/min,离心3 min。再次重复这个过程,弃上清,保持cDNA沉淀,置室温下5 ~10 min 晾干cDNA,取10 µLDEPC 水重悬cDNA,用枪对其进行30 ~40 次吹吸,瞬时离心2 s 后对cDNA进行收取,即刻放置于冰上。
1.2.7 电转化大肠杆菌感受态细胞
在-80℃下放入1 mm 电击杯(Bio-Rad)进行30 min 的预冷处理,将感受态细胞50µL 及重组产物2.5 µL 在电击杯放在冰上的前提下一同放入杯内,持续放置45 min,经电转化仪(Bio-Rad)电击后,立即加入1 mL LB 培养基,将4次转化后的菌液转移至一个新的15 mL 离心管内,并加入培养基至5 mL,于37℃,225 ~250 r/min 培养1 h以上,之后把培养物稀释10、100、1 000、10 000倍,将不同倍数的稀释液分别涂10µL于平板上,其余置4℃过夜,也可倒上甘油使浓度至20%,于-80℃保存。
1.2.8 酵母双杂交文库质量及滴度检测
稀释经过转化的10µL原液至1 000倍,将其中100µL 涂在LB 平板上(具有氨苄抗性),次日统计算出文库的库容量(CFU/mL=平板上的克隆数/100µL×1 000 倍×1×103µL、文库总CFU=CFU/mL×文库菌液总体积mL)。扩增挑取的单克隆,用电泳对PCR 产物大小检测以鉴定插入片段的大小。稀释原核文库菌液10µL至106倍,将其中的100µL 涂在LB 平板上(含A+抗性平板),37℃过夜培养,次日统计,文库滴度CFU/mL=平板上的克隆数/100µL/10µL×106倍×1 000µL。
1.2.9 诱饵载体构建
利用前期克隆的梨果实大小相关基因FWL1(Genebank 收录号为:KM249876)[15],根据pBT3-N、pBT3-C、pBT3-SUC、pBT3-STE 四个载体分别设计梨FWL1 基因全长设计引物,并以cDNA 为模板进行扩增,扩增过程为:95℃5 min,95℃30 s、56℃30 s、72℃2 min(该过程30个循环),72 ℃10 min。之后对PCR产物纯化回收。对pBT3-N/C/SUC/STE 载体进行酶切,按照线性化载体(pBT3-N/C/SUC/STE)50 ng、对应FWL1 cDNA50 ng、Quick-Cloning MIX2 5µL,补水至10µL 配置反应体系,用DNA 连接酶将PCR 产物与线性化pBT3-N/C/SUC/STE载体连接,55℃,20 min,30℃,30 min,取1.5 mL EP 管置于冰上,转化至Top10感受态细胞中,再加入2µL 连接产物,用手指轻轻弹EP 管2 次,置于冰上30 min,42℃热击90 s,迅速置于冰上5 min,加1 mL LB 液体培养基,37℃,150 r/min,震荡45 min,6 000 r/min 离心5 min,去上清,留100µL上清液吹打沉淀使之混匀,涂布对应抗性平板,37℃倒置过夜培养后挑取白色单克隆菌落摇菌,菌液PCR,各挑取阳性克隆斑至加有相应抗性5 mL LB 液体培养基的试管中,37℃,220 r/min培养12 h,小提质粒,用对应引物测序。表3

表3 PCR引物Table 3 List of PCR primers
1.2.10 诱饵表达载体自激活及功能测定
参考酿酒酵母感受态制备及转化试剂盒(货号PT1183)对NMY51 酵母进行感受态制备。将Carrier DNA 和pTSU2-APP 及pNubG-Fe65 混合,加入NMY51感受态和PEG/LiAc转化液,制备好后重悬,各取100 µL 分别涂布DDO/X(SD/-Leu/-Trp/X-a-gal)、QDO/X 平板(SD/-Leu/-Trp/-His/-Ade/X-a-gal)平板,倒置于30℃培养箱内培养5d。对宿主(pTSU2-APP和pNubG-Fe65)检测。
将构建好pBT3-N/C/SUC/STE-FWL1 四个载体分别与pOst1-NubI、pPR3-N 混合,分别加入Carrier DNA(10µg/mL),分成8组,加入NMY51感受态50µL和PEG/LiAc 转化液500µL,制备好后重悬,1 ~4 组各取100 µL 分别涂布DDO(SD/-Leu/-Trp)及QDO/X(SD/-Leu/-Trp/-His/-Ade/Xa-Gal)平板,5 ~6 组取100 µL 涂布SD/-Leu 平板,并倒置于30℃培养箱内培养5 d,对其进行功能检测和自激活检测。
取1支EP管,加入500µL 0.9%NaCl溶液,从上述转化NMY51[pBT3-N-FWL1&pPR3-N]平板挑取1 株状态较好菌落挑入EP 管中,混匀,均稀释OD值为0.1和0.01,并分别取2µL菌液分别点加在DDO、QDO/10mM3-AT、QDO/20mM3-AT、QDO/30mM3-AT、QDO/40mM3-AT、QDO/50mM3-AT平板上,30℃培养箱内培养3 d,观察生长状态。
1.2.11 互作蛋白的筛选
挑取NMY51(pBT3-N-FWL1)单菌落(直径2 ~3 mm)于YPD Plus 液体培养基培养;用TE/Li-Ac 感受态制备液重悬。在CarrierDNA 加入文库质粒,加入NMY51 感受态及PEG/LiAc 转化液进行培养,最后用NaCl 重悬,各取10 µL 转化液稀释10 000 倍取100 µL 分别涂布DDO(SD/-Leu/-Trp)平板上,并倒置于30℃培养箱内培养5 d,统计转化效率。将剩余转化液全部涂布于80个QDO/50mM3-AT(SD/-Leu/-Trp/-His/-Ade/50mM3-AT)平板上,倒置于30℃培养箱内培养5 d,统计阳性克隆子。将筛选所得阳性克隆子分别转接于100µL 0.9%NaCl溶液中,测OD600值,通过补加适量0.9%NaCl 溶液使OD600 值为1,各取1µL菌液接种于QDO/50mM3-AT平板上,30℃培养3 ~5 d,对阳性克隆统计。挑单斑接种装有2 000µLSD/-Leu/-Trp 液体培养基中培养,220 r/min,30℃过夜培养,提取酵母质粒,将PCR 产物送测。
2 结果与分析
2.1 果肉组织总RNA提取
研究表明,28 S 与18 S 条带明晰,RNA 没有污染,较为完整。总RNA 经NanoDrop 2 000 测定后得出RIN≥7,A260/A280为2.01~2.08,其浓度及质量均达到要求。图1
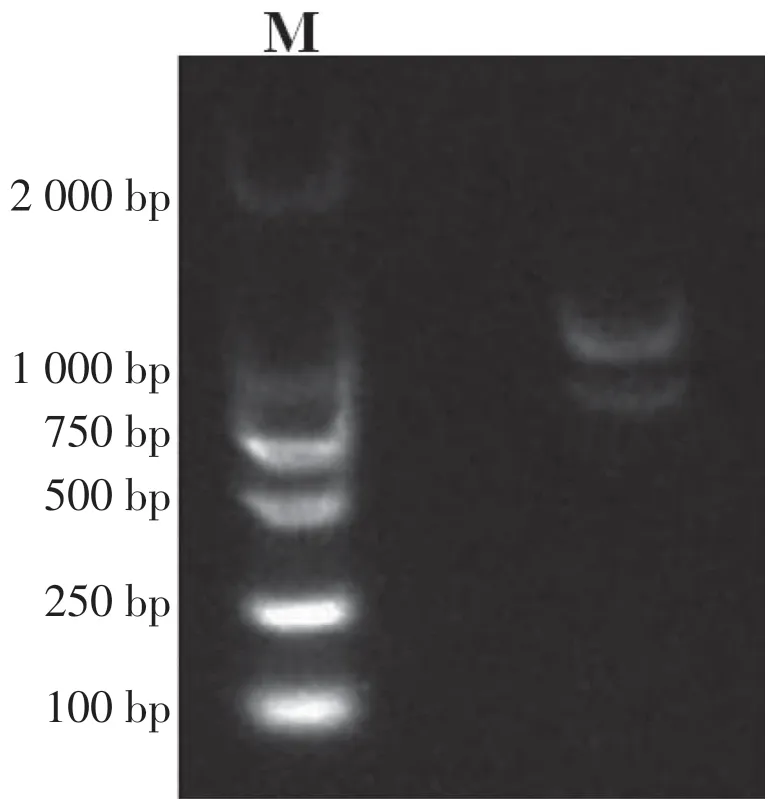
图1 梨肉组织总RNA电泳Fig.1 Total RNA from pear fruit tissues separated on agarose gel
2.2 ds cDNA合成与鉴定
研究表明,ds cDNA 片段集中分布于250 ~2 000 bp,呈弥散状,包含不同大小和丰度差异的mRNA取得有效反转录,符合建库基本要求。图2

图2 LD-PCR 电泳Fig.2 LD-PCR amplification products by agarose gel electrophoresis
2.3 均一化ds cDNA鉴定结果
研究表明,经均一化处理过的ds cDNA 无特异性条带的出现,其覆盖片段长度范围与未均一化处理的ds cDNA 一致,且出现亮度较为统一的弥散状条带,不同片段的转录产物拷贝数已被调节至相似数目。图3

图3 均一化ds cDNA电泳Fig.3 Normalized ds cDNA by agarose gel electrophoresis
2.4 文库的构建及鉴定
研究表明,库容为3×107CFU,大于1×107CFU,该文库的库容量较高。平均插入片段大于1 000 bp,阳性率≥98%,该文库的重组率和随机性符合要求。平板上菌落数量大于600个,该文库滴度为≥6×108CFU/mL,文库的各类指标符合基本要求。图4

图4 均长检测Fig.4 Average length detection
2.5 诱饵表达载体自激活及功能检测
2.5.1 宿主检测
研究表明,无论在DDO/X 或QDO/X 平板上,均能生长出蓝色菌落,宿主基因型状态未发生突变,各报告基因能正常激活。图5

图5 宿主验证Fig.5 Host validation
2.5.2 功能检测和自激活检测
研究表明,共转组pBT3-N-FWL1 及pOst1-NubI和pBT3-N-FWL1及pPR3-N在DDO平板上能正常生长,在QDO/X 平板上能正常生长且变蓝;共 转 组pBT3-C-FWL1 及pOst1-NubI 和pBT3-C-FWL1 及pPR3-N 在DDO 平板上能正常生长,在QDO/X 平板上未能生长;共转组pBT3-SUC-FWL1及pOst1-NubI和pBT3-SUC-FWL1及pPR3-N 在DDO 平板上能正常生长,在QDO/X 平上未能生长;共转组pBT3-STE-FWL1 及pOst1-NubI和pBT3-STE-FWL1及pPR3-N在DDO平板上能正常生长,在QDO/X平板上只有少量菌斑变蓝。pBT3-N一个载体可用。图6

图6 诱饵表达载体功能和自激活检测Fig.6 Decoy expression vector function and self-activation detection
2.5.3 3-AT工作浓度检测
研究表明,NMY51(pBT3-N-FWL1&pPR3-N)在QDO/50mM3-AT 平板上生长受到抑制。图7

图7 NMY51(pBT3-N-FWL1&pPR3-N)生长情况Fig.7 Growth of NMY51(pBT3-N-FWL1&pPR3-N)
2.6 文库筛选
研究表明,每次筛选菌斑数>1 000,转化率≥1.0×106CFU,共转效率达到筛库要求。图8

图8 筛库转化效率Fig.8 Screen storage conversion efficiency
2.7 酵母阳性克隆DNA提取和测序比对
研究表明,与梨FWL1 筛选互作蛋白长出了300个以上菌斑,在阳性克隆子转接测序中,共计长出274个阳性克隆,共计272个阳性克隆测序成功,在NCBI 数据库中进行BLAST 比对。有13个未知蛋白,6个蛋白出现频率在10次以上,其中collagen and calcium-binding EGF domain-containing protein 1、metallothionein-like protein type 2、metallothionein-like protein(Met1)的预测功能显示与细胞分裂有关。表4

表4 出现10次以上的梨FWL1互作蛋白及其功能预测Table 4 FWL1 interacting proteins of pear with more than 10 occurrences and their functional prediction
3 讨论
酵母双杂交技术多用来研究蛋白互作及蛋白质的结构与功能[17],也是迄今为止研究蛋白质互作中最常用的生物技术之一[18]。传统酵母双杂交系统适用于定位在细胞核内的互作蛋白。试验研究的FWL1 基因定位于细胞膜,不能直接行使功能,而DUAL membrane 技术在原有酵母双杂交系统的基础上,利用分离的泛素系统(splitubiquitin)进行蛋白质相互作用的筛选,为膜蛋白互作研究提供了可能[19]。酵母双杂交三框cDNA文库通过在普通单独文库上逐个增添了一个碱基于上游引物上,使得其读码框后移一到两位,用可能的3种读码框来表达克隆的cDNA,能够更好的捕捉生物体内真实的读码方式,确保筛选出所有可以正确表达的插入片段,提升了文库表达效率[20]。由于DSN 要求cDNA 片段长度和未经均一化处理的覆盖范围必须一致,能在不损坏大片段cDNA 的前提下,有效去除高丰度的cDNA[21],增加文库内cDNA均一化程度。实验利用同源重组的手段连接了合成的cDNA及通过酶切处理后的pPR3-N 载体。基因组DNA 多个序列与线性化DNA两端具备同源性,这将大大提升后续重组连接的精确性。这种方法结合了其它连接方法的优点,降低了操作难度,提升了连接的效率,提升文库的质量[22]。
判断cDNA文库质量的重要指标是文库的库容和重组cDNA 序列的完整性[23]。文库当中的独立重组子克隆数就是该文库的库容量,独立重组子克隆数的数量代表了该文库的覆盖度。cDNA文库最少应当含有1×106CFU 的库容量[24],经检测,研究所构建的梨幼果膜系统酵母双杂交三框cDNA 文库的库容量为3×107CFU,大于1×106CFU。构建的炭疽菌侵染后刺葡萄果皮酵母双杂交cDNA文库、陆地棉酵母双杂交cDNA文库以及小麦酵母双杂交cDNA 文库的库容量均大于1×106CFU[25-27]。研究所构建的梨幼果膜系统酵母双杂交三框cDNA文库符合建库的基本要求。重组cDNA序列完整性由重组率与插入片段的长度共同组成[21]。构建的草莓果实酵母双杂交文库、剑麻酵母双杂交cDNA 表达文库以及Cf-19 介导的抗番茄叶霉病免疫应答酵母双杂交cDNA文库的平均插入片段长度均大于500 bp,且阳性重组率为92%以上[28-30]。研究构建的cDNA文库经检测,
平均插入片段大于1 000 bp,阳性重组率≥98%。文库指标合格,符合后续筛库的基本要求。
筛选的272个互作的候选蛋白中,collagen and calcium-binding EGF domain-containing protein 1、metallothionein-like protein type 2、metallothionein-like protein(Met1)的预测功能可能与梨果实细胞分裂有关。collagen and calcium-binding EGF domain-containing protein 1 为胶原蛋白和含钙结合EGF域的蛋白,EGF为表皮生长因子(epidermal growth factor EGF)[31-32],EGF 可以促进细胞的增殖分化[33-34],庞实锋等[35]将大豆油体和EGF 融合基因成功转化进红花细胞的基因组中,并证实表达的EGF 对一些细胞具有促细胞增殖活 性。 metallothionein- like protein type 2 和metallothionein-like protein(Met1)为金属硫蛋白(metallothionein,MT),其功能为螯合重金属离子及重金属解毒,参与必须微量元素的储存、运输和代谢,参与激素和发育过程的调节等[36]。Yuan等[37-38]研究发现水稻OsMT2b 参与了植物体内细胞分裂素的调控,MT 可能在细胞的修复、生长和分化过程中起着金属调节剂的作用[39]。梨FWL1可能与上述两个蛋白互作后调节梨果实大小。
4 结论
利用DUAL membrane 系统构建梨幼果膜系统酵母双杂交三框cDNA 文库,文库的库容量为3×107CFU,平均插入片段大于1 000 bp,阳性率≥98%,均达到cDNA 文库的建库标准,符合后续筛库的基本要求。诱饵载体无自激活功能,利用共转化方法,筛选出272个与FWL1互作的蛋白质,其中collagen and calcium-binding EGF domaincontaining protein 1 和metallothionein-like protein可能与梨果实大小发育有关。

