若尔盖高寒沙化地中伴生草种对杯腺柳凋落叶初期分解的影响
李 沛, 周春梅, 陈冬明, 李 其, 邓东周, 黄 倩, 胡兴鹏, 邓竹辛, 周冀琼, 孙飞达, 白彦福, 韩金锋, 孙 庚, 鄢武先*, 刘 琳*
(1.森林和湿地生态恢复四川省重点实验室, 四川 成都 610081; 2. 四川农业大学草业科学与技术学院, 四川 成都 611130; 3. 中国农业大学草业科学与技术学院, 北京 100193; 4. 四川若尔盖湿地国家级自然保护区管理局, 四川 阿坝 624500; 5.中国科学院成都生物研究所, 四川 成都 610041)
若尔盖高原地处青藏高原东南缘高寒半湿润区,是我国主要牧区之一,也是黄河、长江上游水源涵养的重要生态功能区和生物多样性重要保护地,在区域经济社会可持续发展、维护国家生态安全和藏区长治久安中具有重要战略地位[1-4]。近年来,受自然因素与人为因素的综合影响,若尔盖高原沙化面积逐年扩大。2010年,若尔盖高原已出现3 470 km2沙化草地,占整个区域9.09%的面积,且近30年里,以每年0.007 km2的速率持续扩增[5],生态系统健康和服务功能严重下降。种植适生灌木[6-8],利用灌木的“资源岛效应”来改善土壤条件和局部小气候,为此后定居的草本植物提供保育作用,是全球沙化地治理常见方法[9-10]。在灌丛的遮挡和截获作用下,草本植物种子可以更好地聚集,并利用灌丛冠幅下土壤富集的养分和更温和的局部小气候,提高草本植物定居成功率和促进草本层物种多样性恢复[11]。自上世纪90年代以来,一系列生态治理工程在若尔盖高原实施,许多乡土灌木被广泛应用于高寒沙化草地的生态恢复。若尔盖高寒草甸区的沙化地植被恢复实践已证明,杯腺柳(Salixcupularis)因具有很强的适应性[12],可改善高寒沙化土壤特性[13],且与草本配合种植可使沙化地土壤有机质和总氮含量显著升高[14]。在高寒沙化地中,以杯腺柳为护理植物,选择适宜的乡土草本作为其伴生植物,可进一步加快区域沙化地植物物种多样性和土壤生态功能的恢复。
植物凋落物分解影响着土壤有机质组成、养分浓度和土壤CO2排放[15],是陆地生态系统物质循环过程十分关键的环节。一方面,温度和水分等环境因素对凋落物分解有十分重要的影响[16]。此外,不同植物种类及器官来源的凋落物由于化学组分不同,其分解特性存在一定差异[17],凋落物C、N含量、纤维素含量、木质素含量以及C/N和木质素/N等一系列指标常用于凋落物质量评价。高N凋落物比低N凋落物的分解速率高[18]。凋落物在分解过程中,当凋落物C/N值>25时发生氮固持,进而导致剩余凋落物中氮浓度增加;而当C/N值<25时凋落物氮开始矿化,释放速率随之加快[19]。木质素是植物凋落物中相对稳定的成分,在凋落物分解初期其浓度(质量百分率,%)常表现为增加,而到凋落物分解后期缓慢下降,是凋落物分解过程中主要的限速组分[20]。此外,伴生草种凋落物与杯腺柳凋落叶会产生混合凋落物分解的效应。与单种凋落物相比,混合凋落物具有更丰富的结构,凋落物的大小、几何结构以及持水力之间的差异使分解的异质性增大,这种异质性的增加能够使分解者具有更丰富的取食选择。而且,一些土壤动物对多样性高的凋落物更敏感[21]。此外,由于混合凋落物具有的营养元素更完整,各种营养元素通过淋溶作用在不同凋落物之间进行转运,使微生物群落能够更高效的利用碳源底物,从而抵消单种凋落物分解的营养限制[22]。有证据表明,由于凋落物之间的非加性相互作用,观察到的总凋落物质量损失和营养矿化率很大程度不同于组分中单种凋落物分解总和的预期值[23-25]。而且,植物凋落物的投入数量对C和养分循环有很强的影响[26-28]。
退化生态系统恢复的最终目的,是建成一个新的自我支持生态系统,不需要持续人工输入物质和能量,使生态系统具有一定的抗干扰能力[29]。因此,选择适宜的植物及物种搭配,加快凋落物分解及释放养分,促进土壤特性改善和物质循环的恢复,对于退化生态系统恢复意义重大。我们的前期研究发现,若尔盖高寒草甸区沙化地中杯腺柳凋落叶分解特征存在着空间异质性,即凋落叶质量损失率在裸地高于在杯腺柳冠幅下[30]。在杯腺柳与草本配合种植的治沙模式中,不同伴生草本对杯腺柳凋落叶提供添加物的数量和质量均不一样,直接影响着杯腺柳凋落叶的分解;不同伴生草本不同的存活率和地上生物量积累必会引起植被盖度的差异,造成凋落叶分解微生态环境条件的差异,间接影响着杯腺柳凋落叶的分解。因此,选择杯腺柳的适宜伴生草本植物,研究不同伴生草种对杯腺柳凋落叶分解的影响,探明这些伴生草种凋落物与杯腺柳凋落叶的混合分解反应和养分释放规律,找出有利于杯腺柳凋落叶养分回归的伴生草种,有助于提高高寒沙化地植被恢复的效率,加快高寒沙化地可自我支持的自然生态系统的重建,减少生态治理过程后期物质和能量的投入。
1 材料与方法
1.1 研究区概况
试验样地位于四川省阿坝州红原县瓦切乡(33o10′ N,102o37′ E,海拔3 366 m)。该区域为大陆性高原寒温带季风气候,春秋短促、长冬无夏。年均降水量792.0 mm,降雨主要集中在5-10月,年均气温为0.9℃,年均积雪期为76 d,无绝对的无霜期。相对湿度71%,昼夜温差大,冷暖变化剧烈。该地由于沙源、风口、气候变化、人为因素等导致沙化严重,土壤均为沙土且土质疏松,原有植被均已退化。目前所种植的灌木主要是青藏高原特有的杯腺柳等柳属灌木和沙棘(Hippophaerhamnoides)等,其中杯腺柳等柳属灌木对沙化地适应良好。
1.2 试验方法
1.2.1试验设计 试验为双因素设计,以未播种伴生草种的杯腺柳植株为对照,选用3种伴生草本植物分别单播(3水平)和杯腺柳的不同微位置(3水平,即内、中、外圈)为处理因素。随机选取12株自然生长、大小相近的杯腺柳植株,随机分为3组,分别播种垂穗披碱草(Elymusnutans)、中华羊茅(Festucasinensis)和老芒麦(Elymussibiricus)三种伴生草本植物,每4株为一组重复。并以每株杯腺柳茎基为中心,根据每株杯腺柳冠幅的大小,分别在茎基周围、冠幅半径中点和边缘处,设置内、中、外3圈。
凋落叶收集与处理:2016年10月,在研究区域人工收集当年新鲜杯腺柳凋落叶,带回实验室风干后,65℃烘至恒重,分装于凋落叶网袋中。按照取样次数为6次的设计,以杯腺柳植株内圈可满足放置18个凋落叶网袋为前提,确定最小凋落叶网袋的大小为10 cm×10 cm。然后,为保证单位面积凋落叶初始重量相同及各网袋内凋落叶厚度与几何大小分布一致,确定中圈和外圈的凋落叶网袋大小,分别为10 cm×20 cm和15 cm×20 cm,并准确称取烘干重为1.33 g的杯腺柳凋落叶装入10 cm×10 cm的网袋、2.67 g的杯腺柳凋落叶装入10 cm×20 cm的网袋、4 g的杯腺柳凋落叶装入15 cm×20 cm的网袋。为排除小动物活动的影响,凋落叶网袋孔径均为1 mm×1 mm。
伴生草种的播种方法:2015年5月,根据各株杯腺柳的内、中、外圈的周长,按照相同的播种密度(即,6粒·cm-1),沿各圈环形播种伴生草本的种子。
杯腺柳凋落叶袋的布置:沿每株杯腺柳伴生草本的环形播种槽外缘,分别放置凋落叶网袋,为保证每圈的取样次数均为6次,每圈均放置凋落叶网袋18袋。同时,以未播种伴生草种的4株杯腺柳(冠幅大小与播种实验的植株接近)作为对照,同样的方法放置凋落叶网袋。试验共16株杯腺柳,冠幅体积平均为(805.799±44.751)dm3,3种规格的凋落叶网袋各54袋,共864袋。在放置凋落叶袋之前,清除试验样地的原有凋落物。2016年11月,将处理好的凋落叶网袋放入试验地,水平铺于地表,用竹筷和铁丝固定。放置凋落叶网袋时,尽可能使网袋之间的距离保持均匀一致。
1.2.2样品收取与分析 在样品放置后的第4个月(2017年3月)进行第一次取样,此后每3个月取一次样,共取6次。为减小空间异质性影响,每次取样的3个凋落叶网袋与灌木茎基中心相连的半径之间保持120°夹角。每次取回的3个凋落叶袋去除外来杂物和表面泥沙后,均匀混合凋落叶,待风干后,置于烘箱中,65℃烘至恒重,测定凋落叶的残留量。随后使用旋风研磨仪(装置0.5 mm筛)将样品研磨成粉末,密封干燥保存,用于凋落叶碳、氮、纤维素、木质素的测量。同时,测定杯腺柳凋落叶的初始化学成分。
1.2.3指标测定 凋落叶质量(含灰分干重):65℃烘至恒重,称量并记录。凋落叶总有机碳:采用K2Cr2O7-H2SO4氧化外加热法测定(GB7657-87)。凋落叶全氮:采用凯氏定氮法测定(LY/T1269-1999)。凋落叶纤维素、木质素:改进的范式酸性洗涤纤维法[31]。
1.2.4数据统计 凋落叶质量损失率、半分解时间和95%分解时间计算公式分别为:
质量损失率Lt(%)=100×(Mt-M0)/M0
50%分解时间t50%(a)=-ln(1-0.50)/k
95%分解时间t95%(a)=ln(1-0.95)/k
式中,Mt为t时刻凋落叶网袋内剩余凋落叶干重量(g),M0为凋落叶网袋内初始凋落叶干重(g);k为凋落叶分解速率,应用Olson指数衰减模型ln(Mt/M0)=-kt拟合求得。
采用SPSS 20.0和Canoco 5.0进行统计分析。采用重复测量方差分析(Repeated-measure ANOVA)检验分解时间、伴生草种和微位置对凋落叶分解的影响。方差分析前,对不满足正态分布的数据进行Box-Cox变换处理。采用单因素方差分析(One-way ANOVA)分别检验不同微位置、伴生草种和取样时间对凋落叶分解的影响,影响显著的处理因素再采用LSD检验法进行多重比较。采用Canoco 5.0对2019年6月凋落叶分解特征数据进行主成分分析及作图。
2 结果与分析
2.1 伴生草种对凋落叶质量损失率的影响
对照和各草种伴生下,杯腺柳凋落叶质量损失率均随时间延长显著升高(P<0.05,表1)且均在582天时质量损失率最高(图1)。而且,在垂穗披碱草伴生下,内圈和中圈的凋落叶质量损失率均分别比对照、中华羊茅和老芒麦伴生下相应的微位置更高。在第一个秋冬交替期(2017年9月到12月,即308天到398天),三种草本植物伴生下的凋落叶质量损失率出现整个分解试验中的最大增幅。在214天和582天,在对照和中华羊茅伴生下,中圈和外圈的质量损失率均显著高于内圈(图1A,1B,P<0.05)。此外,垂穗披碱草伴生下,各微位置的杯腺柳凋落叶的50%和95%分解时间均最短,而且其伴生下中圈杯腺柳凋落叶分解时间最短(表2)。

图1 不同伴生草种对凋落叶质量损失率的影响Fig.1 Effect of different companion grass species on the loss rate of litter mass注:*表示在0.05水平上差异显著Note:* Indicates significant difference at the 0.05 level
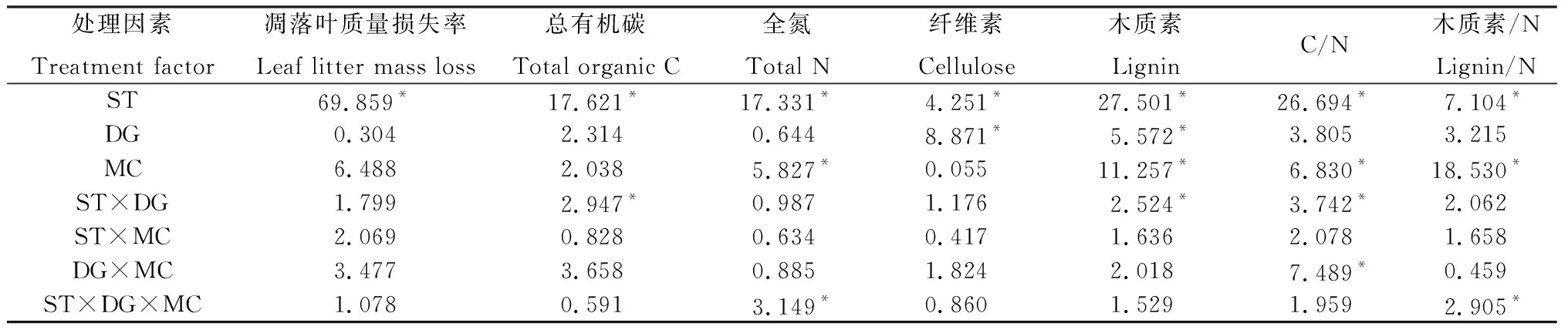
表1 杯腺柳凋落叶质量、养分残留率和化学计量比的重复测量方差分析结果(F值)Table 1 The results of repeated-measure ANOVA on leaf litter quality,nutrient residual rate and stoichiometric ratio (F value)

表2 不同伴生草种下杯腺柳灌丛不同微位置杯腺柳凋落叶的分解特征Table 2 The decomposition characteristics of leaf litter at different microsites under the canopy of Salix cupularis with different companion grass species
2.2 伴生草种对凋落叶总有机碳和总氮含量变化的影响
分解时间及其与伴生草种交互效应显著地影响着杯腺柳凋落叶总有机碳含量(P<0.05,表1)。在第398天,在中华羊茅和垂穗披碱草伴生下,内圈的凋落叶总有机碳含量均显著高于中圈和外圈(P<0.05,图2B,2C)。在第582天,垂穗披碱草伴生下,各微位置的凋落叶总有机碳含量均比初始含量显著降低(P<0.05,图2C),而在对照、中华羊茅和老芒麦伴生下,外圈的凋落叶总有机碳含量均显著高于中圈和内圈,且均高于其初始含量(P<0.05,图2B,2C,2D)。

图2 不同伴生草种对凋落叶碳氮养分浓度变化的影响Fig.2 Effect of different companion grass species on the concentration of carbon and nitrogen nutrients in litter注:*表示在0.05水平上差异显著Note:* Indicates significant difference at the 0.05 level
杯腺柳凋落叶全氮含量受分解时间、微位置及它们与伴生草种交互效应的显著影响(P<0.05,表1)。随着分解时间延长至第582天,各草种伴生下的各微位置凋落叶全氮含量比初始含量显著上升(P<0.05)。而且,此时,在杯腺柳冠幅下(内圈和中圈),与无伴生草种的对照相比,垂穗披碱草伴生下的凋落叶全氮含量均显著更高(P<0.05)。从第308天到398天,各草种伴生下的各微位置,凋落叶总有机碳含量和全氮含量几乎都显著升高,而且此后凋落叶全氮含量保持较之前更高的水平。
2.3 伴生草种对凋落叶纤维素和木质素分解的影响
伴生草种和分解时间对杯腺柳凋落叶纤维素含量均影响显著(P<0.05,表1)。在整个分解试验期间,凋落叶纤维素含量先缓慢上升,然后在第一个生长季(即2017年6月至9月,即第214天到308天)显著降低,随后的秋冬交替期间(即2017年9月至12月,即第308天到398天)其含量显著升高。在第308天,除对照的内圈外,各微位置凋落叶纤维素含量均处于整个试验期间的最低值,而且在垂穗披碱草伴生的中圈和外圈下,凋落叶纤维素含量均显著比其它两种伴生草种和对照低(P<0.05,图3B,3C,3D)。

图3 不同伴生草种对凋落叶纤维素和木质素分解的影响。Fig.3 Effect of different companion grass species on the cellulose and lignin decomposition of litter.注:*表示在0.05水平上差异显著Note:* Indicates significant difference at the 0.05 level
凋落叶木质素含量受分解时间、微位置及它们与伴生草种交互效应的显著影响(P<0.05,表1)。到第398天,在各草种伴生下的各微位置,凋落叶木质素含量均无显著变化,此后在2017年12月至2018年3月(即第398天到487天)的冬春交替期,其含量均显著升高。分解至582天时,凋落叶木质素含量均显著高于初始浓度(P<0.05),而且垂穗披碱草伴生下,内圈的凋落叶木质素含量高于对照和其它两种草本伴生下的内圈(图3F,3G,3H)。
杯腺柳凋落叶的C/N、木质素/N均受分解时间和微位置的影响显著(P<0.05,表1)。随分解时间延长,凋落叶的C/N降低(P<0.05),且垂穗披碱草和老芒麦伴生下,凋落叶C/N几乎一直低于25。分解至582天,三种草本伴生下,除对照、中华羊茅和老芒麦伴生的外圈以外,其余微位置的凋落叶C/N均较初始值显著下降(P<0.05),且垂穗披碱草伴生下各微位置的C/N无显著差异,而在对照、中华羊茅和老芒麦伴生下,外圈的凋落叶C/N均显著高于冠幅下(即内圈和中圈)。分解至308天,在对照和各草种伴生下的各微位置,凋落叶木质素/N均无显著变化,而在第一个秋冬交替期(即从308天到398天),垂穗披碱草和中华羊茅伴生下,凋落叶木质素/N均显著降低至整个试验期间的最低值,且均显著低于初始浓度(P<0.05),此后冬春交替期(即从398天到487天),各处理下的木质素/N均显著升高。
2.4 伴生草种对杯腺柳凋落叶分解空间差异的影响
在主成分分析结果中(图5),其PC 1与PC 2分别解释了所有变量变异的48.31 %和33.75 %,总解释率为82.06%。分析结果表明,在分解第582天(即2018年6月),杯腺柳凋落叶质量损失率、总氮和木质素含量两两互为正相关,凋落叶总有机碳、C/N和木质素/N也两两互为正相关;并且,垂穗披碱草集群在PC1轴左边,与中华羊茅和老芒麦明显分离,且凋落叶质量损失率、总氮和木质素含量也在PC1左侧。这说明,在垂穗披碱草伴生下,杯腺柳凋落叶质量损失率较高,且凋落叶总氮含量和木质素含量也更高,即与中华羊茅和老芒麦相比,在垂穗披碱草伴生下,杯腺柳凋落叶的分解更快,且在分解的第582天,其凋落叶的质量损失率、总氮和木质素含量均最高。

图4 不同草种伴生的杯腺柳灌丛下其凋落叶C/N和木质素/N的变化Fig.4 Changes of C/N and lignin/N in litter under the canopy of Salix cupularis associated with different companion grass species注:*表示在0.05水平上差异显著Note:* Indicates significant difference at the 0.05 level

图5 不同草种伴生下凋落叶分解各指标的主成分分析Fig.5 Principal-component analysis of all variables associated with different companion grass species注:横坐标和纵坐标分别代表第一(PCA axis 1)和第二(PCA axis 2)主成分值。DC,凋落叶总有机碳;DN,凋落叶总氮;MLR,凋落叶质量损失率;○表示中华羊茅(FS)伴生,□表示垂穗披碱草(EN)伴生,◇表示老芒麦(ES)伴生;黄色代表灌丛内圈(C),绿色代表灌丛中圈(M),蓝色代表灌丛外圈(I)Note:DC,Total organic carbon;TN,Total nitrogen;MLR,Mass loss rate;○ denotes microsites under the S. cupularis associated with F. sinensis,□ denotes microsites under the S. cupularis associated with E. nutans,◇ denotes microsites under the S. cupularis associated with E. sibiricus;Yellow represents canopy center (C),Green represents midpoint of canopy radius (M),Blue represents canopy edge (I)
3 讨论
3.1 不同伴生草种对杯腺柳凋落叶分解的影响
3.1.1不同伴生草种与杯腺柳的混合凋落物的分解反应 本研究表明,相对于另外两种草本植物,垂穗披碱草作为杯腺柳的伴生草种,在混合凋落物分解初期更加有利于其分解。这可能是由于垂穗披碱草凋落物的数量和质量都更优。一方面,我们的前期研究表明,在若尔盖高寒草甸区以杯腺柳为建群种的沙化地植被中,作为伴生草本植物,垂穗披碱草比中华羊茅和老芒麦有更高的发芽率[32],据此推测垂穗披碱草可形成初级生产量更高的植物群落,进而提供更多的凋落物,因此可促进杯腺柳凋落叶更快分解。另一方面,高质量的凋落物比低质量的凋落物具有更高的N浓度和更低的C/N,其分解速率也相对更大[33]。当质量差异明显的凋落物混合时,可减少营养元素的淋溶损失[34],促进真菌菌丝体从周围环境的养分吸收,从而提高养分的固持和减少养分的释放,使得高质量凋落物组分促进了其它较低质量凋落物组分的分解[35]。本试验中,来自不同伴生草种的凋落物对混合凋落物分解作用的总体表现为分解和周转速率加快,而且垂穗披碱草(或老芒麦)混合杯腺柳凋落叶的C/N均一直低于25,以垂穗披碱草伴生对杯腺柳凋落叶分解的促进作用最为明显。混合凋落物分解产生混合效应与凋落物的物种组合密切相关[36]。张丽莉[37]在对15种常见青藏高原高寒草甸植物凋落物分解的研究中显示,垂穗披碱草具有较高的初始N浓度与较低的C/N,且与其他高原草种呈现显著差异,这说明与其他营养成分含量偏低的高寒草甸植物相比,垂穗披碱草凋落物作为养分元素较高的高质量凋落物,可更有效地促进混合凋落物分解。本研究也证明,与中华羊茅和老芒麦相比,垂穗披碱草和杯腺柳的混合凋落物中,N浓度更高,且C/N更低,这可能使杯腺柳凋落叶中的微生物能固定的N源更丰富,可利用养分增加[38-40],从而更好地促进杯腺柳凋落叶初期的分解和养分释放。
3.1.2伴生草种根系对杯腺柳凋落叶分解的影响 在本研究试验中,我们观察到三种伴生草本的根系均在杯腺柳凋落叶网袋中有分布。我们前期的研究表明,在若尔盖高寒沙化地中,垂穗披碱草比另外两种草本植物发芽率更高,可推测其根系也会发育得相对更好。根系从凋落物层中获取养分更有效率,因此凋落物输入常促进根系从土壤向凋落叶层中转移[41]。而根系在凋落物层生长会对凋落物分解产生复杂的影响[41-42](图6-③)。细根通过改变根际微生物的活力[43]和觅食行为[44-45]来对地上凋落叶的产量和分解产生直接或者间接的影响。伴生植物根系的激发效应、对矿质氮的吸收、以及与其共生的真菌,均能加速凋落物的分解[46]。根系激发效应对凋落叶分解的影响体现在两个方面,一是根系分泌物能够激活或改变微生物群落的组成[47],从而加速或抑制凋落叶的分解(图6-②);二是根系死亡后作为高能量碳源,会促进微生物对旧有机物质的分解。根际激发效应对凋落叶分解可能产生正效应,也可能产生负效应。正的根际激发效应可促进有机质矿化增加达3.8倍,而负的根际激发效应会减少50%的有机质矿化[48]。而且,不同植物根系分泌物的化学组成成分常存在明显差异。已有研究发现,19份不同基因型拟南芥(Arabidopsisthaliana)的根系分泌物化学成分差异明显[49-50]。由此可以推测,与另外两种草本植物相比,垂穗披碱草的根系分泌物和根系凋落物的数量和质量可能更有利于混合凋落物分解。此外,根系激发效应与氮的有效性相关[51],而氮的有效性也是影响凋落物分解的重要因素。本研究也表明,分解至2018年6月(即第582天)时,杯腺柳和伴生草本混合凋落物的全氮浓度均较初始增加,且均高于没有伴生植物影响的单一杯腺柳凋落叶全氮浓度,这可能是由于分解前期,微生物固持氮而使凋落物中氮浓度升高,而且在有草本植物伴生的情况下,草本植物根系进一步促进了凋落物的微生物发育。

图6 高寒沙化草地中伴生草对灌木凋落叶分解的影响途径Fig.6 Effects of companion herbs on the decomposition of shrub leaf litter in the desertified alpine meadow注:①伴生草地上凋落物输入量;②进入灌木凋落物袋的草本根系分泌物;③进入灌木凋落物袋的草本根系凋落物;④伴生草本减弱凋落物袋温湿度变幅;⑤伴生草本削弱凋落物袋紫外线强度Note:①The leaf litter input of companion herbs;②Root exudates of companion herbs in the shrub litter bag;③Root litter of companion herbs in the shrub litter bag;④Attenuated variations of air temperature and humidity of shrub litter bag;⑤Reduced intensity of UVB exposure to the shrub litter bag
3.2 灌丛下不同微位置凋落物分解的差异
伴生草本植物通过提高植被盖度,间接影响着杯腺柳凋落叶层的光照、温度、湿度等微生态环境条件(图6-④)。在生长季,伴生草种的叶层与杯腺柳灌丛相互遮盖,阻滞空气流通,使冠幅下微环境热量更加不易损失,缓减群落下微环境的温度波动。同时,通过减缓表层土壤与凋落叶层之间的昼夜温差,创造更为温润的环境条件,影响土壤和凋落叶层的微生物活性,从而对凋落叶的分解产生间接影响。同时,不同伴生草种形成的地上植被盖度和生物量存在差异,因此对微环境条件波动的缓减效果不同(图6-①)。我们的前期研究也发现,在此区域,与中华羊茅和老芒麦相比,垂穗披碱草的出苗率显著更高[32],因此垂穗披碱草形成的伴生草本层盖度和地上生物量更高,更有效地缓解群落下微环境条件的波动,有利于凋落物层的微生物发育,进而更好地促进杯腺柳凋落叶分解。此外,在青藏高原高寒沙化地中的混合凋落叶分解初期,与生长季相比,非生长季(秋冬交替期和冬春交替期)的凋落叶分解动态也是剧烈和关键的。特别是在非生长季,各微位置之间凋落叶特征指标更多地表现出显著差异。这可能是由于在非生长季,与裸地和杯腺柳灌丛的外围相比,杯腺柳的茎基周围常积累更厚的雪层。已有研究表明,雪被可改变土壤的冻融状态(温湿度条件)、土壤微生物和土壤动物的区系组成[52-53],进而影响季节性雪被分布区的凋落物分解。
其次,伴生草本的遮挡常减弱凋落叶层接受到的光强,并改变其光质,而紫外线显著地影响着凋落物分解,其作用机制包括UVB的光降解和UVB导致分解微生物活性降低[54](图6-⑤)。由于伴随海拔的升高,空气逐渐变稀薄,UVB辐射强度一般也逐渐增强。有观测表明,正午时,与海拔2 300 m的西宁相比,海拔3 200 m的海北UVB辐射强度高10%~15%[55]。本试验中研究样地位于青藏高原东部,且海拔在3 300 m以上,同属于UVB辐射高强度地区,UVB深刻影响着高寒沙化地的凋落物分解。因此,杯腺柳灌丛下不同微位置紫外辐射强度的差异也会影响凋落物分解。本研究也发现,微位置显著地影响着杯腺柳凋落叶的总氮、木质素含量、C/N和木质素/N。特别是在无伴生草本的情况下,外圈的杯腺柳凋落叶质量损失率显著高于内圈。说明,外圈更强的UVB辐射更有利于凋落叶的光降解。此外,UVB辐射通过在生长阶段改变植物组织的营养组分来影响凋落物分解,例如,增加纤维素、木质素浓度[54],减少N浓度[57]等。李传龙[58]研究表明,生长在较弱UVB辐射环境下的垂穗披碱草凋落物质量趋于较高水平,即C/N低、木质素/N低。本试验也观测到,在垂穗披碱草为伴生草种时,分解第19个月时,在内圈和中圈(即冠幅下)的杯腺柳凋落叶的质量损失率明显高于外圈,这可能是因为冠幅下较弱的UVB辐射使垂穗披碱草提供了更高质量的凋落物添加,并且这种正效应影响超过了外圈更强烈的UVB光解正效应。
4 结论
综上所述,在若尔盖高寒沙化草地中,垂穗披碱草做为杯腺柳的伴生草种,比中华羊茅和老芒麦更有利于杯腺柳凋落叶的分解,更适宜作为高寒沙化地优势植物——杯腺柳的伴生植物,促进高寒沙化地生物多样性等生态功能的进一步恢复。

