适于β-内酰胺类抗生素耐药机制检测用参考菌株的研制
秦明倩,马嘉琦,黄巾凌,冯承谦,卢行安,赵红阳,周巍,崔生辉,杨保伟*
(1 西北农林科技大学食品科学与工程学院 陕西杨凌 7121002 汉中市汉台区市场监督管理局 过街楼蔬菜批发市场监管所 陕西汉中723000 3 中国检验检疫科学研究院 北京100176 4 河北省食品检验研究院 河北石家庄050000 5 中国食品药品检定研究院 北京 100050)
在众多食品安全风险中,微生物污染已成为全球性公共安全威胁[1]。据WHO 统计和发布,致病性微生物导致全世界70%食源性疾病的发生[2],它们会在生产、加工和运输等各个阶段污染食品,造成食源性疾病爆发[3]。比较近些年来我国家庭中食源性致病菌引发的疾病暴发事件,了解到沙门氏菌占据食源性致病菌的首位[4-5],使人们更加关注食品微生物风险防控[6]。抗生素药物使用是防控致病菌感染最直接、有效的手段[7-8]。β-内酰胺类药物抗菌谱广,杀菌能力强,低毒,治疗效果好[9],然而,大量使用导致很多食源性致病菌对其产生耐药性。研究者揭示其耐药是由于致病菌产生的β-内酰胺酶会与抗生素快速牢固结合,干扰抗生素进入靶位发生作用,或者水解抗生素[10-11],使其抗菌活性丧失[12],以及β-内酰胺酶相关编码基因通常会频繁地在不同细菌间转移[13],导致此类抗生素耐药性传播范围扩大。据统计,目前已有肠炎沙门氏菌、动物源致病性大肠杆菌、泛耐药铜绿假单胞菌等对β-内酰胺类抗生素的耐药率在逐年增加[14-17]。
标准物质兼具均匀性强、稳定性好,测量值精准等特点[18-19],可避免含复杂成分检测背景的干扰。近年来,我国食源性细菌耐受β-内酰胺类抗生素非常普遍,迫切需求准确、快捷检测食源性致病菌携带耐药基因的方法,开展相关菌株的标准物质研制,利于更有效溯源和控制污染源的传播[20]。同时,微生物检测参考菌株的研究、验证和使用可以实现具有自主知识产权菌种在食品微生物标准样品领域的广泛应用,缩短抽检、监测机构标准样品采购周期,降低采购价格[21]。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 3 株供试菌均为沙门氏菌(Salmonella),来源于农贸市场、超市零售食品和食源性疾病临床样本,保存于-80 ℃超低温冰箱。供试菌已获得中国医学细菌保藏中心(National Center for Medical Culture Collections,CMCC)保藏号。标准菌株鼠伤寒沙门氏菌(Salmonella typhimurium LT2)由中国食品药品检定研究院惠赠。
1.1.2 培养基 LB 溶菌肉汤和LB 琼脂培养基,北京陆桥技术股份有限责任公司。
1.1.3 试剂 Taq DNA 聚合酶、10×PCR Buffer(Mg2+free)、MgCl2、dNTP Mixture、DL2000 DNA Marker,宝生物工程有限公司(TaKaRa);海藻糖、谷氨酸钠等分析纯化学试剂,广东光华科技有限公司。
1.1.4 聚合酶链式反应(Polymerase chain reaction,PCR)引物 blaTEM、blaOXA和blaCTX-M扩增和测序用引物见表1。

表1 PCR 扩增用引物序列和产物长度Table 1 Primer sequence used for PCR amplification and the size of corresponding PCR product
1.2 仪器与设备
基因扩增仪(Mycircle),美国Bio-rad 公司;凝胶成像系统(GELDOCXR),美国Bio-rad 公司;电泳仪(Hema9600),北京六一生物科学仪器有限公司;-80 ℃超低温冰箱(MDF-3286S),日本SANYO 公司;4 ℃冰箱(BCD-205TA),青岛海尔股份有限公司;超净工作台(SW-CJ-1CU),苏州安泰空气技术有限公司;真空冷冻干燥机(SP SCIENTIFIC wizard 2.0),美国Virtis 公司。
1.3 方法
1.3.1 参考菌株制备
1.3.1.1 菌种活化 首先将冷冻保藏的菌种恢复到室温状态,无菌划线接种菌液于LB 琼脂培养基,37 ℃过夜培养。
1.3.1.2 参考菌株β-内酰胺类抗生素耐药性相关编码基因验证 用无菌牙签挑取适量活化好的单菌落,于100 μL 无菌ddH2O 的PCR 管中分散均匀,裂解法制备菌株DNA 模板[23]。使用PCR 检测耐药性相关编码基因,引物见表1。设置PCR 扩增条件:94 ℃预变性10 min;94 ℃变性1 min,退火1 min,72 ℃延 伸2 min,35 个循环;72 ℃延 伸10 min。根据不同基因的引物序列设置退火温度。对PCR 产物进行染色和电泳分析,于凝胶成像系统下拍摄扩增产物条带。阳性PCR 产物低温送样测序,将结果与原始序列通过BLAST 分析和比对,验证基因类型及是否突变。
1.3.1.3 目标基因遗传稳定性检验 对携带β-内酰胺类抗生素耐药性编码基因的3 株沙门氏菌连续传代培养,选取每株菌的第1,3,6,9,12,15 代检测目标基因的遗传稳定性(表2)。主要操作方法:接种冻存保藏的原代菌株,37 ℃培养18~24 h后获得第1 代菌株;使用无菌接种环随机挑取第1 代菌株中的单个菌落,划线、分离、培养;连续重复传代培养直至第15 代。分别从各代取菌的同一菌落挑取第1,3,6,9,12,15 代培养物,煮沸制备DNA 模板,扩增目标基因。PCR 扩增条件和序列分析如1.3.1.2 节。根据扩增片段大小确定传代过程基因是否丢失。对测序扩增产物、原代菌株的基因序列比对,验证基因是否发生突变。

表2 真空冷冻干燥制备的3 株参考菌株信息Table 2 Information of the 3 reference strains prepared by vacuum freeze drying
1.3.1.4 冷冻干燥制备参考菌株 挑取LB 培养基活化培养的单菌落,划线至LB 斜面,置37 ℃培养20~24 h。取少许菌体混散在含有无菌冻干保护剂的试管中制备菌悬液,然后,加入装有冻干保护剂和转子的锥形瓶中,轻度旋转3~5 min,混匀,制得菌液浓度在106~107CFU/mL。分装1 mL 预制备样品于无菌西林瓶中,轻放瓶盖,保证留有空隙,使瓶内空气排出,形成真空。将装好样品的西林瓶放入真空冷冻干燥机,设定程序并运行约25~35 h。冷冻干燥完成后,将样品压盖密封、编号,于4℃条件短期保存。制备过程及完成样品如图1 所示。

图1 参考菌株标准样品制备流程图Fig.1 Procedure of reference strain preparation
试验中,3 株参考菌株分别制备500 瓶,选用西林瓶真空包装,内盖用橡胶塞,外层用铝箔盖加强密封。
1.3.2 参考菌株均匀性检验 分别从3 株菌制备的500 瓶样品中随机抽取12 瓶,各用60 mL 无菌水室温下水化。样品经充分溶解、震荡混匀后,梯度稀释至检验所需浓度。吸取100 μL 待测样品稀释液,无菌均匀涂布培养基,37 ℃培养18~24 h,每个样品做3 个平行。按照GB 4789.2-2016《食品微生物学检验》[26]完成菌落计数定量检验,对数据结果进行处理和方差分析,评估样品的均匀性。
1.3.3 参考菌株稳定性检验
1.3.3.1 运输稳定性检验 因参考菌株于-80 ℃贮存,故不需要考虑极端低温下的运输稳定性。研究参考菌株在37 ℃存放13 d 的活菌数动态,模拟考察不加冰室温运输中活菌数的变化和目标基因的遗传稳定性。对保存在37 ℃的参考菌株每样每次抽检3 瓶,每瓶重复检验3 次。分别从制备完成第1,3,5,7,9,11,13 d 抽检,共抽检7 次。活菌数和目标基因检验方法同1.3.1.2 节和1.3.2 节。
1.3.3.2 短期贮存稳定性检验 对保存在4 ℃的参考菌株每样每次抽检3 瓶,每瓶重复检验3 次。从制备完成至第1,3,5,7,9,11 d 和13 d 每天抽检1 次,之后,每月抽检1 次,即21,30,60,90 d,共抽检11 次,监测活菌数是否变化,耐药基因是否稳定遗传,检验方法同1.3.1.2 节和1.3.2 节。
1.3.3.3 长期贮存稳定性检验 对保存在-80 ℃的参考菌株每样每次抽检3 瓶,每瓶重复检验3次。从制备完成至第3 个月每月1 次,即第30,60,90 天。后期视情况而定,若稳定可2~3 个月抽检1 次,于第150,210,300,360 天各抽检1 次,共7 次。监测活菌数是否变化,耐药基因是否稳定遗传,检验方法同1.3.1.2 节和1.3.2 节。
1.3.4 参考菌株的联合定值 为了保证参考菌株的特性值及研制过程的准确性,委托全国7 家具有定值资质和能力的实验室对参考菌株RM_AST_SM 176 的特性值进行联合定值。每个参与定值的实验室发放3 个样品,每个样品2 个平行。测试方法参考GB 4789.4-2016 和SN/T 1869-200T 进行[27-28]。
1.4 数据统计分析
所得数据通过Excel 2019、SPSS 20.0 统计软件进行收集、统计学方差分析(Duncan 法,P<0.05)和作图,每组试验数据均取得3 次平行。
2 结果与分析
2.1 供试菌中目标基因遗传稳定性
3 株菌携带的blaTEM、blaOXA和blaCTX-M基因扩增条带清晰单一、片段大小一致,表明目标基因在15 代传代中均可稳定遗传(图2:以blaCTX-M-3为代表的电泳结果)。各代菌株目标基因测序结果与初代菌株无差异,无基因突变(图3:以blaC-TX-M-3为代表的基因序列比对结果)。3 株菌性质稳定,满足制备β-内酰胺类抗生素耐药机制检测用参考菌株的预期要求。

图2 耐药基因PCR 扩增的电泳分析结果Fig.2 PCR amplification results of antibiotic-resistance encoding genes analyzed by agarose gel electrophoresis
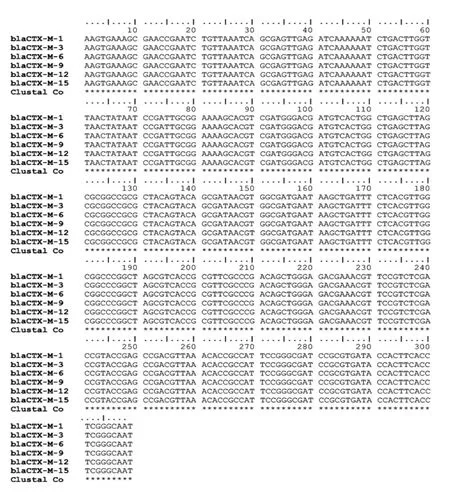
图3 不同代菌株中blaCTX-M-3 序列比对结果Fig.3 Results of blaCTX-M-3 sequence alignment in different generational strains
2.2 参考菌株均匀性检验结果
检测到由每株参考菌株随机抽取的12 瓶样品菌落数均为×106CFU/瓶。由方差分析可知,随机抽取的菌株样品活菌数间不存在显著差异(F 值<F 临界值,置信概率为95%,见表3),表明均匀性满足标准样品要求。

表3 参考菌株均匀性方差分析检验结果Table 3 Results of homogeneity variance analysis for reference strains
2.3 参考菌株稳定性检验结果
2.3.1 运输稳定性 参考菌株在37 ℃存放5 d后,瓶内活菌数有微弱的降低趋势,13 d 时降低10%~20%,而活菌数量均保持在104~105CFU/瓶的水平,总体情况稳定,满足定性标准样品要求(图4)。

图4 参考菌株37 ℃条件下的贮存稳定性结果Fig.4 Stability results of the reference strains stored at 37 ℃
贮存于37 ℃,不同时间取样的参考菌株的特征基因均可检出,出现的PCR 扩增条带清晰单一、整齐明亮、片段大小均匀一致(图5:以blaCTX-M-3为代表的电泳结果)。参考菌株目标基因运输稳定性良好。

图5 37 ℃保存参考菌株blaCTX-M-3 PCR 扩增和琼脂糖凝胶电泳检测结果Fig.5 Results of PCR amplification and agarose gel electrophoresis for blaCTX-M-3 in the reference strain stored at 37 ℃

图6 参考菌株4 ℃条件下的贮存稳定性结果Fig.6 Stability results of the reference strains stored at 4 ℃
2.3.2 短期稳定性 参考菌株于4 ℃贮存90 d,不同时间的活菌数基本维持在8.53×105~5.57×106CFU/瓶的水平,活菌数下降幅度在27%左右,总体低于存放在37 ℃时活菌数的变化率,表明参考菌株在4 ℃短期储存稳定性良好。
4 ℃贮存时,不同时间取出的样品中目标基因均可检出,得到的PCR 扩增条带清晰单一,整齐明亮,片段大小均匀一致(图7:以blaCTX-M-3为代表的基因扩增电泳结果),表明参考菌株在4 ℃贮存90 d 稳定性良好。

图7 4 ℃保存参考菌株blaCTX-M-3 PCR 扩增和琼脂糖凝胶电泳检测结果Fig.7 Results of PCR amplification and agarose gel electrophoresis for blaCTX-M-3 in the reference strain stored at 4 ℃
2.3.3 长期稳定性 参考菌株于-80 ℃存放360 d,等时间间隔不同时间点取出的样品中活菌数均落在合理范围浮动(因第150 天和第180 天受到新型冠状病毒疫情影响,监测数据无法得到),菌落计数结果维持在106CFU/瓶的水平及以上(图8),表明参考菌株在-80 ℃保存稳定性良好。

图8 参考菌株-80 ℃条件下的贮存稳定性结果Fig.8 Stability results of the reference strains stored at -80 ℃
检测储存在-80 ℃的参考菌株特征性基因,目标基因均可被检出,PCR 产物电泳结果如图9所示。可扩增出清晰单一的条带,片段大小一致,表明参考菌株在-80 ℃长期稳定性良好。

图9 -80 ℃保存参考菌株blaCTX-M-3 PCR 扩增和琼脂糖凝胶电泳检测结果Fig.9 Results of PCR amplification and agarose gel electrophoresis for blaCTX-M-3 in the reference strain stored at -80 ℃
2.4 联合定值
7 家实验室的联合定值结果表明,携带β-内酰胺类抗生素耐药基因blaCTX-M-3的参考菌株RM_AST_SM 176 特性值与预期结果一致,符合标准样品要求,能够满足预期用途。
3 讨论
沙门氏菌是非常普遍的食源性致病菌,在公共卫生安全领域占有主导地位,是公众健康研究的重点关注菌种[29]。其携带多种耐药性编码基因,是研制耐药基因和耐药机制检测用参考菌株的合适材料[30]。食品微生物检验有力地支撑和保障了我国的食品安全体系[31]。虽然全基因组测序可以全面、准确地捕获和检测食源性致病菌携带的耐药基因,有效地掌握其介导的耐药机制,但是耗时较长,专业性也很强,不易在基层推广使用,比较难以实现耐药机制和耐药基因的临检和快检[32]。PCR 技术相对简单、快捷,利用PCR 对检测食源性致病菌所用参考菌株很有必要,可切实保障检测结果的可靠性。
我国多个领域已初步研发出参考物质,并且建立用于研发技术交流、质量评价的国家参考物质资源共享平台[33]。然而,在该平台上乃至全球范围内都缺乏适用于食品微生物检验的参考物质,主要归因于微生物易变异,易发生污染,代谢机制复杂等,纯菌种也大多数由菌种保藏机构来提供。目前,我国市场上对标准物质的需求量和需求品种增长迅速,然而,我国微生物标准物质的研发基础和进度整体性不够。虽然骆海朋等[36]研制出阪崎克罗诺杆菌标准物质,夏丹丹等[37]制备了大肠杆菌DNA 定性标准物质,王深垒[38]研制了沙门氏菌质粒DNA 定性标准物质,含有食品基质的微生物参考物质在国内个别机构展开研究和推行,但是目前国内尚无用于介导β-内酰胺类抗生素耐药机制及耐药基因检测用定性标准样品。
通常将食源性致病菌携带的特定编码基因作为研究目标,方便于对菌株特性进行追踪和检测[39]。因此,要求标准菌株中携带特定的编码基因,在菌株的不同代、不同运输和贮藏环境中都可以稳定存在。本研究制备的β-内酰胺类抗生素耐药机制检测用参考菌株特性基因在15 代内均可稳定遗传,无突变,可用作标准物质和参考菌株制备的供试菌。
真空冷冻干燥技术可以很好地维持和稳定生物材料在贮藏过程中数量和特性值随温度、时间的变化[41]。冷冻干燥操作时,会将微生物与保护剂混合,使微生物细胞形成玻璃化状态,尽可能地消除或减弱冰晶对微生物细胞的伤害,更好地保证微生物活性[42]。本研究经真空冷冻干燥技术制备的参考菌株标准物质均匀性良好。制备完成后,对参考菌株标准样品的稳定性检验主要集中在温度对其活性、存活率以及目标基因遗传稳定性的影响。37 ℃贮存13 d,前5 d 菌落数的变化最明显,可能是由于瓶中原始活菌数多,气温较高导致微生物死亡,然而,目标基因稳定性保持良好。参考菌株标准样品最好采用冷链运输,若没有冷链条件则需要加冰处理,可在一定程度上减少微生物活菌数的减少。4 ℃贮存90 d 后,参考菌株菌落数总体呈下降趋势,部分参考菌株标准样品的活菌数波动幅度较大,可能是由于瓶间原始活菌数存在差异。总体来看,使用过程中将参考菌株短期存放于4 ℃冰箱,可使温度对活菌数的影响控制在一定范围内。-80 ℃贮存360 d,每瓶标准样品内的活菌数在贮藏过程随时间的延长虽有一定量的减少,但在一定范围内波动,属于正常情况,活菌数含量一直保持在×104CFU/瓶以上,参考菌株稳定性良好,符合标准样品要求。
为切实保证参考菌株特性值的准确性和可靠性,7 家具有食品安全检测资质的承检单位对其联合定值,研制参考菌株标准样品的特性值与联合定值结果是相吻合的,符合参考物质要求。
4 结论
本研究研制出3 株携带β-内酰胺类抗生素耐药机制编码基因的参考菌株,其均匀性、贮藏性和目的基因遗传稳定性皆良好,可直接用于食品、临床及环境领域β-内酰胺类抗生素相关基因介导的耐药机制的快检和临检,丰富了我国在耐药微生物及其耐药机制检测标准中的参考物质资源。

