乳酸菌合成细菌素的细胞通讯机制研究进展
孔令誉,夏超然,沈淇元,曾小群*,郭宇星,吴振,潘道东
(1 宁波大学 省部共建农产品质量安全危害因子与风险防控国家重点实验室浙江省动物蛋白食品精深加工技术重点实验室 食品与药学学院 浙江宁波315800 2 南京师范大学食品与制药工程学院 南京 210097)
细菌素是某些细菌在生长代谢过程中由核糖体合成的,具有抑菌作用的多肽或蛋白质[1],广泛应用于食品加工贮藏及生物医药领域。细菌素作为一种生物防腐剂,比化学防腐剂更有效和更利于人体健康[2]。抗生素滥用引起多数致病菌产生耐药性,已成为重大公共卫生安全问题,而细菌素具备更好的抑菌性、靶向性、变化性和可组合性,使其成为抗生素的有效替代物[3]。其中,乳酸菌(lactic acid bacteria,LAB)细菌素因无毒、非免疫原性、耐热性和广谱抑菌等特性[4]而成为细菌素研究和应用的热点。已报道的产细菌素的乳酸菌主要有乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、链球菌属(Streptococcus)、片球菌属(Pediococcus)和肠球菌属(Enterococcus)等[5]。
乳酸菌产生细菌素,是乳酸菌对抗自然界复杂的生存条件,适应进化所形成的竞争和防御机制[6-8],尤其在种内竞争中表现出更明显的抑菌特性[9]。乳酸菌细菌素表现出以下多样性,早期研究根据细菌素分子结构中是否含有羊毛硫氨基酸,可以将细菌素分为羊毛硫抗生素和非羊毛硫抗生素,而近几年的研究对乳酸菌细菌素的分类有新的改动,即而根据细菌素翻译后是否经过明显修饰过程,将其划分为翻译后修饰细菌素(posttranslationally modified bacteriocins)和非修饰细菌素(unmodified/slight-modified bacteriocins)[10]。根据是否经过明显翻译后修饰,可将乳酸菌细菌素分为[11-13]:Ⅰ类,为经过明显翻译后修饰的小分子多肽(分子质量小于10 ku),如羊毛硫菌素、含硫碳键修饰细菌素、噻唑/恶唑修饰肽等;Ⅱ类,也是小分子多肽,为非修饰肽或非显著修饰肽,热稳定性更强,根据其结构与活性不同,又被分为4 个子类(Ⅱa:片球菌素样细菌素;Ⅱb:双肽细菌素;Ⅱc:无前导序列细菌素;Ⅱd:线性非片球菌素样细菌素);以及溶菌素(bacteriolysins),是一类热敏大分子蛋白质(分子质量大于10 ku),早期被分类为Ⅲ类细菌素,但该类细菌素完全不同于Ⅰ类和Ⅱ类细菌素,因此它作为一类特殊细菌素被分支出来。Ⅰ类细菌素Nisin,是目前唯一被美国食品药品管理局(Food and Drug Administration,FDA)认证为公认安全产品(Generally Recognized As Safe,GRAS),且被广泛作为天然防腐剂而投入到商业化生产中[14]。其它乳酸菌细菌素因产量低、活性低等问题而无法用于实际生产,使乳酸菌细菌素的使用存在较大的局限性。为了拓宽细菌素的应用,研究者通过开展蛋白质组学、基因组学、转录组学、基因工程、毒理学等多方面研究[15-16],以实现细菌素的高效表达与生产,并揭示乳酸菌细菌素的形成及作用机制。同时,人们根据Nisin 的多肽结构,着手人工合成稳定的抗菌肽[17]。虽然细菌素的特征结构复杂,存在如套索结构、糖基化侧链、复杂的肽基序等,给化学合成细菌素带来了巨大的困难和挑战[18],但是这一举措若成功,足以保证未来对细菌素的供应。
细胞通讯(cell communication)普遍存在于生物中,如神经元之间化学信号与电信号的传递和转化、成肌过程以及细菌细胞间的群体感应(quorum sensing,QS)等[19-20]。QS 是分子介导的细胞通讯方式,即细胞产生扩散性小分子信号(又称自诱导物质,autoinducer,AI)并积累达到一定阈值,这时细胞之间开始接收这些信号,被诱导并启动相关基因表达,因此是一种群密度依赖性调控机制。QS 的完整信号通路,除了AI 外,还需要信号感受器和反应器,即双组分调节系统(two-component regulatory system),由组氨酸激酶(histidine kinase,HK)和反应调节蛋白(response regulator,RR)组成[21],这2 种蛋白是细菌细胞的固定构成成分,其基因表达与细胞生长同步进行。以上3 部分(AI,HK,RR)构成“信号发出、接收信号和反应刺激”这一基本的信号转导过程。乳酸菌细菌素的产生多受控于QS[22-23]。由于不同乳酸菌产生细菌素类型可能不同,因此所诱导的信号分子类型也不同,主要涉及细菌素的诱导信号主要是由核糖体合成的寡肽类物质,也称为自诱导肽(autoinducing peptides,AIP),其次是微生物中普遍存在的非核糖体合成诱导信号AI-2[24]。其中,AI-2 还调控细菌生物发光、生物膜的形成、分泌毒力因子和遗传转化等能力[25]。目前关于Ⅰ类和Ⅱ类细菌素受信号分子诱导的研究相对于Ⅲ类细菌素更成熟。本文主要针对Ⅰ类和Ⅱ类乳酸菌细菌素,综述诱导乳酸菌细菌素形成的细胞通讯机制。
1 诱导型乳酸菌细菌素形成概述
乳酸菌细菌素一般在细菌的指数期开始形成[26],主要是受诱导产生的诱导型细菌素,也有组成型细菌素(自然低水平表达),诱导型细菌素在乳酸菌生长竞争中更占据优势[22]。并非所有诱导型乳酸菌细菌素均依赖于HPK-RR。Noda 等[27]报道,在短乳杆菌174A 中并未发现编码HPK 和RR的基因,而发现与正调控其产生细菌素的2 种调控蛋白(BreD 和BreE)。一般单一乳酸菌菌种在液体培养基中培养时,细菌素的抑菌活性无法被检测到[28],这是由于信号分子在液体中的扩散能力强于在固体介质中的,导致液体中细胞周围的信号分子浓度远低于在固体中的,达不到诱导细菌素产生所要求的阈值[29]。
2 诱导乳酸菌产细菌素的方式
2.1 AIP 诱导乳酸菌产细菌素
2.1.1 AIP 来源及形成 AIP 诱导是乳酸菌产细菌素的主要诱导调控形式,属于种内信号传递,具有特异性[30]。AIP 信号一般分为2 类:i 类AIP 是乳酸菌自身产生的少量细菌素;ii 类AIP 是类细菌素肽,这2 类AIP 与同基因簇内转运蛋白均为组成型[31]。
Nisin 是乳酸菌细菌素中最典型的i 类AIP[32]。研究表明乳酸乳球菌转至新的培养环境时,其细胞表面已附着少量Nisin[33],说明在细胞培养初期,这些附着的Nisin 能够刺激细胞持续分泌Nisin,并随胞外Nisin 达到一定浓度,最终其能够诱导自身细菌素的大量表达。也有研究证明,在亚抑制浓度(即未达到抑菌效果的浓度)下,细菌素起诱导信号的作用[34]。添加一定量的外源Nisin,可以促进Nisin 的诱导形成。另外,不利生长条件[35]、光刺激[36]等因素,也能刺激乳酸菌产生少量的细菌素作为AIP,进而启动细菌素大量表达。除Nisin 外,副干酪乳杆菌J23 表达的 Lac-B23[37],戊糖乳杆菌CS2 表达的戊糖乳杆菌素MQ1[38]和唾液乳杆菌SPW1 表达的唾液乳杆菌素Mmaye1[39]均被发现作为i 类AIP 的能力;也有同一细胞内多种细菌素受同一AIP 诱导的报道,如屎肠球菌NKR-5-3 产5 种细菌素(肠球菌素NKR-5-3A、B、C、D和Z)的,其中NKR-5-3D 可诱导自身与NKR-5-3A、C、Z 的表达[40-41],这类乳酸菌,其不同细菌素基因分别位于染色体和质粒上,因此其AIP 并不能诱导表达所有的细菌素。
ii 类AIP 通常是由细菌素基因簇上的调控基因表达的不具备抑菌活性的类细菌素寡肽。如清酒乳杆菌Lb706[42]、嗜酸乳杆菌NCFM[43]、鸟肠球菌XA83[44]、嗜热链球菌LMD-9[45]、加氏乳杆菌EV1461[46]等,均含有编码ii 类AIP 的基因序列。其中,植物乳杆菌产Ⅱb 类细菌素受plNC8IF 或plnA 编码的寡肽诱导已被熟知[47]。ii 类AIP 通常由产Ⅱ类细菌素乳酸菌产生,在胞内时,其结构中多含有双甘氨酸前导序列,需经过与自身细菌素相同的转运系统,从胞内运至胞外发挥作用[48](图1 中途径(1)所示)。
2.1.2 AIP 的信号转导机制 乳酸菌合成细菌素相关的HK-RR 双组分系统,由细菌素基因簇内的调控基因表达合成,如研究最多的乳酸链球菌,其细菌素基因簇中nisK 和nisR 分别表达HK 和RR[49];又如植物乳杆菌内调控子plnABCD,plnB表达HK,plnC 和plnD 表达RR[50]。在结构上,双组分系统包含特异性结构与非特异性结构,特异性结构包括HK 的N-端信号识别结构域和RR 的C-端效应输出结构域(DNA 结合结构域,启动特定基因表达);非特异性结构包括HK 和RR 参与磷酸化和去磷酸化反应结构域(高度保守)[51]。乳酸菌在生长繁殖过程中向胞外分泌AIP,胞外AIP浓度达到阈值后,会与特定的HK 特异性结合并激活其活性,并进一步使细胞质中相应的RR 磷酸化,磷酸化的RR 与细菌素基因簇中的启动子结合,进而开始合成、分泌细菌素,如图1 途径(2)所示。当乳酸菌培养至一定阶段,胞外AIP 被水解导致信号刺激消失,该过程也会终止[52]。
如图1 所示,信号通路的末端由磷酸化的RR特异性地结合细菌素基因簇(包括编码细菌素前体肽、修饰蛋白、免疫蛋白、转运蛋白、调节蛋白和辅助蛋白等的序列)的各启动子(这些启动子中均含有特定的半保守序列,与RR 和DNA 结合有关)来开启转录,并使该基因簇的转录水平显著提高[53-54]。以含有调控子plnCD 的植物乳杆菌为例,RRplnC和RRplnD分别起到激活和抑制的作用,在细胞生长初期,AIP 在胞外积累到一定范围,RRplnC被激活并正调控细菌素表达;当细胞密度过高,胞外AIP 过多时,会激活RRplnD开启负调控[21]。Risùen 等[55]较早发现RRplnD需要达到RRplnC的10倍,才具有与RRplnD同样的DNA 结合能力。这些说明RRplnD需要在细胞内表达到一定量,才会阻碍RRplnC与DNA 的结合,其机理可能是RRplnD开始磷酸化并导致RRplnC去磷酸化。另外,这2 类RR 与细菌素基因簇内各启动子的结合能力也各有差异,RRplnC与plnA 启动子结合能力较强,而RRplnD与转运蛋白相关基因plnG 的启动子的结合能力较强[56]。对于仅含有一种RR 的乳酸菌,AIP在高浓度下,RR 被去磷酸化而无法与启动子结合。
当磷酸化的RR 激活细菌素基因簇内各启动子后,乳酸菌便开始细菌素的转录、翻译和分泌过程。Ⅰ类和Ⅱ类细菌素,由结构基因编码其前体,该前体除了含有具抑菌活性的结构外,还包括协助细菌素转运至胞外的前导序列,以保证Ⅰ类和Ⅱ类细菌素前体在胞内无抑菌活性(除Ⅱc 类细菌素,在胞内合成便具有抑菌活性,以不同的机制实现分泌和自身免疫)[58]。前体在短时间内再通过修饰酶对氨基酸残基进行修饰,如丝氨酸或苏氨酸经脱水酶产生羊毛硫氨基酸或甲基羊毛硫氨基酸[59]、分子内环化(最终形成球状肽结构,像Ⅱ类细菌素内常见的二硫键等稳定结构,可以赋予细菌素较好的耐热性)[60-61]、半胱氨酸S-糖基化[62]等;接着,由ABC 转运蛋白和辅助蛋白协同作用,切除细菌素前体的前导序列并转运至胞外,以成熟并具抑菌活性形式的存在[63-64],由水解酶水解被切除的前导序列。而菌株自身免疫产生的细菌素,是由细菌素结构基因相邻的免疫基因表达的免疫蛋白引起的。免疫蛋白直接与穿过细胞膜的细菌素相互作用,或间接形成“细菌素-受体-免疫蛋白”复合物,从而以这2 种方式阻断了细菌素引起细胞死亡的后续途径[65]。
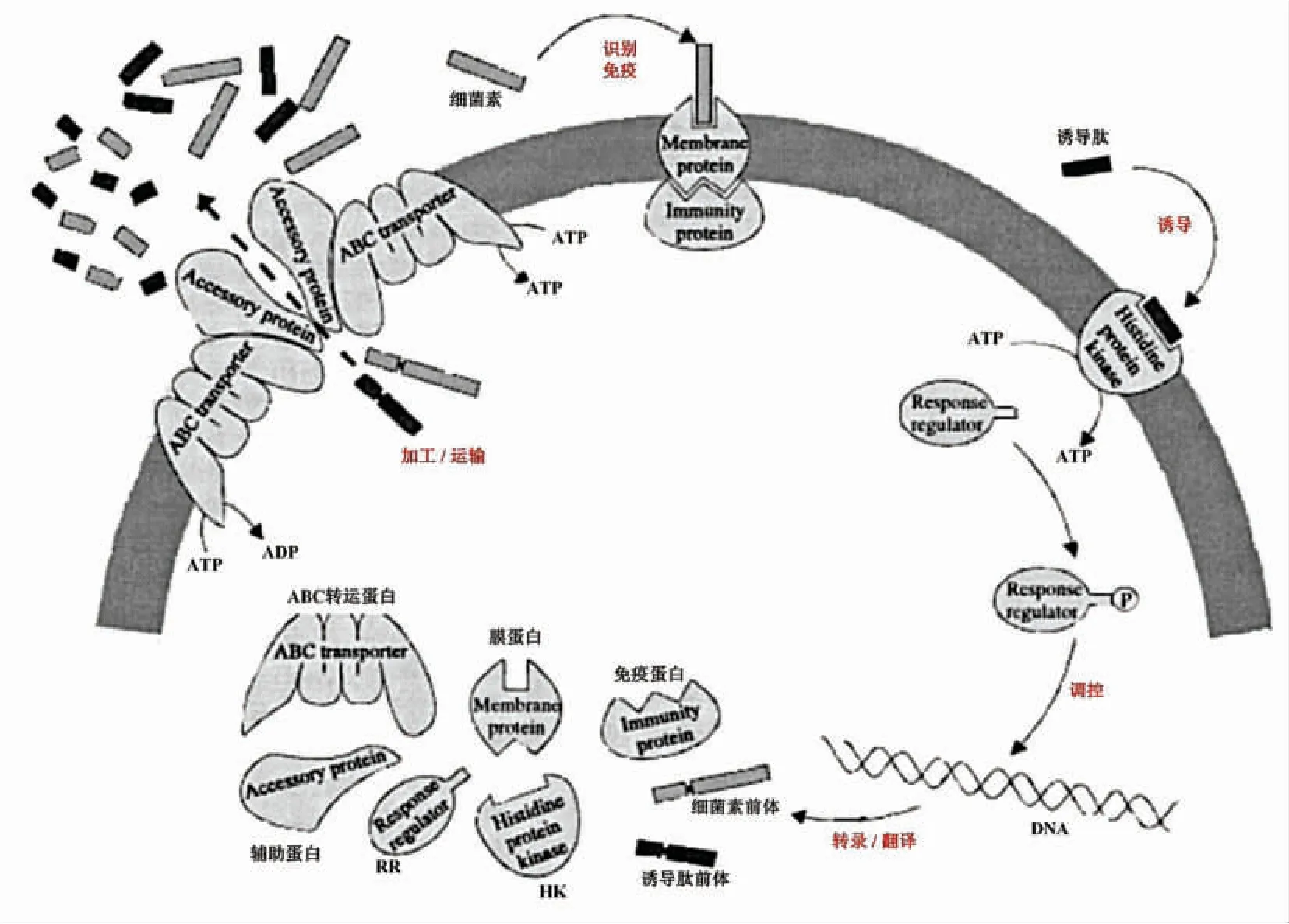
图2 细菌素的诱导、合成、运输及自身免疫[57]Fig.2 The induction,synthesis,processing,transportation and self-immunity of bacteriocin[57]
2.2 AI-2 诱导乳酸菌细菌素合成
2.2.1 AI-2 来源及形成 与AIP 不同,AI-2 作为种间细胞交流的通用信号,由S-核糖同型半胱氨酸裂解酶(S -ribosylhomocysteine lyase,SRL/LuxS)催化合成[66-67]。如图3 所示,有2 条循环途径,均以S-腺苷甲硫氨酸(S-adenosyl-methionine,SAM)作为甲基供体,将甲基转移给其它底物后,转化为S-腺苷同型半胱氨酸(S-adenosyl-homocysteine,SAH),然后,由途径Ⅰ和途径Ⅱ对有毒中间产物SAH 进行回收。途径Ⅱ下的SAH 经S-腺苷同型半胱氨酸核苷酶(S-adenosylhomocysteine nucleosidase,SAN/Pfs)水解生成S-核糖同型半胱氨酸(S-ribosyl-homocysteine,SRH),SRH再经LuxS 催化生成4,5-二羟基-2,3-戊二酮(4,5-Dihydroxy-2,3-pentandione,DPD)和同型半胱氨酸,由于DPD 结构不稳定发生分子重排,转化为信号分子AI-2[68]。而途径Ⅰ为甲硫氨酸循环(methionine cycle),不产生AI-2,因此Pfs 和LuxS 同为合成AI-2 的关键酶和限速酶。最后,同型半胱氨酸依次经MetH/ MetE 和SAM 合成酶合成SAM。目前关于乳杆菌属分泌AI-2 的报道较多,主要是植物乳杆菌[21]。孙思睿等[69]发现含有LuxS 基因的植物乳杆菌KLDS1.0391 在缺失该基因片段的情况下,菌株产细菌素能力和盐胁迫下的生长代谢能力均显著降低。张腾[70]从HE-1 中扩增出LuxS 基因,并与其它植物乳杆菌的该基因序列比较,同源性达到99%。此外,Jenabian 等[71]报道了鼠李糖乳杆菌GG、嗜酸乳杆菌NCFM、唾液乳杆菌UCC118、约氏乳杆菌NCC 533 这4 株乳杆菌均可分泌AI-2 信号。AI-2 与AIP 相似,外界因子在一定程度上刺激细胞而引起LuxS 基因表达上调,使AI-2 的产量增加。田甜等[72]从枯草芽孢杆菌分离出对副干酪乳杆菌HD1.7(含LusX 基因)合成AI-2 有增强作用的肽类刺激因子。
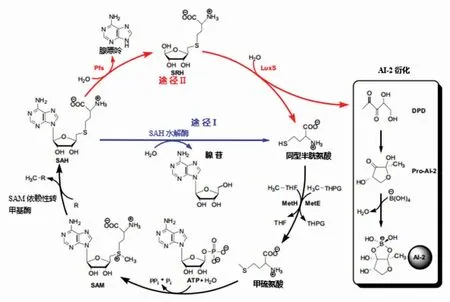
图3 AI-2 的合成途径[73]Fig.3 The synthetic pathway of AI-2[73]
2.2.2 AI-2 信号转导机制 虽然目前AI-2 诱导细菌素的机制尚不明确,但是在其基因调控方面有较详细的报道。LuxS/AI-2 QS 系统在哈维氏弧菌中被首次发现,并且其与调控生物发光有关[74]。之后,陆续在许多革兰氏阴性菌和阳性菌中发现[75]。在哈维氏弧菌的生物发光机制中,LuxP 和LuxQ 分别负责识别AI-2 和基因调控[76]。LuxS/AI-2 QS 系统与AIP QS 系统的信号转导机制相似,而胞内调节机制稍有差异。当胞外无AI-2 或AI-2 处于较低浓度时,LuxP 未识别到AI-2,胞内LuxQ 仍与LuxP 结合并处于激酶的状态,将磷酸基团通过磷酸转移酶LuxU 和σ54转移给LuxO,随后LuxO-P 与伴侣蛋白Hfq 一起激活产生具调节作用的sRNAs,这些sRNAs 通过破坏LuxR 的mRNA 的稳定性,进而抑制LuxR,而LuxR 负责激活荧光基因及其它靶基因的转录,因此,此时细胞不会产生荧光;当AI-2 处于较高浓度并与LuxP相结合时,这会使LuxP/Q 由激酶转变为磷酸酶,LuxU-P 和LuxO-P 则被去磷酸化而失去活性,此时LuxR 能够被正常表达,从而激活荧光基因使细胞发出荧光[77-78]。因为AI-2 可能调控某一细胞的多种表型,所以一个细胞存在多种不同的双组分系统,表现出不同的特性以适应外界环境变化。
虽然没有报道指出AI-2 直接参与乳酸菌细菌素的表达,但是研究表明,AI-2 确实在细菌素的表达上起重要作用,如:张筠等[79]在培养植物乳杆菌KLDS1.0391 时,外源添加AI-2 并观察PlnEF 表达的变化,发现AI-2 对细菌素的表达起正向调控作用。对于拥有LuxS/AI-2 QS 系统的植物乳杆菌KLDS1.0391,Man 等[80]利用蛋白质组学分析比对植物乳杆菌KLDS1.0391 的LuxS 突变型菌株与野生型菌株的蛋白表达差异,发现LuxS缺失引起AIP 诱导的双组分系统中HK 蛋白表达水平下调,以及在碳水化合物代谢、氨基酸代谢、脂肪酸合成代谢中蛋白表达水平也发生变化,并证明植物乳杆菌KLDS1.0391 产生细菌素的能力与AI-2 活性呈正相关。这些说明AI-2 可能是通过调节细胞其它生理代谢活动,来提供合成细菌素所需的底物和能量。也有研究指出,同一乳酸菌中LuxS/AI-2 QS 系统与AIP QS 系统的双组分系统是一致的[81],说明AI-2 与AIP 受体之间具备一定特异性结合能力,可能是由于HK 识别AIP后,其蛋白结构发生改变,形成可与AI-2 结合的结构域,导致AI-2 与AIP 共同作用于细菌素的诱导调控。
2.3 共培养诱导
共培养是更复杂的培养体系,可能是多种信号诱导和细胞刺激共同作用的过程(如图1 途径(4)所示)。不论是AIP 还是AI-2 诱导,在单独培养乳酸菌时,其细菌素产量很低,以致无法检测到细菌素活性,分离纯化更是十分困难。然而,乳酸菌在与诱导菌(如靶细菌、产诱导信号细菌等)共培养或在多菌培养环境中,都能产生细菌素。某一乳酸菌与其它乳酸菌共培养[82-83],或与沙门氏菌、大肠杆菌、哈维氏弧菌等致病菌共培养[84-86],乳酸菌均可以利用其它菌种产生的更充足的特定诱导信号或细胞之间的接触刺激,增强其产细菌素的能力。Di Cagno 等[87]将旧金山乳杆菌DPPMA174和戊糖片球菌2XA3 与植物乳杆菌DC400 共培养,检测到2 种菌均使植物乳杆菌DC400 中诱导肽PlnA 的含量不同程度地提高。Maldonado-Barragán 等[47]发现,同一诱导菌可以诱导分别含有plNC8IF 和plnA 2 种调控子的不同植物乳杆菌菌株,表明诱导菌的作用方式与乳酸菌产生AIP 无关。而双组分系统是诱导型细菌素的必需部分,在共培养条件下,细胞之间的竞争会促进或抑制HK-RR 双组分系统介导信号转导通路的细菌素合成途径。同时,某些诱导菌的代谢活动可以形成更适宜于乳酸菌产细菌素的环境。酸的积累使pH值降低是产细菌素的一个限制因素,乳酸菌与酵母菌共培养时,酵母菌能够利用乳酸菌生长中产生的乳酸、乙酸和丙酸等有机酸,使pH 值恢复回接近中性并保持恒定,有利于乳酸菌细菌素的合成[88]。在“热灭活诱导菌或活诱导菌”[89]和“只有活诱导菌”[90]的存在下,能检测到乳酸菌被诱导并产生细菌素,而以无诱导菌细胞上清液作为诱导剂,均无法检测出细菌素活性,说明只有乳酸菌及其它菌种活细胞共同存在,才是共培养下诱导乳酸菌产生细菌素的必要条件之一。然而,乳酸菌也存在与某些细菌共培养,其产细菌素被抑制的情况。Domínguez-Manzano 等[91]将植物乳杆菌NC8C 和屎肠球菌6T1a 共培养,发现这2 株菌的产细菌素能力相互抑制,在其它发酵食品中分离的乳酸菌之间也有此现象。
3 复杂环境下的QS 信号识别网络
乳酸菌在识别细菌素诱导信号时,会受到复杂环境因素的干扰。第一,受体识别QS 信号分子受阻。存在某些小分子抑制物质或大分子抗体或水解酶,会阻碍AI 的产生或转导,该现象被称为群体猝灭(quorum quenching,QQ)[92]。在QS 系统中,人们利用某种拮抗剂对QS 信号进行降解或阻断其信号通路,从而抑制细胞生长这一手段常被用来控制病原菌,如抑制生物膜和毒性的形成[93-94]。研究证明,生物膜是致病菌形成耐药性和产生毒性的主要原因之一,与游离的致病菌相比,在生物膜下致病菌的组织传播能力和致病性更突出,因此阻断AI-2 的合成途径成为抑制这类致病菌的重要治疗手段[75,95]。Weiland-Bräuer 等[96]从宏基因组中筛选出一种氧化还原酶QQ-2,能有效抑制肺炎链球菌的生物膜形成。另外,Santamaría 等[97]利用全基因组转录分析,发现豆科植物中的橄榄苦苷(oleuropein)具备QS 拮抗剂的潜力,使与其共存的植物乳杆菌WCFS1 的QS 诱导调控基因和细菌素基因表达下调,说明QS 拮抗剂也可以促进宿主与有益菌之间的共生。第二,菌体微生物间还存在信号分子错配,即串扰(crosstalk)和窃听(eavesdrop)[98]:串扰常出现在2 种及以上菌种细胞之间的信号识别,它们可以相互识别对方产生的自诱导信号,能被抑制或激活;而窃听是某一菌种虽不产生信号但能对非己信号作出响应。例如,肺炎链球菌产细菌素的诱导机制中的Blp QS 系统会频繁出现信号的错配,信号BlpC 会被亲和力较弱的非同源受体BlpH 识别,表现出单一信号对应一个特定的受体集群,从而导致自诱导被弱化或无效化,而相应的肺炎链球菌内Com QS 系统几乎不存在信号错配现象[99]。Silva 等[100]借这种错配现象,以5 株不同枯草芽孢杆菌菌株为研究对象,构建QS 网络模型,通过设定这5 株菌共培养中所产生的5 种不同信号的混合浓度,可以定向串扰细菌群落中的某一菌种被QS 激活。而AI-2作为通用信号,在细胞通讯间因交叉反应引起错配的现象也更为常见。第三,培养基质也会影响QS 信号网络。Turgis 等[101]报道了pH、温度、碳源、氮源对乳酸乳球菌MM19 和乳酸片球菌MM33产细菌素的影响,适宜的产细菌素条件取决于菌种自身的生长特性。培养条件的不同会改变代谢物质的转化速率或方向,从而影响诱导信号的表达及细菌素合成所需成分的获取。Caballero-Guerrero 等[102]在外源添加AIP 的条件下液体培养植物乳杆菌,调节NaCl 含量并观察产细菌素情况,发现NaCl 含量提升到2%以上时,在液体培养基中检测不到细菌素活性,说明较高NaCl 离子浓度抑制了细菌素的诱导产生,而在无外源AIP 共培养时,NaCl 含量提升到4%后,仍能在培养基中检测出细菌素活性,这可能是由于在同一生长环境下,菌种之间可以相互削弱环境压力;而且,由其它细胞分泌的酶、次级代谢产物,也会引起竞争干扰的作用[103]。
4 展望
目前,为应对应用型细菌素种类少,成本高,新型细菌素产量低等问题,不断发现新的细菌素,研究其诱导机制、合成机制以及高效表达方法,成为解决这些问题的重要手段。乳酸菌细菌素为有效对抗有害菌的生物活性物质,通过深入分析其产生的细胞通讯机制,建立特定的QS 调控系统(如已知的Nisin 生产中应用的NICE 系统)[104],以诱导机理为理念进行生产设计[105],异源表达[106]等方法来提高细菌素基因的表达或获取诱导信号。也可以利用QS 系统高度灵敏的感知能力、生物相容性和可再生性,构建监测和控制有害微生物的生长状况的一类生物传感器,如通过对革兰氏阴性菌特有的AHL 信号检测并利用QS 拮抗剂,达到快速、及时抑制某些致病菌的目的[107];还可以建立检测诱导信号阈值的生物传感器,这有利于人为添加准确的信号浓度来控制乳酸菌快速表达细菌素。对于作用更广泛的LuxS/AI-2 QS 系统,利用AI-2 和AIP 的协同作用,可有效提高乳酸菌细菌素产量。综上,深入了解乳酸菌细菌素产生的细胞通讯机制,对于促进乳酸菌细菌素的研究和应用具有重要意义。

