HDAC抑制剂对脉络膜黑色素瘤细胞系C918细胞增殖的影响及相关机制
张益萌,杨瀚毅,宁佳怡,闫小龙,韩 静
0 引言
作为成人最常见的眼内肿瘤,脉络膜黑色素瘤(choroidal melanoma, CM)的发病率仅低于视网膜母细胞瘤,是位居眼内肿瘤发病率第二位的恶性肿瘤[1]。CM病情复杂,恶性程度高,预后极差,易通过血行转移累及肝脏,由于缺乏特异的治疗手段,导致患者的长期生存率较低[2-4]。目前临床上针对CM患者的主要治疗手段包括激光疗法、放射治疗、眼球摘除术等[4-5]。值得指出的是,出于降低肿瘤细胞转移率和提高患者生存率等方面的考虑,过去对CM的治疗常采用眼球摘除术,但并未明显降低CM转移率以及患者生存率[6-8],并且其作为一种破坏性手术,给患者带来了极大的身心影响。因此,在保留眼球和视力的前提下,探寻有效提高CM患者生存率,且无创伤的治疗方法成为了目前亟需解决的问题。组蛋白去乙酰化酶(histone deacetylase, HDAC)是一种酰胺水解酶,通过调控组蛋白赖氨酸位点的乙酰化和去乙酰化动态平衡参与染色质结构修饰和基因表达。研究发现多种肿瘤细胞中HDAC过度激活,使组蛋白去乙酰化增强,在肿瘤细胞凋亡、增殖和分化等过程中发挥重要作用[9-10]。因此,HDAC成为了研究抗癌药物的重要靶点。HDAC抑制剂(histone deacetylase inhibitors, HDACi)通过改变组蛋白和非组蛋白的乙酰化状态,诱导肿瘤细胞的凋亡、分化、抑制细胞增殖,从而表现出抗癌活性[11-15]。作为HDACi的重要代表之一,辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid, SAHA)已经在临床用于治疗皮肤T细胞淋巴瘤[10]。同时,研究表明SAHA在多种肿瘤模型中都能够通过单一或联合用药发挥有效的抗肿瘤作用[11]。成纤维细胞生长因子18(fibroblast growth factor 18,FGF18)参与了细胞分化,血管形成,关节软骨的修复,同时已有证据表明,FGF18在肿瘤细胞增殖以及促迁移和侵袭能力方面发挥重要作用[16]。本研究旨在探讨SAHA对CM细胞系C918细胞增殖的影响以及对FGF18的调控作用,进一步阐明CM的发病机制,并为SAHA治疗CM提供新的实验依据。
1 材料和方法
1.1材料
1.1.1细胞培养C918细胞培养于含10%胎牛血清、10U/mL青、链霉素双抗的DMEM高糖(Corning, USA)培养基,并置于37℃、5% CO2恒温培养箱中进行贴壁培养。取对数生长期细胞(细胞增殖至85%左右),弃旧培养基,PBS涮洗3遍,加入胰蛋白酶进行消化传代。
1.1.2主要试剂脉络膜黑色素瘤细胞系C918购自湖南丰晖生物科技有限公司;青链霉素购自上海格来赛生命科技有限公司;胎牛血清购自以色列Biond Biologics公司;β-actin单克隆抗体、c-Myc抗体、CDK2抗体、CyclinA2抗体和FGF18抗体购自CST公司;SAHA购自MedChemExpress(Monmouth Junction, NJ, USA);BeyoClickTMEdU-594试剂盒购自上海碧云天生物技术有限公司;增强型细胞活力检测试剂盒(CCK-8)购自上海七星复泰生物科技有限公司;DMSO购自天津市富宇精细化工有限公司。
1.2方法
1.2.1细胞形态学观察将C918细胞接种于培养皿中,随机分为空白对照组、SAHA 0.625、1.25、2.5μmol/L组。观察细胞的贴壁率及细胞形态,当细胞贴壁后按照药物梯度分别处理48h,利用倒置荧光显微镜观察各培养皿内细胞形态的变化。

1.2.3细胞平板克隆形成实验检测细胞集落形成能力用胰蛋白酶消化C918细胞,低速常温离心收集细胞沉淀,加入培养基吹打混匀,进行细胞计数,调整细胞密度为1×105/mL,倍比稀释至1×103/mL,将混匀的细胞悬液接种于培养板中。待细胞生长稳定后,加入SAHA 1.25μmol/L处理48h,空白对照组加入同等量的DMSO。48h后,换用新培养基继续培养细胞14d。每孔加入4%多聚甲醛1mL,固定细胞15min,去除固定液,加入适量结晶紫染液30min,然后用水冲洗,放置常温干燥。用Image J计克隆数,计算克隆形成率。
1.2.4EdU染色法检测细胞增殖取对数生长周期的C918细胞,常规操作,消化细胞,制成单细胞悬液,以8×104个/皿接种于共聚焦皿中。细胞培养过夜或状态稳定后,加入SAHA 1.25μmol/L处理48h,空白对照组加入同等量的DMSO。稀释EdU原液,每孔加100μL 50μmol/L EdU培养基,培养箱中孵育2h,弃旧培养基,PBS洗细胞3次。加入4%多聚甲醛固定,30min后弃固定液。每孔加入0.3% Triton X-100 100μL,室温处理15min。配制Click反应液,室温避光孵育35min。弃反应液,1mL的PBS洗3次。制备适量1000×Hoechst 33342反应液,避光保存。每孔加入100μL 1× Hoechst 33342反应液,避光、室温、孵育35min后,弃结晶紫染色反应液,每孔加入1mL的PBS洗3次。
1.2.5细胞蛋白质提取和定量收集培养48h的各组C918细胞,冰板上操作,倒干培养基,预冷的PBS洗3遍,用负压吸引器将PBS吸净。每皿加入约200μL裂解液,收集细胞裂解液于1.5mL离心管中,4℃裂解20min,在低温高速离心机中4℃ 12 000r/min离心20min,取上清液用BCA法行蛋白定量,加入5×loading buffer煮沸8min。
1.2.6Westernblot检测蛋白表达每孔上样相同蛋白量,置于电泳缓冲液中电泳,电泳结束后,采用恒压90V湿转90min,将蛋白转至PVDF膜,用5%脱脂奶粉室温下摇床慢速封闭2h,将目的条带切下,置于相应一抗中并在4℃下孵育过夜。第2d用TBS缓冲液(TBST)漂洗PVDF膜3次,每次10min。室温下摇床孵育二抗120min,采用Bio-Rad ChemiDocXRS+化学发光仪进行灰度值检测,用Image Lab软件统计各目的蛋白的相对表达。以β-肌动蛋白(β-actin)作为内参。
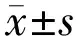
2 结果
2.1SAHA呈浓度依赖性降低C918细胞活力空白对照组C918细胞形态呈梭形,48h后细胞密度达到90%(图1A)。给予不同浓度SAHA药物处理48h后,C918细胞表现出不同程度的形态学改变,表现为细胞皱缩变形,且细胞贴壁不良、生长显著受到抑制,细胞密度逐渐减小,该作用随药物浓度的升高更为明显(图1B~D)。当药物浓度增加到2.5μmol/L时,细胞出现明显死亡(图1D)。CCK-8检测结果显示,空白对照组、SAHA 0.625μmol/L组、SAHA 1.25μmol/L组、SAHA 2.5μmol/L组C918细胞存活率分别为(100±7)%、(77±10)%、(58±12)%、(22±14)%。与空白对照组相比,SAHA呈浓度依赖性地抑制C918细胞活力(均P<0.05),药物浓度为2.5μmol/L时抑制率达80%。

图1 不同浓度SAHA对C918细胞形态和活力的影响 A:空白对照组;B:SAHA 0.625μmol/L组;C:SAHA 1.25μmol/L组;D:SAHA 2.5μmol/L组。
2.2SAHA呈浓度依赖性降低C918细胞增殖相关蛋白的表达SAHA可呈浓度依赖性地降低C918细胞中增殖相关蛋白c-Myc以及细胞周期蛋白CyclinA2和CDK2的表达(图2),与空白对照组(100.00±0.00)%相比,差异均有统计学意义(P<0.05)。当SAHA浓度为0.625μmol/L时,将c-Myc、CyclinA2和CDK2的蛋白相对表达量分别降低到(67.33±2.08)%、(71.66±1.52)%和(75.00±5.00)%;当SAHA浓度为1.25μmol/L时,c-Myc、CyclinA2和CDK2的蛋白相对表达量分别降低到(45.67±1.52)%、(42.67±4.04)%和(52.33±2.52)%;而当SAHA浓度为2.5μmol/L时,其抑制作用最明显,c-Myc、CyclinA2和CDK2的蛋白相对表达量分别降低到(29.00±2.53)%、(28.00±6.69)%和(35.00±5.00)%。

图2 SAHA作用下C918中细胞增殖相关蛋白的表达 c-Myc、CyclinA2和CDK2的蛋白表达检测条带。
2.3SAHA可降低C918细胞EdU染色和细胞集落形成能力SAHA浓度为1.25μmol/L时,可将EdU染色阳性细胞数比例降低到(13.80±4.50)%,与空白对照组的阳性比例(34.80±1.64)%相比,差异具有统计学意义(P<0.01),见图3A。同时,细胞克隆实验显示,与空白对照组(142.67±8.74)%相比,1.25μmol/L SAHA组(49.33±14.76)%细胞克隆数显著减少,差异具有统计学意义(P<0.01),见图3B。

图3 SAHA对C918细胞EdU染色和细胞克隆的影响 A:EdU染色图;B:细胞克隆实验图。
2.4SAHA呈浓度依赖性抑制C918细胞中HDAC7和FGF18表达Western blot结果显示,与空白对照组相比,随着SAHA处理浓度的增加,C918细胞中HDAC7和FGF18蛋白相对表达量显著降低,见图4。当SAHA浓度为0.625μmol/L时,HDAC7和FGF18蛋白相对表达量分别下降到(75.67±1.53)%和(75.00±4.36)%,与空白对照组(100.00±0.00)%比较差异均具有统计学意义(P<0.05);当SAHA浓度为1.25μmol/L时,HDAC7和FGF18蛋白相对表达量分别下降到(46.67±3.61)%和(55.67±6.44)%,与空白对照组比较差异均具有统计学意义(P<0.01);当SAHA浓度为2.5μmol/L时,HDAC7和FGF18蛋白相对表达量分别下降到(30.33±5.14)%和(41.67±7.97)%,与空白对照组比较差异均具有统计学意义(P<0.01)。

图4 不同浓度SAHA对HDAC7和FGF18蛋白表达量的影响HDAC7和FGF18的蛋白表达检测条带。
3 讨论
作为成人发病率最高的眼内肿瘤,大多数的CM患者被诊断时已经发生远处转移,其中以肝转移最为常见[17-18]。目前CM治疗缺乏特异性强的化疗策略[19],临床治疗采用的肿瘤手术切除常需联合眼球摘除,创伤大,但却很难有效降低其复发率和转移率,同时对患者的心理和远期生存质量均会产生极大负面影响。因此,对肿瘤的早期发现并对其生长进行阻断是降低肿瘤复发率、转移率,以及提高患者生存率的重要因素。
SAHA作为经典的HDACi之一,能够在对正常细胞几乎没有毒性作用的浓度下发挥有效的抗肿瘤效应。同时,研究证明SAHA能抑制耐药性黑色素瘤生长[20-21]。另外,已有研究指出HDACi能抑制非小细胞肺癌A549、H1299细胞系的增殖。恶性肿瘤细胞最主要的危害是具有无限增殖的潜能。而SAHA在多种恶性肿瘤中都表现出了较强的抑制肿瘤生长的作用[22-24],然而其在CM细胞中是否具有抑制细胞生长的作用并不清楚。本研究发现,SAHA对C918细胞增殖具有明显的抑制作用,且SAHA浓度介于0.625~2.5μmol/L,该药物随着浓度的增加抑制作用也增强,这与其在肺癌肿瘤中的作用相一致。以上结果表明,SAHA在CM细胞系C918细胞中发挥明显的抑制细胞增殖的作用。
研究发现,HDAC7在多种肿瘤中均能起到促进肿瘤细胞增殖的作用[25-28],且该作用与上调FGF18信号通路相关。而FGF18在细胞分化和生长,炎症反应,组织修复,血管新生,骨骼生长以及肿瘤细胞增殖中扮演了重要角色[29-34]。作为HDAC家族抑制剂,SAHA抑制C918细胞增殖的作用是否与调节HDAC7/FGF18信号有关还不清楚。此外,以往研究表明,在肺癌中SAHA能够通过抑制HDAC降低c-Myc和CyclinA2的表达,发挥抑制细胞增殖的作用。本实验结果也显示,SAHA处理的C918细胞中c-Myc和CyclinA2的表达显著降低;同时,细胞周期蛋白CDK2的表达也随之降低。更为重要的是,SAHA还能够浓度依赖性抑制HDAC7和FGF18在C918细胞中的表达。以上实验结果表明,SAHA能够通过抑制HDAC7/FGF18信号,降低增殖相关蛋白c-Myc、细胞周期蛋白CyclinA2、CDK2的表达。
综上所述,本实验探讨了SAHA对C918细胞增殖影响的相关机制,证明SAHA能够通过调控HDAC7/FGF18信号抑制C918细胞增殖,这为SAHA应用于CM患者临床治疗提供了一定的理论依据。需要指出的是本次研究仍有一定的局限性,由于本研究只采用了一种CM细胞系,故此次研究结论对其他CM细胞系是否可以推广暂不能确定。因此SAHA对其他CM细胞系的增殖、代谢、转移等相关生物学功能的影响及机制研究将是我们要进一步探讨的问题。

