静脉滴注榄香烯联合腹腔热灌注化疗治疗胃癌腹腔转移的效果
黄永红,萧嘉铭,刘美媛
胃癌是严重危害人类健康的恶性疾病,中国癌症统计数据显示,中国胃癌的发病率居全部恶性肿瘤的第2位,病死率居全部恶性肿瘤的第2位,其中男性和女性的发病率分别居第2位和第3位,男性和女性的病死率均居第2位[1]。腹膜转移是晚期胃癌患者死亡的首要原因,与原发肿瘤穿透全层胃壁至浆膜外脱落、术中肿瘤细胞脱落到腹腔生长等因素有关。研究表明,约20%的胃癌患者在术前或术中被诊断为腹膜转移,50%的T3、T4期患者于胃癌根治术后发生腹膜转移[2]。胃癌无腹膜转移患者的5年生存率达75%,而发生腹膜转移患者的自然生存期常常小于6个月[3]。腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy, HIPEC)是治疗胃癌腹膜转移的有效手段,可以改善患者的生活质量,延长生存期;然而HIPEC与常规的静脉化疗一样有明显的毒副作用,生存期仍然不够理想,给晚期胃癌患者的治疗带来新的挑战与困扰[4]。榄香烯是我国首先从姜科植物温郁金(莪术)的根茎中提取的抗肿瘤有效成分[5],是我国自主研发的抗癌中药,但将其应用于晚期胃癌的研究报道较少,本文通过对108例胃癌HIPEC患者的临床资料进行回顾性分析,探讨静脉滴注榄香烯联合HIPEC在胃癌腹腔转移治疗中的临床疗效。
1 资料与方法
1.1 一般资料 回顾性分析广州医科大学附属肿瘤医院2017年1月至2019年12月因胃癌腹腔转移行HIPEC的患者108例。纳入标准:1)所有患者均经病理检查证实为胃腺癌;2)均由病理活检证实存在腹腔转移癌,或腹水检查出癌细胞;3)均顺利完成3次HIPEC治疗;4)入院时的KPS(Karnofsky)评分>40分。排除标准:1)伴有严重心、肺、肝、肾疾病,无法耐受HIPEC;2)合并肠梗阻,腹腔容量小;3)既往接受过免疫治疗。纳入本研究的患者根据是否联合静脉滴注榄香烯分为观察组和对照组,其中观察组50例,对照组58例,两组患者治疗前的一般资料对比差异无统计学意义(表1)。

表1 两组患者一般资料比较
1.2 治疗方法 所有纳入患者采用常规的HIPEC方案,分别在患者的腹腔左、右膈下及两侧盆腔各放置灌注引流管1条,一般上腹部2条作为进水管,盆腔2条作为出水管,可根据管道通畅情况进行调整。设定灌注温度为43 ℃,持续灌注60 min,灌注容量为3 000~5 000 mL。灌注前常规使用苯海拉明和地塞米松进行抗过敏预处理,灌注后进行心电监测及吸氧,第2天抽血复查血常规、生化相关指标,评估骨髓抑制和肝肾功能情况,若无明显禁忌,第2天进行下一次HIPEC。根据体表面积灌注化疗药物紫杉醇1.75 mg/m2,分2次进行,第3次腹腔热灌注洛铂30 mg/m2。所有患者每次入院时均检测血常规、生化相关指标、肿瘤指标及免疫相关指标。HIPEC期间常规进行静脉营养、护胃、护肝对症处理。观察组在上述治疗的基础上额外静脉滴注榄香烯,将榄香烯400 mg配500 mL生理盐水静脉滴注,每天1次。
1.3 观察指标 1)HIPEC治疗结束后,下一次返院静脉化疗时(4周后)评估HIPEC的治疗效果。根据WHO实体瘤治疗效果评价标准进行疗效评价:完全缓解(complete response, CR):肿瘤病灶完全消失,肿瘤标志物在正常水平;部分缓解(partial response, PR):肿瘤灶直径降低大于30%,或原有腹水的患者无新增腹水;疾病稳定(stable disease, SD):肿瘤灶直径降低小于30%或增加小于20%,或腹水恢复至上次治疗前水平;疾病进展(progressive disease, PD):肿瘤灶直径增加超过20%或出现新的肿瘤灶或腹水较上次治疗前增多;总有效率(overall response rate, ORR)=(CR例数+PR例数)/总例数×100%,疾病控制率(disease control rate, DCR)=(CR例数+PR例数+SD例数)/总例数×100%。2)两组患者治疗前后肿瘤指标癌胚抗原(CEA)、CA199、CA125的变化;3)两组患者治疗前后免疫功能指标CD3+、CD4+、CD8+、CD4+/CD8+的变化;4)两组患者腹腔热灌注化疗并发症的发生情况;5)随访记录两组患者的总生存期(overall survival, OS)。
1.4 统计学方法 采用GraphPad Prism 9.0软件进行统计分析,计数资料采用例(%)表示,组间比较使用χ2检验;计量资料采用均数±标准差表示,组间比较使用t检验;生存分析使用Logrank检验;P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后免疫功能相关指标比较治疗前,两组患者的T淋巴细胞亚群(CD3+、CD4+、CD8+和CD4+/CD8+)分析差异无统计学意义(P>0.05)。治疗后,两组CD8+比例差异无统计学意义(P>0.05),观察组的CD3+、CD4+和CD4+/CD8+比例均显著高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组患者免疫功能相关指标比较
2.2 两组患者治疗前后相关肿瘤标志物水平比较 治疗前,两组患者肿瘤标志物CEA、CA199、CA125的表达水平差异无统计学意义(P>0.05),治疗后,两组肿瘤标志物均有不同程度下降(P<0.05),两组CEA表达水平差异无统计学意义(P>0.05),观察组CA199、CA125的表达水平显著低于对照组,差异有统计学意义(P<0.05),见表3。

表3 两组患者治疗前后肿瘤标志物水平比较
2.3 两组患者不良反应比较 两组腹部胀痛及恶心呕吐发生率差异无统计学意义(P>0.05),观察组的骨髓抑制、肝功能损害和肾功能损害发生率均显著低于对照组,差异有统计学意义(P<0.05),见表4。

表4 两组患者不良反应比较[n(%)]
2.4 两组患者短期疗效比较 观察组的短期ORR显著优于对照组,差异有统计学意义(P<0.05),但两组患者的短期DCR比较差异无统计学意义(P>0.05),见表5。
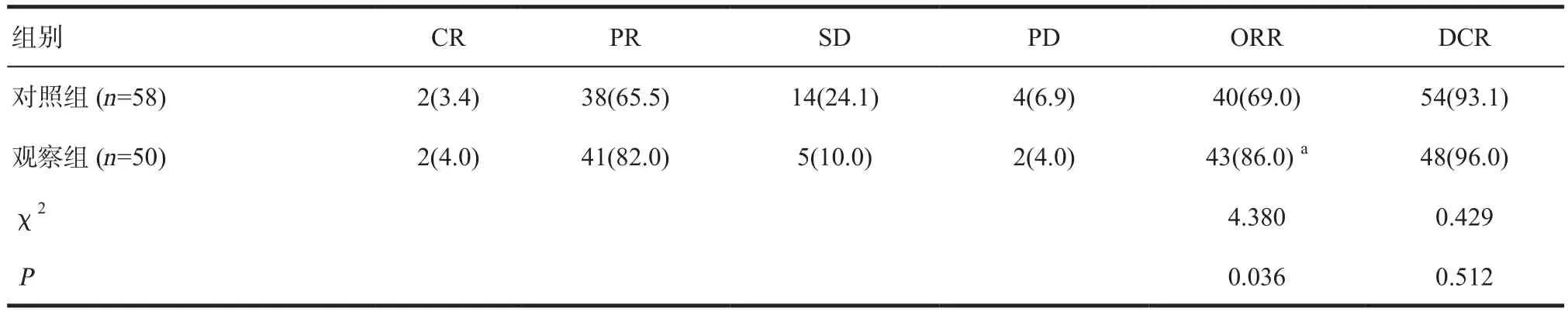
表5 两组患者临床短期疗效 [n(%)]
2.5 两组患者OS比较 随访发现,观察组的中位OS为10.5个月,显著高于对照组的9个月,两组患者生存曲线差异有统计学意义(P=0.038),见图1。

图1 两组患者生存分析曲线
3 讨论
HIPEC是通过一套精密的腹腔内灌注治疗系统实现对腹腔内热化疗的精准控温、循环灌注,从而达到预防和治疗腹腔恶性肿瘤的目的[6]。正常组织在47 ℃条件下能耐受1 h以上,而恶性肿瘤细胞能耐受的温度仅为43 ℃。研究发现,43~45 ℃的高温对人体的正常组织没有损伤,但却能对癌细胞产生致死效应,同时,化疗药物在加温条件下,抗肿瘤作用会明显增强。因此,如果将“热”与具有抗癌作用的化疗药物相结合,就可以达到热化疗增敏、热化疗协同抗癌的双重作用[7]。HIPEC用于胃癌腹膜转移的治疗,对胃癌腹膜转移的控制率较高,且可延长患者的生存期,改善生活质量[8]。近年来本研究单位对于胃癌腹腔转移患者无明显禁忌证时常规进行HIPEC治疗,中位OS可达10个月,而常规单纯静脉化疗的患者中位OS仅有6个月,效果显著[3]。
目前的榄香烯制剂以β-榄香烯为主要成分,同时含有少量γ-和δ-榄香烯及其他萜类化合物,三者均为抗癌活性物质,统称为榄香烯,是一种广谱抗癌药物,相对于大多数化疗药物而言,具有安全性高和耐药性低等优点,对常规的化疗药物具有补充、替代的作用[5]。一项榄香烯联合吉非替尼治疗晚期肺癌的临床研究显示,联合榄香烯治疗组的治疗效果明显优于单纯吉非替尼组患者,疾病控制率由58.1%上升至83.3%,中位无进展生存期(PFS)由4个月延长至4.2个月,治疗后的生命质量和免疫功能方面也均优于对照组[9]。有Meta分析纳入46项文献研究榄香烯治疗恶性胸腔积液的效果,结果发现榄香烯可以显著改善恶性胸水的总控制率[10]。在以铂类为基础的III/IV期非小细胞肺癌化疗中,辅助静脉注射榄香烯可明显提高化疗患者的疾病控制率、总有效率、生存期和生活质量,T淋巴细胞亚群中CD4+和CD4+/CD8+百分比明显高于对照组,免疫功能改善,化疗毒副作用降低[11],与本研究结果一致。有Meta分析纳入了16项随机对照临床研究结果显示,对于进展期胃癌,静脉化疗联合静脉注射榄香烯可明显提高胃癌患者的总有效率,提高生活质量的KPS评分,减少骨髓抑制引起的白细胞、中性粒细胞、血红蛋白和血小板减少[12]。本研究在晚期胃癌的HIPEC治疗中辅助静脉滴注榄香烯,可显著改善患者的免疫功能,减少毒副作用,提高HIPEC治疗的临床效果,延长生存期,与文献报道的结果类似。
榄香烯是以中医理论的“散结化血、抗癌解毒”治疗癌肿原则,通过临床实践及基础研究反复验证,以分子配伍理论指导,利用现代靶向制剂技术研制成功的抗癌新药,其抗癌机制涉及诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖、肿瘤细胞周期停滞和坏死等多方面[13]。宫颈癌细胞株与榄香烯在体外共培养实验研究显示,榄香烯可以通过增强p53和Bax的表达并抑制Bcl-2的表达来诱导宫颈癌细胞凋亡,通过下调基质金属酶(MMP)-2和MMP-9表达水平来抑制细胞迁移和侵袭,降低了β-catein及其下游靶分子TCF7的表达水平,从而导致宫颈癌细胞中的c-Myc、Cyclin D1、Bax和MMP-2靶蛋白水平降低,进而抑制宫颈癌细胞增殖和侵袭[5]。此外,榄香烯通过调节miR-1323/Cbl-b/EGFR信号轴可以抑制多重耐药胃癌细胞的转移[14]。KRAS突变型结直肠癌细胞培养和动物体内实验显示,榄香烯可以作为一种新型的铁死亡诱导剂,改变KRAS突变型结直肠癌对西妥昔单抗耐药的问题,其机制可能涉及诱导铁死亡和抑制上皮间质转化[15]。此外,榄香烯的抗癌活性涉及了肿瘤免疫微环境的改变,在巨噬细胞浸润和M2极化以及调节免疫紊乱中起着至关重要的作用,它甚至可以调节转录因子NF-κB和STAT3以改变炎症、肿瘤发生和发展[16]。胃癌的发生、发展伴随着机体免疫功能的抑制,尤其是胃癌腹腔转移患者,各类增强免疫功能的淋巴细胞及细胞因子均有不同程度的下降[17]。CD3+、CD4+和CD8+是临床上评价机体免疫功能的常用指标。本研究中,胃癌腹腔转移患者经HIPEC治疗后,CD3+、CD4+和CD4+/CD8+的比例较治疗前均明显上升,肿瘤得到控制后机体免疫状态改善,尤其是观察组比例更高,表明榄香烯具有改善肿瘤患者免疫功能的作用。榄香烯的抗肿瘤免疫治疗机理涉及多个方面[18],榄香烯可以增加CD4+T细胞的转化生成,分泌相关细胞因子,增强细胞毒性T细胞的功能,直接杀伤肿瘤细胞,也可激活NK细胞和巨噬细胞参与抗肿瘤作用[16]。树突状细胞(DC)是目前已知的功能最强大的抗原呈递细胞(APC),常用来制作抗肿瘤疫苗,在小鼠胰腺癌动物模型中,榄香烯可显著增强白细胞介素(IL)-23修饰的DC疫苗发挥抗肿瘤作用[19]。体液免疫方面,榄香烯还可以调节肿瘤坏死因子(TNF)、IL和干扰素(IFN)的分泌,从而发挥抗肿瘤作用[16]。
榄香烯具有显著的独立抗肿瘤功效外[19],在肿瘤的辅助治疗方面也起到重要的作用。HIPEC治疗可引起部分患者轻度腹痛、腹胀,治疗结束后可自行缓解。恶心呕吐、肝肾功能损伤及骨髓抑制是化疗的常见不良反应,恶心呕吐主要是化疗药物引起5-羟色胺(5-HT)等物质的释放作用于大脑中枢所致;肝脏是化疗药物的代谢场所,化疗药物及其代谢产物容易引起肝细胞的损伤;化疗药物的代谢产物经肾脏排泄,容易对肾小球肾小管细胞造成损伤;化疗药物作用于肿瘤细胞增殖周期的不同环节,抑制DNA的分裂增殖能力,达到治疗肿瘤的目的,由于化疗药物的攻击缺乏高精度选择性,容易对骨髓红细胞系、粒细胞系及巨噬细胞系的增殖分化造成抑制,造成外周血白细胞、红细胞及血小板下降的骨髓抑制表现[20]。本研究中,榄香烯辅助治疗组骨髓抑制、肝功能损害和肾功能损害的发生率均显著低于对照组,表明榄香烯具有减轻化疗不良反应的功效,与文献报道的结果类似[21],其可能机制包括榄香烯提高了机体的免疫力,对化疗不良反应的耐受性增强,调节肝细胞、肾小管细胞的抗氧化酶活性,减少正常肝肾细胞的凋亡坏死,从而起到对骨髓及肝肾功能的保护作用[22]。本研究结果显示榄香烯辅助治疗组的OS明显高于对照组,证实榄香烯在晚期胃癌的辅助治疗方面效果显著,其可能原因包括榄香烯本身具有直接的抗肿瘤特性[15-16,19];另一方面,榄香烯提高了患者的抵抗力,减轻化疗不良反应,使患者对肿瘤治疗的耐受性增强[12,13];此外,榄香烯还可以逆转机体对化疗药物的耐药性,增强化疗效果[14,23]。
本研究回顾性分析了108例胃癌腹腔转移患者进行HIPEC治疗的临床资料,结果表明HIPEC治疗可以明显提高胃癌腹腔转移患者的OS,辅助静脉滴注中药榄香烯,可以更好地改善患者的免疫功能,减轻HIPEC治疗的毒副作用,提高短期的ORR并延长OS。本研究存在一定的局限性,样本量不多,临床资料不够全面;其是一项单中心的回顾性研究,可能存在较多混杂因素;本研究主要评价榄香烯静脉滴注的临床效果,后期可延伸至胃癌腹腔转移患者进行腹腔热灌注榄香烯治疗以及动物细胞基础实验的研究,进一步扩展抗癌中药榄香烯在晚期肿瘤中的应用,改善患者生活质量,延长生存期。

