黄芪甲苷预处理对大鼠肠缺血再灌注所致肺损伤的影响及其机制
王 蕾,杨 涛,李 曼,庞申月,鲁富泰,耿立成
肠缺血再灌注(ischemia/reperfusion, I/R)是腹部大手术患者围手术期的严重并发症,能够进展为肠源性脓毒症甚至多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),严重威胁着患者的生命健康[1]。肠I/R除影响肠组织本身之外,还能够造成远端器官的功能障碍,其中以肺脏受累最为常见[2]。本课题组前期研究证实,黄芪甲苷(astragaloside Ⅳ, AS-Ⅳ)灌胃预处理对肠I/R所致的肠损伤具有明确的保护作用,然而AS-Ⅳ对I/R所致肺损伤的作用仍不清楚[3]。本研究拟通过建立大鼠肠I/R模型,探讨AS-Ⅳ对肠I/R所致肺损伤的影响以及相关的分子机制。
1 材料与方法
1.1 材料
1.1.1 动物 健康成年雄性SPF级、体质量180~220 g的SD大鼠,购于北京维通利华实验动物技术有限公司。
1.1.2 主要药物与试剂 AS-Ⅳ购自上海源叶生物科技有限公司;白细胞介素(IL)-1β和IL-18的ELISA试剂盒购自武汉Elabscience公司。兔抗NLRP3单克隆抗体、兔抗ASC单克隆抗体、兔抗caspase-1单克隆抗体、小鼠抗GAPDH单克隆抗体均购自上海Arigo公司。
1.1.3 主要仪器设备 正置光学显微镜(德国Carl Zeiss公司);高速低温离心机(美国Thermo Fisher公司);酶标仪(美国BioTek公司);SDSPAGE凝胶电泳系统及全自动凝胶成像-分析系统(美国Bio-Rad公司)。
1. 2 方法
1.2.1 分组与给药 将45只SD大鼠按照随机数字表法分为3组:假手术(sham)组、肠缺血再灌注(I/R)组、AS-Ⅳ预处理(AS-Ⅳ)组,每组15只。AS-Ⅳ组于造模前60 min,使用AS-Ⅳ 60 mg/kg灌胃预处理;sham组和I/R组给予等体积的生理盐水灌胃预处理。
1.2.2 模型制备 本研究已通过天津市人民医院动物伦理委员会批准(审批号:2021-SYDWLL-000190),并严格按照动物实验伦理学原则进行。大鼠于术前禁食12 h,自由饮水,参照文献[4]制备肠I/R模型。采用10%水合氯醛(3.5 mL/kg)行腹腔注射,待麻醉满意后仰卧位固定于动物手术台。按照无菌操作原则,经腹正中切口,寻找并分离肠系膜上动脉(superior mesenteric artery, SMA),无创微动脉夹夹闭SMA,待SMA搏动消失且肠壁色泽变苍白时,开始肠缺血计时;缺血60 min后恢复SMA血流灌注,SMA搏动恢复且小肠组织颜色由暗红变为鲜红,表明再灌注成功。回纳血管,关闭腹腔。I/R组和AS-Ⅳ组依照上述方法建立模型,sham组仅分离SMA而不夹闭。各组均于再灌注120 min时,取肺组织进行各项指标的测定。
1.2.3 肺组织染色及病理学评分 每组取3只大鼠,取其肺组织,用10%多聚甲醛固定24 h。经石蜡包埋、切片后进行HE染色,光镜下(×100)观察肺组织病理学改变水平并进行病理学损伤评分,评分标准参考文献[5]。
1.2.4 肺组织湿/干(W/D)比值的测定 每组取3只大鼠,取其左肺上叶,滤纸吸干表面液体,电子天平精确称量肺组织的湿质量;随后将肺组织置于烘箱中80 ℃条件下鼓风干燥48 h,精准称量肺组织的干质量。肺组织W/D比值=肺组织湿质量/干质量。
1.2.5 酶标仪检测支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)/血清分子量为4 kDa的FITC标记右旋糖酐(FITC-dextran 4 kDa, FD4)比值 每组取3只大鼠,经尾静脉注射10 mg/kg的FD4。10 min后于心尖部穿刺取血,行气管切开并气管插管,使用1 mL注射器向气管内缓慢注射PBS溶液充分冲洗3次,每次0.8 mL,回收得BALF。利用酶标仪分别检测血清和BALF中的FD4浓度,并计算BALF/血清FD4浓度的比值。
1.2.6 ELISA法检测肺组织IL-1β和IL-18水平每组取3只大鼠,取适量肺组织,冰上充分匀浆,4℃静置30 min后离心10 min(4×103r/min,离心半径10 cm),收集上清。利用酶标仪采用ELISA法检测上清液中IL-1β和IL-18浓度水平,具体操作步骤参照试剂盒说明书。
1.2.7 Western blotting法测定大鼠肺组织中NLRP3、ASC和caspase-1的蛋白表达 每组取3只大鼠,取适量肺组织,冰上充分匀浆裂解,4 ℃离心10 min,收集上清,BCA法测定蛋白浓度。各组蛋白样品分别加入10%浓度的SDS-PAGE凝胶泳道中电泳,湿转至PVDF膜,5%脱脂牛奶封闭2 h,分别加入以下一抗:兔抗NLRP3单克隆抗体(稀释比1∶500)、兔抗ASC单克隆抗体(稀释比1∶1 000)、兔抗caspase-1单克隆抗体(稀释比1∶500)和兔抗GAPDH单克隆抗体(稀释比1∶2 000),4 ℃孵育过夜。加入辣根过氧化物酶标记的山羊抗兔二抗(稀释比1∶2 000),室温孵育2 h。洗涤PVDF膜,于暗室加入ECL发光液,利用凝胶成像系统进行阳性信号检测,并用Image J软件分析蛋白条带的灰度值,计算目的蛋白条带与GAPDH条带灰度值的比值,即为目的蛋白的相对表达水平。
1.3 统计学处理 使用SPSS 21.0统计学软件进行数据分析。计量资料以均数±标准差表示,组间比较采用单因素方差分析,多重比较采用LSD-t法,以P<0.05 为差异有统计学意义。
2 结果
2.1 AS-Ⅳ对肺组织病理学的影响 与sham组比较,I/R组中的肺泡形态结构紊乱,肺泡腔发生塌陷、融合,肺泡壁增厚,肺间质水肿,毛细血管充血,肺泡腔和肺间质存在大量炎性细胞浸润,肺组织病理学损伤评分显著升高(P<0.05);与I/R组比较,AS-Ⅳ组中的肺泡形态学结构破坏减少,水肿减轻,炎性细胞浸润减少,肺组织病理学损伤评分显著降低(P<0.05)。见图1、表1。

图1 三组肺组织病理学变化情况比较 (HE染色,×100)

表1 三组大鼠肺组织病理性损伤评分、W/D比值和BALF/血清FD4比值的比较
2.2 AS-Ⅳ对肺组织W/D比值和BALF/血清FD4比值的影响 与sham组比较,I/R组肺组织W/D比值和BALF/血清FD4比值显著升高(P<0.05);与I/R组比较,AS-Ⅳ组肺组织W/D比值和BALF/血清FD4比值显著降低(P<0.05)。见表1。
2.3 AS-Ⅳ对大鼠肺组织IL-1β和IL-18含量的影响 与sham组比较,I/R组IL-1β和IL-18含量显著升高(P<0.05);与I/R组比较,AS-Ⅳ组IL-1β和IL-18含量显著降低(P<0.05)。见表2。

表2 三组大鼠肺组织IL-1β和IL-18含量的比较
2.4 AS-Ⅳ对肺组织NLRP3、ASC和caspase-1蛋白表达的影响 与sham组比较,I/R组NLRP3、ASC和caspase-1的蛋白表达水平显著升高(P<0.05);与I/R组比较,AS-Ⅳ组NLRP3、ASC和caspase-1的蛋白表达水平显著降低(P<0.05)。见图2、表3。
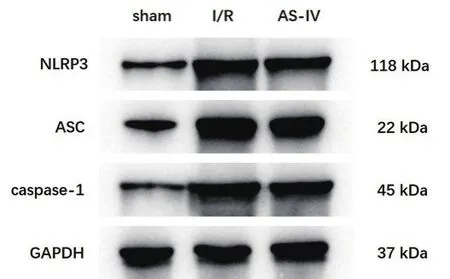
图2 Western blotting法测定大鼠肺组织中NLRP3、ASC和caspase-1的蛋白表达情况

表3 三组大鼠肺组织NLRP3、ASC和caspase-1的蛋白表达水平的比较
3 讨论
急性肺损伤是肠I/R最易并发的远隔脏器损伤,也是肠I/R损伤引发MODS的重要环节,探讨肠I/R所致肺损伤的治疗手段十分必要[6]。本研究通过建立肠I/R的大鼠模型,研究AS-Ⅳ对肠I/R所致肺损伤的影响及其分子机制。
黄芪作为珍贵的传统中药材,始载于《神农本草经》,在我国沿用已有千年之久。中国药典记载,药用黄芪为豆科植物蒙古黄芪或者膜荚黄芪的干燥根,AS-Ⅳ是黄芪最主要的活性单体成分,其化学本质是一种四环三萜类皂苷[7]。近期研究证实,AS-Ⅳ对多种因素导致的肺损伤具有一定的治疗作用[8-10]。因此,本研究参照前期实验条件,用60 mg/kg的AS-Ⅳ对大鼠进行灌胃预处理,观察AS-Ⅳ对肠I/R所致肺损伤的影响。结果发现,肠I/R模型组的肺组织病理学损伤评分、肺组织W/D比值和BALF/血清FD4比值均显著升高,表明大鼠肠I/R能够诱发肺组织损伤,证实动物模型构建成功;AS-Ⅳ能够显著降低肺组织病理学损伤评分、肺组织W/D比值和BALF/血清FD4比值,表明AS-Ⅳ对肠I/R所致的肺损伤具有明确的保护作用,能够减轻急性肺损伤的严重程度。
促炎细胞因子过度释放能够启动炎症级联反应,诱发炎性免疫细胞浸润,导致损伤肺血管内皮细胞和肺泡上皮诱发肺水肿,最终发生急性肺损伤,因此炎性介质过度释放被认为是肺组织损伤的重要发病机制[11]。有研究表明,肠I/R引发的肺损伤能够通过激活免疫细胞释放更多的IL-1β、IL-6、肿瘤坏死因子(TNF)-α等炎性因子,从而进一步加重肺脏及全身炎症反应[12]。本研究进一步探讨AS-Ⅳ对肠I/R相关肺损伤的炎症反应的影响。结果表明,肠I/R模型的肺组织中IL-1β和IL-18的含量显著升高,AS-Ⅳ则能显著降低炎性因子IL-1β和IL-18在肺组织中的含量,提示AS-Ⅳ对肠I/R所致肺损伤的改善作用可能与其显著的抗炎作用有关。
NLRP3炎症小体在机体的炎症反应调控机制中扮演着核心角色[13]。在I/R等伤害性信号的刺激下,损伤相关分子模式(damage associated molecular patterns, DAMPs)能够被多种模式识别受体所识别,其中的胞浆内模式识别受体NLRP3通过与凋亡相关斑点样蛋白ASC相互衔接,进而募集pro-caspase-1形成巨大的蛋白复合体,即为NLRP3炎症小体,促使pro-caspase-1自我切割成熟为caspase-1,活化的caspase-1一方面切割消皮素(Gasdermin D, GSDMD)形成GSDMD-NT,后者与细胞膜上的磷脂蛋白结合,导致质膜孔的形成,诱发细胞焦亡;另一方面,caspase-1切割pro-IL-1β和pro-IL-18形成具有活性的IL-1β和IL-18,并随细胞焦亡的发生释放至胞外,引发强烈的炎症反应[14]。本研究在发现AS-Ⅳ对肠I/R相关肺损伤的改善作用与减少IL-1β和IL-18含量的基础上,进一步探讨NLRP3炎症小体在AS-Ⅳ治疗肠I/R相关肺损伤中的作用。结果发现,在I/R模型的肺组织中,NLRP3、ASC和caspase-1的蛋白表达水平显著升高,表明NLRP3炎症小体参与肺损伤的发生与进展过程;而AS-Ⅳ能够显著下调肺组织中NLRP3、ASC和caspase-1的高表达水平,提示AS-Ⅳ可能是通过抑制NLRP3炎症小体激活来发挥对肠I/R所致肺损伤的保护作用。
综上所述,AS-Ⅳ灌胃预处理能够显著改善大鼠肠I/R所致的肺损伤,其机制可能与下调NLRP3炎症小体活化水平,减少IL-1β、IL-18等炎性因子释放,进而减轻肺部组织炎症反应有关。

