十字花科植物次生代谢物硫代葡萄糖苷生物合成运输分解的研究进展
王伟杰, 禹艳坤, 谭小力
(江苏大学生命科学研究院,江苏镇江 212013)
植物在与食草动物和微生物的长期斗争中,进化出了各类防御系统,例如快速反应的氧爆发、细胞壁蛋白富集的交联反应、胼胝质沉淀等[1-2]。有些反应发生得较慢,如产生次生代谢产物来抵御外界威胁[3]。在十字花科植物中,次生代谢产物硫代葡萄糖苷(glucosinolate,GLS,硫苷)是主要的防御物质之一[4]。其化学结构主要包括3部分:β-D-硫苷葡糖基、醛肟酸、不同的R基。R基的前体是氨基酸,不同的氨基酸可以衍生出不同的R基,进而合成不同种类的硫苷[5]。根据不同的氨基酸前体,可将硫苷分为3类:脂肪族硫苷、吲哚族硫苷、芳香族硫苷[6-7]。脂肪族硫苷R基前体包括亮氨酸、异亮氨酸、丙氨酸、缬氨酸、甲硫氨酸;吲哚族硫苷的R基前体则是色氨酸等;芳香族硫苷R基前体是酪氨酸、苯丙氨酸。常见的硫苷类型如表1所示。
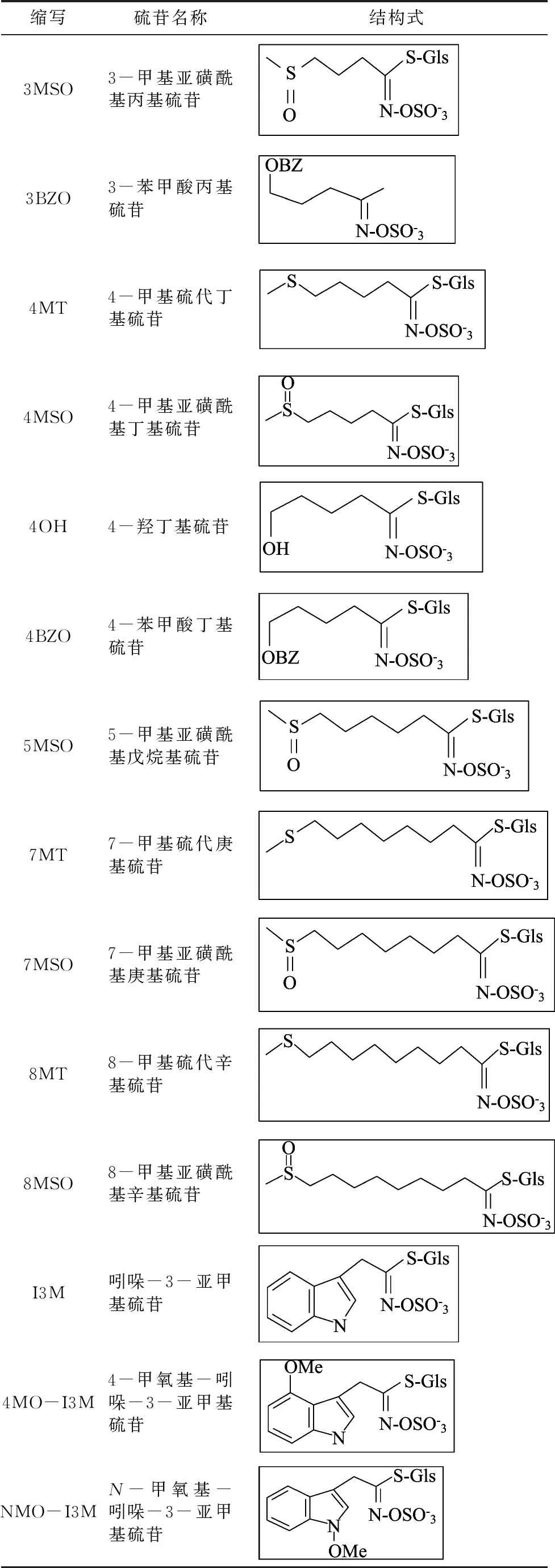
表1 常见硫苷的种类
硫苷的含量在植物不同的组织和生长阶段是动态变化的,成熟种子中的硫苷含量通常高于叶片中的,营养生长期叶片中的硫苷含量通常高于生殖生长期的。硫苷转运蛋白(glucosinolate transporter,GTR)参与了这一调节过程[8-9]。
参与硫苷水解的黑芥子酶位于质外体,合成的硫苷会储存在细胞内,避免被黑芥子酶水解。当植物受到损伤或攻击时,细胞破裂,硫苷与黑芥子酶反应,进而产生不同的水解产物来抵抗微生物和食草昆虫。硫苷除了防御作用,在风味调节以及抗癌、生物熏蒸等方面都有较大的贡献[10-11]。
本文将对硫苷的合成、运输、分解以及硫苷的应用进行讨论。
1 硫苷的合成
硫苷的合成分为3个步骤:主链的延长、核心结构的生成、侧链的修饰。根据不同的R链可分为3种硫苷:脂肪族硫苷、吲哚族硫苷、芳香族硫苷[5,14]。硫苷在淀粉鞘和薄壁细胞中合成,储存在硫细胞中或者由韧皮部转运到不同部位[12]。硫苷主要在营养生长期的叶片和茎、生殖生长期的幼嫩角果皮中合成,成熟的种子中检测不到硫苷合成必需基因的表达,因此一般认为种子中的硫苷累积主要来源于营养体,如叶片和角果[12-13]。
1.1 主链的延长
氨基酸首先在甲硫氨酸转氨酶(branched-chain amino transferase4,BCAT4)的作用下脱氨基,生成对应的含氧酸,再经历乙酰辅酶A缩合、异构化、氧化羧合循环进行主链延长(图1-a),主链的延长循环最多9次。硫苷的合成涉及到大量基因,包括上述的甲硫氨酸转氨酶和甲硫烷基苹果酸盐合成酶基因MAMs(methylthioalkymalate synthase)[15]。MAM基因在主链延长步骤中起重要作用[17],MAM1主要作用于前2个循环,MAM2仅催化循环的第1轮反应,MAM3主要作用于第6次延长反应,其余反应由MAM-L(methylthioalkymalate synthase-like,MAM-LIKE)基因完成[18]。
1.2 核心结构的合成
主链延长结束后,开始核心结构的合成,主链延长后的产物在细胞色素P450家族CYP79作用下生成醛肟[16]。CYP79在此步骤中主要负责N-羟基化反应,可以催化二高甲硫氨酸生成5-甲硫基戊醛肟,其中,脂肪族硫苷合成中此步骤主要由CYP79F1/F2负责(图1-b);吲哚族硫苷合成中的此步骤则主要由CYP79B2/B3负责[19-22];芳香族硫苷研究较少,目前尚未明确在此步骤中起作用的关键基因。5-甲硫基戊醛肟在CYP83的作用下形成异硝基化合物,然后在谷胱甘肽转移酶(glutathione transferase,GST)和C-S裂解酶的作用下形成硫基吲哚羟肟酸,最后在硫-葡糖转移酶(sulfur glucotransferase,S-GT)和磺基转移酶(sulfotransferase,ST)的作用下形成脱硫硫苷和硫苷。UGT74家族也作用于此步骤,主要参与的基因是UGT74B1/C1,分别参与吲哚族和脂肪族硫苷的合成。
1.3 侧链修饰
侧链修饰包括羟基化、氧-甲基化、糖基化以及酰化作用等,该步骤中起主要作用的是氧化戊二酸依赖的双加氧酶AOP2(alkenyl hydroxalkyl producing 2)和AOP3以及FMOGS-OX1(FLAVIN-MONOOXYGENASE GLUCOSINOLATE S-OXYGENASE 1)(图1-c)。AOP2的作用是将侧链修饰为羟基,而AOP3的作用则是将侧链修饰为苯甲酸基[23-24]。二者的主要区别是启动子区域的差异以及AOP2开放阅读框的部分缺失,导致AOP2是一个高度截短的蛋白[25],FMOGS-OX1的作用是催化甲基硫代烷基转化为甲基亚磺酰基。
研究发现,与野生型相比,AOP2过表达的拟南芥植株中MYB28/29的表达量显著上调,且硫苷的含量上升了近2倍,其作用机制是AOP2控制MYB28/29的表达量来调节短链硫苷的合成。另外,AOP2不仅可以调控MYB转录因子的转录,还可以不经过MYB转录因子,对5个硫苷合成相关基因(GGP1、CYP83B1、SOT16、CYP81F4、GS-OX2)进行直接调控[26]。

R2R3MYB转录因子与植物代谢密切相关[28],参与例如花青素、植保素等次生代谢产物的调控[29-30]。MYB28、MYB29在脂肪族硫苷的合成途径中会与很多基因互作影响硫苷的合成,例如BCAT4、MAM、CYP79;这2个MYB转录因子与MAM基因结合共同调控短链脂肪族硫苷核心结构的生成[31]。脂肪族硫苷4-甲基硫代丁基硫苷(4-MTO)是典型的短链脂肪族硫苷,在myb28突变体中,其含量显著下降,证明MYB28对短链脂肪族硫苷的合成十分重要[32]。另一个MYB28对短链脂肪族硫苷核心结构生成十分重要的证据是,使用外源葡萄糖诱导拟南芥后,发现MYB28的表达量和硫苷的含量显著升高,并且上升趋势与时间呈正相关线性关系[33]。进一步研究发现,葡萄糖分子被己糖激酶(hfexokinase,HXK)识别并被RGS1(regulator of G-protein signaling 1)调节,RGS1会持续地影响MYB28、MYB29、CYP79F1/F2的表达,但是葡萄糖调节硫苷合成相关基因的具体机制尚未清晰。在hkx突变体中,使用外源葡萄糖诱导,不能引起硫苷合成相关基因的表达量和硫苷含量的改变。另外,在myb29突变体中,经外源葡萄糖诱导,硫苷含量有所增加,在myb28中则没有类似现象,说明MYB28在脂肪族硫苷合成中的作用要大于MYB29[34]。不仅外源葡萄糖可以影响硫苷合成,有研究表明外源硒诱导后,脂肪族硫苷合成相关基因的表达量下调,而吲哚族硫苷合成的相关基因表达量上调[35]。
主要涉及到吲哚族硫苷合成的基因是MYB家族的MYB34、MYB51、MYB122以及MYC家族的MYC2、MYC3[36-37]。在不同部位和激素刺激下,MYB基因的功能不同。例如,MYB34主要在根中起作用,当受到脱落酸(abscisic acid,ABA)刺激后,会产生大量的吲哚-3-亚甲基硫苷(indole-3-methylene,I3M)和1-甲氧基-吲哚-3-亚甲基硫苷(1-methoxy-indole-3-methylene,1-MO-I3M)。MYB51主要在侧枝中起作用,在茉莉酸(jasmonic acid,JA)和乙烯(ethylene,ET)的刺激下,会提高I3M和4-MO-I3M含量。MYB122调节硫苷合成能力较弱,只有在JA的刺激下起作用[38]。MYC家族主要涉及植物激素的合成,在吲哚族硫苷的合成过程中,MYC家族与MYB家族的成员结合后,共同调控硫苷的合成[39],例如MYC2需要和MYB51结合,调节硫苷的合成。另外,种子萌发以及受到病原微生物侵害时,吲哚族硫苷的含量会发生明显变化,感知非病原微生物存在时,吲哚族硫苷含量变化相对较小。因此,吲哚族硫苷的含量变化或许可以开发为一项识别病原微生物的指标[40]。
硫苷合成涉及的基因不是简单的基因加和效应,而是一个复杂的网络结构。不同的转录因子作用于不同的基因,并且每个转录因子在基因网络中作用不同。例如,MYB28对短链脂肪族硫苷的合成具有重要作用,但是在复杂的基因网络中,对于不同种类的硫苷,MYB29的作用有时会大于MYB28。并且,同样的基因在不同的环境和组织中会产生不同的效应。在不同酶的作用下或在不同组织中,原本起协同作用的转录因子可能会转变为拮抗作用[41]。对于MYB34来说,在与MYB51协同作用的同时与MYB122是拮抗作用,因此3个转录因子能够精准地调控吲哚族硫苷的含量[42-43]。
环境条件也会对硫苷含量造成影响,如湿度、温度等。当温度较高时,吲哚族硫苷的含量会受到较大影响,而脂肪族硫苷则受影响较小[86]。光强可以影响CYP83B1的表达量从而改变吲哚族硫苷和IAA的含量[16]。
2 硫苷的转运
硫苷主要在营养器官中合成,然后通过转运蛋白运输至生殖器官[12],不同时期和不同部位的硫苷含量也会随着基因表达量的不同而改变[44]。例如,当叶片衰老以及种子萌发时,硫苷含量会下降[45]。研究硫苷运输最直接的方法是利用放射性元素标记来指示硫苷的运输路径,可以观测到硫苷从合成部位(如叶片)被运输至其他部位(如种子)。此外,由于拟南芥不表达CYP79A1基因,将白菜型油菜的CYP79A1基因导入拟南芥,可以通过该基因参与合成的硫苷来研究运输[46-47]。另外,在韧皮部运输的是完整的硫苷,而不是脱硫硫苷[48-50]。
种子中没有检测到硫苷合成基因MYB28/29、MAMs的表达,说明在种子中几乎没有硫苷合成的主链延伸和核心结构生成这2个步骤,所以种子中的硫苷主要源于其他器官[13]。在低硫苷油菜早期的角果壁中,硫苷含量大约为30 μmol/g,种子成熟后角果壁中硫苷含量降至1 μmol/g,这个现象说明硫苷可能从角果壁转运至种子中[4]。在过表达MYB28基因的植株中,其叶片硫苷的含量相比于野生型高了近3倍,而在种子中仅有微量的上升,这说明营养体中的硫苷并不会完全转运到种子中,或者种子中的硫苷含量有一定的上限[51]。
GTR转运蛋白是一个H+/硫苷共转运蛋白,属于硝酸盐和肽转运蛋白NPF(NRT1-PTR)家族,并且该蛋白的运输效率不受底物侧链结构的影响[9]。从进化的角度来看,NPF转运蛋白可能是生氰糖苷的转运蛋白进化而来,并且进化时间要早于硫苷合成途径[52-53]。异源表达试验发现,在非洲爪蛙卵母细胞中表达GTR后,细胞可以转运4-甲基硫代丁基硫苷(4-MTB)和3-丙烯基(3-BUT)2种硫苷[54]。
GTR蛋白家族成员GTR1(NPF2.10)、GTR2(NPF2.11)、GTR3(NPF2.9)负责硫苷运输[9]。GTR转运蛋白主要在根部和茎表达,亚细胞定位试验显示GTR蛋白定位在质膜上,GTR1一般富集在叶片叶肉细胞的周围,主要在韧皮部周围的细胞中运输硫苷。GTR2一般富集在脉管系统、韧皮部和质外体运输硫苷[54]。GTR3主要富集在根器官韧皮部的伴随细胞质膜上,其作用可能是将吲哚硫苷转运到储存细胞,从而保证根中硫苷含量[55]。GTR3转运蛋白对吲哚族硫苷具有极高的偏好性,其转运吲哚族硫苷的能力几乎是转运脂肪族硫苷的10倍。
gtr2突变体的种子由于转运蛋白的部分缺失,影响硫苷从营养器官运输到种子,从而引起硫苷在营养器官中的累积,种子中硫苷含量显著下降。在gtr1、gtr2双突变体种子中几乎检测不到硫苷的含量[13]。另外,与脂肪族硫苷大量滞留在营养器官中不同,色氨酸衍生的硫苷即吲哚族硫苷,虽然在种子中的含量明显下降,但是在营养器官中却没有发现累积,这说明吲哚族硫苷可能存在其他转运机制[56]。
NPF(nitrate transporter)转运蛋白家族不仅涉及到硫苷的转运,并且与植物激素的运输也有关系,例如生长素、赤霉素、脱落酸[57]。在gtr1中,与野生型相比,不仅种子中硫苷的含量下降,植株表型也发生了变化,花丝延长能力和花粉开裂能力都下降,且角果也变得干瘪,经赤霉素诱导可恢复部分表型。其原因是GTR1转运硫苷的同时,也可以转运具有生物活性的赤霉素(gibberellin,GA)和茉莉酸衍生物(JA-Ile),由于GTR1在花器官中的表达部位主要是花丝基部、维管束、花药,影响花丝部位GA从维管束到细胞的运输,导致gtr1突变体花药表层的厚度变薄,并减少了开裂所需的机械力。使用外源GA处理花苞后,角果变得饱满,生殖能力恢复,但角果中的种子却不能完全发育,可能是因为GA只能补偿JA的部分作用。但是,当硫苷和GA等植物激素同时存在时,GTR1仍具有对硫苷的偏好性,会优先转运硫苷[54]。
硫苷在细胞中合成后具有多个转运途径,使硫苷在叶片不同部位的分布情况不同:(1)硫苷合成后,被运输至质外体,进入韧皮部,再通过GTR蛋白进入叶肉细胞和硫细胞,这些细胞大概具有 130 mmol/L 的硫苷渗透压来保证运输的效率[48];(2)叶肉细胞同样可以通过胞间连丝吸收硫苷,硫苷随后会被运输至表皮细胞,并在液泡表面GTR蛋白的作用下储存在液泡中;(3)如果硫苷合成细胞位于韧皮部周围,硫苷会被GTR转运至韧皮部相连的细胞,然后通过胞间连丝进入韧皮部[13,53](图2-d)。
在叶片中,硫苷主要集中在边缘,叶柄以及叶片中轴(图2-a)。硫苷的分布模式影响了昆虫的摄食习惯,导致其更加偏好摄食低硫苷含量的叶肉细胞[58]。硫苷在GTR的作用下运输至叶片边缘 (图2-b、图2-c),硫苷转运至表皮细胞胞质的液泡中,在液泡中形成浓度梯度,在保证表皮细胞中高硫苷含量的同时,也可以使硫苷向叶片边缘流动[9]。
植物抽薹后硫苷不再大量储存在叶片,而是通过GTR转运蛋白逐渐运输至花序[59]。另外,由于衰老器官中前体的减少和氮元素的重新分配,也会造成叶片中硫苷含量的大幅下降[60]。
硫苷的转运模式提供了一种新的育种方向,可以通过调节转运基因的表达,实现保证叶片或者营养生长期较高硫苷含量的同时,尽可能降低种子中硫苷含量的目标,这样既能保证抗性不受影响,又提高了菜籽油品质。

3 硫苷的水解
硫苷水解过程中黑芥子酶起重要作用,黑芥子酶是自然界中发现的唯一可以裂解含硫基团葡糖基的酶[61]。黑芥子酶主要由TGG1~TGG6(thioglucoside glucohydrolases,TGG)合成;另外,黑芥子酶合成后需要在ESM1(epithiospecifier-modifier 1)蛋白的协助下分解硫苷[62]。黑芥子酶通常存在于叶片、茎和花序的韧皮部组织。植物细胞完整时,黑芥子酶和硫苷是被生物膜隔离的;当植物受到食草类昆虫和病原菌的攻击时,硫苷与黑芥子酶之间的隔离被破坏,在黑芥子酶的催化下,硫苷被水解为异硫氰酸酯和腈类等物质[63]。硫苷水解生成有毒的水解产物,来抵抗昆虫或者病原菌的侵害[64]。当植物感知到细菌鞭毛蛋白时,会提高吲哚族硫苷的产量,并同时提高黑芥子酶相关基因的表达量,使吲哚硫苷大量水解,其水解产物会进一步刺激胼胝质沉淀,从而激活植物的免疫[65]。在某些物种中(如芥末),黑芥子酶和硫苷可以共存而不发生水解。这个现象可能是由于抗坏血酸抑制了黑芥子酶的活性,具体机制仍需要进一步研究[66]。
在不同的条件下硫苷会产生不同的水解产物:(1)当pH值=5~8时会产生异硫氰酸酯(isothiocyanate,ITC);(2)当pH值=2~5或者有ESP(epithiospecifier protein)存在的情况下会产生腈类物质;(3)末端双键捕获腈类形成时释放的S原子则会形成环硫醚;(4)如果在硫苷的3号位C原子上连接有羟基官能团则会形成恶唑烷-2-硫酮;(5)当pH值=8时还有可能会形成硫氰酸酯[67]。腈类是硫苷的简单水解产物,其毒性往往不如同一底物产生的ITC[68]。不同种类硫苷的水解产物也不同,水解产物的毒性也有差异。以ITC为例,ITC的毒性取决于硫苷的R基种类以及链长度,芳香族硫苷产生的ITC毒性要大于脂肪族硫苷产生的,而短链硫苷产生的ITC毒性则要大于长链硫苷产生的[69]。另外,ITC在植物的耐热性方面也有贡献,可以作为一种信号分子来调节耐热性[70]。
拟南芥受到绿桃蚜虫(Myzuspersicae)的攻击时,叶片中硫苷总量显著上升,其中4MI3M、8MSO的含量上升最明显;进一步试验发现,相较于脂肪族硫苷,吲哚族硫苷会在CYP81F2酶的作用下产生4-甲氧基吲哚硫苷用于保卫细胞,可能吲哚族硫苷在抵抗昆虫的摄食方面作用更大[71-72]。但是,cyp83a1突变体中不仅吲哚族硫苷的含量下降,表面蜡质也减少,这也会影响虫类的摄食行为,因此不能简单地归因于吲哚族硫苷[73]。
吲哚-3-乙醛是吲哚族硫苷合成过程的中间产物,同时也是生长素(IAA)和植保素的中间产物,当IAA缺乏时,吲哚族硫苷被分解起到补偿作用。如果吲哚族硫苷的合成被终止,累积的吲哚-3-乙醛会衍生为生长素,植物会表现出高生长素累积的表型。cyp79f1突变体中会产生大量的不定根,是因为根中的吲哚硫苷比例较高[45],同时cyp79f1突变体会更吸引昆虫的摄食。造成这种现象的原因一方面是由于硫苷含量降低,另一方面也与IAA含量上升有关,两者共同导致了昆虫摄食偏好性的改变[84]。
UDP-糖基转移酶基因(UDP-glucosyltransferasegene)是吲哚族硫苷核心结构生成的重要基因,对核盘菌和灰霉菌的抗性研究发现,在ugt74中叶片染菌的面积更大,软腐的现象也更严重;脂肪族硫苷合成关键基因突变后,染菌情况没有明显的差别,这说明在核盘菌和灰霉菌的抗性方面,吲哚族硫苷起到了更为重要的作用[74]。
硫苷的水解产物不是对所有食草性昆虫都具有毒性,有些昆虫会对硫苷的水解产物产生抗性,甚至有些昆虫会将硫苷水解产物作为诱导剂在植株上产卵。这些昆虫对硫苷的水解产物具有抗性的原因有很多,有些昆虫体内会产生类似于黑芥子酶的蛋白来影响硫苷的水解,不会产生对昆虫有害的ITC,而是将硫苷水解为腈类物质,进而排出体外[75];另一种方式是昆虫体内的裂解酶起作用,将硫苷结合的硫酸根裂解后,导致硫苷无法被黑芥子酶水解,也就不会产生毒害物质[76]。
在植物生长环境营养缺乏时,硫苷还可以起到后备能源的作用。研究发现,在缺乏硫的土壤上,野生型萌发时期拟南芥的质量相较于正常生长条件大幅下降,同时体内的硫苷也下降到了无法探测的水平,有可能是因为在营养缺失时,硫苷作为能源和营养储备发挥作用[56]。另外,有研究发现硫苷合成的前体物质和水解物质之间有联系,且这种联系是属间特异的,这赋予了硫苷作为化学分类标志物的潜能[77]。
4 硫苷的应用
虽然硫苷会影响油菜籽的品质,但是硫苷仍然有非常重要的应用价值。比如,研究人员利用硫苷抗菌抗虫的特性,开发出其作为生物熏蒸材料的功能[78];植物长期连作会造成土地营养缺失和病虫害暴发,通过使用高硫苷含量的十字花科植物作为生物熏蒸材料,不仅可以补充土地肥力[79-80],同时硫苷的水解产物如异硫氰酸酯可有效抑制土传病害[81-82]。试验证明,在不同温度和不同添加物下抑菌效果也不同,例如在28.5 ℃时,芥菜与麦麸共同作用,对黄瓜枯萎病菌的抑制效率最高,抑菌率为68.2%;当枯草芽孢杆菌作为添加物,与芥菜结合使用时,对于种植茄子土壤中的大丽轮支菌(Verticilliumdahliae)的抑制率能达到33%[83]。
研究发现,很多植物的次生代谢物在抗癌方面有重要的作用。20世纪80年代研究发现,硫苷具有抗癌功能[86-88],起作用的主要物质是异硫氰酸酯,对多种癌症都有抑制作用,例如前列腺癌、胃癌、皮肤癌等[89]。研究人员通过纯化异硫氰酸酯等水解产物进行抗癌研究时发现,它可以通过阻断细胞周期来抑制前列腺癌细胞PC-3的增殖[90-91]。目前对于异硫氰酸酯如何阻断细胞周期的机制尚未研究清晰,研究人员普遍猜测可能是由于其影响了癌细胞中的Ⅰ相和Ⅱ相还原酶,进而影响了癌细胞的代谢[92]。
另外,在风味方面,吲哚族硫苷和带有烯基的硫苷水解产物可以产生特殊的苦味以及辛辣味[93],通常会被作为调味品使用,例如辣根[94-96]。
5 总结与展望
十字花科植物种植广泛,营养丰富,通过对十字花科植物次生代谢物硫苷的合成、转运、代谢等方面作更深层次的研究,有助于进一步提高硫苷的利用率,进而实现更高的经济价值。
首先,在硫苷合成方面,通过控制合成MAM、AOP2等关键基因的表达,可以调节硫苷总量,也可以调节脂肪族硫苷和吲哚族硫苷的比例,实现不同目标。例如,可以增加吲哚族硫苷的比例来提高其抗癌的作用,或提高脂肪族硫苷的比例来使其更加辛辣。其次,对于硫苷水解也值得进一步研究。水解产物对于维持植物自身的抗逆性十分重要,在抗癌和风味调节等方面也有贡献。除此之外,如何利用水解产物的特性来开发更多的功能,仍需要继续研究。对硫苷转运能力的调节可以改变硫苷在不同部位的含量,在转运能力被限制后,大量的硫苷会滞留在营养器官,使植株的抗逆性增加,并且能够减少饼粕中硫苷的含量,提高饼粕的经济价值。最后,硫苷被人体摄入后的反应及作用机制仍未被阐明,而最大化提升该机制对人体抗癌功能的同时,减少硫苷水解物对人体的危害十分关键,因此该方向具有很强的研究价值。
总之,硫代葡萄糖苷研究的重点是生物合成、运输、分解,随着相关基础研究的不断深入,可以预见这3个机制将会被阐明,使硫苷在试验和生活中发挥更多作用。

