Fe3+掺杂聚多巴胺纳米球荧光适配体传感器对小麦中脱氧雪腐镰刀菌烯醇的检测
路 念,马 骥,4,成军虎,孙大文,*
(1.华南理工大学食品科学与工程学院,广东 广州 510641;2.华南理工大学 现代食品工程研究中心,广东 广州 510006;3.广东省冷链食品智能感知与过程控制工程技术研究中心,广东省农产品智能冷链物流设备工程实验室,广东 广州 510006;4.华南理工大学 发光材料与器件国家重点实验室,广东 广州 510640)
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),是黄色镰刀菌(Fusarium culmorum)和禾谷镰刀菌(Fusarium graminearum)产生的高毒性次级代谢产物,属于单端孢霉烯B族化合物[1]。因为该种毒素可以引起猪产生呕吐症状,故又命名为呕吐毒素。DON的主要污染对象为小麦、玉米、燕麦等农副产品[2-4],且容易引起动物的拒食反应,还具有免疫毒性、器官毒性、抑制蛋白合成和致畸性等毒性作用[5-6]。此外,DON具有很强的热稳定性,一般的食品加工和烹饪方法均不能破坏其毒性[7-8],对食品安全存在隐患。DON是粮食库中小麦等农副产品入库的必要检测指标之一。
目前DON的测定方法主要有液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法[9-10]、高效液相色谱(high performance liquid chromatography,HPLC)法[11-12]、薄层色谱(thin layer chromatography,TLC)法等[13-14],这些方法虽然具有高准确性、高灵敏性、高选择性等优势,但所需设备昂贵、样品前处理繁琐,且需要专门的技术操作人员。酶联免疫检测法(enzyme-linked immunosorbent assay,ELISA)具有成本低、操作简便、灵敏度高、样品前处理简单等优势,但抗体与酶易变质,且存在非特异性反应、假阳性等问题[15]。因此,开发一种简单、灵敏、快速且准确性高的DON检测方法具有十分重要的意义。
荧光分析方法是一种基于荧光信号探针的荧光强度对物质进行分析的方法,近年来被广泛应用于生物医学诊断[16]、环境检测[17]、食品安全检测[18-20]等方面。核酸适配体是利用指数富集的配体系统进化(systematic evolution of ligands by exponential enrichment,SELEX)技术从核酸分子文库中得到的一段寡聚核苷酸序列(DNA或RNA),它能与目标物质高特异性、高选择性地结合[21]。此外,核酸适配体还具有分子质量小、易于修饰功能性基团等特点,因此被广泛应用于生物传感器领域[22]。聚多巴胺纳米球(polydopamine nanospheres,PDANS)是一种由多巴胺在碱性条件下发生自聚集形成的类黑色素聚合物,具有良好的生物相容性和生物降解性。有研究表明PDANS对氨基甲基香豆素乙酸酯、6-羧基荧光素(6-carboxyfluorescein,FAM)、6-羧基四甲基罗丹明和Cy5具有优异的猝灭能力[23]。基于上述优点,研究者们利用PDANS作为猝灭剂设计了多种荧光适配体传感器用于对DNA、RNA、蛋白质、真菌毒素等物质进行检测[24-28]。然而,将基于PDANS的荧光适配体传感器用于食品中DON的检测鲜见报道。
本研究利用PDANS材料高效的猝灭性能,结合核酸适配体的特异性识别能力,通过掺入Fe3+提高PDANS对FAM的荧光共振能量转移(fluorescence resonance energy transfer,FRET)效率,从而提高PDANS对FAM的荧光猝灭效率,构建一种荧光适配体传感器用于DON的检测。该传感器设计简单、响应快速,可用于小麦中DON的定量检测。
1 材料与方法
1.1 材料与试剂
盐酸多巴胺、三(羟甲基)氨基甲烷(Tris)、NaCl、MgCl2、CaCl2、KCl、FeCl3·6H2O 上海麦克林生化科技有限公司;DON、NH4OH(质量分数25%) 美国Sigma-Aldrich公司;玉米赤霉烯酮(zearalenone,ZEN)、黄曲霉毒素G1(aflatoxin G1,AFG1)、黄曲霉毒素B1(flatoxin B1,AFB1) 坛墨质检科技股份有限公司;DON核酸适配体(5’-FAM-GCA TCA CTA CAG TCA TTA CGC ATC GTA GGG GGG ATC GTT AAG GAA GTG CCC GGA GGC GGT ATC GTG TGA AGT GCT GTC CC-3’)由生工生物工程(上海)股份有限公司合成及纯化。所用试剂均为分析纯,实验用水均为超纯水(18.2 MΩ·cm)。
1.2 仪器与设备
Merlin高分辨场发射扫描电子显微镜 德国Zeiss公司;Nicolet Is50傅里叶变换红外光谱仪 美国ThermoFisher公司;UV-1800紫外-可见分光光度计、RF-6000荧光分光光度计 日本岛津公司;圆二色光谱仪英国Applied Photophysics Ltd.公司;SCIENTZ-18N冷冻干燥机 宁波新芝生物科技股份有限公司;JW-3024HR高速冷冻离心机 安徽嘉文仪器装备有限公司。
1.3 方法
1.3.1 传感器的构建
适当修改已报道文献[29]的方法,合成了PDANS。将24 mL无水乙醇与56 mL超纯水混合均匀后,加入0.8 mL氨水溶液(NH4OH,25%)并在室温下搅拌30 min,然后加入200 mg盐酸多巴胺,持续搅拌30 h后于9000 r/min离心20 min,收集沉淀并用超纯水洗涤3 次,冻干后获得PDANS,并于4 ℃保存备用。合成Fe3+掺杂聚多巴胺纳米(Fe-PDANS)的方法与合成PDANS相似,区别是在加入盐酸多巴胺的同时加入0.8 mL 10 mg/mL FeCl3溶液,其他步骤不变。
将40 µL 100 nmol/L标记有FAM的DON核酸适配体(PDON)和40 µL 1 µg/mL的DON溶液于37 ℃振荡孵育30 min,然后加入35 µL 1 mg/mL Fe-PDANS继续振荡孵育35 min,最后将溶液体积补充至1500 µL。
1.3.2 实验可行性验证
1.3.2.1 圆二色谱测定
通过圆二色谱验证DON和PDON间的结合作用。吸取500 µL 100 nmol/L PDON分别和500 µL 1.5、2 µg/mL和2.5 µg/mL DON于37 ℃反应30 min,将该溶液在1 cm路径长度的石英比色皿中进行圆二色谱测定,分析该混合物的椭圆度光谱,并与作为参考的100 nmol/L PDON的光谱进行比较。
1.3.2.2 荧光发射光谱扫描
荧光扫描参数设置激发波长为470 nm,发射波长测量范围为490~650 nm,激发带宽和发射带宽均为5 nm,记录520 nm波长下的最佳荧光发射强度。将测量体系仅存在PDON时的荧光强度记为F0,测量体系不存在DON时加入Fe-PDANS后的荧光强度记为F1,测量体系存在DON时加入Fe-PDANS后的荧光强度记为F2。
1.3.3 反应条件优化
为了获得最佳的传感性能,优化反应条件,包括Fe-PDANS合成过程中Fe3+掺入量、DON检测过程中Fe-PDANS加入量、Fe-PDANS和PDON孵育时间。
1.3.3.1 Fe3+掺入量对PDON猝灭性能的影响
在Fe-PDANS的合成过程中,分别加入0、0.2、0.4、0.8 mL和1.0 mL 10 mg/mL的FeCl3溶液,制备Fe3+掺入量相当于盐酸多巴胺加入量1%、2%、3%、4%和5%的Fe-PDANS。使用上述不同Fe3+掺入量的Fe-PDANS构建传感器并对传感器进行荧光扫描。经重复实验,根据所得荧光强度计算Fe-PDANS对PDON的猝灭效率Q,通过比较猝灭效率得出最佳的Fe3+掺入量。
式中:F0为测量体系仅存在PDON时的荧光强度;F1为测量体系不存在DON时的荧光强度;F2为测量体系存在DON时的荧光强度。
1.3.3.2 Fe-PDANS加入量的优化
将40 µL 100 nmol/L PDON和40 µL 1 µg/mL DON溶液于37 ℃振荡孵育30 min,分别加入10、15、20、25、30、35、40、45 µL 1 mg/mL Fe-PDANS,振荡孵育30 min后取出,将溶液体积补充至1500 µL后进行荧光扫描。经重复实验,选取最佳的荧光强度比值(F2/F1)所对应的Fe-PDANS用于构建传感器。
1.3.3.3 Fe-PDANS与PDON的孵育时间优化
将40 µL 100 nmol/L PDON和40 µL 1 µg/mL DON溶液于37 ℃振荡孵育30 min,然后加入35 µL Fe-PDANS分别振荡孵育10、15、20、25、30、35、40 min和45 min后取出,将溶液体积补充至1500 µL后进行荧光扫描。经重复实验,选取最佳的F2/F1值所对应的孵育时间用于构建传感器。
1.3.4 标准曲线的建立
在上述步骤所得的最优实验条件下分别测定DON质量浓度为0.2667、1.333、2.667、13.33、26.67 ng/mL和133.3 ng/mL条件下传感器获得的荧光强度,并根据DON质量浓度及F2/F1值的关系建立标准曲线并进行比较,考察线性范围以及检出限。
1.3.5 传感器特异性和重复性分析
在上述步骤所得的最优实验条件下构建传感器,分别检测1 µg/mL DON、1 µg/mL ZEN、1 µg/mL AFG1、1 µg/mL AFB1。经重复实验,分析比较DON以及其他毒素存在时传感器的荧光强度比值,以评估所构建传感器对DON的特异性。
在相同条件下,连续6 d用所构建的传感器测量1 µg/mL的DON,每批检测重复3 次,以评估传感器的重复性。
1.3.6 阳性样品检测
根据呕吐毒素检测试剂盒中的方法对小麦进行预处理。将受DON污染的小麦经研磨机磨碎后称取2 g于50 mL离心管中,加入10 mL水,置于涡旋振荡器中振荡5 min,于4000 r/min离心10 min后收集上清液于干净的容器中,得到阳性样品。然后使用ELISA和本研究的方法对阳性样品分别进行检测。
2 结果与分析
2.1 实验原理
利用Fe-PDANS材料高效的猝灭性能、PDON的识别能力和Fe-PDANS对PDON的吸附能力,构建一种基于FRET的荧光适配体传感器。其检测原理如图1所示。
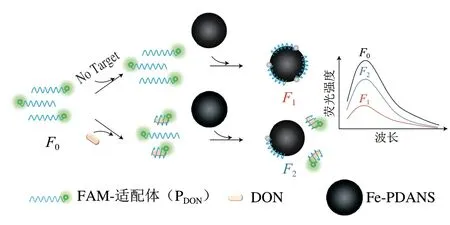
图1 基于Fe-PDANS的荧光适配体传感器对DON检测原理图Fig.1 Schematic illustration of the fluorescent aptasensor based on polydopamine nanospheres for DON detection
当体系中不存在DON时,向体系中加入Fe-PDANS后,单链PDON通过其碱基芳香环结构与Fe-PDANS间通过π-π堆积的非共价作用吸附到Fe-PDANS上,形成PDON/Fe-PDANS复合物。此时,由于FAM与Fe-PDANS间的FRET作用,FAM的荧光被Fe-PDANS猝灭,此时传感体系的荧光信号较弱。当体系中存在DON时,PDON将会首先与DON特异性结合,其空间构象发生改变,阻碍了PDON与Fe-PDANS间的π-π堆积的非共价作用,从而使得FAM的荧光不能被Fe-PDANS所猝灭,产生荧光信号。
2.2 验证实验的可行性
2.2.1 Fe-PDANS的形貌及光谱表征
利用扫描电镜观察Fe-PDANS的形貌及粒径,如图2A所示,Fe-PDANS维持着较好的球形,尺寸约为170 nm。图2B是多巴胺、PDANS和Fe-PDANS的傅里叶红外光谱图,其中,多巴胺在3370 cm-1和3340 cm-1处分别有一个宽峰和一个小峰,对应N—H的伸缩振动峰。PDANS在3430 cm-1处有一个峰,属于N—H的伸缩振动峰;在1620 cm-1处和1520 cm-1处分别有一个峰,为吲哚和吲哚二氢的特征峰,这与相关文献报道一致[26],表明成功合成出PDANS。Fe-PDANS在3260 cm-1处有一个弱峰,且相对于PDANS发生了蓝移。此外,1610 cm-1和1510 cm-1两处的峰也发生了蓝移,表明酚羟基上的氧原子参加了金属配位,间接表明Fe3+成功掺杂到PDANS中[30]。同时,由图2C可知,PDANS和Fe-PDANS的紫外吸收光谱均与PDON的荧光发射光谱存在部分重叠,证明PDAND和Fe-PDANS均可与PDON发生FRET效应[22]。此外,由于Fe-PDANS的光谱重叠部分大于PDANS的光谱重叠部分,因此Fe-PDANS比PDANS具有更高的FRET效率,这证明掺入Fe3+可以提高FRET效率[22,31]。上述实验结果表明成功制备出Fe-PDANS,且将其用作PDON的猝灭剂可行。
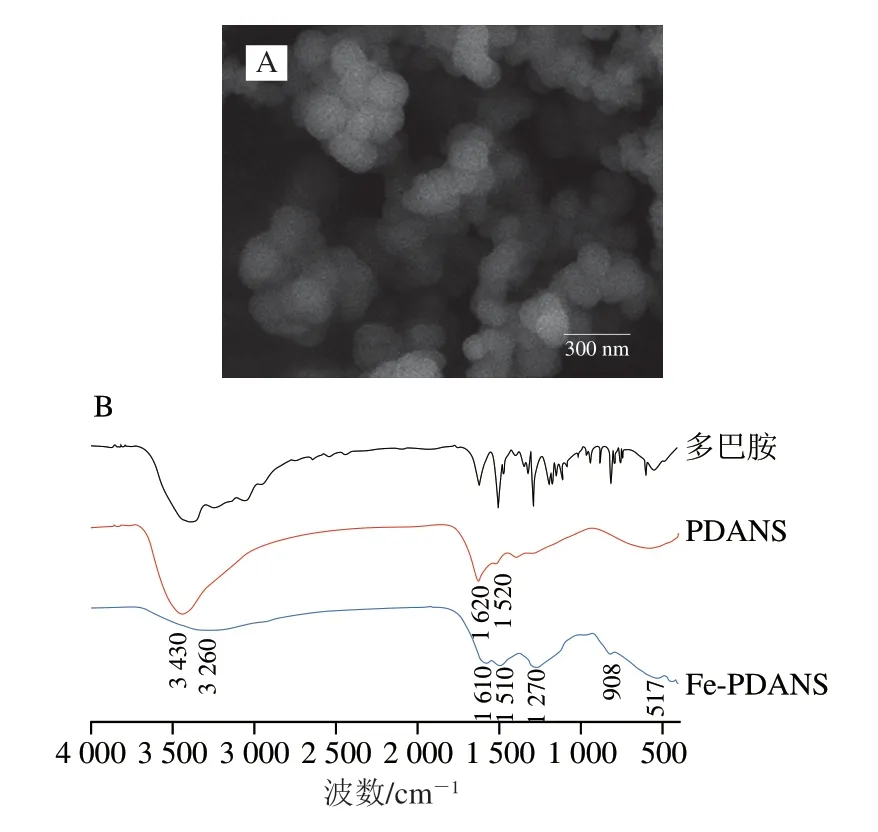

图2 Fe-PDANS的形貌及传感器的光谱表征Fig.2 Morphology of Fe-PDANS and spectral characterization of the aptsensor
2.2.2 圆二色谱分析
为进一步验证实验原理的可行性,使用圆二色谱仪考察PDON与DON孵育引起PDON的构象发生变化情况。如图2D所示,PDON的圆二色谱显示在243 nm处存在一个负峰,在272 nm处存在一个正峰,表明该适配体形成了具有小发夹结构的主环[32-33]。加入DON后,272 nm处的正峰没有显著变化,但243 nm处的负峰随着DON质量浓度的增加而逐渐加深,这是由DON嵌入到PDON中,引起螺旋碱基数的增加所导致的[32,34]。证明该适配体可以和DON有效结合并导致适配体的空间构象发生改变,从而可以通过改变适配体的空间构象达到阻止其吸附到Fe-PDANS上的目的。
2.2.3 传感器荧光光谱分析
所制备的传感器对DON检测所获得的荧光发射光谱图如图2E所示。在传感器仅存在PDON时,荧光强度较高,而在传感器存在PDON和DON时,荧光强度与仅存在PDON时无明显差别,证明DON与PDON结合后对FAM的发光性能没有影响,可将PDON用作传感器的信号探针。当向传感器中加入Fe-PDANS时,在不存在DON的情况下,传感器的荧光被猝灭。在存在DON的情况下,传感器的荧光被猝灭的程度降低,证明DON与PDON结合,阻碍了PDON与Fe-PDANS间的π-π堆积的非共价作用,从而降低了PDON与Fe-PDANS间的FRET效应。这与CD分析所得到的结果一致,进一步表明所构建的传感器具有可行性,能够实现检测DON的目的。
2.3 反应条件优化
2.3.1 Fe3+掺入量对Fe-PDANS猝灭性能的影响
如图3A所示,PDON的荧光强度随着Fe3+掺入量的增加而下降,在掺入相当于盐酸多巴胺加入量4%的Fe3+时达到最低值,此时Fe-PDANS对PDON的荧光猝灭效率最高。此外,如图3A3所示,在DON存在的情况下,4%Fe-PDANS具有最高的F2/F1值,说明在此条件下传感器具有最佳的检测性能。过少Fe3+对Fe-PDANS的猝灭性能有限,而过多Fe3+可能会破坏Fe-PDANS的形态,影响到其对PDON的吸附作用[35]。因此选择掺入4% Fe3+的Fe-PDANS作为PDON的猝灭剂。
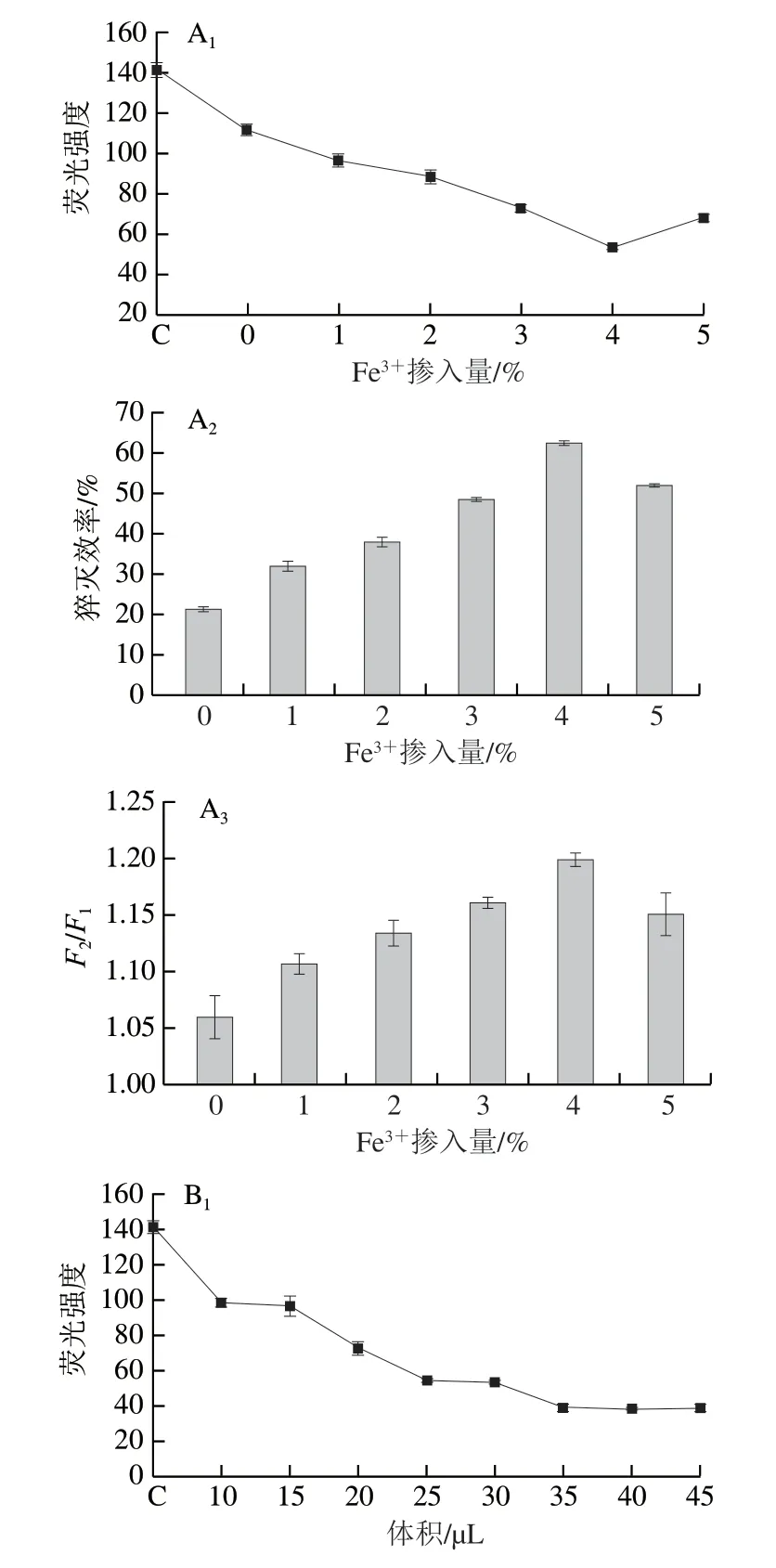
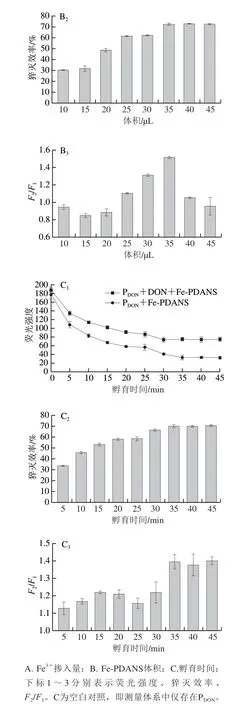
图3 传感器制备条件优化Fig.3 Selection of optimal preparation conditions for the aptasensor
2.3.2 Fe-PDANS加入量的优化
如图3B所示,PDON的荧光强度随着Fe-PDANS加入量的增加而逐渐下降,加入量达到35 µL后不再发生变化。相应的,Fe-PDANS对PDON的荧光猝灭效率随着Fe-PDANS加入量的增加而逐渐上升,加入量达到35 µL后不再发生变化。此外,如图3B3所示,加入35 µL Fe-PDANS的传感器具有最高的F2/F1值,在此之后F2/F1值逐渐下降,这是由于过量的Fe-PDANS会对PDON产生过猝灭效应[36]。因此选择加入35 µL 1 mg/mL Fe-PDANS来构建传感器,此时传感器中Fe-PDANS终质量浓度为0.02333 mg/mL。
2.3.3 Fe-PDANS与PDON孵育时间优化
如图3C所示,传感体系的荧光强度随着时间的延长逐渐下降,在不存在DON的情况下,至35 min时传感体系的荧光强度达到最小值,此后不再发生变化。相应的,Fe-PDANS对PDON的猝灭效率随着时间的延长逐渐升高,35 min后不再发生变化,这表明孵育35 min即可使传感体系中所有的PDON全部吸附到Fe-PDANS上。而当存在DON时,孵育30 min时传感体系的荧光强度达到最小值,此后不再发生变化。这可能是因为部分PDON与DON结合,减少了能与Fe-PDANS结合的PDON,因此反应时间缩短。此外,如图3C3所示,传感体系的荧光强度比值F2/F1在35 min达到最佳,表明此时可达到最佳的传感性能。因此,为确保PDON可以识别传感体系内所有的DON,选择35 min作为Fe-PDANS与PDON的孵育时间。
2.4 标准曲线的建立
通过上述实验结果,在最优的条件下建立传感体系,对0.2667、1.333、2.667、13.33、26.67 ng/mL和133.3 ng/mL质量浓度的DON进行测试,以研究DON质量浓度与F2/F1的相关性。由图4A可知,传感体系的荧光强度随着毒素质量浓度的上升而增强。由图4B可以看出,F2/F1在此质量浓度区间具有良好的线性关系,其线性方程为F2/F1=0.1583lgCDON+1.3112(R2=0.9954),检出限为0.1182 ng/mL(RSN=3)。与现有的用于DON检测的荧光适配体传感器相比,本实验具有较高的灵敏度,表明本实验所制备的传感器具有优越性[37]。
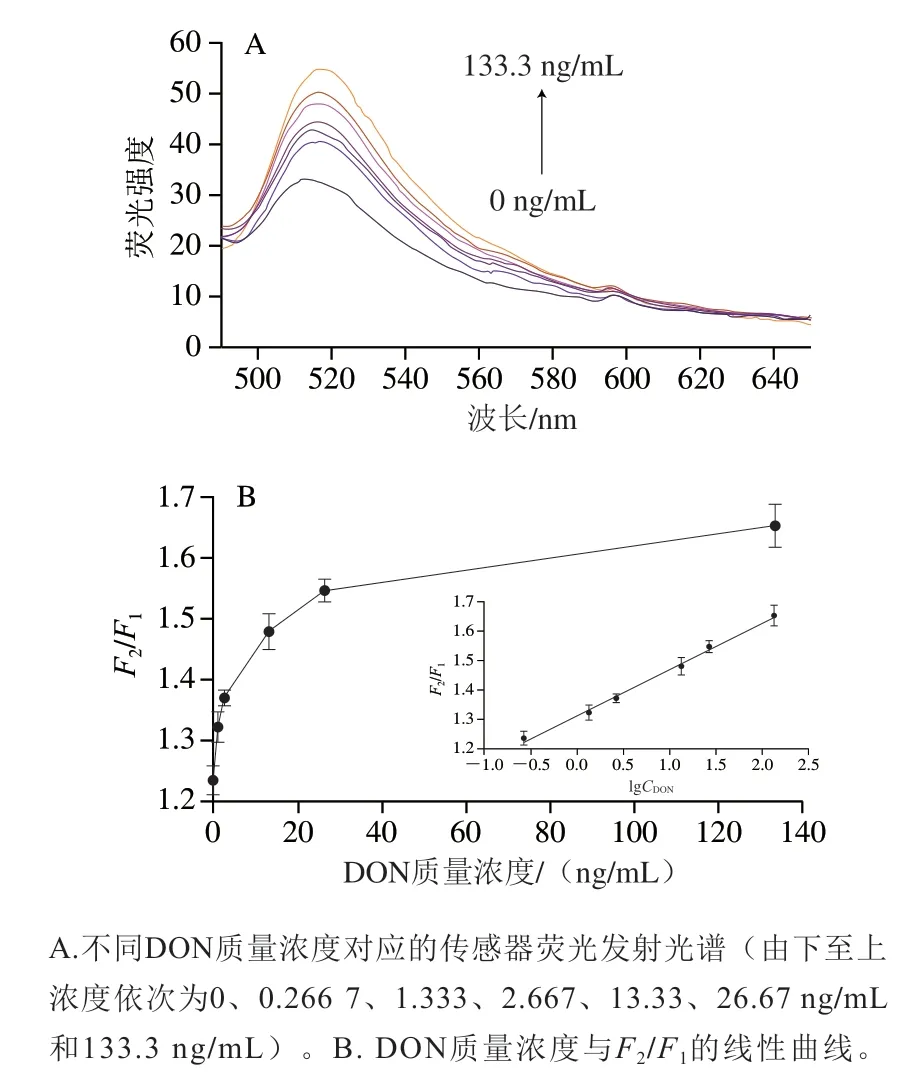
图4 荧光强度与DON质量浓度的关系Fig.4 Relationship between fluorescence intensity and DON concentration
2.5 传感器的特异性
通过检测质量浓度为1 µg/mL的不同真菌毒素(DON、ZEN、AFB1、AFG1)评估所构建传感器的特异性。如图5所示,在DON存在的情况下,F2/F1大于1,而在其他毒素的F2/F1值接近1,这表明该传感器仅与DON相互作用,具有良好的特异性。
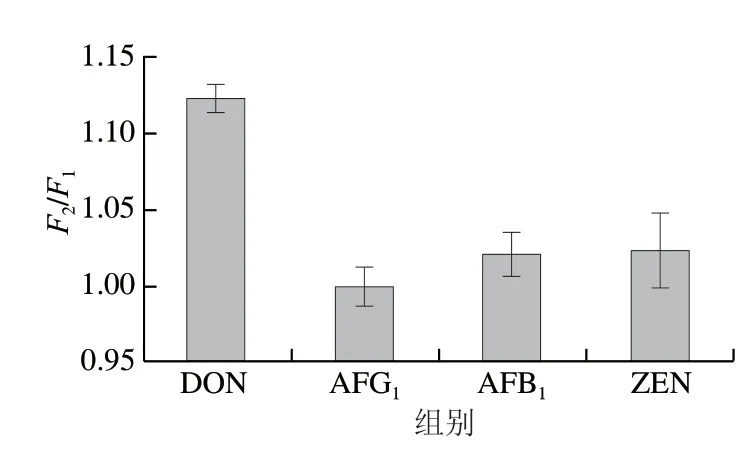
图5 传感器的特异性评估Fig.5 Selectivity assessment of the aptasensor
2.6 重复性分析
为考察所制备的传感器的重复性,在最佳条件下,测定6 批1 µg/mL DON溶液,结果见表1。相对标准偏差值小于3%,说明该传感器具有良好的重复性。

表1 重复性实验结果Table 1 Results of repeatability tests
2.7 阳性样品中DON的检测
为验证该荧光适配体传感器的可靠性,使用国标方法ELISA和所构建的荧光适配体传感器同时对受DON污染的小麦进行检测,测试结果如表2所示。同时利用统计学方法对两种方法的检测结果进行显著性分析,t检验和f检验的P值分别为0.4513和0.5297,在95%的置信水平下均超过0.05,结果表明,所构建的荧光传感器在精度上与ELISA无显著性差异。证明该荧光适配体传感器可应用于小麦中的DON检测。

表2 阳性小麦样品中DON的检测Table 2 Results of detection of DON in positive wheat samples
3 结论
利用PDANS材料良好的猝灭性能,以及对DON具有特异性识别能力的核酸适配体,通过掺入Fe3+提高PDANS与核酸适配体上修饰的FAM间的FRET效率,从而提高PDANS对FAM的荧光猝灭效率,构建一种基于FRET的荧光适配体传感器,用于检测DON。该传感器反应快速、灵敏,且具有良好的特异性和重复性,其检出限为0.1182 ng/mL,对阳性小麦样品中DON的检测结果与ELISA所得结果无显著差异(P>0.05)。

