高粱复配米脂肪体外消化产物及其氧化稳定性
刘 念,姜 鹏,戴凌燕,阮长青,张东杰, ,王长远,李志江,
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.黑龙江省杂粮加工及质量安全工程技术研究中心,黑龙江大庆 163319;3.国家杂粮工程技术中心,黑龙江大庆 163319;4.黑龙江八一农垦大学生命科学技术学院,黑龙江大庆 163319)
高梁(Sorghum bicolorL.Moench)是第五大谷类作物,富含人体所需的多种营养成分及活性物质,能够预防癌症、改善心血管疾病、降低糖尿病患病风险,具有较高的营养价值和保健功能[1−2]。当前,以精细米面为主食的饮食结构易引起糖尿病、高血压等多种慢性疾病,“合理搭配,谨和五味”的多元化合理饮食受到越来越多人们的关注与重视[3]。将高粱与常见主食大米进行复配后食用,既可提高单一食用大米时的保健价值,又可改善高粱的适口性。
高粱富含人体健康所需的多种不饱和脂肪酸和必需脂肪酸,在膳食中作用突出[4]。食物中的油脂需经过消化吸收后才能被人体利用。评估食物消化常用实验方法为细胞培养、体内消化及体外消化,其中体外消化模型主要是以商品酶或人体消化液提取液为消化酶,模拟人体消化环境进行食物的体外消化,被广泛用于食物成分在模拟胃肠道条件下释放情况、生物可及性、样品稳定性和结构变化等研究,具有灵活性、准确性和重复性高等优点[5−6]。目前,体外消化法已被证明在预测体内消化结果方面非常有效,并且与体内研究和细胞研究相比成本低、实验周期短,不受道德伦理束缚[7−9]。关于脂质体外模拟消化的研究开始较早,二十世纪七十年代,运用体外实验将唾液脂肪酶和胰脂肪酶对牛乳脂肪分解的影响结果进行比较[10]。近年来的研究多为消化液的成分、其他外在添加物及油脂本身结构性质对脂肪体外消化的影响。脂肪消化产物主要为游离脂肪酸,脂肪酸检测方法较多,如气相色谱法(GC)、高效液相色谱法(HPLC)和近红外光谱法(NIRS)等,其中GC应用最为广泛[11]。GC主要是依据各脂肪酸碳链长度、双键几何构型的不同,使其在色谱柱固定相中保留的时间不同来进行定性定量分析检测[12]。但由于油酸和亚油酸等有些脂肪酸保留时间很接近,可采用气相色谱-质谱联用法(GC-MS),根据已有的成熟标准谱图数据库,对未知化合物进行快速检索和鉴定,具有灵敏度高、检出限低、分离度好等优点[13−14]。
目前,脂肪体外消化研究大多围绕着纯油脂而展开,很少有针对纯食物的脂肪消化研究,在高粱膳食脂肪方面研究也鲜有报道[15−16]。本研究考虑食物基质等对脂肪消化的影响,对高粱大米复配米饭整体进行体外模拟消化,探究复配米饭脂肪的消化产物及氧化稳定性,从而根据其消化的特性指导高粱大米复配米饭开发,为高粱等杂粮的食用提供新思路。
1 材料与方法
1.1 材料与仪器
龙米粮1号高粱、龙粳13大米 黑龙江省农业科学院提供;α-淀粉酶(100 U/g)、胃蛋白酶(30 U/g)、胰蛋白酶(2500 U/g)、脂肪酶(30 U/g)、人工胃液、人工肠液 上海源叶生物科技有限公司;胆盐 北京索莱宝科技有限公司;游离脂肪酸试剂盒、丙二醛试剂盒 南京建成生物工程研究所;其他试剂无特殊说明均为分析纯级。
GL124-1SCN万分之一天平 德国赛多利斯公司;ZWF-110X50恒温培养震荡器 上海智城分析仪器制造有限公司;UV-1500PC紫外可见分光光度计 上海美析仪器有限公司;QL-866涡旋仪 长安科学仪器;Agilent 7890/5975C气-质联用仪 美国安捷伦科技公司;Agilent DB-WAX色谱柱30 m×0.25 mm ID×0.25 μm 美国安捷伦科技公司。
1.2 实验方法
1.2.1 样品熟化 参考姜鹏等[17]方法,将高粱清洗除杂后于45 ℃温水中浸泡2 h,待表面水分自然风干后,600 W条件下微波8 min,对高粱进行预熟化。依据课题组前期所做的不同比例高粱大米复配米饭食味值实验的结果,选择高粱大米质量比1:4复配米和高粱大米质量比1:1复配米进行实验。本实验样品分为高粱、大米、高粱大米质量比1:4复配米、高粱大米质量比1:1复配米4组,分别记为1-0组、0-1组、1-4组、1-1组。样品按水米质量比1.6:1添加蒸馏水,蒸煮20 min,关火焖制10 min。
1.2.2 脂肪含量的测定 参照GB 5009.6-2016,称取熟化样品5 g,移入滤纸筒内后放入索氏抽提器的抽提筒内,接收瓶中加入石油醚,于水浴上加热,抽提5 h。回收石油醚,将接收瓶于(100±5) ℃干燥直至恒重。
1.2.3 模拟体外消化过程 根据食品静态体外消化国际共识模拟体外消化过程[18]:
口腔消化:取5 g熟化后样品,加入4 mL人工唾液(NaCl 0.4 mg/mL、KCl 0.4 mg/mL、Na2S·2H2O 0.005 mg/mL、NaH2PO4·H2O 0.78 mg/mL),100 U/gα-淀粉酶7.6 mg,0.3 mol/L CaCl2溶液25 μL,975 μL蒸馏水,充分破碎食物后,反应2 min。
胃消化:在上述模拟口腔消化后的消化液中,依次加入9.1 mL人工胃液,30 U/g胃蛋白酶1.34 g,0.3 mol/L CaCl2溶液5 μL,695 μL蒸馏水,使用1 mol/L HCl溶液将消化液pH调至3.0,于37 ℃恒温水浴摇床反应2 h。
肠消化:在上述模拟胃消化后的消化液中,分别加入18.5 mL人工肠液,2500 U/g胰蛋白酶1.6 mg,30 U/g脂肪酶2.67 g,100 U/gα-淀粉酶0.08 g,胆盐20 mg,0.3 mol/L CaCl2溶液40 μL,1.31 mL蒸馏水,使用1 mol/L NaOH溶液将消化液pH调至7.0,于37 ℃恒温水浴摇床反应2 h。
每个样品进行3次重复体外消化,将模拟消化后的胃液、肠液3500 r/min离心10 min,取上清液用于后续检测。
1.2.4 脂肪酸种类及含量的测定
1.2.4.1 标准品配制 采用40种脂肪酸甲酯混合标准品溶液制成0.5、1、5、10、25、50、100、250、500、1000 mg/L共10个混合标准浓度梯度,其中浓度为各组分的总浓度。40个脂肪酸甲酯的标准品中,各组分浓度占总浓度的比例有2%、4%两个梯度。其中,30种组分占2%,10种组分占4%。取500 μL混合标准品,加入25 μL浓度为500 ppm的正十九酸甲酯作为内标,混匀加入进样瓶,进入GCMS检测,进样量1 μL,分流比10:1,分流进样。
1.2.4.2 脂肪提取 取样品1 mg或100 μL消化液上清液于2 mL玻璃离心管中,加入1 mL氯仿-甲醇溶液,超声30 min,取上清液,加入1%硫酸-甲醇溶液2 mL,放在80℃水浴上,甲酯化0.5 h。再加入1 mL正己烷萃取,5 mL纯水洗涤,吸取上清液500 μL,加入25 μL正十九酸甲酯作为内标,混匀加入进样瓶,进入GC-MS检测,进样量1 μL,分流比10:1,分流进样。
1.2.4.3 气相色谱条件 样品采用Agilent DB-WAX毛细管柱(30 m×0.25 mm ID×0.25 μm)气相色谱系统进行分离。程序升温:初始温度50 ℃,保持3 min,以10 ℃/min升温至220 ℃,并维持5 min。载气为氦气,载气流速1.0 mL/min。样本队列中每间隔一定数量的实验样本设置一个QC样本,用于检测和评价系统的稳定性及重复性。
1.2.4.4 质谱分析 采用Agilent 7890/5975C气-质联用仪进行质谱分析。进样口温度280 ℃,离子源温度230 ℃,传输线温度250 ℃。电子轰击电离(EI)源,SIM扫描方式,电子能量70 eV。
1.2.5 游离脂肪酸释放量的测定 取各样品消化液上清液0.2 mL,按照游离脂肪酸试剂盒说明书进行,于440 nm下测定其吸光度。
1.2.6 过氧化值的测定 参考GB 5009.227-2016,取1 mL上清液,加入3 mL三氯甲烷-冰乙酸混合液,充轻轻振摇使试样完全溶解。准确加入1.0 mL饱和碘化钾溶液,盖紧瓶盖,轻轻振摇,暗处放置3 min。取出加入10 mL水,摇匀后立即用0.01 mol/L硫代硫酸钠标准溶液滴定,至溶液透明无色。同时进行空白实验。
1.2.7 丙二醛含量的测定 取各样品消化液上清液0.1 mL,按照丙二醛试剂盒说明书进行,于532 nm处测其吸光度值。
1.3 数据处理
样品采用三次平行取样,数据用平均值±标准差来表示。采用MSD ChemStation软件提取色谱峰面积及保留时间,利用统计学软件SPSS23.0和Origin 8.0进行分析作图,采用单因素方差分析比较各组间数据,t检验法分析组间差异显著性,P<0.05表示有统计学意义。
2 结果与分析
2.1 高粱与大米脂肪含量及组成
高粱总脂肪含量为2.81%,大米仅为0.39%,高粱脂肪含量高于大米的脂肪含量。高粱经微波蒸煮后总脂肪含量降低至2.38%,大米经蒸煮后降至0.35%。与Afify等[19]研究结果相似,除浸泡处理外,蒸煮、发芽、微波等处理均会显著降低高粱中的脂肪含量。Kumar等[20]研究也表明,蒸煮可使大米的脂肪提取率降低2.6%~9.9%。脂肪含量的降低可能是由于在熟化过程中脂质发生降解或形成了脂肪-蛋白质、脂肪-淀粉等复合物[15]。
高粱与大米熟化前后脂肪酸组成及含量如表1所示,高粱和大米中共检测出30种脂肪酸,主要脂肪酸为亚油酸、油酸、棕榈酸、亚麻酸和硬脂酸,以上5种脂肪酸占到总脂肪酸含量的95%以上。经过熟化后,仍可检测出30种脂肪酸,并没有出现新的脂肪酸,各脂肪酸含量均有所降低,这与测定的总脂肪含量变化具有一致性。高粱中饱和脂肪酸、单不饱和脂肪酸、多不饱和脂肪酸含量分别降低23.82%、21.06%、25.07%,大米分别降低25.70%、18.38%、12.93%。研究发现,高粱经蒸煮后,饱和脂肪酸降低33%,不饱和脂肪酸降低30%;高粱经微波处理后,饱和脂肪酸降低56%,不饱和脂肪酸降低64%[19]。微波和蒸煮等处理会降低高粱中的脂肪酸含量,本实验与之相比减少程度较低可能是由于蒸煮时间、微波时间和功率等实验条件的不同。
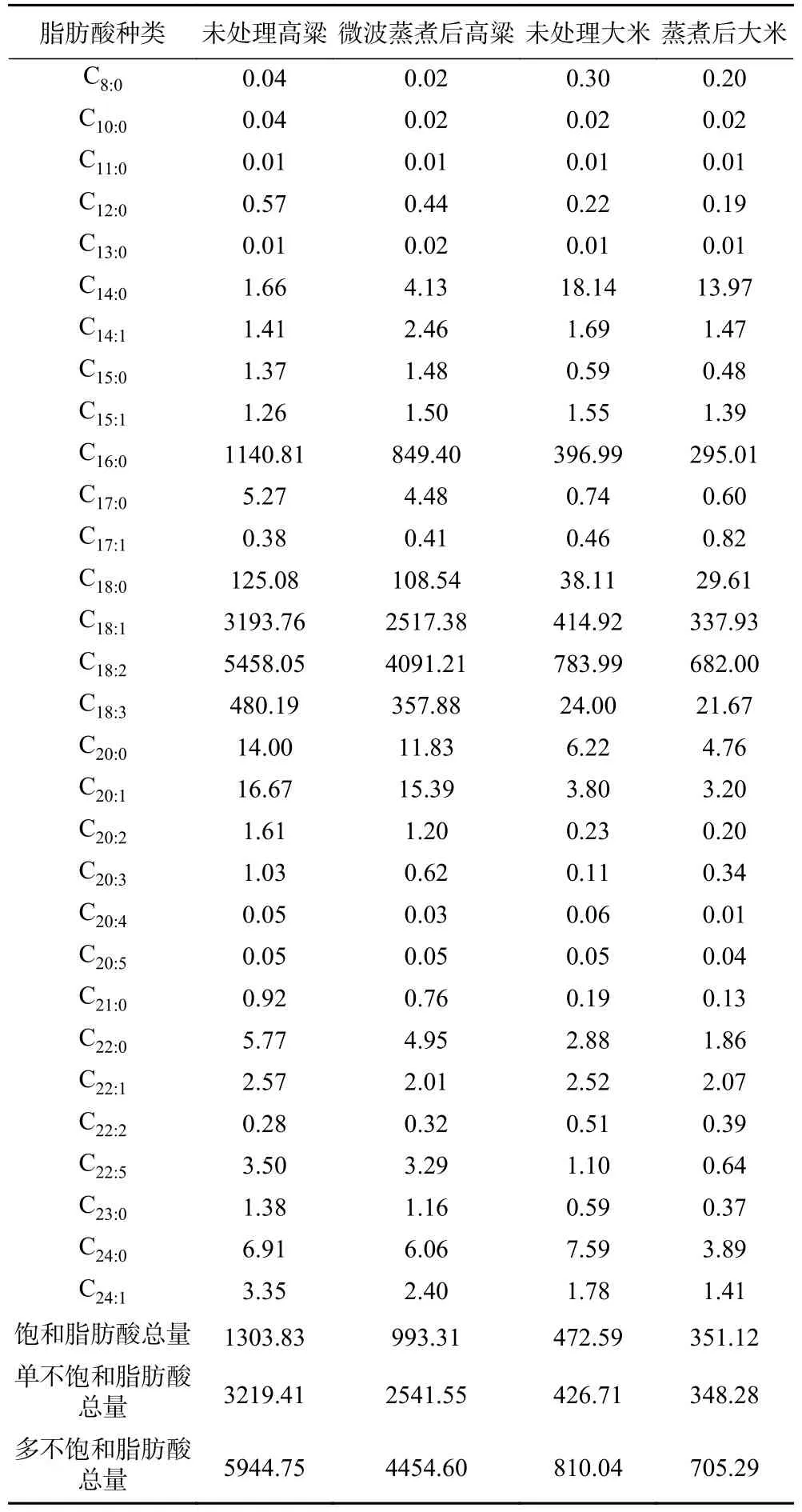
表1 高粱与大米熟化前后脂肪酸含量(μg/g)Table 1 Fatty acid content of sorghum and rice before and after maturation (μg/g)
虽然熟化过程中的热处理会降低高粱和大米中各脂肪酸含量,但各脂肪酸占总脂肪比例变化不明显。熟化后,高粱和大米主要脂肪酸仍为亚油酸、油酸、棕榈酸、亚麻酸和硬脂酸,分别占高粱总脂肪酸的51.21%、31.51%、10.63%、4.48%和1.36%,大米的48.55%、24.06%、21.00%、1.54%和2.11%。研究表明,高粱中主要脂肪酸为亚油酸、油酸、棕榈酸、亚麻酸和硬脂酸,分别为43.33%、37.15%、13.73%、1.55%和1.07%,微波处理后变为43.39%、37.12%、13.73%、1.54%和1.07%[21]。大米中主要脂肪酸为油酸、亚油酸、棕榈酸、硬脂酸和亚麻酸,分别为41.3%、32.4%、19.6%、3.5%和0.8%,经蒸煮后变为42.0%、31.2%、19.0%、4.6%和0.8%[22]。蒸煮和微波处理对高粱和大米的脂肪酸组成影响不大,主要脂肪酸仍是亚油酸、油酸、棕榈酸、亚麻酸和硬脂酸。本实验结果与其相似,但由于高粱和大米的品种和生长环境的不同,脂肪酸含量会有变化[4]。
2.2 消化液中游离脂肪酸含量
油脂在胃肠中可被消化酶水解为甘油二酯、甘油一酯和游离脂肪酸等,因此胃肠液中游离脂肪酸的含量可用来反映脂质的消化程度[23]。样品消化后胃肠液中游离脂肪酸含量由图1所示,肠液中的游离脂肪酸的含量显著高于胃液(P<0.05),脂质在肠中的脂解程度更高。小肠是脂肪消化的主要部位,肠液中脂肪消化酶的含量高于胃液[24]。胃液中,高粱组(0.38 μmol/g)与1:1复配米组(0.32 μmol/g)的游离脂肪酸含量最高,其次为1:4复配米组(0.20 μmol/g)和大米组(0.18 μmol/g)。肠液中,高粱组中的游离脂肪酸的含量最高(15.15 μmol/g),其次为1:1复配米(9.70 μmol/g)和1:4复配米组(7.89 μmol/g),最低为大米组(5.95 μmol/g)。主要是由于样品中高粱所占比例增加,脂肪含量增加,消化后的游离脂肪酸的含量也随之增加。但与此同时,脂肪酸释放率和消化程度随着样品中脂肪含量的增加而降低。经胃液消化后,大米组脂肪酸释放率最高,为2.06%,其次为1:4复配米和1:1复配米组,分别为1.17%和1.11%,最低为高粱组,为0.50%。经肠液消化后,大米和1:4复配米组最高,分别为67.71%和46.31%,其次为1:1复配米组,为33.02%,最低的为高粱组,为30.28%。主要是由于脂肪消化产物的积累会抑制肪酶的活性,游离脂肪酸含量越高则脂肪酶的活性越低,样品游离脂肪酸释放率越低[25]。研究者将150、300和850 mg玉米油进行体外肠道消化,结果显示850 mg的脂质消化程度最低,但其释放的游离脂肪酸含量最高[26]。此外,本实验的复配米脂质消化率低于叶展[27]研究的棕榈油(71.97%)、菜籽油(69.01%)等典型膳食油脂的消化率,主要是由于脂质与蛋白质、碳水化合物之间存在相互作用,脂质分解受固体食物基质分解速率和程度的制约[28−29]。
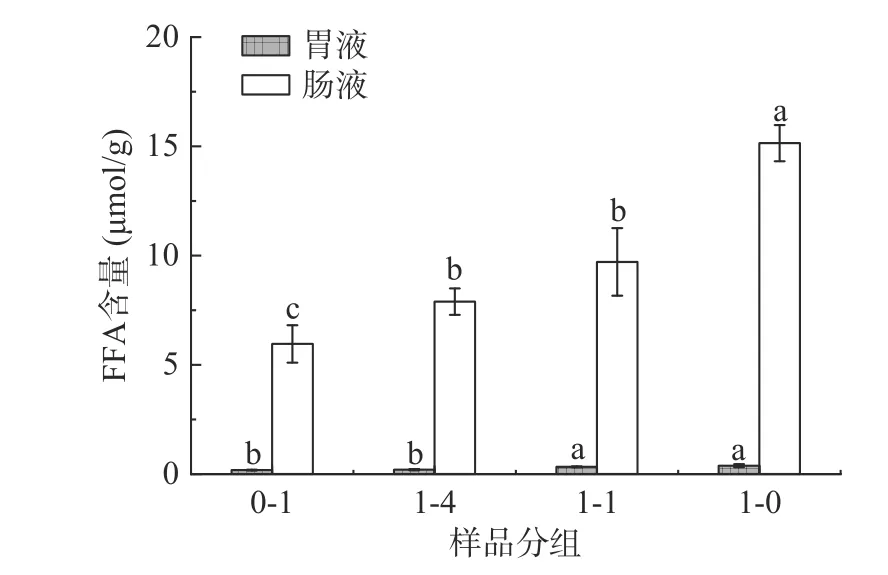
图1 样品消化后胃肠液中游离脂肪酸含量Fig.1 Free fatty acid content in gastrointestinal fluid of samples after digestion
2.3 消化产物脂肪酸种类及含量
各组样品消化后胃液、肠液中脂肪酸种类及含量如表2、表3所示。相比于原样,样品消化后脂肪酸种类及组成比例发生明显变化。消化前各组样品中存在的癸酸、十三酸、二十碳三烯酸、二十二碳五烯酸、二十三酸在胃肠液中含量均低于检测范围,未被检测到。四组样品胃液中脂解主要产物为棕榈酸、硬脂酸、亚油酸和芥酸,肠液中主要为棕榈酸、硬脂酸和亚油酸,消化前样品中含量较高的油酸和亚麻酸在胃肠液中含量较低。饱和脂肪酸棕榈酸和硬脂酸的消化率高于不饱和脂肪酸油酸、亚油酸和亚麻酸。研究显示,豆油乳剂体外消化后各脂肪酸的释放百分比,其中棕榈酸和硬脂酸的释放率也显著高于亚麻酸、油酸和亚油酸[30],原因可能是饱和脂肪酸棕榈酸和硬脂酸主要占据甘油三酯分子Sn-1和Sn-3位,而不饱和脂肪酸油酸、亚油酸等通常占据Sn-2位,胰脂肪酶对Sn-1和Sn-3位特异性导致消化过程中棕榈酸和硬脂酸的释放量更大。
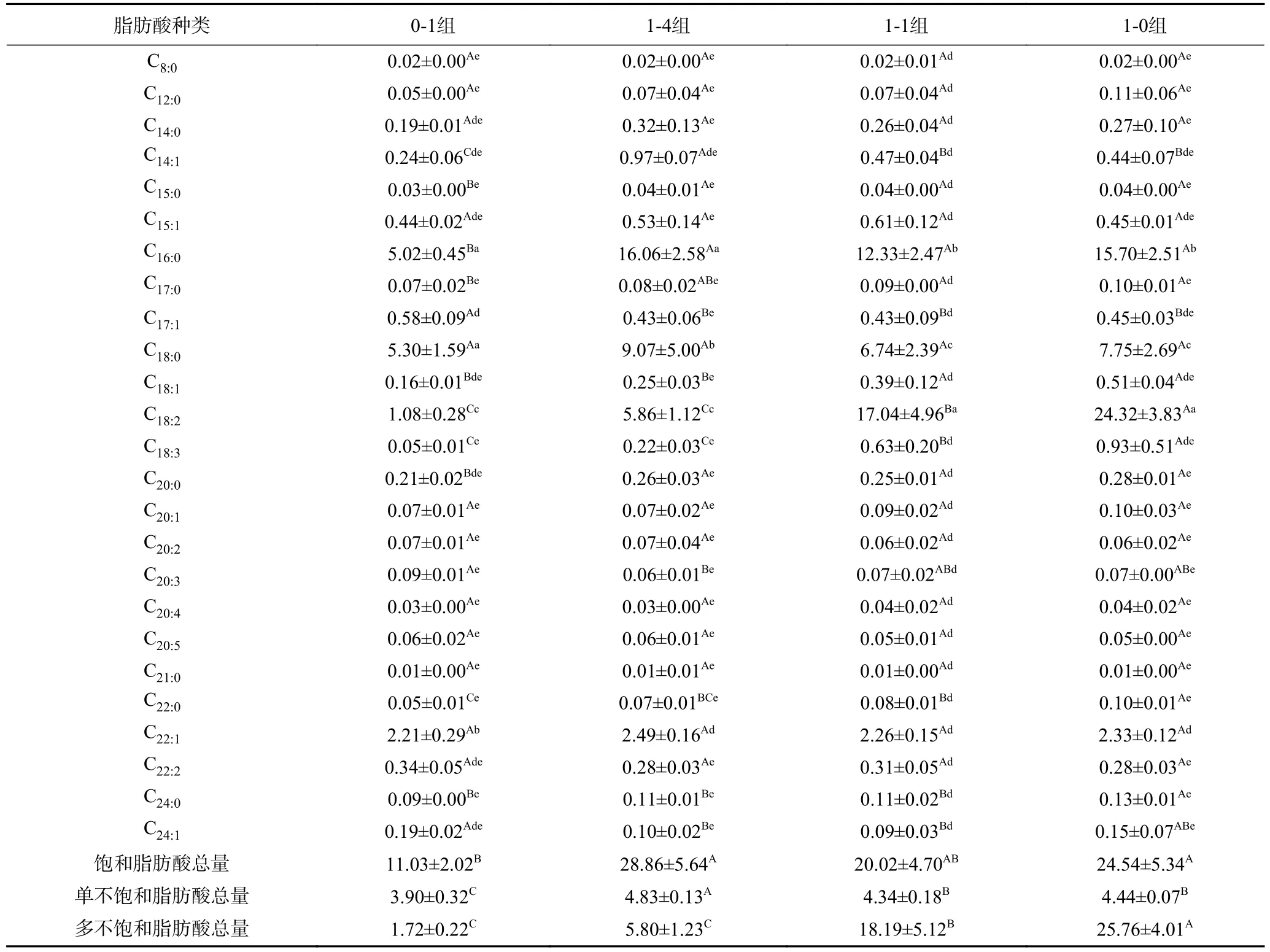
表2 样品消化后胃液中脂肪酸种类及含量(μg/g)Table 2 Types and contents of fatty acids in gastric juice after sample digestion (μg/g)
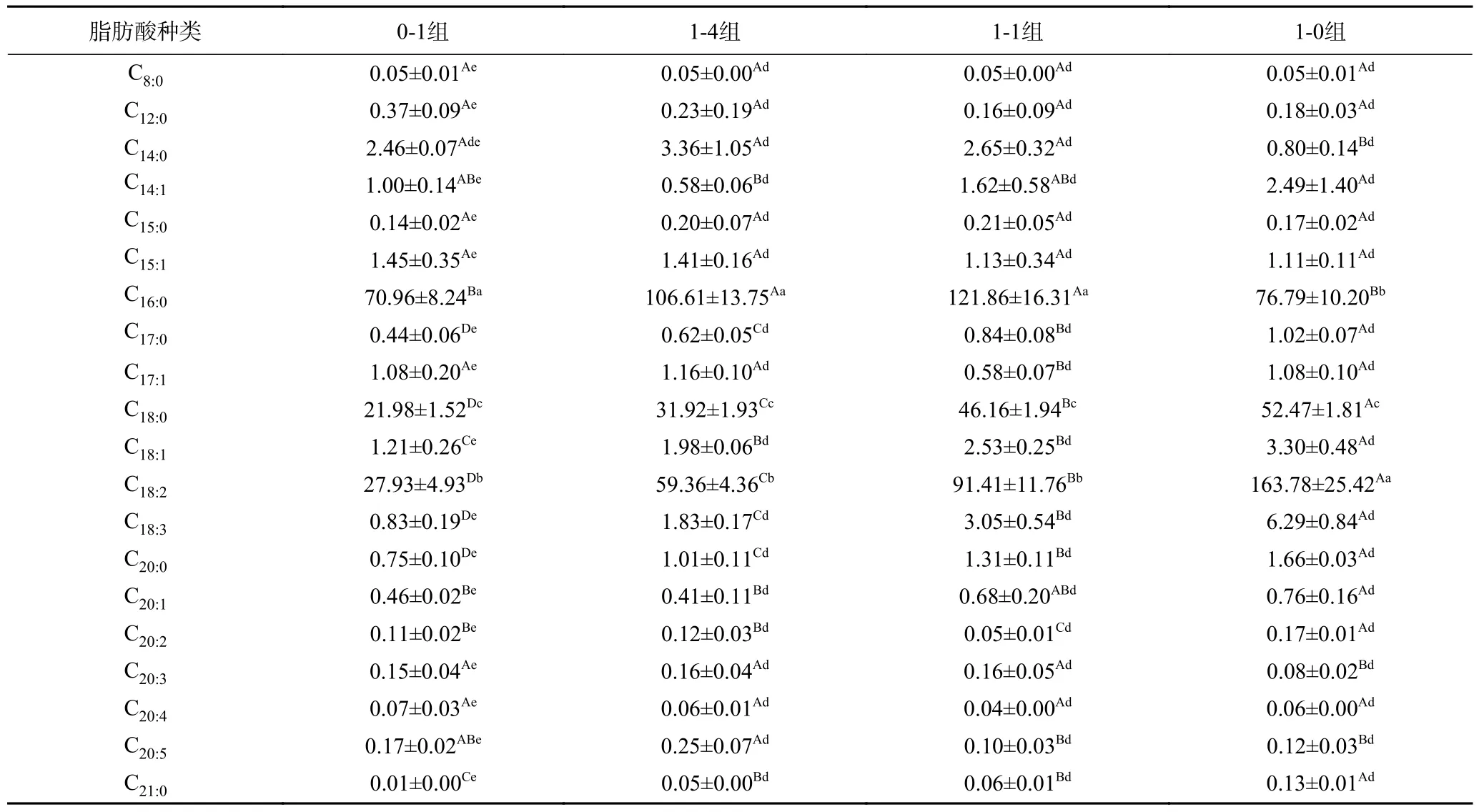
表3 样品消化后肠液中脂肪酸种类及含量(μg/g)Table 3 Types and contents of fatty acids in intestinal fluid after sample digestion (μg/g)
不饱和脂肪酸代替饱和脂肪酸的摄入,可改善高胆固醇血症和高甘油三酯血症,保持人体正常的血脂水平,预防动脉粥样硬化,降低冠心病的发病危险[31]。不饱和脂肪酸中的亚油酸及α-亚麻酸为人体必需脂肪酸,人体无法合成,主要通过食物提供[32]。但食物中的油脂并不能被人体直接利用,必须经过胃肠道消化吸收后才可以参与人体代谢[27]。经体外胃肠模拟消化后,1:4复配米组、1:1复配米组不饱和脂肪酸含量分别为28.50%、34.34%,大米组不饱和脂肪酸含量为21.75%。相比于大米,复配米组中的不饱和脂肪酸所占比例更高。亚油酸在1:1复配米组和1:4复配米组中的含量分别为91.41、59.36 μg/g,显著高于大米组(27.93 μg/g)(P<0.05)。α-亚麻酸在1:1复配米组和1:4复配米组的含量分别为3.05、1.83 μg/g,也显著高于大米组(0.83 μg/g)(P<0.05)。因此,在等量摄入的情况下,相比于大米,高粱大米复配米会使人体吸收摄入的不饱和脂肪酸比例和人体必需脂肪酸含量有所提升,改善饮食脂肪酸摄入吸收平衡。

续表 3
2.4 消化产物的氧化稳定性
由于强酸、酶、胆盐、盐离子等作用,脂质在胃肠道内消化过程中易发生氧化反应,其生成的初级和次级代谢产物会被人体吸收进而在体内积累,损害正常细胞和功能,危害人体健康[33−34]。过氧化值(POV)可表示初级氧化产物,丙二醛(MDA)则是次级氧化产物,两者共同检测可更全面说明脂质在模拟消化过程中的氧化反应[35]。
由图2、图3可知,1:1复配米和1:4复配米组胃液中的POV值和MDA含量均显著低于高粱组(P<0.05),肠液中的POV值显著低于高粱组(P<0.05),MDA含量与高粱组差别不显著。由上述结果2.3可知,1:1复配米和1:4复配米组在胃液中不饱和脂肪酸含量分别为22.53和10.63 μg/g,在肠液中不饱和脂肪酸含量分别为109.57和73.29 μg/g,均显著低于高粱组在胃肠液中不饱和脂肪酸含量30.20和185.42 μg/g。而脂质氧化作用主要是发生在不饱和脂肪酸共价键上的自由基反应,复配米组不饱和脂肪酸含量较高粱组低,POV值也较低[35]。MDA含量差别不显著可能是由于MDA为次级氧化产物,是以初级氧化产物作为底物进一步氧化分解,而在消化过程中初级氧化产物尚未分解完全[36]。
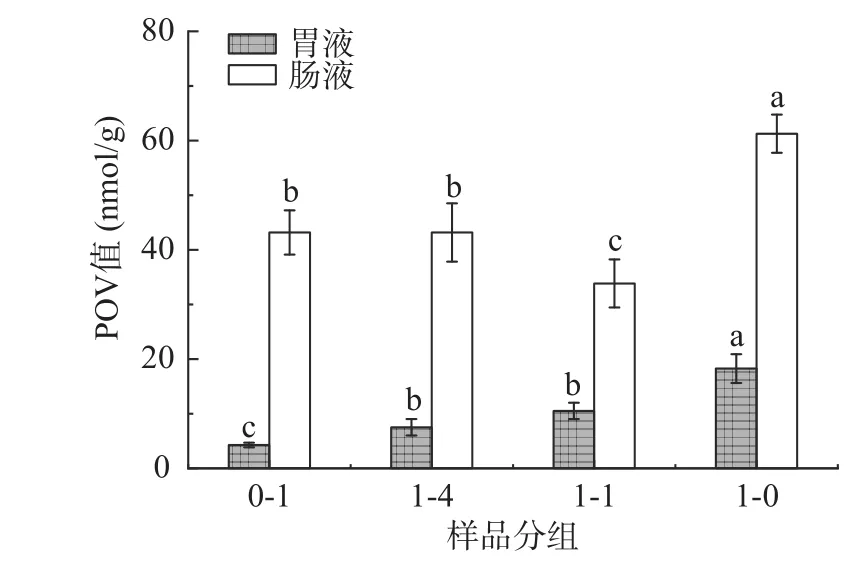
图2 样品消化后胃肠液过氧化值Fig.2 Peroxide value of gastrointestinal fluid after sample digestion
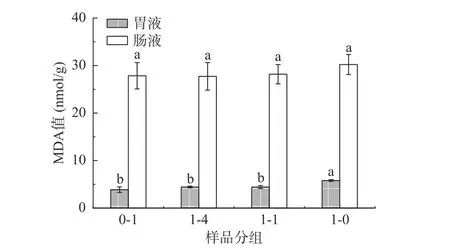
图3 样品消化后胃肠液中丙二醛含量Fig.3 Malondialdehyde content in gastrointestinal fluid after sample digestion
总之,在等量摄入的情况下,相比于高粱,高粱大米复配米会减少人体对脂质氧化产物的吸收积累。此外,1:1复配米和1:4复配米组肠液中MDA含量、1:4复配米组肠液POV值与大米组差别不显著,1:1复配米组肠液POV值低于大米组,可能是高粱中具有抗氧化性的多酚、单宁等活性物质所导致[3]。由此可知,即使复配米组中不饱和脂肪酸含量高于大米组,但其与大米组在肠中产生的氧化代谢产物含量差别不显著。所以相比于等量摄入大米,高粱大米复配米既可提高不饱和脂肪酸摄入量,也不会增加肠中脂质氧化产物的吸收积累。
3 结论
高粱富含人体健康所需的不饱和脂肪酸和人体必需脂肪酸亚油酸和α-亚麻酸。但脂肪并不能被人体直接利用,需经过胃肠道消化后才可以被人体吸收代谢,将高粱与大米复配或单独进行体外胃肠模拟消化,可为粮食脂肪的体内消化提供参考。经消化后,1:1复配米、1:4复配米不饱和脂肪酸含量为34.34%和28.50%,亚油酸含量为91.41和1.83 μg/g,α-亚麻酸含量为3.05和1.83 μg/g,均显著高于大米组(P<0.05)。与大米相比高粱复配米改善了摄入的饮食脂肪酸组成。此外,1:1复配米、1:1复配米经消化后肠液中POV值为33.83和43.16 nmol/g,均低于高粱组。与高粱相比,高粱复配米减少了人体对脂质氧化产物的吸收积累。因此,高粱复配米为高粱的食用方法提供一种新思路,本实验也从摄入脂肪角度为高粱大米复配米饭开发研究提供理论依据。但消化后的脂肪酸还需经过肠道吸收后才可进入体内,因此要探究复配米的脂肪对人体作用还需后续吸收代谢方面研究。

