PKMYT1在乳腺癌中表达的生物信息学分析及实验用细胞系筛选
安彦榕 贾永峰
乳腺癌(breast cancer,BC)是一种在临床特征和分子特征上均具有异质性的恶性肿瘤,仍是全球女性中最普遍的疾病且是和肿瘤相关死亡最主要的原因。全球每年新发病例近170万,死亡人数超过52万[1,2]。乳腺癌是癌症导致死亡的第二大原因,约占女性诊断肿瘤的30%[2,3]。虽然手术为主的治疗方法可以提高早期乳腺癌患者的远期生存率,但由于缺乏有效的治疗手段,晚期乳腺癌患者的5年生存率较低,因此迫切需要研究乳腺癌的分子调控机制,寻找新的且合适的治疗靶点[4]。PKMYT1是WEE家族的成员,最早被报道为一种能够有效磷酸化Thr14和Tyr15的激酶[5]。据报道,PKMYT1通过抑制细胞周期相关蛋白(如Cyclin A、CDK1和CDK2)的活性来抑制细胞周期的进程[6]。在最近的报道中,PKMYT1也被发现驱动多种肿瘤的进展[7]。然而,PKMYT1在乳腺癌进展中的作用和机制尚不清楚。在本研究中,分析了PKMYT1在乳腺癌进展中的重要作用及影响,并验证了PKMYT1在乳腺癌各细胞系中的表达情况,提示其可能在乳腺癌发生和恶化等过程中起到重要作用。
材料与方法
1.数据处理及分析:从TCGA数据库中下载乳腺癌RNA转录组数据和临床数据,并使用R语言软件(Rx64 4.0.2版本)对其进行分析,其中包括113例正常样本和1109例肿瘤样本。采用Limma包进行差异基因表达分析、GSEA及KEGG富集分析以及生存分析。差异表达基因(DEGs)的阈值设为|fold-change|>2和错误发现率(FDR)<0.05,富集结果的FDR阈值设置为0.05[8]。
2.生物信息学分析:除利用TCGA数据库进行分析外,还通过其他数据库进行验证。基因表达谱和交互分析工具(GEPIA 2)是一个在线工具,可提供肿瘤和正常组织中差异基因表达的信息、相关分析以及基于广泛的RNA测序数据患者的生存分析。此外,使用包含54675个基因和10461个癌症样本(包括4929个乳腺癌样本)的Kaplan-Meier Plotter数据库来评估PKMYT1对乳腺癌患者生存率的影响。TIMER 2.0可对PKMYT1在泛癌中的差异表达进行分析。HPA数据库收集了基因在泛癌细胞系中的表达情况,可对PKMYT1进行分析。
3.细胞培养:人类正常乳腺上皮细胞系MCF10A和乳腺癌细胞系MCF-7、MDA-MB-231、MDA-MB-468、HCC1937以及小鼠乳腺癌细胞系C127、4T1、EMT6、E0771均购自武汉普诺赛(Procell)生命科技有限公司。DMEM培养基、1640培养基、胰酶及牛胎血清(FBS)购自美国Gibco公司。MCF10A采用专用培养基购自武汉普诺赛(Procell)生命科技有限公司;MDA-MB-231、HCC1937、EMT6细胞均采用1640培养基(90%1640培养基+10%FBS),其他细胞均采用DMEM培养基(90%DMEM培养基+10%FBS),置于细胞培养箱(37℃、5%CO2)内培养[9]。当细胞汇合度为80%~90%时进行传代,保持细胞良好的生长状态,取对数增长的细胞进行后续研究。
4.总RNA提取及实时荧光定量PCR:根据制造商的说明,使用碧云天RNAeasyTM动物RNA抽提试剂盒(离心柱式)提取总RNA。互补DNA (cDNA)通过TIANGEN Fastking一步法除基因组cDNA第一链合成预混试剂反转录总RNA获得,并用于TRANS PerfectStartTMGreen qPCR SuperMix的实时定量聚合酶链反应(qRT-PCR)实验。人细胞系采用GAPDH作为内参,鼠细胞系采用ACTB作为内参。人类PKMYT1上游引物:5′-CATGGCTCCTACGGAGAGGT-3′,下游引物:5′-ACATGGAACGCTTTACCGCAT-3′。人类GAPDH上游引物:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物:5′-GGCTGTTGTCATACTTCTCATGG-3′。小鼠PKMYT1上游引物:5′-GTACCCCCATCCCAGTTCCA-3′,下游引物:5′-TCTGAGGTCTCACACAGGAAA-3′。小鼠ACTB上游引物:5′-GTGCTATGTTGCTCTAGACTTCG-3′,下游引物:5′-ATGCCACAGGATTCCATACC-3′。PKMYT1相对表达量用 2-ΔΔCt表示,ΔΔCt = CtPKMYT1-CtGAPDH/ACTB,ΔΔCt=ΔCt样本-ΔCt参考样本[10]。

结 果
1.PKMYT1在乳腺癌中高表达且可能成为新型肿瘤标志物:通过TCGA数据库下载的乳腺癌转录组数据,对其1222例乳腺样本(N:113/T:1109)进行差异分析及配对差异分析。经差异分析发现,P<0.001说明PKMYT1在正常和肿瘤样本中的表达差异有统计学意义,且在肿瘤样本中高表达(图1A);经配对差异分析可知,P≤2×10-16说明PKMYT1对于同一个样本癌旁组织和癌组织中的表达是有差异的,且在癌组织中表达更高(图1B);同时PKMYT1在乳腺癌中的差异表达在GEPIA 2(图1C)及TIMER2.0(图1D)数据库中加以验证,其结果一致,PKMYT1均在乳腺癌中高表达,提示PKMYT1可能在乳腺癌发生和恶化等过程中起到重要作用。其中TIMER2.0数据库分析发现PKMYT1在多种肿瘤中均为高表达且具有差异,提示PKMYT1可能成为新型肿瘤标志物。
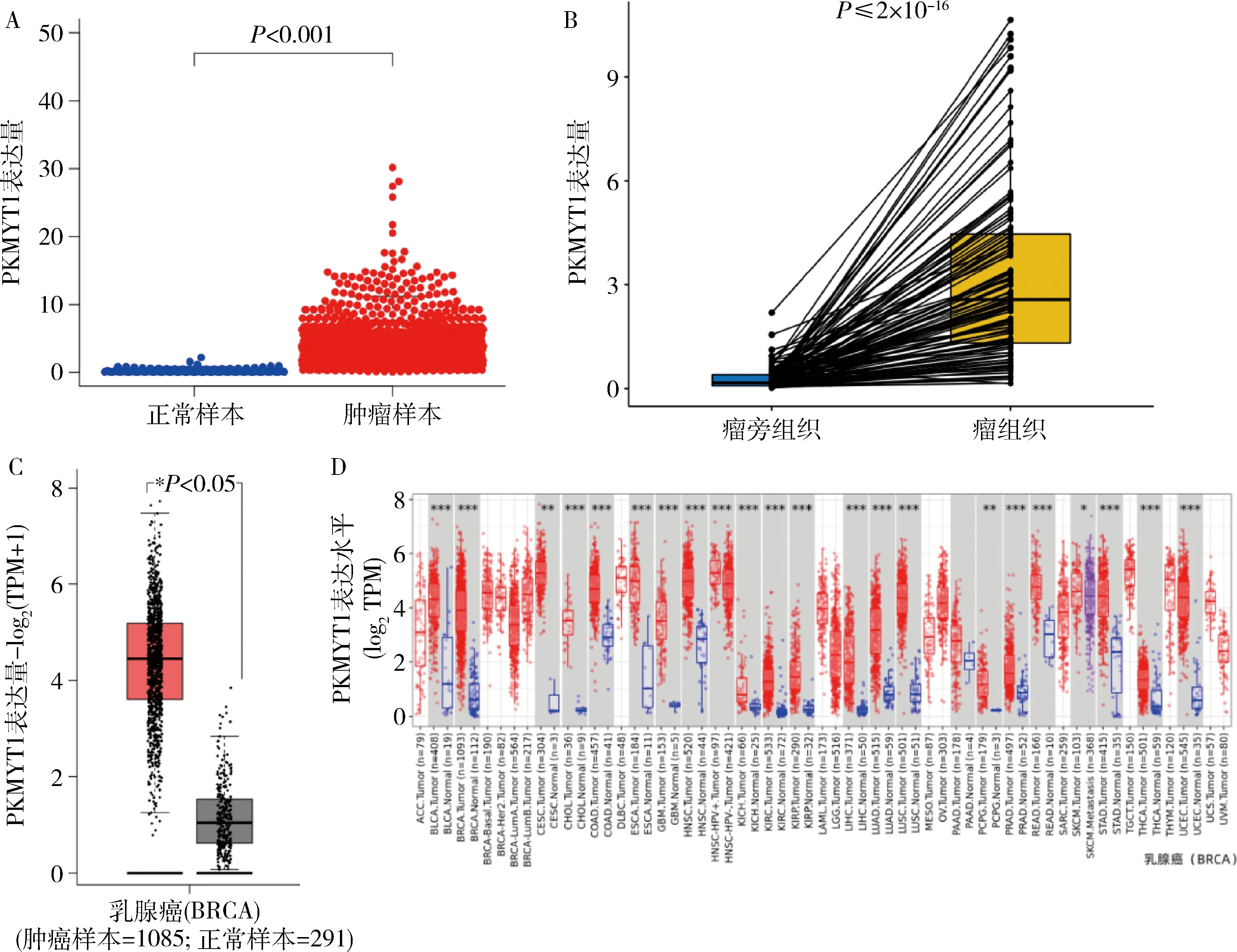
图1 PKMYT1在乳腺癌中的差异表达A.PKMYT1在TCGA数据库中的差异分析;B.PKMYT1在TCGA数据库中的配对差异分析;C.PKMYT1在GEPIA 2数据库中的差异分析;D.PKMYT1在TIMER 2.0数据库中的差异分析
2.PKMYT1在乳腺癌中影响肿瘤分期及原发肿瘤直径:将TCGA获取的1222例乳腺样本的转录组数据及临床数据应用Perl软件及R语言软件的Limma及Ggpubr包对数据进行合并及临床相关性分析。PKMYT1在乳腺癌中与年龄、肿瘤分期(Ⅰ~Ⅱ期及Ⅰ~Ⅲ期)及原发肿瘤直径(T、T1~2、T1~3、T1~4)相关,差异有统计学意义(P<0.05),而与性别、远处转移(M)、淋巴结转移无关(N),差异无统计学意义(P>0.05,图2)。
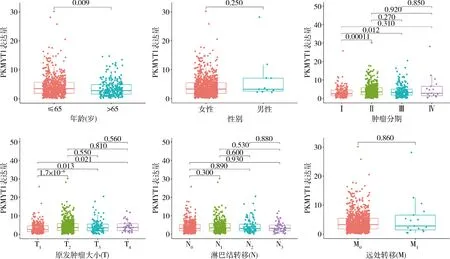
图2 PKMYT1在乳腺癌中的临床相关性分析
3.GSEA功能富集分析提示PKMYT1在乳腺癌中与肿瘤生长、增殖相关:利用GSEA(GSEA_4.0.3版本)分析PKMYT1在乳腺癌中的功能及通路,进而了解PKMYT1在乳腺癌中发挥的作用。分析结果显示当PKMYT1高表达时,经554例样本的功能富集分析显示与细胞周期、DNA复制、同源重组等功能性关系较高,则说明PKMYT1在乳腺癌中可能对癌细胞的生长、增殖相关(图3A);低表达时则与胞外基质受体相互作用、TGF-β信号通路、MAPK信号通路等相关(图3中B和C),差异有统计学意义(P<0.05,表1,表2)。

表1 PKMYT1高表达功能富集结果(554个样本)

表2 PKMYT1低表达功能富集结果(555个样本)

图3 PKMYT1在乳腺癌中的功能富集分析A.PKMYT1高表达时GSEA多通路富集图; B.PKMYT1低表达时GSEA多通路富集图; C.PKMYT1参与重要通路的KEGG详情
4.PKMYT1为乳腺癌的高风险因素且与其生存相关:通过Kaplan-Meier Plotter来评估PKMYT1对乳腺癌患者生存率的影响,结果发现PKMYT1显著影响乳腺癌患者的生存,其HR=1.22提示为高风险因素,且差异有统计学意义(P<0.001,图4)。PKMYT1低表达组的生存率更高,说明当PKMYT1高表达时对乳腺癌是有促进作用的。
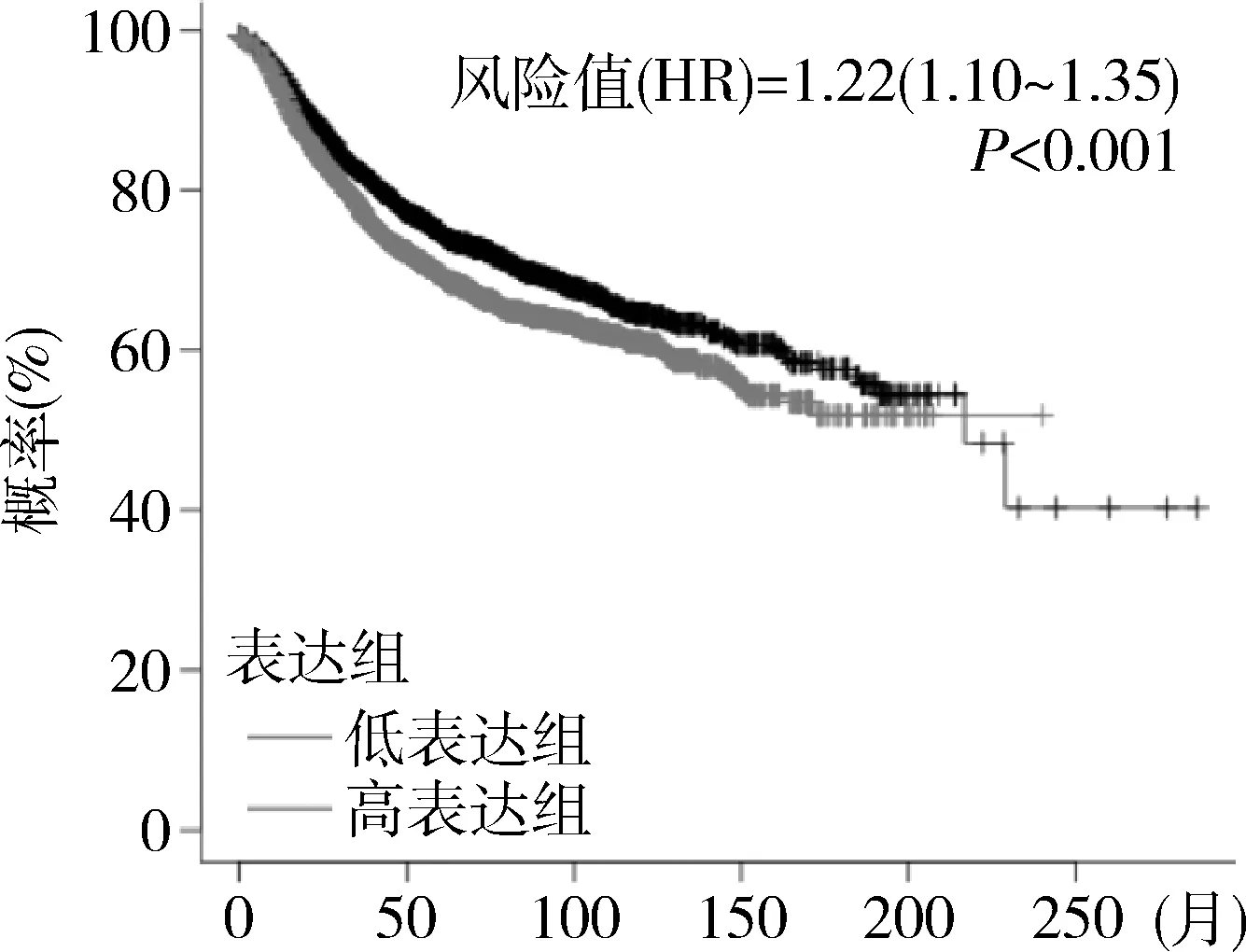
图4 PKMYT1在乳腺癌中的生存分析
5.PKMYT1在乳腺癌各细胞系中的表达情况:经在线工具HPA数据库分析发现PKMYT1在泛癌各细胞系之间的差异表达,其中以MCF-7的表达量是最高的,其nTPM值可达127.5,证明PKMYT1在乳腺癌中高表达(图5A)。为此选取了5种人乳腺细胞系及4种小鼠乳腺癌细胞系做验证,为选择PKMYT1高表达的细胞系进行后续的功能验证。经前期的差异分析及细胞系表达分析,通过qRT-PCR技术检测了1种人类正常乳腺上皮细胞系MCF10A和4种人类乳腺癌细胞系MCF-7、MDA-MB-231、MDA-MB-468、HCC1937以及4种小鼠乳腺癌细胞系C127、4T1、EMT6、E0771中PKMYT1的相对表达水平。结果验证了PKMYT1在人乳腺癌细胞系中以正常乳腺细胞系为参照表达由高到低的细胞系依次为MDA-MB-231、MDA-MB-468、MCF-7、HCC1937(图5B);PKMYT1在小鼠乳腺癌细胞系中的表达由高到低依次为4T1、E0771、C127、EMT6(图5C)。
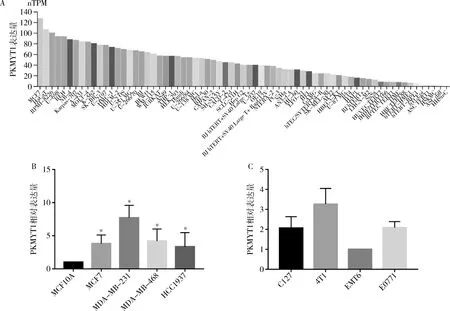
图5 qRT-PCR检测PKMYT1mRNA在乳腺癌细胞系中的相对表达量A.PKMYT1在泛癌细胞系中的表达情况;B.PKMYT1在人类乳腺癌细胞系中的相对表达量。与MCF10A比较,*P<0.05;C.PKMYT1在小鼠乳腺癌细胞系中的相对表达量
讨 论
在生理条件下PKMYT1作为一个周期蛋白调节激酶,主要负责当CDK1与细胞周期蛋白复合时,通过磷酸化CDK1激酶作为有丝分裂(G2期到M期转变)的负调节因子,主要介导CDK1在Thr14 上的磷酸化,可能在较小程度上参与了CDK1在Tyr15上的磷酸化[11]。PKMYT1是WEE蛋白激酶家族的一员,WEE家族包括WEE1、PKMYT1、WEE2[12]。在非恶性真核体细胞中,它们作为肿瘤抑制因子,主要生物学功能是防止在细胞复制时发生DNA改变,也作为G2检查点维持复制的稳定。而在肿瘤细胞中,又类似于癌基因,其升高与肿瘤进展和更具侵袭性疾病以及不良预后相关[13]。一旦恶性转化过程被诱导,WEE家族上调通过确保癌细胞的基因组不稳定性达到可容忍水平而发挥促进肿瘤的功能[7]。
在乳腺癌中PKMYT1是WEE家族唯一过表达的基因,可见PKMYT1对乳腺癌的发生、发展起着重要的作用,具体机制还有待研究[11]。肝细胞癌和结肠癌中,PKMYT1通过激活β-连环蛋白/TCF调节上皮-间质转化,这是一个与肿瘤进展、侵袭、转移和耐药性相关的过程[14,15]。PKMYT1已被报道在非小细胞肺癌中控制Notch通路,特别是该途径的关键成分包括Notch1、p21和Hes1,通过PKMYT1的化学抑制下调后可抑制其增殖、迁移、侵袭及促进凋亡[13]。神经母细胞肿瘤中,PKMYT1是稳定MYCN蛋白所必需的,MYCN蛋白是这种癌症类型的关键原癌基因[16]。食管鳞状细胞癌细胞系和原代细胞中,PKMYT1的表达与Akt/mTOR通路的激活相关并对其进行调节[17]。胃癌中PKMYT1表达增加可激活MAPK从而促进其恶性生物学行为[18]。卵巢癌中PKMYT1高表达,敲低PKMYT1可抑制其增殖、迁移、侵袭及远处转移[19]。
目前迫切需要新的、更有效的乳腺癌治疗靶点,像TCGA和GEPIA这样的公共数据库提供了大量有价值的高通量数据。挖掘这样的公共数据库可以帮助识别乳腺癌的生物学标志物和治疗靶点,并为乳腺癌的发展和机制研究提供见解。本研究中笔者对乳腺癌RNA转录组及其临床数据进行了多方面的分析,并确定了一个新的基因PKMYT1。PKMYT1是乳腺癌数据集中肿瘤和正常样本之间的一个差异基因,经分析PKMYT1的表达显著影响乳腺癌患者的生存期且通过GSEA功能富集分析发现与癌细胞的生长增殖密切相关。最后通过细胞实验验证PKMYT1无论是在人乳腺癌细胞系中还是小鼠乳腺癌细胞系均呈高表达,在后续研究中将会挑选表达量较高的细胞系进行功能验证。
综上所述,本研究通过基因差异表达分析、临床相关性分析、GSEA富集分析及生存分析发现了一个新的乳腺癌驱动基因PKMYT1,且证明了PKMYT1在多种乳腺癌细胞系中高表达。因此PKMYT1或可成为乳腺癌中一个很有前途的治疗靶点,但PKMYT1影响乳腺癌发生、发展的具体机制有待于进一步开展实验研究予以证实。

