馆藏砖石质文物有害盐中多种无机及有机酸阴离子的定量分析
王倩倩,铁付德,丁 莉,吴 娜,雷 磊,晏德付,陈星灿
(1. 中国国家博物馆,北京 100006; 2. 中国社会科学院考古研究所,北京 100101)
0 引 言
有害盐可使砖石质文物风化[1,2],从而产生粉化、脱落、剥落等多种较为严重的文物盐害[3]。有害盐的形成与文物本体盐分、存放环境等密切相关。馆藏砖石质文物表面形成有害盐有以下三种途径[2,4]:一是由于环境温湿度变化,文物本体深处的溶液受毛细管作用而使阳离子(如钠离子、钾离子、钙离子等)和阴离子(如硫酸根、氯离子等)随水的蒸发向文物表面迁移,最终在表面析出有害盐;二是,文物表面的阳离子与博物馆环境空气中污染物接触而析出有害盐;三是,砖石质文物表面的有害盐在博物馆环境空气中污染物的作用下发生转化。可见,在文物表面所形成的有害盐是非常复杂的,其中阳离子的来源主要是文物本体;而阴离子通常可分为无机和有机酸阴离子,可能来自于文物本体也可能来自于环境;所以,常见的有害盐一般是同时含有多种无机或有机酸阴离子的复盐、混盐[5]。
关于有害盐含有的无机阴离子,报道较多的有硫酸根[6-7]、氯离子[8]、硝酸根[9]等。其中硫酸钠被认为是最具破坏性的盐,因为与其他盐类相比,硫酸钠溶液具有较高的饱和度,对温度也更敏感;当硫酸钠转移到文物表面、或当水分减少、温度降低时,均会在文物表层析出盐结晶,并进行反复的溶解和结晶。在硫酸钠溶解收缩-结晶膨胀的过程中,其体积可膨胀约4倍,所产生巨大的机械压力会极大地破坏文物的结构[1]。
馆藏砖石质文物有害盐中的有机酸阴离子可能来源于木质及纸质材料(例如木质囊匣、展柜、纸质包装材料或纸质及木质文物[10-11])、胶片醋酸综合症[12]、文物藏展装饰装修材料[13-14]及甲醛氧化[15]等的释放,种类复杂。周新光等[13]采用固相微萃取气相色-质谱联用技术(SPME-GC/MS)检测9种木材中的挥发性有机物,检测出乙酸、丙酸、丁酸、戊酸、己酸、庚酸、辛酸以及壬酸共8种有机酸。Clark等[16]通过顶空固相微萃取/气相色谱-质谱法(Headspace SPME-GC/MS)检测了期刊以及历史书籍中的70多种挥发性有机物,其中包含甲酸、乙酸、丙酸、丁酸、戊酸等短链有机酸。但目前国内外的报道对文物造成危害的有机酸污染物主要还集中在甲酸和乙酸[17-19]。王倩倩等开发了一种可同时测定博物馆环境空气中甲酸、乙酸、丙酸、丁酸和戊酸等五种挥发性有机酸浓度的离子色谱方法[20]。
离子色谱法具有快速、操作简单、灵敏度高、准确性高和多种组分可以同时分离等特点,近年来在文物表面有害盐分检测方面得到一定的应用[21-22]。蔺青涛等[23]采用离子色谱法研究汉唐古城之一锁阳城遗址的城墙体盐分,其中含有硫酸根,硝酸根和氯离子等阴离子。屈松等[24]采用离子色谱法研究了造成长城居庸关云台出现的表面泛盐、片状脱落、裂缝等病害,其中盐害以氯离子为主,并伴有少量硫酸盐。张亚旭等[25]利用离子色谱法对196窟主室内部有害盐检测后发现,造成破坏的阴离子以氯离子为主,还有少量硫酸根。这些研究主要集中于室外文物的无机阴离子的检测,极少有关于同时检测多种无机和有机酸阴离子的报道。
本研究建立了一种可同时检测馆藏砖石质文物上有害盐中多种无机及有机酸阴离子的离子色谱法,可测定甲酸根、乙酸根、丙酸根、丁酸根、戊酸根、氟离子、氯离子、溴离子、硝酸根、亚硝酸根、磷酸根和硫酸根等十二种阴离子。采用超纯水作为有害盐的溶剂,样品处理简单,离子色谱检测,具有操作简单,成本低廉,检测时间短和准确性高的特点。通过检测结果可定量计算有害盐中多种无机及有机酸阴离子的质量分数,对认识文物病害和分析病害产生的原因,阻止、延缓及预测病害的发生提供了新的依据。将该方法应用于中国国家博物馆馆藏“汉并天下”瓦当(藏品编号:保C09.0362)和仿制玉炉(藏品编号:53.2.178)外壁表面有害盐分析,证明了该方法的可用性和实用性。
1 实验方法
1.1 仪器设备和试剂材料
ICS1000离子色谱仪(美国赛默飞世尔科技有限公司):配备AS-DV自动进样器、KOH淋洗液发生装置、电化学抑制器和Chromeleon 7.2色谱工作站。色谱柱为带有保护柱的阴离子色谱分离柱AS11-HC(4 mm×250 mm)+AG11-HC(4 mm×50 mm);超纯水机(Millipore Simplicity UV)等。
所用水为新制的超纯水,电阻率不低于18.2 MΩ/cm。所用试剂均为优级纯或色谱纯。所使用的标准品有:甲酸根标准溶液(1 000 μg/mL,AccuStandard)、乙酸根标准溶液(1 000 μg/mL,阿拉丁)、丙酸根标准溶液(50 000 μg/mL,Dr.EhrenstorferGmbH)、丁酸钠(98%,麦克林)、戊酸钠(97%,麦克林)、多元素标准溶液(含有氟、氯、溴、硝酸根、亚硝酸根、磷酸根、硫酸根,100 μg/mL,国家有色金属及材料分析测试中心)、氟离子单元素标准溶液(1 000 μg/mL,国家有色金属及材料分析测试中心)、氯离子单元素标准溶液(1 000 μg/mL,国家有色金属及材料分析测试中心)、溴离子单元素标准溶液(1 000 μg/mL,国家有色金属及材料分析测试中心)、硝酸根离子单元素标准溶液(1 000 μg/mL,国家有色金属及材料分析测试中心)、亚硝酸根离子单元素标准溶液(1 000 μg/mL,国家有色金属及材料分析测试中心)、磷酸根离子单元素标准溶液(1 000 μg/mL,国家有色金属及材料分析测试中心)、硫酸根离子单元素标准溶液(1 000 μg/mL,国家有色金属及材料分析测试中心)。
1.2 混酸标准储备液的配制
精确称取51.02 mg丁酸钠标准品、51.55 mg戊酸钠标准品,分别溶解于适量超纯水中,在50 mL容量瓶中定容,配制丁酸根标准溶液(1 000 μg/mL)、戊酸根标准溶液(1 000 μg/mL)。
用移液枪分别精确量取2.5 mL甲酸根标准溶液(1 000 μg/mL)、2.5 mL乙酸根标准溶液(1 000 μg/mL)、0.05 mL丙酸根标准溶液(50 000 μg/mL)、2.5 mL丁酸根标准溶液(1 000 μg/mL)、2.5 mL戊酸根标准溶液(1 000 μg/mL)至容量瓶中,再用超纯水定容到25.00 mL,配制成为含甲、乙、丙、丁、戊酸根各浓度为100 μg/mL的混酸标准溶液。定容后摇匀,放置于4 ℃冰箱中保存备用。
1.3 标准工作液的配制
分别取混酸标准溶液(100 μg/mL)和多元素标准溶液(100 μg/mL)为1.25 mL、2.5 mL、3.75 mL、5 mL、6.25 mL、7.5 mL于6个25 mL的容量瓶中,用超纯水定容至25 mL,配制一系列梯度浓度为5.0、10.0、15.0、20.0、25.0和30.0 μg/mL的标准工作液。该标准工作液含甲酸根、乙酸根、丙酸根、丁酸根、戊酸根、氟离子、氯离子、溴离子、硝酸根、亚硝酸根、磷酸根、硫酸根等十二种阴离子,临用现配。空白对照样为超纯水。
1.4 采样及制样方法
使用镊子、棉签、称量纸等在文物上轻轻擦取采集文物上有害盐。取样时应注意文物本体表面和有害盐的界面,在不损害文物的前提下擦取适量。采样后,用洁净称量纸包装好,便于保存和运输。
有害盐水溶液样品的制备如下:称取有害盐样品质量0.025 g,溶解于超纯水中,用针式过滤器过滤并转移到25 mL容量瓶中,定容。
1.5 实验条件
采用抑制型电导检测器,检测器温度30 ℃;IonPac AS11 HC型分离柱(250 mm×4 mm),IonPac AG11 HC型保护柱(50 mm×4 mm),柱温30 ℃;采用KOH溶液梯度洗脱,KOH淋洗液浓度范围为2~30 mmol/L,流速为1.2 mL/min,抑制器电流90 mA,进样量为25 μL,检测时间为35 min。具体的洗脱程序为:0~10.5 min时,KOH淋洗液浓度为2 mmol/L;10.5~29 min时,KOH淋洗液浓度从2 mmol/L递增到30 mmol/L;29~34 min时,KOH淋洗液浓度为30 mmol/L;34~35 min时,KOH淋洗液浓度为2 mmol/L。
2 实验结果与分析
2.1 色谱条件的选择
通过赛默飞开发的虚拟柱模拟发现,分析甲酸根、乙酸根、丙酸根、丁酸根、戊酸根、氟离子、氯离子、溴离子、硝酸根、亚硝酸根、磷酸根、硫酸根等十二种阴离子较为适合的柱子为阴离子色谱分离柱AS11-HC(4 mm×250 mm)。流动相的种类、浓度和流速是后续为使十二种阴离子实现高效分离的关键因素。氟离子、甲酸根、乙酸根、丙酸根、丁酸根、戊酸根等六种阴离子属于弱保留离子,而溴离子、硝酸根、亚硝酸根、磷酸根、硫酸根等阴离子属于强保留离子。考虑到,一是为避免影响后续进样的分离,需加强对强保留离子的洗脱;二是对柱子的日常维护。因此,选用KOH淋洗液。本实验中采用KOH淋洗液发生装置产生高浓度KOH淋洗液。
由于甲酸根、乙酸根、丙酸根、丁酸根、戊酸根等五种阴离子的峰是连续出峰,本次十二种阴离子的色谱条件的建立分为三步:第一步,建立检测甲酸根、乙酸根、丙酸根、丁酸根、戊酸根等五种有机酸的色谱条件;第二步,建立检测氟离子、氯离子、溴离子、硝酸根、亚硝酸根、磷酸根、硫酸根等七种无机阴离子的色谱条件;第三步,拼接第一步和第二步的色谱条件。
KOH淋洗液浓度的增加或流速的增大,均会缩短有机酸离子的保留时间,减小离子间的分离度;而KOH淋洗液浓度的减小或流速的减小,将增加有机酸离子的保留时间[26]。本工作对淋洗液流速为1.2 mL/min时的淋洗液浓度进行了优化,选取了四个淋洗液浓度点分别为2 mmol/L、3 mmol/L、4 mmol/L、5 mmol/L。该五种有机酸的保留时间和分离度参见表1。

表1 流速为1.2 mL/min时不同淋洗液浓度下五种有机酸的保留时间和分离度Table 1 Retention times and resolutions of five organic acids at different eluent concentrations at a flow rate of 1.2 mL/min
氟离子、氯离子、溴离子、硝酸根、亚硝酸根、磷酸根、硫酸根等七种无机阴离子的色谱条件通过淋洗液流速为1.2 mL/min时的淋洗液浓度进行了优化而建立;选取了四个淋洗液浓度点分别为30 mmol/L、25 mmol/L、20 mmol/L、15 mmol/L,检测了30.0 μg/mL的多元素标准溶液。七种无机阴离子的保留时间和分离度参见表2。
从表2中可知,当淋洗液浓度在为15 mmol/L时,七种无机阴离子的中保留时间最短的氟离子,其保留时间为2.954 min,而且随着淋洗液浓度从30 mmol/L降到15 mmol/L过程中,氟离子的保留时间逐渐增大。由表1可知,当淋洗液浓度为2 mmol/L时,色谱图中乙酸、丙酸、甲酸、丁酸和戊酸等五种有机酸的保留时间为6.700 min、7.720 min、8.594 min、9.574 min、15.540 min,相比较淋洗液浓度分别在为3、4、5 mmol/L时的保留时间更为靠后。为避免保留时间最短的氟离子与乙酸根、丙酸根、甲酸根、丁酸根和戊酸根等五种有机酸能完全分离,故设计分析十二种阴离子的色谱条件中,初始的淋洗液浓度可从2 mmol/L开始。
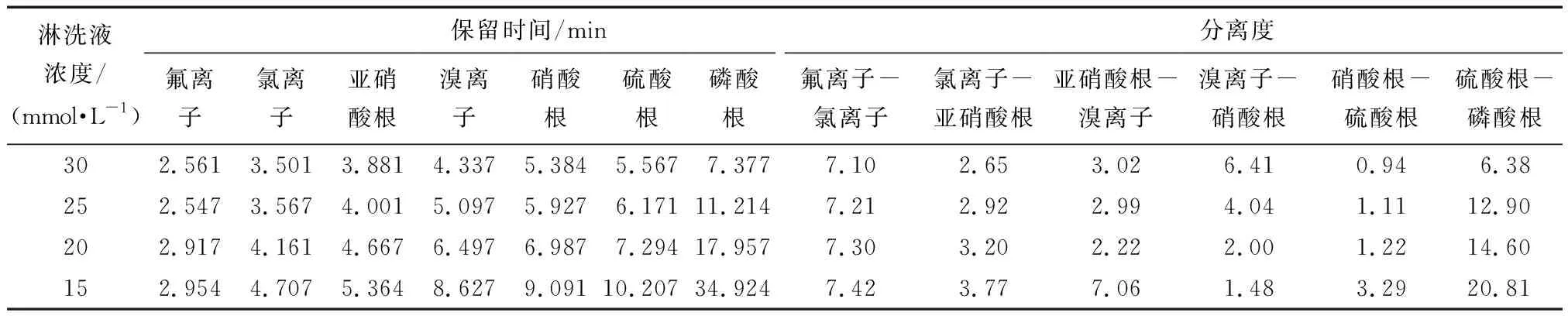
表2 流速为1.2 mL/min时不同淋洗液浓度下七种无机阴离子的保留时间和分离度Table 2 Retention time and resolution of seven inorganic anions at different eluent concentrations at a flow rate of 1.2 mL/min
从表2中可知,当淋洗液浓度为30 mmol/L时,在七种无机阴离子的色谱图中,硝酸根-硫酸根的分离度仅为0.94,可见,硝酸根和硫酸根的两个峰基本没有分离开。随着淋洗液浓度的降低,当淋洗液浓度分别为25、20和15 mmol/L时,硝酸根-硫酸根的分离度分别增大为1.11、1.22和3.29;与此同时,溴离子-硝酸根的分离度分别降低为4.04、2.00和1.48。故此,设计淋洗液的梯度程序时,在15~20 mmol/L的淋洗液浓度范围下,可将溴离子、硝酸根和硫酸根的三个峰分离。此外,对于磷酸根,适当提高淋洗液浓度,可以提高磷酸根的保留时间,有利于缩短整个检测时间。
综上所述,综合考虑保留时间和分离度两个因素,在洗脱条件为:KOH淋洗液流速为1.2 mL/min,采用2~30 mmol/L KOH淋洗液梯度洗脱,能够在35 min的检测时间下实现甲酸根、乙酸根、丙酸根、丁酸根、戊酸根、氟离子、氯离子、溴离子、硝酸根、亚硝酸根、磷酸根、硫酸根等十二种阴离子的快速分离与准确检测,如图1所示。其中,2~30 mmol/L KOH淋洗液梯度洗脱程序为:0~10.5 min时,KOH淋洗液浓度为2 mmol/L;10.5~29 min时,KOH淋洗液浓度从2 mmol/L递增到30 mmol/L;29~34 min时,KOH淋洗液浓度为30 mmol/L;34~35 min时,KOH淋洗液浓度为2 mmol/L。如表3所列,十二种阴离子的分离度均高于1.5。
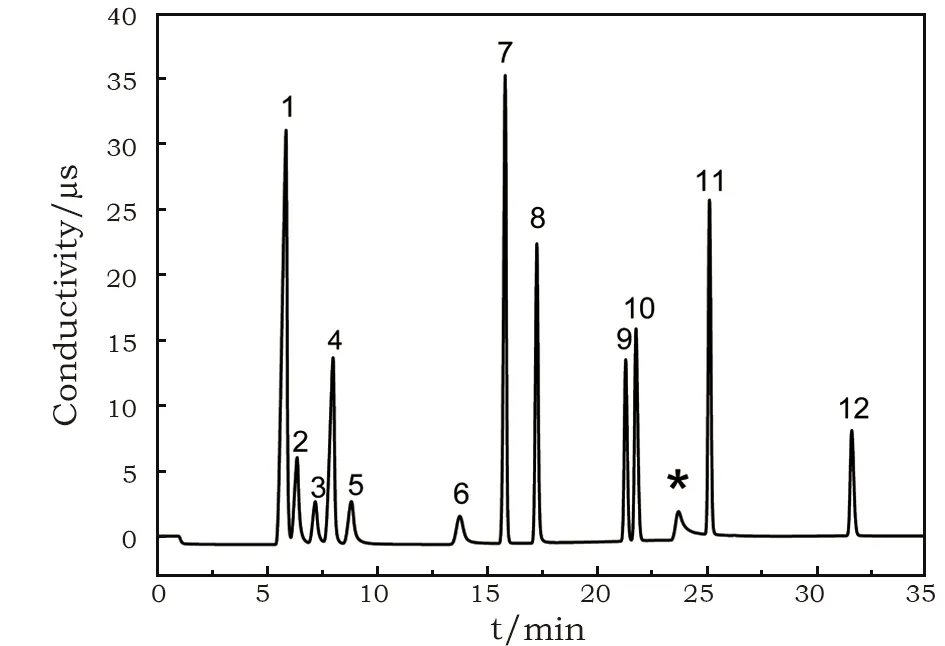
(1)氟离子;(2)乙酸根;(3)丙酸根;(4)甲酸根;(5)丁酸根;(6)戊酸根;(7)氯离子;(8)亚硝酸根;(9)溴离子;(10)硝酸根;(*)超纯水中碳酸根;(11)硫酸根;(12)磷酸根图1 20 μmol/mol标准工作液中多种无机及有机酸阴离子的色谱图Fig.1 Chromatogram of various inorganic and organic acid anions in a 20 μmol/mol standard orking solution
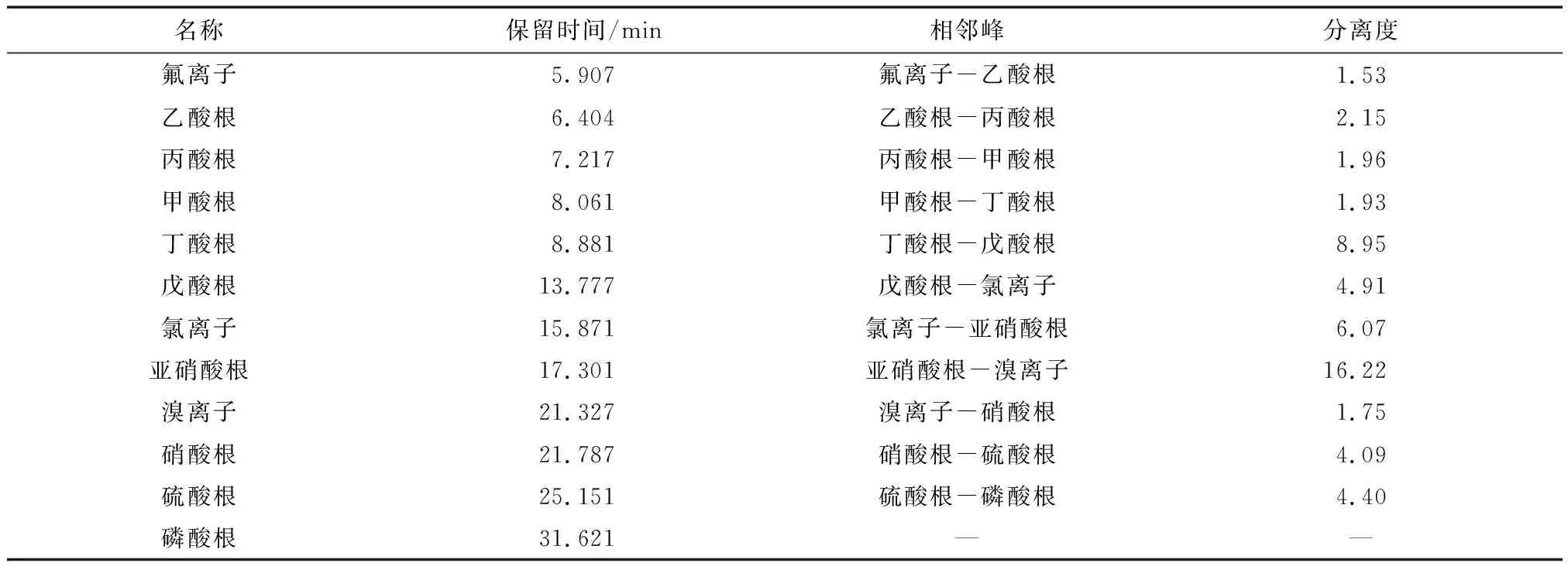
表3 流速为1.2 mL/min时在2~30 mmol/L梯度淋洗液浓度下十二种阴离子的保留时间和分离度Table 3 Retention times and resolutions of twelve anions at different eluent concentrations at a flow rate of 1.2 mL/min
2.2 标准曲线测试
测定5.0、10.0、15.0、20.0、25.0和30.0 μg/mL的标准工作液,每个浓度的标准工作液重复测定3次以上,采用Chromeleon 7.2软件对检测数据进行定量分析,分别绘制各十二种阴离子的标准曲线并拟合成标准曲线方程;空白对照样为超纯水,离子色谱图中在23.744 min也出现有碳酸根的峰检出,但对十二种阴离子的检测不存在干扰。
检测5.0~30.0 μg/mL标准工作液分别得到氟离子、乙酸根、丙酸根、甲酸根、丁酸根、戊酸根、氯离子、亚硝酸根、溴离子、硝酸根、硫酸根和磷酸根的标准曲线,并且所有的标准曲线的相关系数均高于0.995,符合检测标准要求;该十二种阴离子的保留时间、标准曲线方程、线性范围、检出限和定量限,参见表4。其中,以3倍噪音法分别计算方法的检出限(信噪比S/N=3),以10倍噪音法分别计算方法的检出限(信噪比S/N=10)。
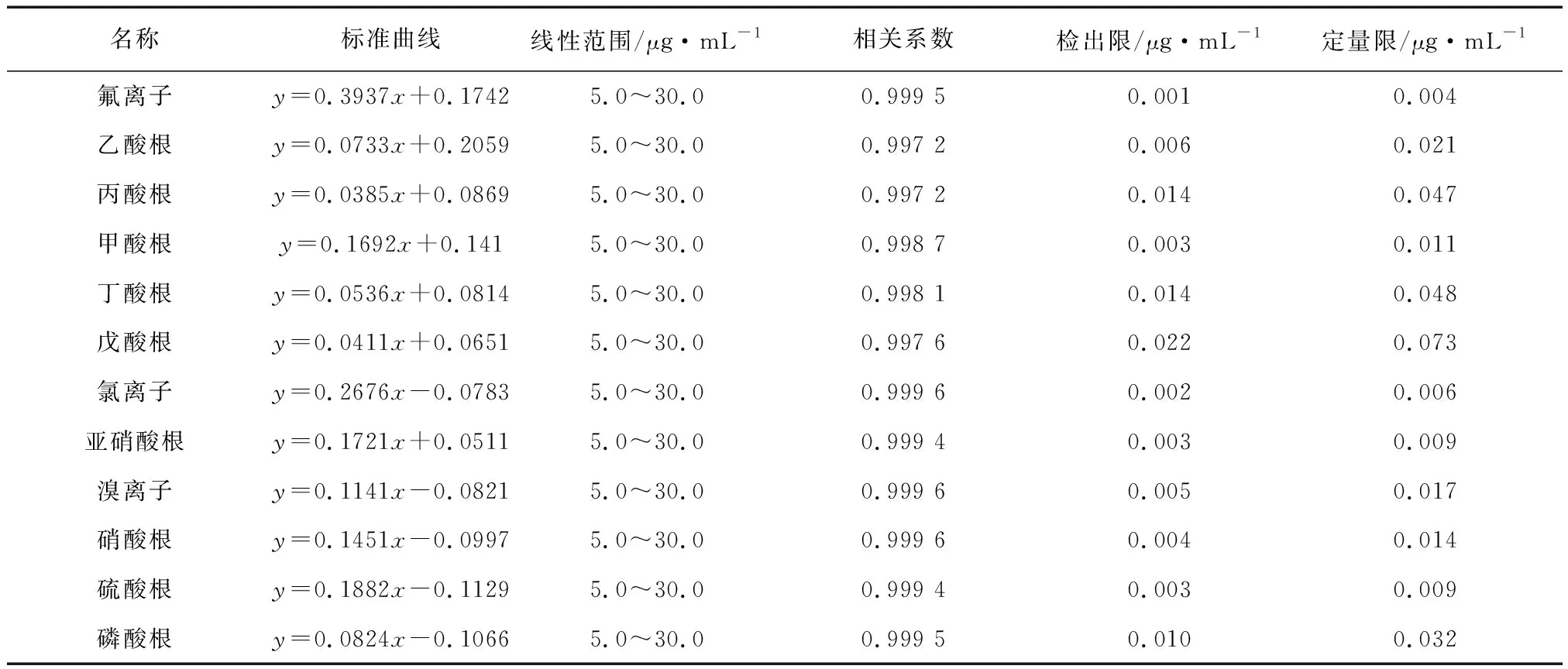
表4 十二种阴离子标准曲线、线性范围、检出限和定量限Table 4 Standard curves, linear ranges, limits of detection and limits of quantitation of twelve anions
2.3 测试精密度
按照标准GBZ/T 210.4—2008《职业卫生标准制定指南第4部分:工作场所空气中化学物质测定方法》中的规定:以低、中、高三种标准溶液连续(5 μg/mL,15 μg/mL,30 μg/mL)在3~5天内进行6次重复测定,计算6次测试浓度值的相对标准偏差来表示方法的精密度,实验结果见表5。可以看出,低、中、高三种浓度中十二种阴离子6次检测浓度值的标准偏差(STDEV)、平均值(AVERAGE)及相对标准偏差(RSD%)。低、中、高三种标准溶液中的五种有机酸的6次重复测定值的RSD%均低于10%,表明该五种有机酸的离子色谱测定方法的精密度符合标准GBZ/T 210.4—2008的要求。

表5 检测方法的精密度结果Table 5 Precision results of the detection method
2.4 采样加标回收实验
按照2.4节中方法,采集文物上有害盐,并按制样方法制备有害盐水溶液样品。将有害盐水溶液样品分别加入到4个离子色谱管中6 mL,3 mL,3 mL,3 mL。在已有3 mL有害盐水溶液的管中分别加入3 mL的12.5 μg/mL,25 μg/mL,50 μg/mL等三个低、中、高标准工作液进行采样加标回收实验测试。
以未加标及加标后的采样吸收液中多种无机及有机酸阴离子的的质量来计算加标回收率。某种无机及有机酸阴离子的加标回收率的计算公式如下
P=(m2-m1)/m3×100%
(1)
式中,P为加标回收率,%;m1为有害盐水溶液中某一种有机酸或无机阴离子的质量,μg;m2为加标后有害盐水溶液中某一种有机酸或无机阴离子的质量,μg;m3为加标用标准工作溶液中某一种有机酸或无机阴离子的质量,μg。
c1=m1/V1
(2)
式中,c1为有害盐水溶液中某一种有机酸或无机阴离子的浓度,μg/mL,V1为有害盐水溶液中某一种有机酸或无机阴离子的体积,mL。
c2=m2/V2
(3)
式中,c2为加标后有害盐水溶液中某一种有机酸或无机阴离子的浓度,μg/mL,V2为加标后有害盐水溶液中某一种有机酸或无机阴离子的体积,mL。
c3=m3/V3
(4)
式中,c3为加标用标准溶液中某一种有机酸或无机阴离子的质量浓度,μg/mL,V3为加标用标准溶液中某一种有机酸或无机阴离子的体积,mL。
当V1=V2条件下,式(1)可简化为式(5):
P=(c2-c1)/c3×100%
(5)
采用式(5)进行某种无机及有机酸阴离子的加标回收率的计算,结果见表6。从表6可知,氟离子、乙酸根、丙酸根、甲酸根、丁酸根、戊酸根、氯离子、亚硝酸根、溴离子、硝酸根、硫酸根和磷酸根的加标回收率为81.8%~107.0%,均在微量仪器分析要求的回收率80%~120%范围内,精密度较好。
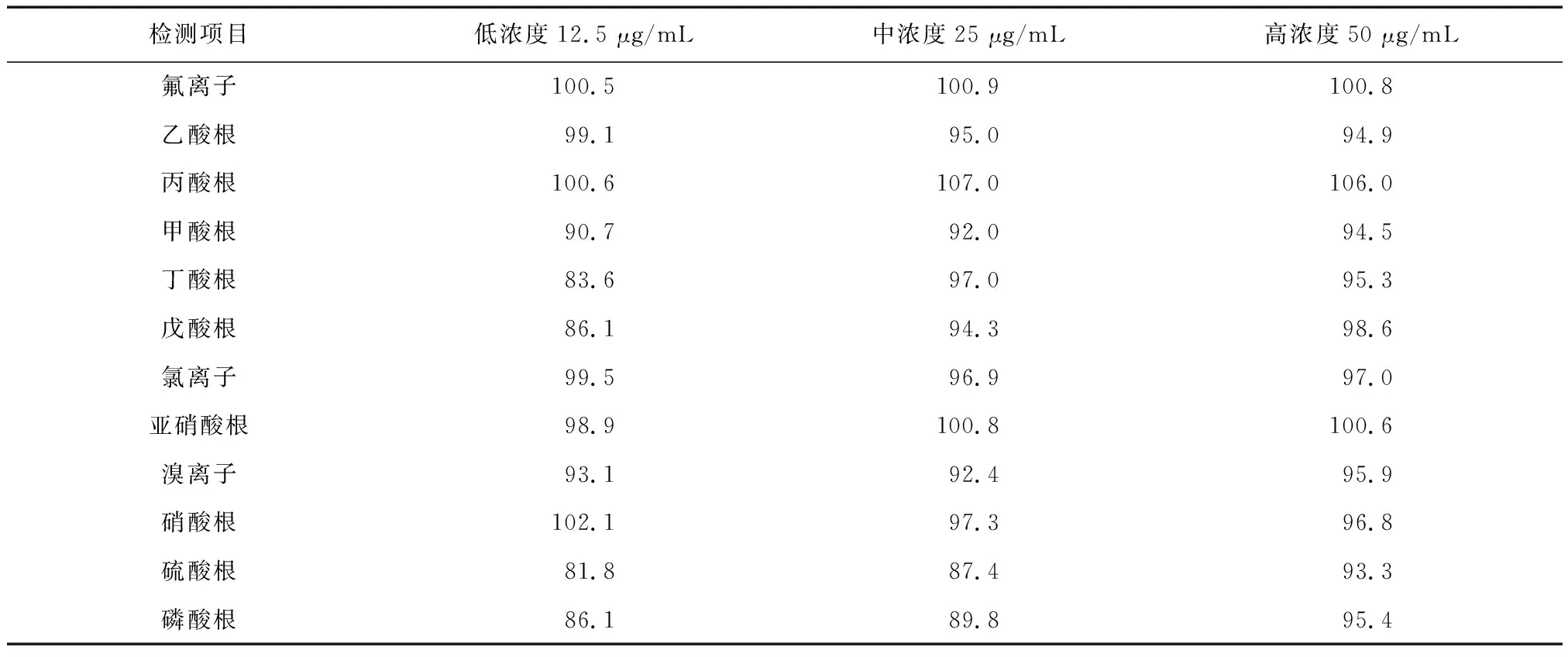
表6 低、中、高三种混标的采样加标回收率Table 6 Recovery rates of the three mixed standards (low, medium and high) (%)
2.5 砖石质文物表面有害盐采样与检测
2.5.1文物信息及取样 本研究中取样文物为“汉并天下”瓦当(藏品编号:保C09.0362)和仿制玉炉(藏品编号:53.2.178)两件。“汉并天下”瓦当出自汉代,由陕西省西安市汉长安城遗址出土,属三级文物,其直径为16 cm,厚度为4.2 cm。仿制玉炉长16.8 cm、宽8 cm、高7.4 cm。敞口,束颈,双兽吞耳,颈部正中凸雕兽面纹,圈足,其具体年代有待于进一步考证。
采集“汉并天下”瓦当背面和仿制玉炉外壁表面的有害盐。“汉并天下”瓦当的有害盐比较均一,外观为亮白色羽绒状晶体,质轻,参见图2a。玉炉外壁取样下来的有害盐质轻,但不均一,从颜色上区分到有两种有害盐,参见图2b;为保证实验取样的有效性,按其外观颜色分为白色粉末样和黄色粉末样,并分别进行分析。三个有害盐样品分别称取质量为0.025 g,按照2.4节中制样方法制备有害盐水溶液样品。

图2 文物表面有害盐采样Fig.2 Sampling of harmful salts from the surfaces of two cultural relics
2.5.2检测结果 用与5.0~30.0 μg/mL标准工作液的相同的检测条件检测有害盐水溶液样品和空白样超纯水;采用Chromeleon 7.2软件对检测数据进行定量分析,计算出有害盐水溶液样品中所检测到的无机及有机酸阴离子的浓度,定量计算有害盐中无机及有机酸阴离子的质量分数,分析导致文物病害析出有害盐的环境污染物。有害盐水溶液样品的对照空白样即为超纯水,有害盐水溶液样品和超纯水在23.744 min也均出现有碳酸根的峰检出,该碳酸根峰对本次多种无机及有机酸阴离子的检测不存在干扰超纯水中无目标有机酸检出,但有微量无机阴离子(如硝酸根、硫酸根、磷酸根)检出;限于篇幅,在此仅展示瓦当有害盐水溶液样品和空白样的离子色谱图,参见图3。
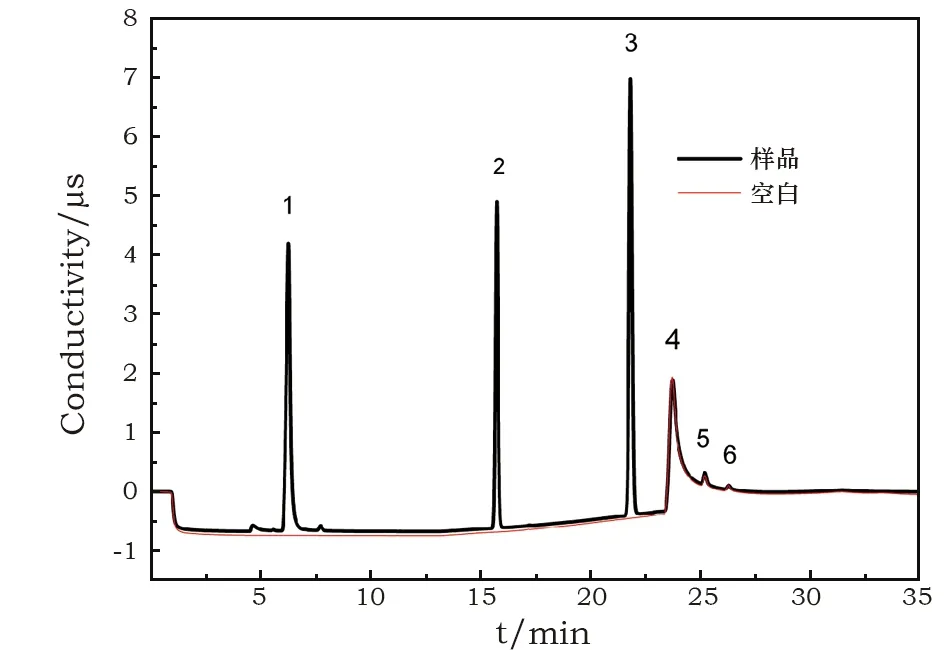
(1)乙酸根;(2)氯离子;(3)硝酸根;(4)超纯水中碳酸根;(5)硫酸根;(6)磷酸根图3 瓦当有害盐水溶液样品和空白样中多种无机及有机酸阴离子的色谱图Fig.3 Ion chromatograms of various inorganic and organic acid anions in the harmful salt water solution of tile and blank sample
从表7的结果可知,瓦当有害盐水溶液样品中检测出6种阴离子。其中碳酸根、硫酸根、磷酸根的数值基本与超纯水中的浓度一致,故认为瓦当有害盐水溶液样品中检出三种阴离子:乙酸根12.296 μg/mL、氯离子3.191 μg/mL、硝酸根8.809 μg/mL。检测结果表明,“汉并天下”瓦当文物上发生的盐害有氯盐、硝酸盐和乙酸盐;其中乙酸盐可能是由于环境污染乙酸气体导致的,氯盐和硝酸盐可能来自空气中的含氯化合物和氮氧化物,但不排除来自文物本体的可能。
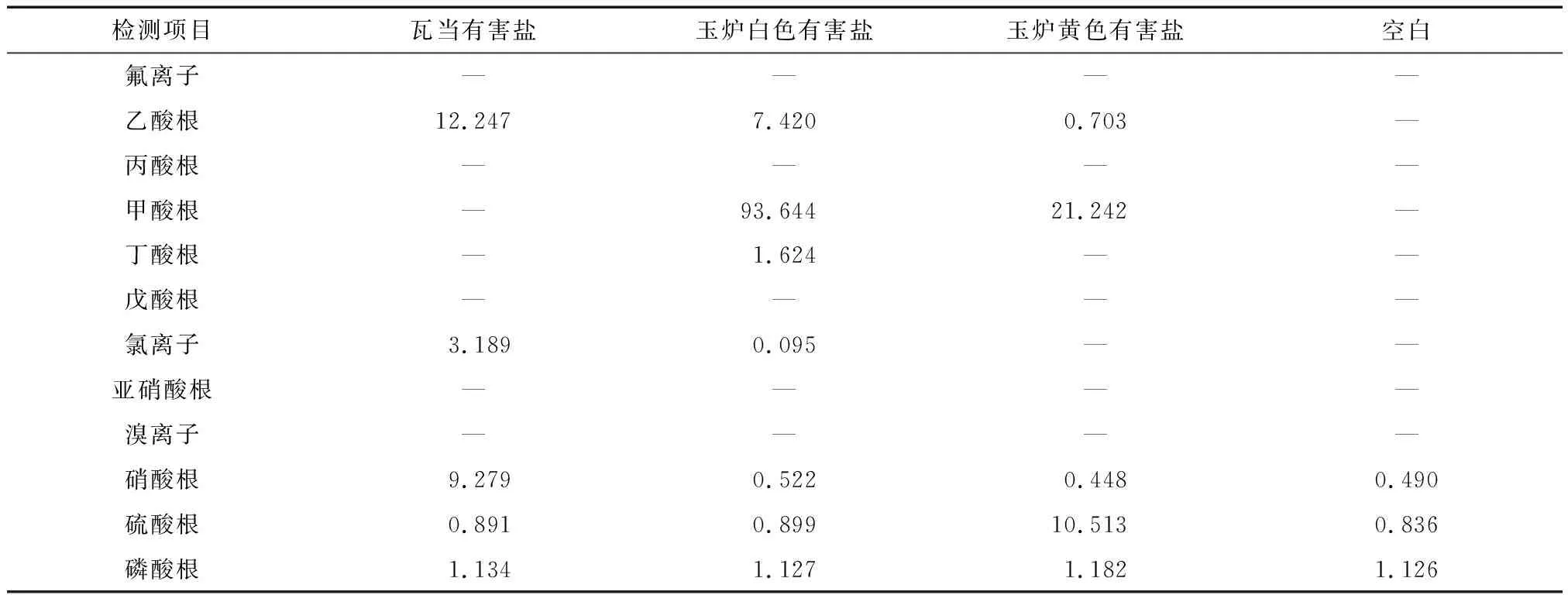
表7 有害盐水溶液样品和空白样中多种无机及有机酸阴离子的浓度测定值Table 7 Concentration determination values of various inorganic and organic acid anions in the harmful salt water solution and blank sample (μg/mL)
玉炉外壁白色有害盐的水溶液样品含有的有机酸为甲酸、乙酸、丁酸三种,浓度分别为93.644 μg/mL、7.420 μg/mL、1.624 μg/mL。检测到的硝酸根、硫酸根、磷酸根无机阴离子的浓度和超纯水中所含有的浓度基本一致,故基本可以忽略;此外。还有少量氯离子检出,浓度为0.095 μg/mL。故玉炉外壁白色有害盐以甲酸盐为主,还含有少量的乙酸盐、丁酸盐和氯盐。从检测结果可以推断,导致玉炉外壁病害析出白色的有害盐很可能为环境污染物甲酸、乙酸、丁酸等有机酸气体;氯离子可能来自空气中含氯化合物或是文物本体。玉炉外壁黄色有害盐含有甲酸根、乙酸根,浓度分别为21.242 μg/mL、0.703 μg/mL;所检测到的硝酸根、磷酸根等两种无机阴离子的浓度和超纯水中所含有的浓度基本一致,故基本可以忽略。超纯水中硫酸根的检测浓度为0.836 μg/mL,外壁黄色有害盐水溶液样品中硫酸根的浓度较高,检测浓度为10.513 μg/mL,故外壁黄色有害盐中硫酸根的实际浓度约为9.677 μg/mL。玉炉外壁黄色有害盐水溶液样品中主要含有甲酸根、乙酸根和硫酸根,并且该有害盐中主要是甲酸盐。因此,导致玉炉外壁病害析出黄色有害盐的环境污染物为甲酸、乙酸、二氧化硫等三种酸性气体。
此外,与玉炉外壁白色有害盐的检测结果对比,可以推测出:有害盐发黄主要是因为析出硫酸盐而导致的。
2.6 有害盐中无机及有机酸阴离子的质量分数计算
通过已知的有害盐水溶液样品中多种无机及有机酸阴离子的浓度的检测结果,定量计算有害盐中无机及有机酸阴离子的质量分数,参见式(6)。“汉并天下”瓦当和仿制玉炉外壁表面的三种有害盐中多种无机及有机酸阴离子的质量分数的计算结果,参见表8。
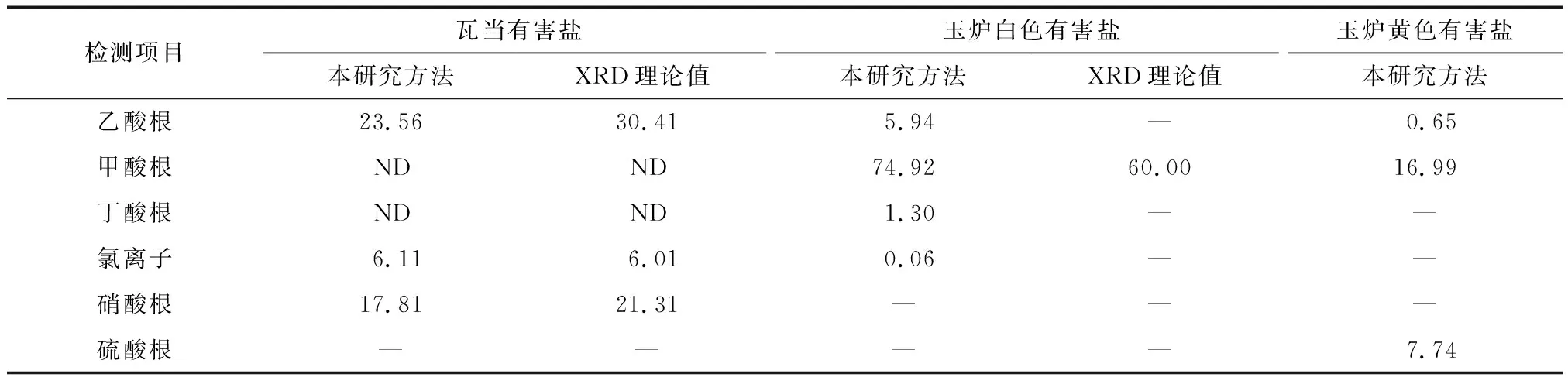
表8 三种有害盐中多种无机及有机酸阴离子的质量分数Table 8 Mass fractions of inorganic and organic acid anions in three harmful salts (%)
(6)
式中,ω为有害盐中某有机酸或无机阴离子的质量分数(%);m为制备有害盐水溶液样品时称取的有害盐的质量(mg);C为有害盐水溶液样品中某有机酸或无机阴离子的浓度(μg/mL);V为有害盐水溶液样品的体积(mL)。
从表8可知,“汉并天下”瓦当文物有害盐水溶液样品中含有乙酸根、氯离子和硝酸根,通过公式(5)计算出该件瓦当背面的亮白色羽绒状晶体有害盐中各阴离子及其质量分数分别为:乙酸根23.56%,氯离子6.11%,硝酸根17.81%。瓦当有害盐采用XRD分析确定主要成分为Ca3(CH3COO)3Cl(NO3)2·7H2O,假设该物质为1 mol,由分子式计算出来其中所含的乙酸根、氯离子和硝酸根的质量分数(%)分别为30.41%,6.01%,21.31%;两种分析方法检测出来的乙酸根、氯离子和硝酸根品种一致,质量分数的计算结果基本近似,说明该离子色谱方法检测有害盐中多种无机及有机酸阴离子的质量分数的方法可靠。其中质量分数上微小的偏差有可能来自结晶水的含量和微量不溶于超纯水的杂质。
玉炉白色有害盐水溶液样品通过离子色谱检测值和公式(5),可计算出有害盐中各阴离子及其质量分数分别为:乙酸根5.94%、甲酸根74.92%、丁酸根1.30%和氯离子0.06%。该玉炉白色有害盐采用XRD分析确定主要成分为Mg(HCOO)2·2H2O,与离子色谱检测结果基本一致,但无法检测到含量较低的乙酸根、丁酸根和氯离子。此外,玉炉黄色有害盐由于可取到的样品量太少,无法采用XRD分析,故在表8中无法提供由XRD检测分析、理论计算的无机及有机酸阴离子的质量分数。可见,与XRD分析方法相比,该离子色谱方法应用于检测馆藏砖石质文物上有害盐中多种无机及有机酸阴离子更具有优势。
3 结 论
本工作建立了一种基于离子色谱同时测定馆藏砖石质文物表面有害盐中多种无机及有机酸阴离子浓度的方法。该方法可测定馆藏文物上有害盐中的甲酸根、乙酸根、丙酸根、丁酸根、戊酸根、氟离子、氯离子、溴离子、硝酸根、亚硝酸根、磷酸根和硫酸根等十二种阴离子。
采集砖石质文物上的有害盐,称取适量有害盐溶解于超纯水并过滤。该样品制备方法备简单,易于操作。采用2~30 mmol/L KOH淋洗液梯度洗脱,能够在35 min的检测时间下实现该十二种阴离子的快速分离与准确检测。所有阴离子的标准曲线的相关系数均高于0.995,检出限为0.001~0.022 μg/mL,定量限为0.004~0.073 μg/mL;十二种阴离子的加标回收率为81.8%~107.0%,精密度较好;此外,精密度符合标准GBZ/T 210.4—2008的要求。
1) “汉并天下”瓦当文物上的有害盐含有氯盐和硝酸盐、乙酸盐。从而可知,导致该文物病害析出有害盐的环境污染物种类主要有乙酸、空气中含氯离子的物质和氮氧化物。
2) 玉炉外壁白色有害盐中主要含有甲酸根、乙酸根、丁酸根等有机酸及量非常少的氯离子。可见导致玉炉外壁病害析出白色有害盐的环境污染物种类主要为甲酸、乙酸、丁酸等有机酸性气体和空气中含氯离子的物质。玉炉外壁黄色有害盐中主要含有甲酸根、乙酸根和硫酸根,可见,导致玉炉外壁病害析出黄色有害盐的环境污染物种类主要为甲酸、乙酸和二氧化硫等三种酸性气体。此外,与玉炉外壁白色有害盐的检测结果对比,可以推测出:有害盐发黄主要是因为析出硫酸盐而导致的。
3) 总结以上的实验结果,文物盐害可分为两种,即无机酸盐害和有机酸盐害。该方法适用于分析导致砖石质文物盐害的环境污染物种类,为分析盐害发生的原因,阻止、延缓及预测病害的发生等提供依据。
4) 考虑到文物表面有害盐中所含有的无机及有机酸阴离子种类比较多,各阴离子的浓度参差不齐,故在检测中,为获得最佳检测结果,特此建议:可根据实际检测需求,在制备有害盐水溶液样品时,配制多个浓度梯度的有害盐水溶液样品进行检测。

