真空碳热预还原-盐酸浸出钛精矿制备人造金红石的研究
阎鑫宇 李 博 黄 润
(贵州大学 材料与冶金学院, 贵州 贵阳 550025)
0 前言
钛是一种非常重要的金属,支撑着许多关乎国计民生的支柱产业[1-2]。攀枝花的钛资源非常丰富,钛储量世界第一,伴生钛矿储量占全国的93%。我国现阶段的钛还原工艺主要为湿法工艺,包括还原-锈蚀法、盐酸浸出法、硫酸浸出法等。湿法工艺可在脱除钛矿物中铁与非铁杂质的同时有效富集钛组分[3-4],但当前各种人造金红石生产工艺都存在一些缺陷。还原-锈蚀法[5-6]去除杂质能力差,技术难度大,锈蚀耗时长,生产效率低,多为露天作业,废液产生量多,对环境影响较大。盐酸浸出法[7-13]副产废盐多,盐酸再生成本较高,设备造价高。硫酸法[14-16]浸出效果比盐酸浸出法差,反应时间较长(浸出时间12 h),对硅酸盐含量较高的矿物处理困难,固体废物产量大,对设备腐蚀严重,环保性差,主体工艺与辅助工艺流程长。
针对上述目前人造金红石制备方法存在的问题,本文进行了真空碳热预还原钛精矿-盐酸浸出制备人造金红石的研究。在现阶段,真空碳热预还原技术[17-31]已经较为成熟,成为冶金的重要技术,它以碳为还原剂,通过真空法和碳热还原共同作用,能够降低杂质的挥发温度,提高钛元素纯度。目前较前沿的盐酸浸出方法是将经过“弱氧化-弱还原”改性的钛铁矿放置在高压反应釜中,加入一定质量浓度盐酸,再将反应釜放入盐浴炉中,设置搅拌速率为7 r/min,升温至150 ℃并持续反应6 h,待反应结束后进行过滤洗涤,随后在120 ℃条件下干燥4 h,接着在850 ℃条件下煅烧1 h,最后冷却至常温,得到人造金红石[13]。但是这种方法耗时长,浴炉所需温度高,煅烧耗能大。真空碳热预还原与盐酸浸出方法联合使用的优势在于真空碳热还原能使杂质铁还原得比较彻底,并形成细小的球状铁颗粒,使其比表面积大大增加,从而降低酸解的反应温度、压强和反应时间,能够在室温常压条件下快速酸解得到金红石,从而大大降低生产成本。
本文以钛精矿为研究对象,将真空碳热还原法用于钛精矿的预处理过程,联合盐酸浸出法制备人造金红石,分析各个参数对人造金红石品位的影响。
1 实验原料与实验原理
1.1 实验原料
实验所用的钛精矿和焦炭出自攀枝花的某企业,预处理前钛精矿的组成见表1。由表1可知,钛精矿中Ti的品位较低,杂质含量较高。
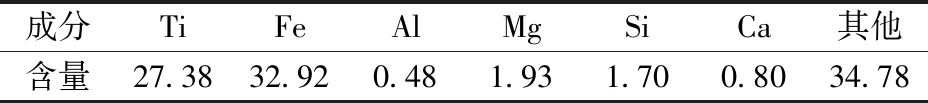
表1 钛精矿组成成分表 %
1.2 真空碳热还原原理
真空碳热还原技术可使相应金属的沸点降低,镁的沸点从105Pa的1 093 ℃降至10-1Pa的367 ℃,硅的沸点从105Pa的3 232 ℃降至10-1Pa的1 450 ℃,铁的沸点从105Pa的3 232 ℃降至10-1Pa的1 450 ℃[32],这意味着降低系统压力使金属在合适的温度下从气相中逸出,可实现对非铁杂质的去除。因此真空条件下能够促进金属的气化、蒸发和金属化合物的分解还原。
1.3 盐酸浸出实验原理
盐酸浸出法的实验原理是将钛精矿中铁、钙、镁等易溶于酸的物质与盐酸进行反应,从而使这些杂质以离子的形式进入溶液中,实现除杂目的。发生的化学反应方程式如下:
FeO·TiO2+2HCl=FeCl2+TiO2+H2O
(1)
MgO·TiO2+2HCl=MgCl2+TiO2+H2O
(2)
CaO·TiO2+2HCl=CaCl2+TiO2+H2O
(3)
Fe2O3·TiO2+6HCl=2FeCl3+TiO2+3H2O
(4)
在浸出的过程中,部分TiO2发生溶解和水解,主要反应如下:
FeO·TiO2+4HCl=FeCl2+TiOCl2+2H2O
(5)
Fe2O3·TiO2+8HCl=2FeCl3+TiOCl2+4H2O
(6)
TiOCl2+(x+1)H2O=TiO2·xH2O+2HCl
(7)
盐酸浸出法制备人造金红石需经过预处理、盐酸浸出、过滤、烘干等步骤,其流程如图1所示。
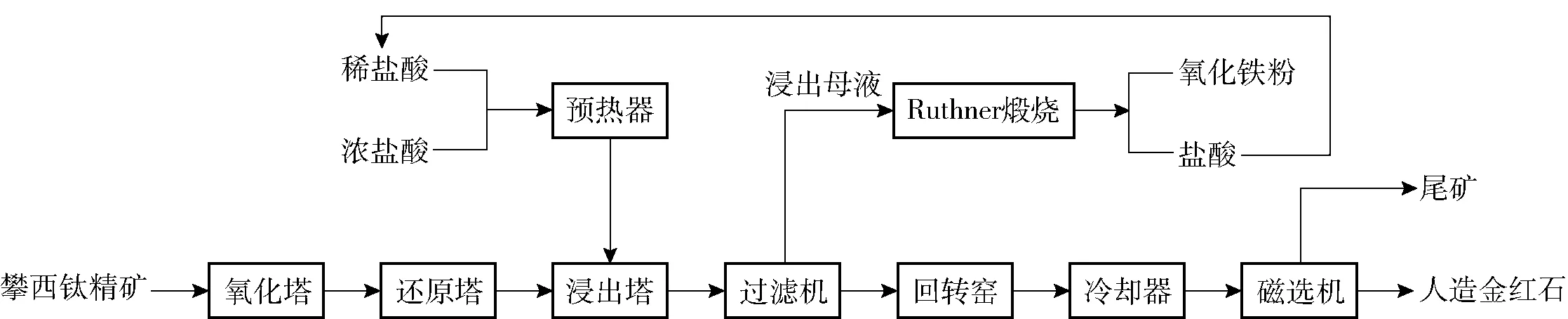
图1 盐酸浸出制备人造金红石的工艺流程图
1.4 盐酸浸出实验方案
称取一定质量经过真空碳热预还原处理的钛精矿置于烧杯中,加入所需浓度的盐酸,再将烧杯置于水浴锅中进行恒温浸出,经过一定时间后将样品取出并进行真空过滤,保留滤液,并对滤渣进行多次清洗以去除滤渣上附着的残留物。过滤后的滤渣使用干燥箱干燥,干燥好的滤渣用筛子进行充分过滤,得到含钛量高于90%的滤渣,该滤渣的钛含量达到人造金红石的水平。滤渣经搅拌均匀,称取样品检测其成分含量。由于母液残留铁元素和盐酸,所以在生产实践中还需要对母液进行回收利用。由于钛精矿经过真空处理,铁以外的其他元素含量极少,所以母液中的氯化铁含量较高,可将母液用作制备高纯度氯化亚铁[29]或氯化铁的原料,从而降低生产成本,提高循环效率。
2 真空碳热预还原实验
取一定量的钛精矿,加入80%含碳量的焦炭、碳酸钠[30]以及甲基纤维素,搅拌至充分混合,然后加水搅拌并用模具压成直径40 mm、厚度10~15 mm的生球团(图2a)。将生球团放入干燥箱内干燥8 h后,放入MTLQ-TG-40真空碳管炉内进行真空还原,目的是把三价铁还原成单质铁。还原后得到的钛精矿(图2(b))主要物相为金属铁相、亚铁板钛矿相(FeTi2O5)以及部分金红石相(TiO2)。镁元素与部分铁、钛元素形成固溶体,钙元素与硅元素形成硅酸盐。还原后取出钛精矿进行破碎处理,用200目筛子进行充分筛分,得到粒度均低于0.74 μm的钛精矿(图2(c)),装好放在干燥箱内保存,供酸浸取用。

图2 钛精矿套定预热碳还原前后对比
2.1 还原温度对金属失重率、金属化率及炉内压强的影响
还原温度对样品失重率、金属化率以及炉内压力的影响如图3所示。由于碳热还原过程中的高温会使钛精矿中的铁元素还原,还原反应所产生的氧气与碳发生反应产生CO、CO2,从而引起炉内气体压强的变化。
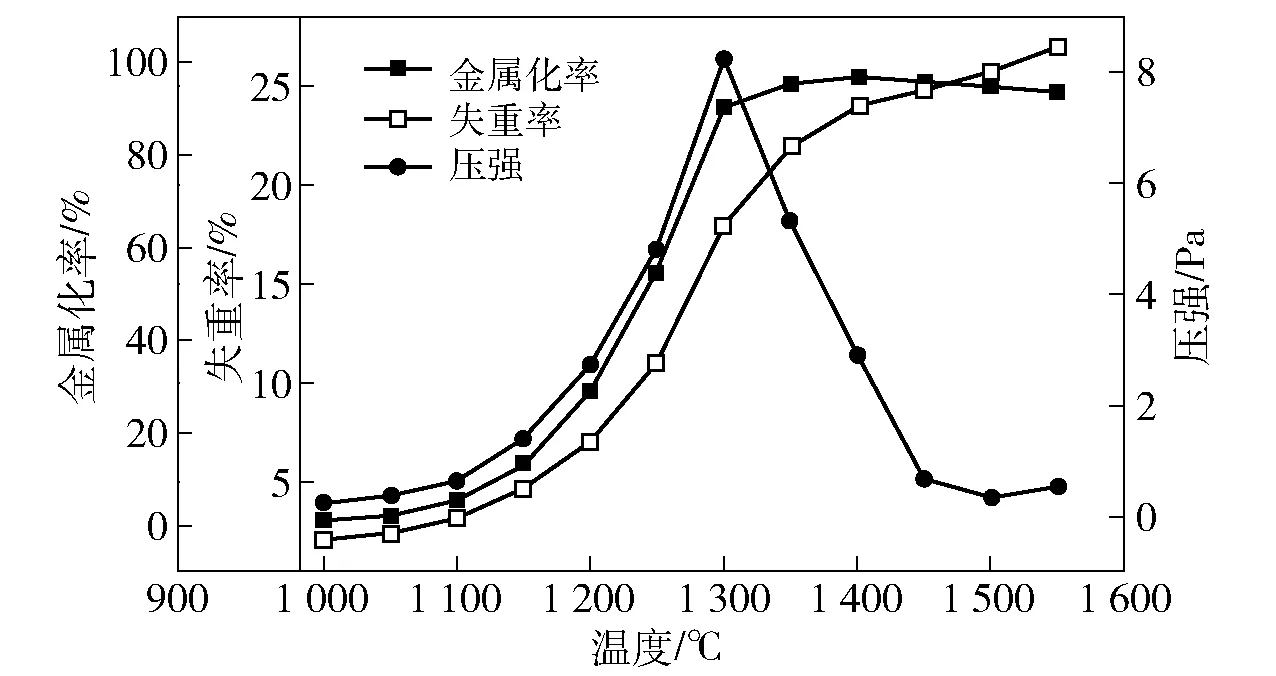
图3 还原温度对金属失重率、金属化率和炉内压强的影响
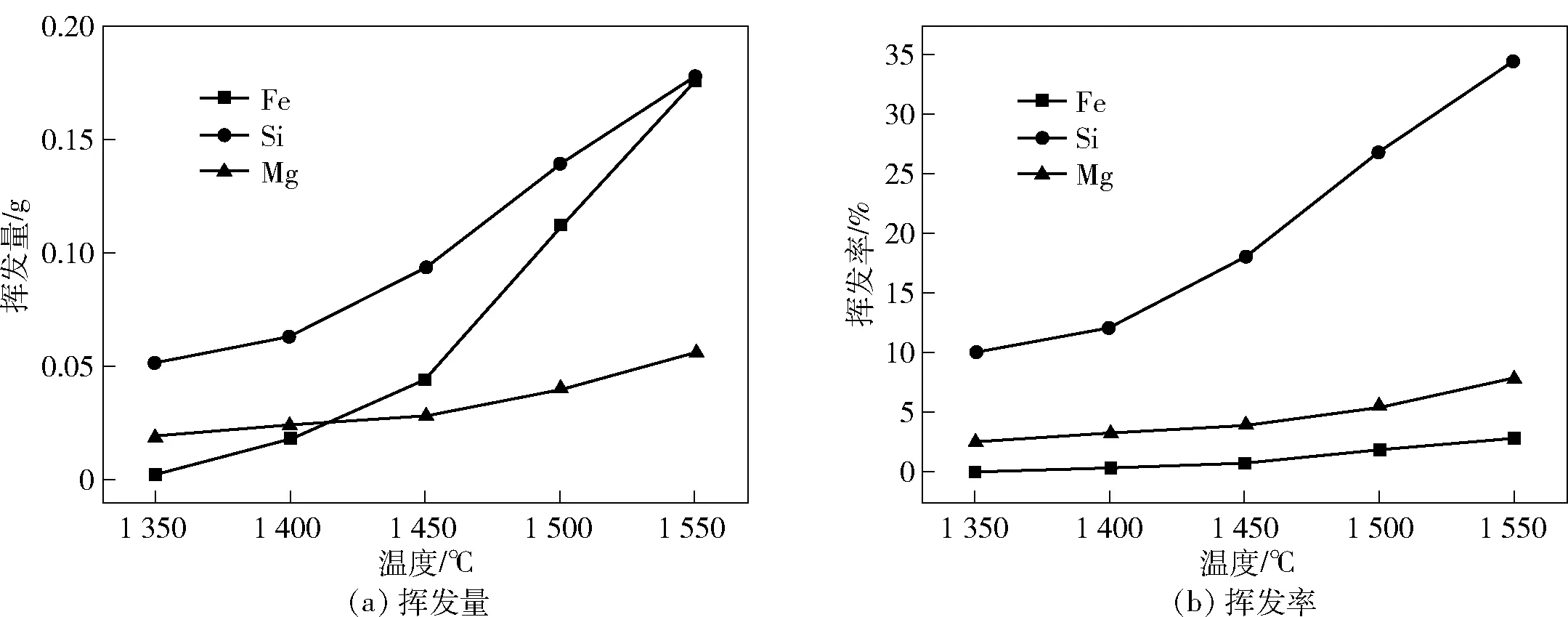
图4 Fe、Si、Mg的挥发量和挥发率和温度变化的关系
由图2可知,当还原温度从1 000 ℃升高到1 300 ℃,金属化率和失重率都呈现增加趋势,而炉内压强则呈先增加后降低趋势。在温度低于1 100 ℃时,金属化率、失重率和炉内压强缓慢增加;当温度高于1 100 ℃时,金属化率、失重率和炉内压强增幅加快,特别是在1 150 ℃后。这是因为在1 100 ℃前发生还原反应的钛精矿量比较少,当温度高于1 100 ℃后发生还原反应的钛精矿量增大。而当温度高于1 300 ℃后,金属化率和失重率增幅减缓,由于此时反应即将完成,还原反应产生的气体量减少,炉内压强降低;当温度超过1 500 ℃时,失重率增加趋势大于金属化率,因此反应温度以1 400~1 500 ℃为最佳。
2.2 还原温度对Fe、Si和Mg挥发情况的影响
Fe、Si和Mg的挥发率和挥发量随还原温度的变化如图4所示。由图4可知,当还原温度为1 350 ℃时,Si的挥发量和挥发率最大, Mg其次,Fe最小。随着反应温度的升高,Fe和Mg的挥发率变化趋势相似。在1 400 ℃时,Si的挥发量和挥发率呈现增加的趋势;温度增至1 450 ℃后,Fe和Mg挥发率的增加趋于缓慢。在1 550 ℃时,Fe、Si和Mg的挥发量分别为0.18 g、0.18 g和0.06 g,挥发率分别为2.76 %、34.37%和7.84%。经过综合考虑,本实验最终选择在1 500 ℃条件下进行。
2.3 钛精矿预还原样品分析
经过真空碳热预处理还原后的钛精矿组成成分见表2。由表2可以看出,钛精矿的成分主要是Ti和Fe,杂质的含量较低,说明真空碳热预还原能减少钛精矿中的杂质含量。
还原后的钛精矿电镜结果如图5所示。从图5可知,钛精矿中的大部分铁经过真空碳热预还原后聚集在一起,还原形成的碎片状二氧化钛上附着球状金属铁,但还有少量的铁处于分散的状态。二氧化钛组成了预还原钛精矿的基本骨架,且经过真空碳热预还原后Si含量减少,分布较散。

表2 钛精矿预处理后的组成成分表 %
3 真空碳热预还原后盐酸浸出实验结果与讨论
3.1 固液比对人造金红石中钛、铁含量的影响
在温度为80 ℃、盐酸浓度为25%、搅拌速度120 r/min的条件下反应1 h,改变固液比,研究不同固液比对浸出结果的影响,结果如图6所示。
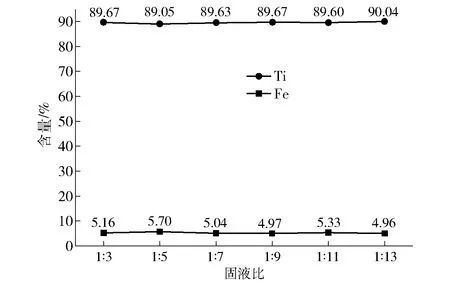
图6 固液比对人造金红石中Ti、Fe含量的影响
由图6可知,不同固液比对人造金红石中钛、镍含量的影响并不明显。当固液比为1∶13时,Ti含量才能达到90%以上;Fe含量基本维持在5%左右。由于固液比的增加带来的Ti含量增加产生的收益并不明显,且会使生产成本上升,因此固液比以1∶5为宜。
3.2 盐酸浓度对人造金红石中钛、铁含量的影响
在搅拌速度120 r/min、温度80 ℃、固液比1∶5的条件下反应1 h,加入不同浓度的盐酸,考察盐酸浓度对人造金红石中Ti含量和Fe含量的影响,结果如图7所示。
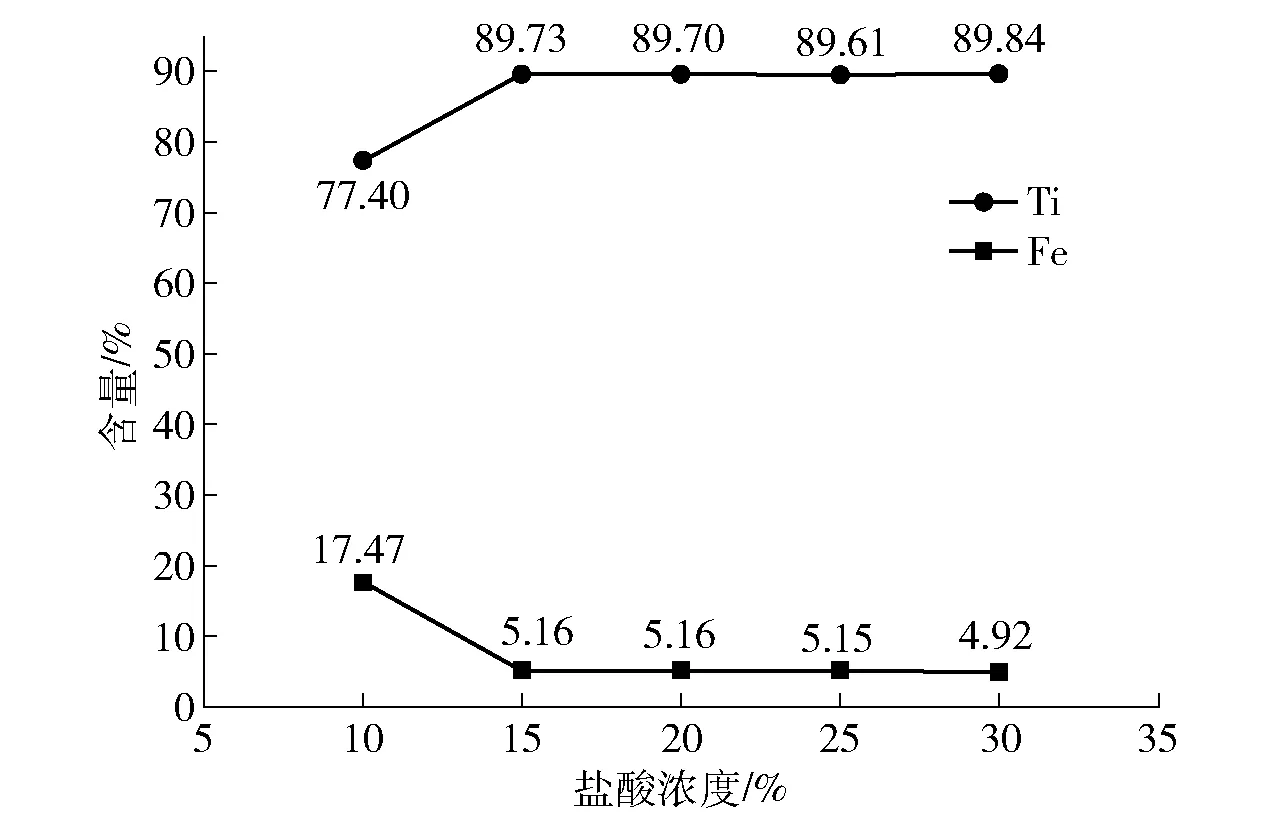
图7 盐酸浓度对人造金红石中Ti、Fe含量的影响
从图7可知,当盐酸浓度从10%增加到15%时,人造金红石中Ti含量和Fe含量发生显著的变化,Ti含量从77.40%增加到89.73%,Fe含量下降速度也非常快;在盐酸浓度大于15%时,Ti、Fe含量的变化并不明显,这说明Fe的反应已经到达极限,继续加入盐酸,样品中剩余的Fe也很难再与盐酸反应,故盐酸浓度选择15%为宜。
3.3 酸浸时间对人造金红石中钛、铁含量的影响
在固液比1∶5、温度80 ℃、盐酸浓度15%、搅拌速度120 r/min的条件下,改变浸出时间,研究浸出时间对人造金红石中Ti含量和Fe含量的影响,结果如图8所示。
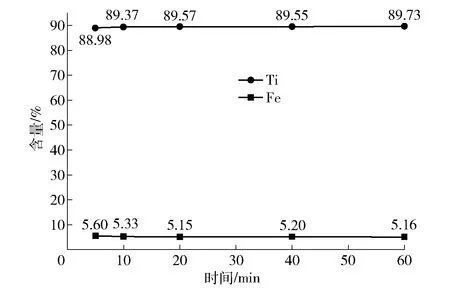
图8 酸浸时间对人造金红石中Ti、Fe含量的影响
由图8可知,浸出开始5 min后,Ti含量已经达到88.98%,这说明反应开始时反应速度非常快,大多数杂质溶解。继续延长浸出时间,Ti含量上升缓慢,Fe含量缓慢下降。综合考虑时间效率和成本,酸浸时间以20 min为宜。
3.4 酸浸后样品电镜分析
在盐酸浓度15%、反应时间20 min、固液比1∶5、温度80 ℃、搅拌速度120 r/min的条件下进行酸浸,并对酸浸样品进行电镜分析,结果如图9所示。
由图9可知,酸浸样品中有孔洞,这些孔洞是铁元素聚集形成的球状物经过酸浸与钛精矿分离导致的结果。酸浸后铁的溶解并没有影响样品的形状,且酸浸可以较好地去除样品中的铁。虽然可以观察到有代表铁粒的亮斑,但这可能是后期拍摄电镜的过程中破碎暴露出来的。
4 结论
本实验以钛精矿作为原料,进行真空碳热预还原-盐酸浸出方法制备人造金红石的实验。在实验中运用控制变量法分析得到最佳的反应条件,并获得以下结论:
1)在搅拌速度120 r/min、盐酸质量浓度为15%、固液比为1∶5、反应时间为20 min条件下,产品中钛的含量达到89.57%。
2)经过真空碳热预还原后,铁单质会聚集成为球状并分布于生成物的球团中。
3)钛精矿的真空碳热预还原使盐酸浸出的难度大幅度降低,在常压的条件下得到高品位的人造金红石。
——以金红石为例

