体外诱导耐药及相关基因检测
张腾月 严梓晴 马驿 丁月霞


摘要[目的]了解常見致病菌产生耐药性后耐药基因和毒力基因的变化。[方法]采用微量肉汤二倍稀释法测定21种临床常见抗生素对大肠杆菌、金黄色葡萄球菌等5种标准菌株的最小抑菌浓度,选取敏感药物进行体外诱导耐药试验,采用PCR法检测耐药基因和毒力基因。[结果]5个标准菌株均对氨基糖苷类药物敏感;大肠杆菌对四环素类药物敏感;鼠伤寒沙门氏菌、多杀性巴氏杆菌和肺炎链球菌对喹诺酮类药物敏感;金黄色葡萄球菌对克林霉素敏感。与标准菌株相比,氨基糖苷类和四环素类耐药菌株中均检测出新出现的相关耐药基因;喹诺酮类耐药基因parE在多杀性巴氏杆菌的标准菌株和耐诺氟沙星菌株中检测出,gyrB基因仅在肺炎链球菌的标准菌株和耐氧氟沙星菌株中检测出。在大肠杆菌中均检测出CS31A毒力基因,此外标准菌株中检测出fimH基因,耐多西环素菌株中检测出afa基因;多杀性巴氏杆菌标准菌株未检测出毒力基因,耐药菌株中均检测出oma87和tbpA基因;而鼠伤寒沙门氏菌、金黄色葡萄球菌和肺炎链球菌仅在标准菌株中检测出毒力基因。[结论]说明氨基糖苷类抗生素更容易诱导菌株产生耐药基因,而毒力基因与耐药基因无明显的相关性。细菌获得耐药性后,其毒力基因变化因菌株不同存在差异。
关键词体外诱导耐药;耐药基因;毒力基因;标准菌株;最小抑菌浓度(MIC)
中图分类号S859.7文献标识码A
文章编号0517-6611(2023)08-0075-04
doi:10.3969/j.issn.0517-6611.2023.08.018开放科学(资源服务)标识码(OSID):
The Inducing Drug-resistance Bacteria in vitro and Detection of Related Gene
ZHANG Teng-yue,YANG Zi-qing,MA Yi et al(College of Coastal Agricultural Sciences,Guangdong Ocean University,Zhanjiang,Guangdong 524088)
Abstract[Objective]To evaluate drug resistance genes and virulence genes of the inducing drug-resistance pathogenic bacteria in vitro.[Method] A total of 21 common antibiotics and 5 standard strains were recruited as the study objects.A broth microdilution method was performed to test standard strains antimicrobial susceptibility and mutants resistant to sensitive antibiotics were selected by stepwise exposure of standard strain to increasing concentrations of drug.PCR was used to determine drug resistance genes and virulence genes.[Result]The results of antimicrobial susceptibility testing showed that five standard strains were highly sensitive to aminoglycoside antibiotics.And Escherichia coli were sensitive to tetracycline antibiotics;Salmonella typhimurium,Pasteurella multocida and Streptococcus pneummoniae were sensitive to quinolones antibiotics;Staphylococcus aureus were sensitive to lincomycin.The results of drug-resistance gene test showed that new resistance genes were detected in aminoglycoside-resistance strains and tetracycline-resistant strains;quinolone resistant gene parE were detected in norfloxacin-resistance and standard strains of Pasteurella multocida;quinolone resistant gene gyrB were detected in ofloxacin-resistance and standard strains of Streptococcus pneumoniae.The results of virulence gene test showed that all the 3 Escherichia coli carried CS31A gene and Escherichia coli standard strains carried fimH ,doxycycline-resistant strains carried afa gene.No virulence genes were detected in Pasteurella standard strain,and oma87 and tbpA genes were detected in the resistant strains.The virulence genes were detected in standard strains of Salmonella typhimurium,Staphylococcus aureus and Streptococcus pneumoniae.[Conclusion]In general,it was easy to select resistant-strains by aminoglycoside antibiotics.There is no significant correlation between different drug resistance gene and virulence gene.There were differences in virulence gene changes after bacteria acquired drug resistance.
Key wordsInduced resistance in vitro;Drug resistance gene;Virulence gene;Standard strain; Minimum inhibitory concentration(MIC)
近年来集约化养殖带来的各种环境污染问题备受关注,高密度的养殖模式使细菌性疾病频发,目前抗生素仍是治疗细菌感染的主要手段[1]。但是抗生素的不规范和不科学使用会引起药物残留和细菌耐药性等问题[2]。研究发现,细菌的耐药机制非常复杂,主要包括产生水解酶或钝化酶、改变细胞膜通透性、激活主动外排系统、药物靶位改变、形成生物被膜、基因突变和获得外源耐药基因等[3-4]。目前,细菌的耐药情况日益严重,多重耐药致病菌频繁出现,给畜牧养殖中的疾病防治带来严峻挑战。环境中的耐药基因可以通过垂直传播遗传给下一代菌株,也可以通过质粒或转座子等进行水平传播,将耐药基因传播给周边环境中的微生物,其中包括大肠杆菌、金黄色葡萄球菌和沙门氏菌等病原微生物,这类细菌在自然环境中广泛存在,其耐药基因会随着食物链传播,严重威胁人类健康安全[5-7]。相关研究表明,病原菌的致病力与毒力因子有直接相关性,某些毒力基因不会增加致病性,但会促进其在宿主中的定植[8-9]。毒力因子是由毒力基因编码的产物,通过破坏宿主细胞或影响细胞调控途径发挥致病作用[10]。耐药性和致病性是细菌适应环境的体现,与自身携带的耐药基因和毒力基因有直接关系[11-12]。病原菌耐药性增强是否影响致病性已引起广泛关注。该研究采用5种病原菌标准菌株,通过体外诱导耐药试验,检测细菌出现耐药表型后,其耐药和毒力基因的改变情况,对细菌性疾病的防治和临床指导用药有重要意义,为研究细菌耐药性与致病性的相关性奠定基础。
1材料与方法
1.1菌株多杀性巴氏杆菌(C48-1)、金黄色葡萄球菌(ATCC29213)、大肠杆菌(ATCC25922)、鼠伤寒沙门氏菌(ATCC13311)、肺炎链球菌(ATCC49619)5种标准菌株购于中国兽药监察所。
1.2药品链霉素、阿米卡星、庆大霉素、新霉素、大观霉素、青霉素、氨苄西林、阿莫西林、阿莫西林克拉维酸、头孢曲松、头孢噻肟、诺氟沙星、氧氟沙星、四环素、多西环素、磺胺间甲氧嘧啶、磺胺嘧啶、克林霉素、黏菌素、红霉素、甲砜霉素共21种抗生素,购自中国食品药品检定研究院。
1.3主要试剂细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;营养肉汤培养基,购自北京陆桥技术股份有限公司;Premix EX Taq versin 2.0、DL1000 DNA Marker,购自宝生物工程(大连)有限公司;琼脂糖,购自北京凯欧迪生物科技有限公司;Goldview核酸染色剂,购自南京诺唯赞生物科技有限公司;TBE缓冲液、试验所用引物合成于生工生物工程(上海)股份有限公司。
1.4标准菌株MIC测定参照美国临床和实验室标准化协会执行标准(CLSI),采用微量肉汤二倍稀释法,测定21种抗生素对标准菌株的MIC。根据21种抗生素对标准菌株的MIC值,选择2种不同种类的敏感抗生素进行体外诱导耐药试验。
1.5体外诱导耐药试验采用药物浓度梯度递增法诱导耐药菌株,初次诱导的药物浓度为1/2 MIC。将各菌株接种于药物浓度递增的营养肉汤培养基,37 ℃振荡培养24 h,待细菌生长状况良好后传代培养3代。采用相同的方法以2倍递增浓度继续诱导菌株,直至药物浓度为128倍MIC,诱导停止。获得的耐药菌株在无抗生素培养基中培养8代,以确保其并非适应性生长,测定其MIC。
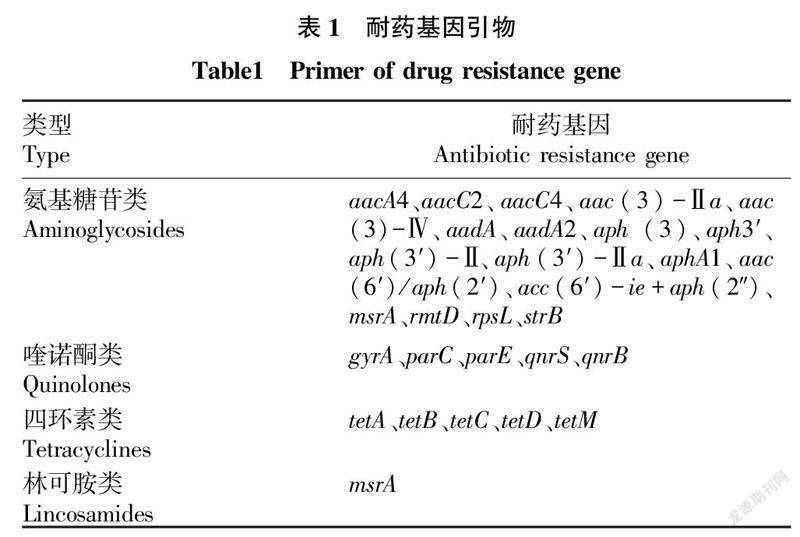
1.6耐药基因和毒力基因的检测耐药菌株接种于营养肉汤培养基,37 ℃振荡培养24 h,离心收集菌体,按照细菌基因组DNA提取试剂盒说明书提取细菌DNA,进行PCR擴增。检测的相关耐药基因与毒力基因见表1和表2。PCR扩增体系为DNA模板0.500 μL,上下游引物各0.500 μL,dNTPs 2.00 μL,Taq酶0.125 μL,10×PCR buffer 2.500 μL,ddHO补足25 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,退火30 s,72 ℃延伸1 min,30个循环;72 ℃终延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测是否有目标条带。
2结果与分析
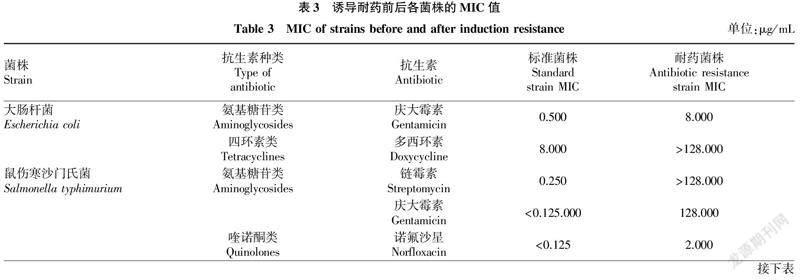
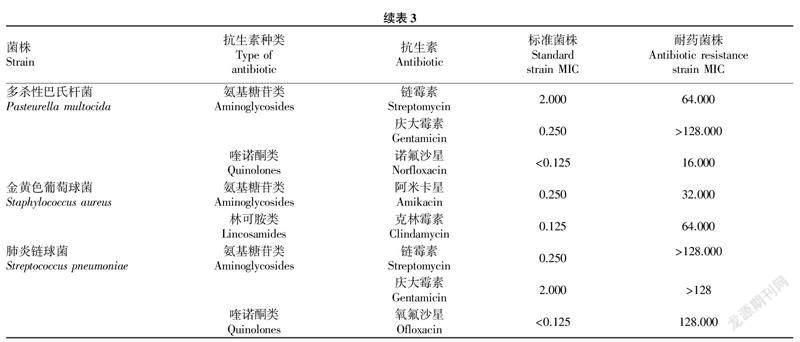
2.1标准菌株MIC测定根据21种抗生素对标准菌株的MIC选择2种不同种类的敏感抗生素进行体外诱导耐药试验,诱导耐药前后各菌株的MIC见表3。结果显示,5个标准菌株均对氨基糖苷类抗生素(链霉素、庆大霉素或阿米卡星)敏感;此外,大肠杆菌对多西环素较敏感;鼠伤寒沙门氏菌和多杀性巴氏杆菌均对诺氟沙星敏感;金黄色葡萄球菌对克林霉素敏感;肺炎链球菌对氧氟沙星敏感。
2.2体外诱导耐药试验由表3可知,耐药菌株经8次传代培养后的MIC 与标准菌株MIC相比,其增长倍数不同。耐庆大霉素鼠伤寒沙门氏菌和耐氧氟沙星肺炎链球菌的MIC与标准菌株相比增长了1 023倍以上,而耐庆大霉素大肠杆菌和耐诺氟沙星鼠伤寒沙门氏菌的MIC与标准菌株相比仅增长了15倍。
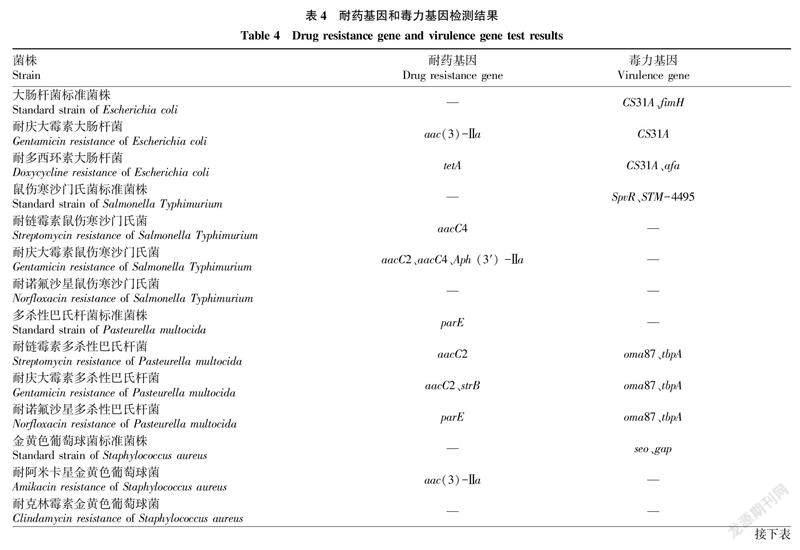
2.3耐药基因检测由表4可知,大肠杆菌诱导耐药前后菌株相比,标准菌株中没有检测出氨基糖苷类和四环素类耐药基因;耐庆大霉素菌株中检测出aac(3)-Ⅱa基因;耐多西环素菌株中检测出tetA基因。鼠伤寒沙门氏菌诱导耐药前未检测出氨基糖苷类和喹诺酮类耐药基因;而耐链霉素菌株中检测出aacC4基因;耐庆大霉素菌株中检测出aacC2、aacC4和Aph(3′)-Ⅱa基因。多杀性巴氏杆菌标准菌株和耐诺氟沙星菌株中均检测出parE基因;耐链霉素菌株中检测出aacC2基因;耐庆大霉素菌株中检测出aacC2和strB基因。金黄色葡萄球菌的耐阿米卡星菌株检测出aac(3)-Ⅱa基因,而标准菌株和耐克林霉素菌株中均没有检测出耐药基因。肺炎链球菌的标准菌株和耐氧氟沙星菌株中检测出gyrB基因;耐链霉素菌株和耐庆大霉素菌株中检测出aacC2基因。
51卷8期张腾月等体外诱导耐药及相关基因检测2.4毒力基因检测各菌株致病基因检测结果见表4。表4表明,大肠杆菌诱导耐药菌株中均检测出CS31A基因,而标准菌株中检测出fimH基因,耐多西环素菌株中检测出afa基因。多杀性巴氏杆菌标准菌株未检测出毒力基因,而3种耐药菌株中均检测出oma87和tbpA基因。鼠伤寒沙门氏菌、金黄色葡萄球菌和肺炎链球菌均在标准菌株中检测出毒力基因,而耐药菌株中未检测出毒力基因。
3讨论与结论
大肠杆菌、沙门氏菌、金黄色葡萄球菌、多杀性巴氏杆菌和肺炎链球菌都是能够引起人兽共患病的病原微生物,在自然环境中广泛分布[13-15]。随着细菌耐药性问题日益严重,这类病原微生物的耐药性和致病性研究也引起越来越多学者的关注。该研究对5种病原菌的标准菌株进行体外诱导耐药试验,结果发现氨基糖苷类抗生素和喹诺酮类抗生素对5种病原菌有较好的抑制效果,其中庆大霉素和链霉素的抑菌作用更加突出。耐药基因检测结果发现,氨基糖苷类耐受菌株中均检测出氨基糖苷修饰酶的编码基因,包括氨基糖苷乙酰转移酶和磷酸转移酶,说明产生修饰酶是病原菌耐受氨基糖苷类抗生素的最广泛、最主要的机制[16]。多杀性巴氏杆菌与肺炎链球菌的标准菌株和喹诺酮类抗生素耐受菌株中检测出耐药基因gyrB和parE,耐药菌株中未检测出新的喹诺酮类耐药基因。喹诺酮类抗生素耐药的主要机制是药物作用的靶位点的基因突变,即由编码DNA促旋酶的gyrA/gyrB基因和编码拓扑异构酶Ⅳ的parC /parE基因发生突变,通常gyrB和parE基因突变对耐药性的影响较小[17-19]。该试验中,耐多西环素大肠杆菌中检测出tetA基因,该基因编码四环素的外排蛋白,通过外排蛋白将药物主動排出胞外,降低胞内的药物浓度,使细菌产生耐药性[20]。崔佳佳等[21]在强力霉素体外诱导嗜水气单胞菌耐药试验中发现,诱导后的耐药菌株中出现tetA基因,猜测tetA基因在该菌耐药机制中有极其重要的作用。
由于病原菌的耐药性和致病性进化时间不同步,所以研究二者的选择和进化机制有较大难度[22]。杨立军等[23]研究发现,禽致病性大肠杆菌的致病性与耐药性存在一定的相关性,90%的强毒株对10种以上抗生素耐受,具有多重耐药性。张珍等[24]对10株广西鸡源沙门氏菌研究发现,沙门氏菌耐药种类越多,携带耐药基因数量越多,其对小鼠的毒力越强,说明沙门氏菌的耐药性与致病性呈正相关关系。方艳红[25]研究发现,非伤寒沙门氏菌耐药性改变时,其毒力基因不会发生明显变化。王德宁[26]研究发现,病鸡中分离的沙门氏菌的耐药性与致病性之间呈负相关关系。该研究中,大肠杆菌中均检测出CS31A基因,此外标准菌株和耐多西环素菌株中分别检测出大肠杆菌粘附因子基因afa、fimH;多杀性巴氏杆菌标准菌株未检测出毒力基因,耐药菌株中均检测出外膜蛋白编码基因oma87和转铁结合蛋白A编码基因tbpA;而鼠伤寒沙门氏菌、金黄色葡萄球菌和肺炎链球菌仅在标准菌株中检测出毒力基因。综合来看,毒力基因与耐药基因无明显的相关性。目前相关研究报道中细菌耐药性对致病性的影响有增强作用、减弱作用或者无明显的相关性,这或许与细菌种类、耐药机制、致病机制等有关[27-28]。现有研究还不足以阐明两者间的关系,还需进行深入研究。
综上所述,标准菌株均对氨基糖苷类药物敏感,而氨基糖苷类抗生素更易诱导菌株产生耐药基因。细菌获得耐药性后,其毒力基因变化因菌株不同存在差异,且毒力基因与耐药基因无明显的相关性。
参考文献
[1] 朱利霞,王洪彬,赵希艳,等.毛皮动物源肺炎克雷伯菌部分毒力基因、耐药基因检测及药敏试验[J].中国兽医学报,2019,39(9):1744-1752.
[2] QU J Y,HUANG Y M,LV X J.Crisis of antimicrobial resistance in China:Now and the future[J].Front Microbiol,2019,10:1-6.
[3] 李昕,曾洁,王岱,等.细菌耐药耐受性机制的最新研究进展[J].中国抗生素杂志,2020,45(2):113-121.
[4] VAN DUIJKEREN E,SCHINK A K,ROBERTS M C,et al.Mechanisms of bacterial resistance to antimicrobial agents[J].Microbiol Spectr,2018,6(1):1-31.
[5] ZHU W M,LAWSIN A,LINDSEY R L,et al.Conjugal transfer,whole-genome sequencing,and plasmid analysis of four mcr-1-bearing isolates from U.S.patients[J].Antimicrob Agents Chemother,2019,63():e02417-e02418.
[6] ALI J,RAFIQ Q A,RATCLIFFE E.Antimicrobial resistance mechanisms and potential synthetic treatments[J].Future Sci OA,2018,4(4):1-10.
[7] MICHAEL G B,SCHWARZ S.Antimicrobial resistance in zoonotic nontyphoidal Salmonella:An alarming trend?[J].Clin Microbiol Infect,2016,22(12):968-974.
[8] FOKA F E T,ATEBA C N.Detection of virulence genes in multidrug resistant enterococci isolated from feedlots dairy and beef cattle:Implications for human health and food safety[J].BioMed Res Int,2019,2019:1-14.
[9] KANG H J,YOON S,KIM K,et al.Characteristics of high-level aminoglycoside-resistant Enterococcus faecalis isolated from bulk tank milk in Korea[J].Animals,2021,11(6):1724-1724.
[10] SHANG W L,RAO Y F,ZHENG Y,et al.β-lactam antibiotics enhance the pathogenicity of methicillin-resistant Staphylococcus aureus via SarA-controlled lipoprotein-like cluster expression[J].mBio,2019,10(3):1-14.
[11] CHEN J,ZHOU H Y,HUANG J B,et al.Virulence alterations in Staphylococcus aureus upon treatment with the sub-inhibitory concentrations of antibiotics[J].J Adv Res,2021,31:165-175.
[12] 宁唤唤,李晶,王严,等.铜绿假单胞菌耐药性与致病性共选择机制研究进展[J].中国抗生素杂志,2015,40(5):382-388,400.
[13] GE H W,WANG Y Z,ZHAO X H.Research on the drug resistance mechanism of foodborne pathogens[J/OL].Microb Pathog,2022,162[2022-01-15].https://doi.org/10.1016/j.micpath.2021.105306.
[14] 華瑞其,赵新新,程安春.多杀性巴氏杆菌脂多糖的结构与功能研究进展[J].畜牧兽医学报,2016,47(10):1961-1968.
[15] 张行,李新圃,杨峰,等.无乳链球菌研究进展[J].中国兽医学报,2020,40(4):864-872.
[16] MANCINI S,MARCHESI M,IMKAMP F,et al.Population-based inference of aminoglycoside resistance mechanisms in Escherichia coli[J].EBioMedicine,2019,46:184-192.
[17] MARKOVSKA R,STOEVA T,DIMITROVA D,et al.Quinolone resistance mechanisms among third-generation cephalosporin resistant isolates of Enterobacter spp.in a Bulgarian university hospital[J].Infect Drug Resist,2019,12:1445-1455.
[18] YANAT B,RODRGUEZ-MARTNEZ J M,TOUATI A.Plasmid-mediated quinolone resistance in Enterobacteriaceae:A systematic review with a focus on Mediterranean countries[J].Eur J Clin Microbiol Infect Dis,2017,36(3):421-435.
[19] 刘晓强,李芳娥,杨鹏超,等.体外诱导大熊猫大肠埃希菌对普多沙星的耐药性及其机制研究[J].西北农林科技大学学报(自然科学版),2017,45(3):68-74.
[20] ALEKSHUN M N,LEVY S B.Molecular mechanisms of antibacterial multidrug resistance[J].Cell,2007,128(6):1037-1050.
[21] 崔佳佳,王荻,卢彤岩,等.嗜水气单胞菌对四环素类药物诱导耐药表型及机理研究[J].微生物学报,2016,56(7):1149-1158.
[22] BECEIRO A,TOMS M,BOU G.Antimicrobial resistance and virulence:A successful or deleterious association in the bacterial world?[J].Clin Microbiol Rev,2013,26(2):185-230.
[23] 杨立军,韩先干,尹会方,等.福建省龙岩市禽致病性大肠杆菌的血清型、毒力因子及耐药研究[J].中国动物传染病学报,2016,24(6):24-29.
[24] 张珍,施开创,王孝德,等.2015—2017年广西鸡源沙门氏菌耐药性与致病性的相关性分析[J].南方农业学报,2019,50(10):2350-2358.
[25] 方艳红.非伤寒沙门氏菌耐药性产生及增强对其毒力的影响[D].合肥:安徽农业大学,2012.
[26] 王德宁.鸡源沙门氏菌耐药性、致病性与毒力基因相关性分析[D].哈尔滨:东北农业大学,2014.
[27] MOHAMMADREZA S,ALIREZA F S,ABDOLLAH K,et al.Antimicrobial resistance and molecular epidemiology of virulence genes among multi-drug resistant Acinetobacter baumannii clinical isolates in Iran[J/OL].Gene Rep,2021,24[2022-01-15].https://doi.org/10.1016/j.genrep.2021.101281.
[28] 陈传荣,韩敏敏,张乃嘉,等.腹泻仔猪源致病性大肠杆菌生物膜与耐药性及毒力的相关性[J].微生物学通报,2016,43(10):2234-2241.

