毛霉菌菌丝体多糖的提取工艺优化和抗氧化活性
王颜天池,史红军,张红,吴连平
南京市高淳人民医院(南京 211399)
多糖是由10个以上的单糖分子以糖苷键呈线性或分支连接形成的含醛基或酮基的高分子聚合物,普遍存在于动物、植物和微生物等生物体中,是生命活动的四大基本物质之一[1]。真菌多糖是从真菌的子实体、菌丝体或发酵液中分离得到的多糖,具有抗肿瘤、抗氧化、抗病毒等多种生物活性,且毒副作用低,产量高。真菌多糖已在临床上广泛应用,具有重要的药用价值,寻找具有生物学活性的真菌多糖具有重要意义[2]。
毛霉菌(Mucorsp.)属于真菌门接合菌亚门,是一种丝状真菌,以孢囊孢子和接合孢子繁殖。毛霉菌广泛分布于自然界,为腐生性真菌,能够引起食物霉变,可以分解蛋白质,常用于食品工业[3]。尚无文献对毛霉菌菌丝体多糖(MPS)进行相关报道,故文章利用单因素试验考察提取温度、提取时间、提取次数和料液比对菌丝体多糖产量的影响,利用正交试验研究MPS的最佳提取条件[4]。同时,文章检测多糖对DPPH、ABTS和羟自由基的清除活性,评价其抗氧化活性;利用CCK-8法检测MPS对人肝癌HepG2细胞增殖的影响,从而为毛霉菌菌丝体多糖产量的提高和生物活性的研究提供理论基础和数据支持。
1 材料与方法
1.1 材料与试剂
CICC 3039毛霉菌(中国工业微生物菌种保藏管理中心);人肝癌HepG2细胞(本实验室);蒽酮、硫酸、果糖(福晨化学试剂有限公司);CCK-8、羟自由基测试试剂盒、总抗氧化能力检测试剂盒(ABTS)、DPPH(南京建成生物工程研究所);DMEM培养基、胎牛血清、胰酶(美国Gibco公司);青霉素、链霉素、磷酸盐(北京索莱宝科技有限公司);所用试剂均为分析纯,水为去离子水。
1.2 仪器与设备
HH-6数显恒温水浴锅[世博(青岛)畜牧设备有限公司];ML104电子分析天平(常州梅特勒托利多集团);RE-2000B旋转蒸发仪(郑州华辰仪器有限公司);SHZ-D(Ⅲ)循环水多用真空泵(河南益源仪器有限公司);SL4F离心机(美国ThermoFisher Scientific公司);3503-2二氧化碳培养箱(美国SHEL.LAB公司);XB.K.25.血球计数板(上海求精生化试剂仪器有限公司)。
1.3 试验方法
1.3.1 菌丝体多糖的提取
菌种接种于马铃薯蔗糖固体培养基中,于28 ℃活化72 h,挑取边缘菌丝接入液体培养基,于28 ℃,以120 r/min的摇床培养箱中培养3 d。经四层纱布过滤发酵液收集菌丝体,菌丝体在沸水中浸提3次,将浸提液减压浓缩至适当体积,冷却后加入四倍体积乙醇[5]。静置过夜后,离心收集沉淀,沉淀复溶后离心收集上清液,用Sevag法(V三氯甲烷∶V正丁醇=4∶1)去除蛋白质,减压浓缩去除有机试剂,利用大孔吸附树脂进行脱色,透析后冷冻干燥得到粗多糖[6]。用硫酸蒽酮法检测总糖含量[7]。
1.3.2 单因素试验
取1.000 g菌丝体粉末,固定提取温度70 ℃、提取时间2 h、提取次数2次,考察料液比1∶10,1∶20,1∶30,1∶40和1∶50(g/mL)对MPS提取率的影响;固定提取时间2 h、料液比1∶30(g/mL)、提取次数2次,考察提取温度50,60,70,80和90 ℃对MPS提取率的影响;固定料液比1∶30(g/mL)、提取温度70 ℃、提取次数2次,考察提取时间0.5,1.0,1.5,2.0和2.5 h对MPS提取率的影响;固定料液比1∶30(g/mL)、提取温度70 ℃、提取时间2 h,考察提取次数1,2,3,4和5次对MPS提取率的影响[8-9]。
1.3.3 正交试验
在单因素试验的基础上进行正交设计法L9(33)优化提取工艺,研究影响因素,确定最佳提取条件,水平和因素见表1。
1.3.4 菌丝体多糖体外抗氧化活性测定
1.3.4.1 MPS对DPPH自由基清除活性的测定
称取适量MPS溶解于2 mL 90%的DPPH溶液中,充分振荡混匀,使多糖质量浓度分别调整至1,2,3,4和5 mg/mL,在室温下避光放置30 min,按10 000 r/min离心20 min,在波长517 nm处检测上清液的吸光度,清除率按式(1)计算。
式中:As为样品管吸光度;A0为样品本底吸光度;Ac为空白对照组吸光度[10]。
1.3.4.2 MPS对ABTS、羟自由基清除活性的测定
利用ABTS、羟自由基检测试剂盒测定MPS对ABTS和羟自由基的清除活力,多糖溶液配制方法同上,以等体积去离子水代替样品检测空白对照组吸光度,以等体积去离子水代替工作液检测样品本底吸光度,清除率计算同1.3.4.1。
式中:As为样品管吸光度;A0为样品本底吸光度;Ac为空白对照组吸光度[11-12]。
1.3.5 菌丝体多糖对肿瘤细胞增殖的影响
取对数生长期细胞接种于96孔板中,密度为6 000个/孔,在二氧化碳培养箱中孵育24 h。称取适量菌丝体多糖溶解于DMEM培养基中,经0.22 μm滤膜过滤,加入至96孔板中,使多糖质量浓度调整至0,0.2,0.4,0.6,0.8和1.0 mg/mL,培养24 h,弃培养液,加入100 μL培养基和10 μL CCK-8溶液,孵育1.5 h后在A450处测定吸光度[13]。
1.3.6 统计学方法
数值资料以均值±标准差表示,采用GraphPad Prism 7.0软件进行统计学分析。采用单因素方差分析比较各组间的统计学差异,显著性差异用*P<0.05,**P<0.01表示。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对菌丝体多糖(MPS)提取率的影响
如图1所示,菌丝体多糖的得率随着料液比中液体占比的增加而显著增加,当料液比等于1∶40(g/mL)时,多糖得率最高,随后降低。溶剂体积的增加,有利于多糖的扩散。但提取溶剂的体积过高时,会影响浸提体系的传热和传质,不利于多糖的提取[14]。
2.1.2 提取温度对菌丝体多糖提取率的影响
如图2所示,当温度为50~80 ℃时,随着温度的升高,菌丝体多糖的提取率也逐渐增加。在提取温度为80 ℃时,提取率为17.825%。当温度高于80 ℃时,多糖提取率逐渐降低。当提取温度升高时,多糖分子的热运动加速,有利于多糖分子的扩散。但温度过高时,多糖分子热不稳定,会遭到破坏,导致提取率降低[15]。

图2 提取温度对多糖提取率的影响
2.1.3 提取时间对菌丝体多糖提取率的影响
由图3可知,多糖提取率随提取时间的增加而增加,当提取时间为2.5 h时,多糖提取率达到最大,提取率为17.10%。
2.1.4 提取次数对菌丝体多糖提取率的影响
由图4可知,多糖提取率随提取次数的增加先增加后降低,在提取次数为3次时,多糖提取率达到最大,提取率为16.44%。
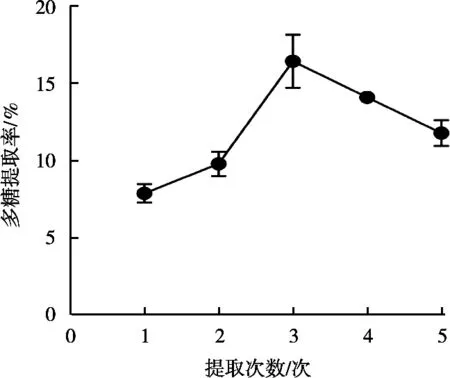
图4 提取次数对多糖提取率的影响
2.2 正交试验结果与分析
通过单因素试验探讨了MPS提取条件的最佳范围,以提取次数、料液比、提取时间和提取温度为考察因素,设计四因素三水平正交试验,正交试验结果见表2,方差分析结果见表3。
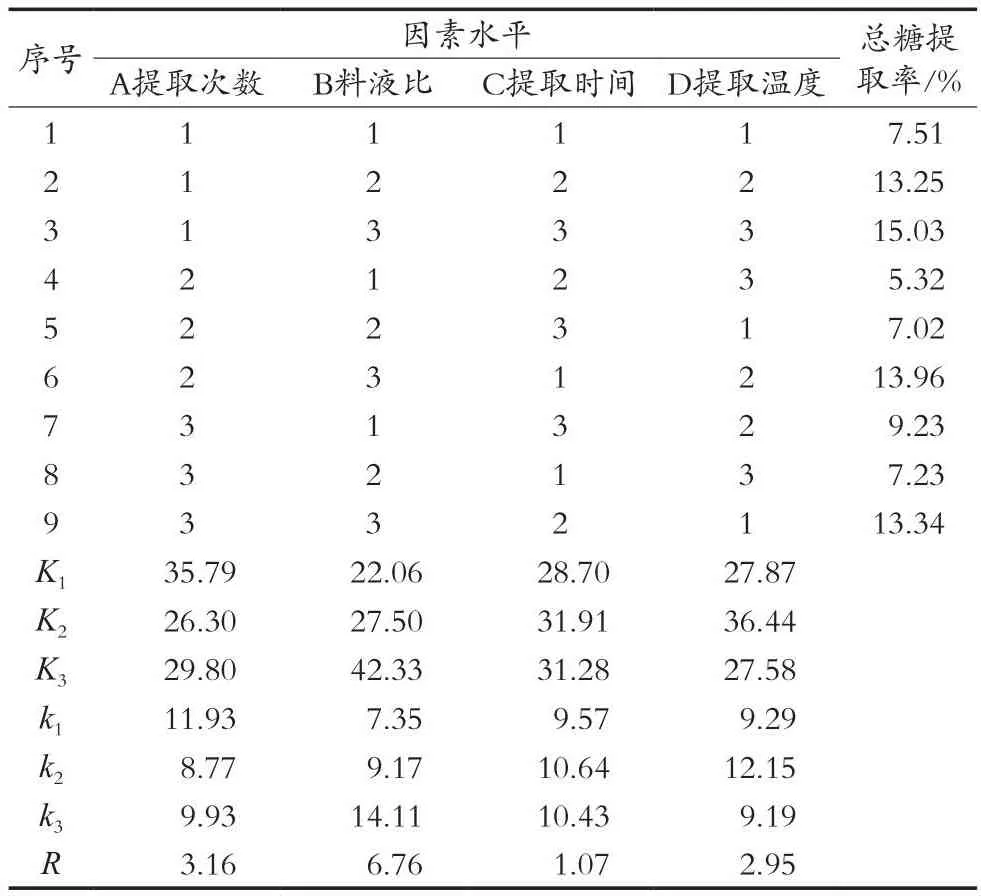
表2 L9(34)正交试验结果
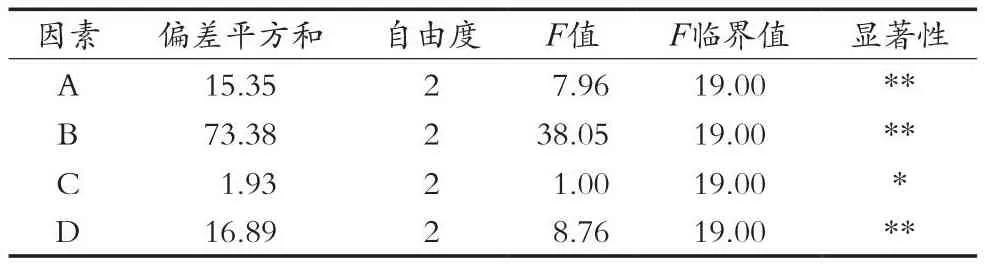
表3 正交试验结果方差分析
通过表2中多糖提取率的极差分析结果表明,影响MPS提取率的因素依次是料液比>提取温度>提取次数>提取时间,通过k值比较可知,kA1>kA3>kA2,kB3>kB2>kB1,kC2>kC3>kC1,kD2>kD1>kD3,即MPS提取的最佳组合为A1B3C2D2,故MPS的最佳提取条件为料液比1∶50(g/mL),提取时间2 h,提取温度为80℃,提取次数2次,MPS提取率为18.24%。
2.3 MPS体外抗氧化活性的测定
2.3.1 MPS对DPPH自由基清除活性的测定
如图5所示,在试验浓度范围内,随着多糖质量浓度的增加,DPPH自由基的清除率也逐渐增加。当MPS质量浓度为5 mg/mL时,其对DPPH自由基的清除率为42.76%,但低于阳性对照VC。
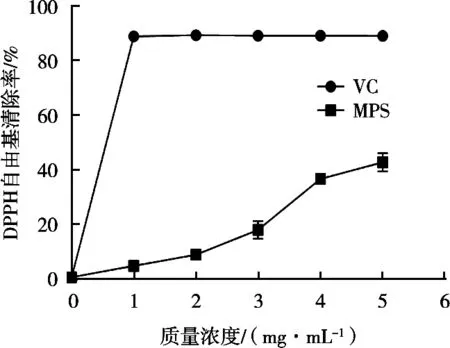
图5 MPS对DPPH自由基的清除活性
2.3.2 MPS对ABTS自由基清除活性的测定
由图6可知,在试验浓度范围内,ABTS自由基的清除活性随着多糖质量浓度的增加而增加,当菌丝体多糖质量浓度为5 mg/mL时,其对ABTS自由基的清除率为40.59%。因此,菌丝体多糖对ABTS自由基具有一定的清除活性,但是低于阳性对照。
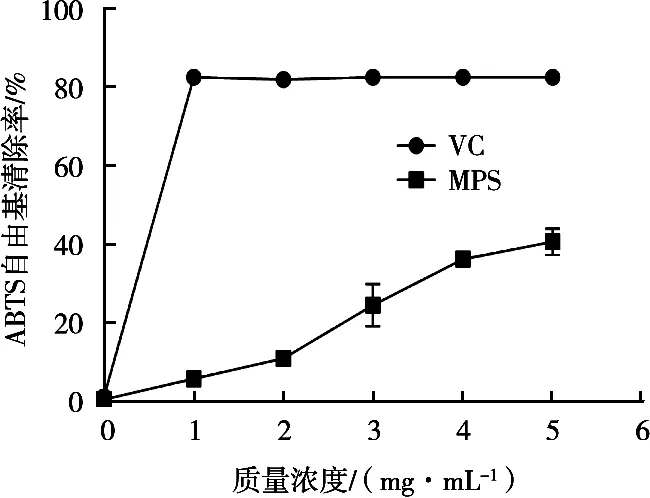
图6 MPS对ABTS自由基的清除活性
2.3.3 MPS对羟自由基清除活性的测定
如图7所示,在试验浓度范围内,MPS对羟基自由基的清除活性随着浓度的增加而增大,当MPS质量浓度为5 mg/mL时,其对羟基自由基的清除率为42.76%。因此,MPS对羟基自由基具有一定的清除活性,但是低于VC。

图7 MPS对羟自由基的清除活性
2.4 毛霉菌菌丝体多糖对人肝癌HepG2细胞增殖的抑制作用
由图8可知,MPS与HepG2细胞孵育24 h后,对人肝癌HepG2细胞的增殖无显著影响(P>0.05)。
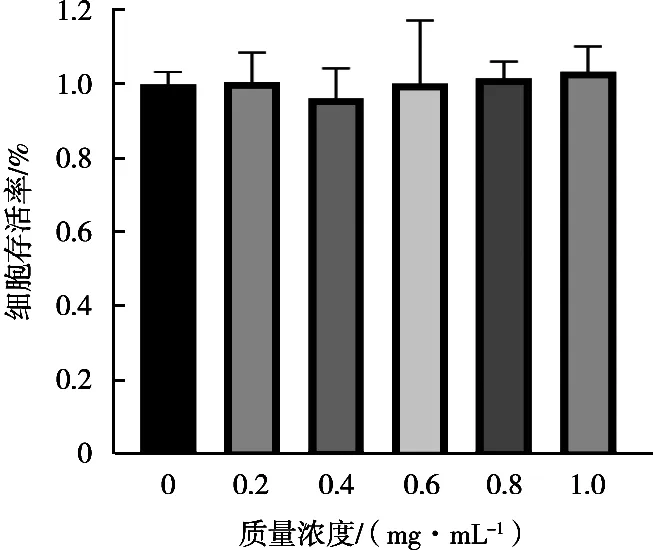
图8 MPS对HepG2细胞增殖的影响
3 结论与讨论
通过单因素试验和正交试验,得出MPS最佳提取条件:料液比1∶50(g/mL),提取时间2 h,提取温度80 ℃,提取次数2次,此时MPS提取率为18.24%。MPS对DPPH、ABTS和羟自由基有一定的清除活力,其在5 mg/mL时对三种自由基的清除率分别为42.76%,40.59%和42.76%,表明MPS具有一定的抗氧化活性。采用CCK-8法检测了MPS对人肝癌HepG2细胞增殖的影响,结果显示MPS对肝癌细胞增殖无显著影响。此研究对MPS的提取工艺进行了优化,明确了该多糖的最佳提取条件,并发现MPS具有一定的抗氧化活性[16]。文章为MPS开发为功能食品或者保健品奠定了基础,为药用真菌多糖资源的研究提供了数据支持[17-18]。

