基于中西医病因特点的射血分数保留性心力衰竭小动物模型建立分析
钟森杰 李静 杨梦 黄淑敏 李琳 胡志希 胡思远

〔摘要〕 射血分數保留性心力衰竭(heart failure with preserved ejection fraction, HFpEF)的发病率逐年上升,成为心力衰竭的主要患病形式,但其病理机制尚未明确,目前缺乏有效治疗方案。通过合理模拟临床病因,以复制出稳定可靠的HFpEF病证一体化模型,是开展HFpEF中西医基础研究的前提。基于HFpEF的中西医病因病机特点,概述现有HFpEF及其中医证候模型的建立方法,探讨不同方法的优势与局限,阐明发展思路。HFpEF建立方法主要涉及主动脉缩窄或高血压引发的心室压力超负荷、心肌缺血损伤、糖尿病心肌损伤等。其中,主动脉缩窄所致的压力超负荷模型为优先选择,但存在每类模型仅反映HFpEF部分特征或仅代表整体病程某一阶段的局限;证候建立方法主要涉及HFpEF辨证与额外施加“证”的致病因素,两类方法相互矛盾且各自具有一定局限。据此提出多种西医病因共同作用以联合诱导HFpEF、施加中医病因应遵循HFpEF证候本质、合理把握病证发生的时间窗等发展思路,以期促进HFpEF病证一体化模型的有效建立。
〔关键词〕 射血分数保留性心力衰竭;啮齿类动物;动物模型;舒张功能障碍;病证一体化;病因
〔中图分类号〕R256.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.005
Modeling the small animal with HFpEF based on etiological characteristics of
Chinese and western medicine
ZHONG Senjie1,2, LI Jing1, YANG Meng1, HUANG Shumin1, LI Lin1, HU Zhixi1*, HU Siyuan1*
1. Diagnostic Institute of Hunan University of Chinese Medicine, Changsha, Hunan 410208, China;
2. The First Hospital of Guangzhou University of Chinese Medicine, Guangzhou, Guangdong 510405, China
〔Abstract〕 The incidence of heart failure with preserved ejection fraction (HFpEF) is increasing year by year and HFpEF has become the main form of heart failure. However, its pathological mechanism remains unclear, and there is no effective treatment scheme at present. It is the premise of basic studies on HFpEF in Chinese and western medicine to replicate a stable and reliable integrated pattern-disease model of HFpEF by reasonably simulating clinical etiology. Based on the etiology and pathogenesis characteristics of HFpEF in Chinese medicine and western medicine, this paper summarized the existing establishment methods of HFpEF and its TCM pattern model, explored the advantages and limitations of different methods, and clarified the development ideas. The establishment of HFpEF mainly involved ventricular pressure overload caused by aortic coarctation or hypertension, myocardial ischemia injury, diabetic myocardial injury, and the others. Among them, the pressure overload model caused by aortic coarctation was preferred, but each model type only reflected partial characteristics of HFpEF or only represented a certain stage of the overall disease course. The methods of pattern establishment mainly involved HFpEF pattern differentiation and the pathogenic factors of additional pattern. The two methods were contradictory and each had certain limitations. Therefore, it is proposed that various western medicine etiologies should act together to induce HFpEF, and the application of TCM etiology should follow the essence of HFpEF pattern and control the time window of disease occurrence reasonably, thus enabling to establish the integrated HFpEF disease-pattern model.
〔Keywords〕 heart failure with preserved ejection fraction; rodents; animal model; diastolic dysfunction; integration of disease and pattern; etiology
心力衰竭(heart failure, HF)是心脏结构或功能异常导致心室充盈或射血能力受损的一种复杂临床综合征,为多种心血管疾病的终末阶段[1]。目前的HF指南根据左室射血分数(left ventricular ejection fraction, LVEF),将HF主要分为两大类,即射血分数下降的HF(heart failure with reduced ejection fraction, HFrEF)与射血分数保留的HF(heart failure with preserved ejection fraction, HFpEF)[2]。流行病学调查数据显示,HFpEF约占HF患病人数的50%,并随老龄化趋势而升高,成为HF患病的主要形式[3]。HFpEF的病理机制尚未完全明确,目前缺乏行之有效的治疗策略,并由此带来的高发病率、高死亡率,使其成为心血管领域的研究重点[4]。
中医药治疗HF具有独特的优势,研究人员将愈来愈多的目光聚集于中医药领域。中医药应用于HFpEF的基础研究日趋增多,动物模型是HF基础研究的重要载体,啮齿类小动物模型(大鼠、小鼠)因实验开展便利、成本低廉、适合大规模运用等特性,是制作HF模型最为常用的动物种属[5]。在稳定的HFpEF小动物模型基础上,进一步建立符合临床实际的中医证候模型,是开展HFpEF中医药基础研究的首要前提,有助于深入阐明HFpEF病理机制与探求药物疗效机制[6]。本文查阅相关研究文献,对HFpEF的中西医病因病机、现有小动物模型与模型证候本质进行概述,探讨不同模型建立思路的优势、局限,以及与临床实际的吻合程度,阐明发展思路,旨在为HFpEF病证结合模型的合理建立提供新思路。
1 HFpEF病因病机分析
1.1 现代医学病因病机
HFpEF具有HF的常见临床表现特征,如心脏结构异常、心肌纤维化、呼吸困难、肢体水肿等,但大多数HFpEF患者出现的左心室向心性重构截然不同于HFrEF的偏心性重构,同时LVEF无显著改变或轻度下降,主要病理特点为静息或压力下心室舒张功能障碍[7]。导致心室舒张功能障碍的因素众多,如钙离子复位延缓、心室顺应性减退、心室充盈障碍、心室舒张势能减弱等,高血压、肥厚型或浸润性心肌病、冠心病、心律失常等心血管疾病与代谢综合征、糖尿病、慢性阻塞性肺疾病等心外疾病均可引发心室舒张功能障碍[8-9]。由此可见,HFpEF的病因复杂,诱发HFpEF的基础性疾病多样且相互间差异性大。
现阶段有观点认为高血压与冠心病是HFpEF的独立危险因素,其中高血压更是血管疾病相关HFpEF的重要病因[10]。一项研究发现,高血压人群较血压正常人群具有更高的HF发病率[11]。高血压引发HFpEF的病理机制较为明确,血压升高与外周阻力增加将加重心室后负荷,直接引发心室向心性肥厚与心室重构,伴随肾素-血管紧张素系统激活,促进心肌纤维化,心室顺应性下降,并最终导致舒张功能障碍[12]。此外,尽管冠心病對HFpEF发病的影响较小,但冠心病引起的心肌缺血和动脉血管损伤亦是导致舒张功能障碍的重要因素[13]。
1.2 中医学病因病机
根据临床症状与体征,中医学将HF归为“心悸”“水肿”“心水”“心胀”等范畴,现已规范命名为心衰病。中医学对HF的病因病机已形成较为统一的认识,即为本虚标实之证,心气、心阴、心阳虚衰为发病之本,瘀血、痰浊、水饮停聚为发病之标,病位以心为主,但也与五脏密切相关[14]。舒张功能障碍是多种因素共同作用的慢性病理过程,饮食失常、情志内伤、年老体衰、劳累过度、久病耗伤、感受外邪等诸多因素,均可损伤心之气血阴阳,致血行不利或水饮停聚,脏腑功能衰退而发为心衰病[15]。
值得注意的是,HFpEF虽具有HF的共性特征,但在病理机制与临床表现上又异于HFrEF,两者的中医病因病机必然有所区别。大量HF病因病机研究因纳入HFrEF患者,故其结论并不完全适用于HFpEF。HFpEF病情较HFrEF轻,发病也较早,其病机应为HF早中期的本虚为主或标本并重。总体而言,中医学仍缺乏对HFpEF病因病机特异性的深入探讨,也未能实现HFpEF与HFrEF病因病机的细化区分。近年来,有学者进行了前瞻性探索,基于证素分布规律的研究发现,HFpEF以气虚或阴虚为本,水停、血瘀、痰浊为标,气虚水停证为主要证型[16-17]。
2 HFpEF小动物模型的建立方法概述
2.1 压力超负荷型
压力超负荷型HFpEF模型的建立原理在于增加心脏负荷,多兼具血压升高,使心脏长期负荷过载,常以心肌肥厚作为主要代偿机制,逐步引发心室重构、心肌纤维化等,终致舒张功能下降而出现HFpEF[18]。压力超负荷是建立HFpEF模型的常用方法,具体方法概述如下。
2.1.1 主动脉缩窄 主动脉缩窄的原理是通过特殊器具缩窄主动脉直径,造成血流阻力升高并加重心室后负荷,以此建立HFpEF。根据缩窄部位分为主动脉弓缩窄(transverse aortic constriction, TAC)与腹主动脉缩窄(constriction of the abdominal aorta, AAC)。
TAC模型贴近临床上因主动脉狭窄而致HF的病理特点,该模型手术方法成熟,已形成较统一的共识:研究动物品系多选用雄性C57BL/6小鼠,将主动脉弓缩窄为26G(0.46 mm)或27G针头(0.41 mm)外径大小,术后2周出现左心室向心性肥厚、收缩功能代偿性增强、舒张功能损伤,术后4~8周发展为失代偿阶段[19-20]。缩窄程度决定TAC模型的病理改变严重与否和失代偿期的发生时间。研究发现27G针头模型比26G针头模型具有更严重的心功能障碍与心肌纤维化,存活率更低[20]。C57BL/6系小鼠对压力负荷的心脏反应较理想,故大量研究优先使用该动物品系[21]。近年来,亦有研究对常用的SD或Wistar大鼠行TAC术,探索建立TAC大鼠模型的可行性,结果发现大鼠模型同样可模拟“代偿性心室肥大-失代偿性HF”病理过程,其病理特点与小鼠模型存在共性,但大鼠模型的病理进程与失代偿期略晚于小鼠模型,行TAC术3周以后发生心肌肥厚,术后约9周出现失代偿表现[22-23]。
AAC模型的缩窄部位多为大鼠双侧肾动脉分支上方,缩窄方法与TAC术相似,造成腹主动脉缩窄50%~60%,以增加外周循环阻力,术后4周为高血压心室肥厚阶段,术后8周HF模型成模率达70%以上,逐步进入失代偿期[24-25]。TAC小鼠模型所需时间短,模型成功率高,但传统TAC术需要打开胸廓与气管插管,高难度的手术操作致使模型死亡率也相对较高,AAC术的操作难度与动物损伤则要低于TAC术[26]。近年有研究探索非开胸式的TAC术,有效降低模型死亡率[27]。TAC与AAC模型均具有时间依赖性特点,即HFpEF的形成是逐步进展,但随长期的心室扩张与心功能障碍,模型可能会收缩功能损伤而发展为HFrEF,模型亦存在一定局限[28]。
2.1.2 自发性高血压 此模型对动物品系有特殊要求,选用由遗传基因调控的自发性高血压大鼠(spontaneously hypertensive rats, SHR)。SHR的高血压自发率可达100%,无需特殊技术干预即可模拟人类原发性高血压与高血压性心血管病的病理过程,模型首先出现持续性高血压,随后发展为进展性心室肥厚,后期引发舒张功能障碍而成HFpEF模型[29]。此模型的建立方法亦存在显著局限,即模型建立周期长,HFpEF的成模时间不定,目前的研究文献未形成统一结论[30]。高血压性HF多发于老年人群,采用老龄SHR更能贴近人类的病理状态,且性别也是重要的影响因素,有研究发现,雄性SHR在15~18个月龄阶段出现心室扩张、舒张功能障碍、红细胞超氧化物增多等病理表现[31]。
2.1.3 盐敏感性高血压 此类模型的建立方法有醋酸脱氧皮质酮(deoxycorticosterone acetate, DOCA)盐敏感与Dahl盐敏感。其中Dahl盐敏感大鼠对盐高度敏感,其高血压形成机制与高盐负荷下的肾功能障碍相关,模型所患高血压属低肾素盐敏感型高血压,肾功能不全是影响该模型病理进展的重要因素[32]。Dahl盐敏感性高血压模型在造模过程中定量饲养高NaCl含量饲料,12周时可出现舒张功能障碍、舒张末期容积下降,16周以后进入失代偿阶段,LVEF维持在正常范围[33]。DOCA盐敏感模型的操作则相对复杂,首先切除单侧肾脏,随后皮下给予DOCA,并结合高盐饮食或溶液灌胃,可持续发展为HFpEF。已有研究证实,小鼠在术后11~14 d出现高血压与舒张功能障碍,且无收缩功能障碍[34-35]。Dahl盐敏感模型特点与SHR相似,操作方法简便,且造成HFpEF的时间节点更明确,但周期长。而DOCA盐敏感模型的舒张功能障碍进展极为迅速,周期虽短,但不适用于高血压发展至HFpEF的慢性病理过程。
2.2 心肌缺血型
當因各种因素造成心肌缺血时,可致心室松弛性减低或心肌僵硬度升高,伴随炎症、水肿等病理变化,最终可引发HFpEF。心肌缺血是舒张功能不全的重要因素之一,故引发心肌缺血损伤亦是HFpEF模型的建立方法。
2.2.1 注射异丙肾上腺素 异丙肾上腺素作为非选择性β肾上腺素受体激动剂,大剂量可造成心肌组织急性供血不足,诱导心肌缺血缺氧,已广泛应用于建立心肌缺血损伤模型。对大鼠或小鼠采用腹腔注射或皮下注射或泵植入等干预方式,旨在激动心肌细胞β1受体,心肌细胞强烈收缩,心脏耗氧与负荷上升而引发缺血损伤,所造模型的心肌缺血与酶学病变特点贴近于临床的急性心肌梗死[36-37]。有研究探索每日皮下注射2.5 mg/kg的方式,约4周可成HFpEF模型[38]。此方法通过不同的注射方式、剂量、周期等因素,还可应用于建立心肌肥厚、心肌梗死等模型,受诸多因素限制而发生HFpEF的时间窗具有不稳定性。
2.2.2 冠状动脉微栓塞 通过微创介入方法栓塞冠状动脉,阻断心肌供血,可导致慢血流或无复流现象,引发冠状动脉储备减少与心肌缺血病变,进而损伤心功能,建立原理与冠状动脉结扎类似[39]。现阶段的冠状动脉微栓塞HF模型多建立在猪、羊、犬等大型动物上,小动物模型仍在不断探索中,且造成微栓塞的方法多样。有研究在阻断大鼠升主动脉的同时向左心室注射同源血栓微颗粒,术后2周出现明显的微梗死、心肌细胞凋亡、心功能降低与左室扩张,收缩功能虽受损,但LVEF仍高于50%[40]。
2.3 糖尿病心肌病型
糖尿病明显增加HF的发生风险,心血管并发症是糖尿病患者死亡的主要原因之一[41]。糖尿病过程中出现的糖脂代谢失衡、胰岛素抵抗、氧化应激增加、炎症等病理反应,对心肌具有多重损伤效应,可诱导心室重构与舒张功能障碍,引发HFpEF,糖尿病导致的HFpEF多见于糖尿病心肌病的早中阶段[42-43]。目前应用较广泛的造模方法为以下两种。
2.3.1 链脲佐菌素诱导 链脲佐菌素对某些种属动物的胰岛β细胞具有选择性破坏作用,通过单次较大剂量或多次小剂量的给药方式可建立Ⅰ型或Ⅱ型糖尿病模型。在链脲佐菌素干预大鼠10周后,出现左心室肥厚、舒张功能不全、收缩功能受损,但LVEF维持在正常范围[44]。高糖高脂膳食可诱导胰岛素抵抗与糖脂代谢紊乱,另有研究将高糖高脂膳食与小剂量链脲佐菌素诱导相结合,12周后出现心室肥厚与舒张功能障碍[45]。
2.3.2 瘦素受体缺陷 此模型需采用特殊的db/db瘦素受体缺乏小鼠,该鼠种敲除了Leptin受体基因,可自发病理性肥胖,并伴随继发于Ⅱ型糖尿病的高血糖,常应用于探讨肥胖和糖尿病对HFpEF的共同作用[46]。有研究发现db/db小鼠在5个月龄以后出现HFpEF,表现为心脏结构和功能损伤,氧化应激增加,舒张功能障碍,而LVEF保持正常[47]。
2.4 其他建立方法
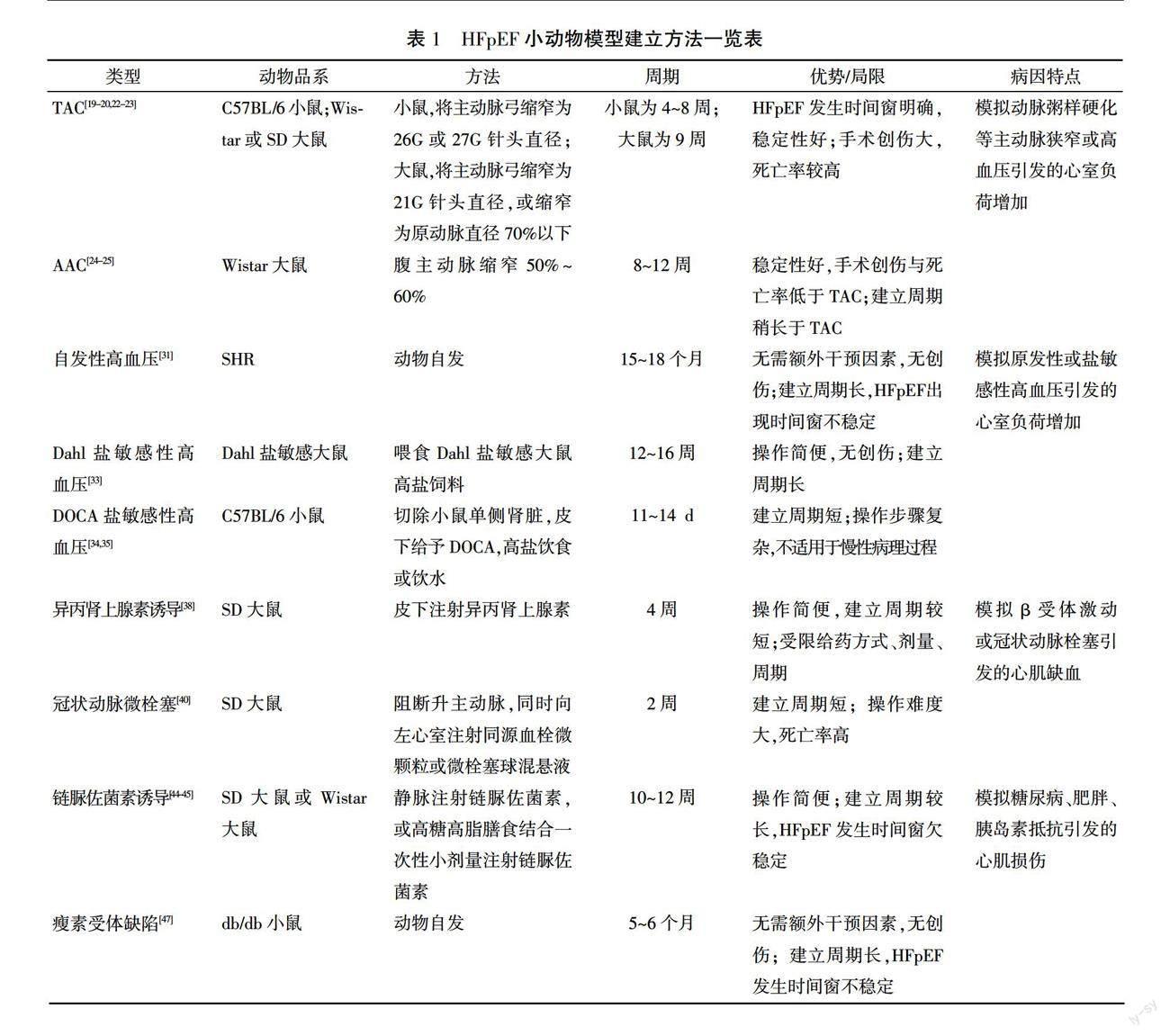
除上述较为常用的建立方法外,目前的研究人员亦进行了诸多创新性探索,如自发性衰老、血管紧张素Ⅱ诱导、心房起搏诱导、肾血管性高血压等,以及高血压合并糖尿病、高血压合并高血脂等复合型建立方法[48]。这些方法对于建立HFpEF模型的意义值得更为深入探讨。HFpEF小动物模型建立方法详见表1。
3 HFpEF小动物模型的中医证型建立方法概述
病证结合是中医药基础研究的重要指导原则,故在稳定的HFpEF模型基础上,模拟中医病因或探索模型证候本质,从而建立HFpEF与中医学“证”共存的病证一体化模型,具有重要意义。本课题组已撰文论述病证结合模型建立的两类基本思路,即病因型(施加病因因素以诱导特定的“证”)或辨证型(通过合理评价以检验模型未知的“证”)[49-51]。基于上述两类研究思路,概述HFpEF小动物模型的中医证型建立方法。
3.1 气虚血瘀证
目前的大量HFpEF模型均涉及血压升高诱导的心室后负荷增加。有观点认为高血压是导致舒张功能障碍的重要因素,舒张功能不全与心气虚损存在密切关联,心气虚衰则致血行不畅,气虚血瘀证又为高血压致舒张功能障碍的主要证型[52]。一项基于宏观表征、行为学、心功能指标的客观评价研究发现,TAC模型术后4周持续存在气虚证候要素,并于术后8~12周发展为气虚血瘀证,与前文观点相一致[53-54]。另一项基于方药疗效反证的前瞻性研究有相同发现,在TAC模型的失代偿HFpEF阶段,活血化瘀法的疗效显著且优于益气养阴法与益气温阳法,验证模型与血瘀状态具有高度相关性,但益气法与活血法联用的干预效应仍待探讨[55]。学术界普遍认为左冠状动脉前降支结扎法制作的HF模型较好地体现气虚血瘀证特点[56-57],而关于HFpEF模型与气虚血瘀证的关系则知之甚少,上述研究证据认为TAC模型在某一阶段与气虚血瘀证确有关联。
3.2 气阴两虚证
心气虚衰为HF发病的始动因素,随病程发展可进而损及阴阳,而出现心气阴虚或心阳气虚。一项关于高血压致HF患者的中医证候分型规律研究发现,气阴两虚证亦是主要证型之一[58]。这一规律亦在动物实验中得到证实。两项关于益气养阴法与益气温阳法对HFpEF模型的疗效对比研究发现,无论是盐敏感性高血压模型,还是AAC模型,益气养阴法均展现出显著疗效,且优于益气温阳法,推测两类模型属气阴两虚证[59-60]。气阴两虚证多见于HF的早中期,与舒张功能障碍的发生时间节点相符合,现有动物研究证据也佐证两者间的内在联系。
3.3 阳虚证
心体阴而用阳,心阳虚衰是导致心功能减退的重要因素,HF进展中往往伴随畏寒肢冷、脉沉弱等虚寒之象。故对动物模型施加可导致阳气虚衰的病因因素,以模拟阳气损伤的病理过程,亦是主要研究思路之一。在AAC术所致的HFpEF模型基础上,将动物每日定时冷藏于低温冰柜中,持续4周以上,模拟“寒邪伤阳”的病理过程,以此建立阳虚证模型[61-62]。此类“寒邪伤阳”的模拟方法是致动物阳气虚损的经典研究思路,应用较为广泛,同样适用于HFrEF模型或HF以外的其他疾病模型。
3.4 其他证型
由前文可知,心之气、血、阴、阳异常是HFpEF证候模型建立的切入点。HFpEF由多种基础病发展而来,可能兼具基础病的病机特点,近年亦有学者根据基础病的病机特点建立证候模型,进行了诸多创新探索。如湿热证为2型糖尿病的常见证型,有研究在db/db小鼠糖尿病模型的基础上,通过高脂饮食结合湿热环境的复合因素建立湿热证模型,持续10周直至心脏舒张功能减退[63]。另有研究发现晚期SHR符合肝肾阴虚证的证候特点,但暂未结合心功能进行探讨[64]。上述有益探索为HFpEF模型的建立提供新思路。
HFpEF小动物模型的中医证型建立方法详见表2。
4 模型建立方法分析与展望
4.1 HFpEF建立方法分析
HFpEF的病因与发病机制复杂多变,其动物模型的建立方法亦呈现多样化。当前HFpEF小动物模型的建立思路,在于精确控制可引发心脏舒张功能障碍的风险因素,如高血压导致心室压力超负荷、心肌缺血损伤、糖尿病心肌损伤等,从而模拟临床实际的发病过程。其中,高血压诱发HFpEF的病理机制较明确,且贴近临床调查结果,故目前应用最为普遍的是血压升高导致的心室压力超负荷模型[65]。基于模型的稳定性考虑,TAC是优先选择,其所造模型的可重复性好、个体间差异小,发生HFpEF的时间节点明确且可通过调整缩窄程度把控,但有较高技术要求,手术创伤亦是不可忽视的干扰因素。基于方法的操作性考虑,Dahl盐敏感性高血压、异丙肾上腺素诱导亦是理想选择,两类方法的操作简便可控,有效避免因技术差异所导致的误差。但Dahl盐敏感性高血压的周期较长,异丙肾上腺素诱导原理与抑制心脏功能有关,且受剂量、周期、注射方式影响而稳定性欠佳。此外,糖尿病心肌病、自发性高血压、冠状动脉微栓塞等方法虽存在成模时间不稳定或技术难度大等局限,而应用于HFpEF的研究较少,但均立足于不同的发病机制角度,模拟不同基础病发展至HFpEF的病理过程,具有各自的病理变化侧重点而更具针对性。
现阶段的HFpEF模型建立存在两个亟须注意的关键要点,每类模型仅反映了HFpEF的部分特征,或仅代表了HF病程的某一阶段。一方面,HFpEF并非为上述建立方法的最终结局,而是整体病理过程的某一阶段,即阶段性结局,如TAC模型等大部分HFpEF模型会伴随心室扩张、收缩功能障碍进展为HFrEF[66]。而且同一方法不同条件下(如TAC术的不同缩窄程度)的舒张功能障碍出现时间会有所差异,故HFpEF发生的时间窗把握极为重要,模型成功后也应定期测定心功能以确保仍处于HFpEF阶段。另一方面,每类模型均具有独特的发病特点、病理过程,每一模型仅能从一个或数个侧面模拟HFpEF的部分病理特点。现有技术条件下,某些驱动舒张功能障碍的遗传或环境因素仍难以在动物中复现。當然,一种动物模型涵盖HFpEF所有病因与特征是不现实的,并不存在普遍适用的最佳模型,应综合考虑研究方案以选择适用方法。临床中HFpEF往往与多种基础病或并发症共存,近年有研究探索了压力超负荷联合高脂饮食等复合因素法[67-68]。与单一因素致病比较,这一思路更符合HFpEF的复杂发病机制,也更贴近老龄化HFpEF的基础病多、并发症多等特点,涵盖更多病理变化而适用范围更广泛。多种因素如何协同作用以合理诱发HFpEF,是今后的重要命题。
4.2 中医证型建立方法分析
以稳定合理的HFpEF模型为前提,施加病因制作证候或合理评价检验证候,是建立HFpEF病证一体化模型的主要思路,当前以辨证型思路应用模型更广,其中又以方药疗效反证最为常用。尽管临床四诊方法无法套用于小动物,但仍可通过某些动物外在表征与可量化的行为学、心功能、心脏结构等指标,或以方药疗效为依据的反证法,从中管窥出各HFpEF模型的潜在证候。现阶段的HFpEF模型辨证研究较少,集中于压力超负荷型模型,而缺乏对其他模型尤其是自发性模型的探讨。从当前结果而言,本虚以气虚或气阴两虚为主,标实以血瘀为主,压力超负荷模型的证候特点与临床中高血压致HF的证型分布规律较契合[58]。即使同属压力超负荷模型,不同方法所制模型也存在证型差异,如基于方药疗效反证的研究结果显示,益气养阴法对TAC模型与盐敏感性高血压模型展现出不一致的疗效反应。提示造模方法、病理阶段的异质性可影响HFpEF证候本质,不同方法建立的同类型模型存在显著的内环境差异,难以将舒张功能障碍或血压升高等微观特征必然等同于某一证候,这也与中医学“同病异证”理论具有趋同性。此外,由于HFpEF与证候的动态发展性,合理的时间窗选择同样重要[69]。
病因型與辨证型的建立思路各有优势与局限。病因型因施加“证”的致病因素,会使证候表现更显著突出,但存在主观偏向性;辨证型从疾病中探索证候而更具客观性,但在某些动物表现评价、方药选择等方面的可信度仍存争议[70]。纵览两类思路在HFpEF模型的应用,相互之间可见矛盾之处,即病因型多建立阳虚证,未与辨证型所探讨的气阴两虚证或气虚血瘀证相一致,而是另有目的建立另一证候。“病”与“证”本质上是中西医学体系对同一病理状态的不同角度认知,只要模型存在客观病理变化,即可能有相关的证候特征表达。概括而言,疾病模型上的“证”,可能已自发形成而无须额外病因。若某类HFpEF模型确实存在自身特有的证候特征,此时施加额外病因,且所制证候非HFpEF本质证候,则可导致“两证共存”。鉴于两类思路均有一定局限性,故将两类思路有机结合、优势互补,应是重要发展方向。笔者以TAC模型为例提出设想:现已探索TAC模型在某一时间窗与血瘀证密切关联,故可在此基础上施加血瘀证的致病因素,以使证候特征更显著,即遵循模型证候本质施加病因,这一思路也可为各类病证结合模型提供借鉴。
参考文献
[1] 王洁妤,华 琦.左心室射血分数保留的心力衰竭研究进展[J].中华老年心脑血管病杂志,2016,18(7):766-769.
[2] WRITING COMMITTEE MEMBERS, YANCY C W, JESSUP M, et al. 2013 ACCF/AHA guideline for the management of heart failure: A report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines[J]. Circulation, 2013, 128(16): e240-e327.
[3] CHO D H, YOO B S. Current prevalence, incidence, and outcomes of heart failure with preserved ejection fraction[J]. Heart Failure Clinics, 2021, 17(3): 315-326.
[4] YOUN J C, AHN Y, JUNG H O. Pathophysiology of heart failure with preserved ejection fraction[J]. Heart Failure Clinics, 2021, 17(3): 327-335.
[5] 郝佳梦,王丹东,集川原,等.射血分数保留型心力衰竭发病机制及治疗进展[J].世界中医药,2021,16(11):1679-1684.
[6] 李小茜,何建成.充血性心力衰竭中医证候动物模型研究思考[J].中国实验动物学报,2020,28(6):831-836.
[7] DRAZNER M H. Insights from the history and physical examination in HFpEF or HFrEF: Similarities and differences[J]. JACC Heart Failure, 2021, 9(5): 398-400.
[8] 张 军,王 晖,史春芳,等.2型糖尿病合并慢性心力衰竭病性要素与病程的Logistic回归分析[J].中医药导报,2021,27(7):118-121.
[9] 王丽蓉,谢盈彧,陈馨浓,等.基于“血-脉-心-神”一体观辨治射血分数保留性心力衰竭[J].中华中医药杂志,2020,35(8):3957-3961.
[10] 李新立.射血分数保留的心力衰竭伴高血压患者管理中国专家共识[J].中华高血压杂志,2021,29(7):612-617.
[11] LLOYD-JONES D M, LARSON M G, LEIP E P, et al. Lifetime risk for developing congestive heart failure: The framingham heart study[J]. Circulation, 2002, 106(24): 3068-3072.
[12] LEE C J, PARK S. Hypertension and heart failure with preserved ejection fraction[J]. Heart Failure Clinics, 2021, 17(3): 337-343.
[13] AHMAD A, CORBAN M T, TOYA T, et al. Coronary microvascular dysfunction is associated with exertional haemodynamic abnormalities in patients with heart failure with preserved ejection fraction[J]. European Journal of Heart Failure, 2021, 23(5): 765-772.
[14] 陈 勇,王 洁,杨 彤,等.心衰病中西医研究进展[J].陕西中医,2022,43(1):134-136.
[15] 王 静,朱海燕,赵明镜,等.从“气、血、水”三因素探讨心衰合并利尿剂抵抗[J].湖北中医药大学学报,2023,25(1):55-58.
[16] 王艳霞,张 艳.谈心力衰竭津液代谢障碍的中医思辨[J].湖北中医药大学学报,2020,22(1):48-51.
[17] 努力帕尔·再丁,熊 双,董国菊.射血分数保留的心力衰竭病人中医证候特征初探[J].中西医结合心脑血管病杂志,2020,18(23):4014-4017.
[18] MOORE-MORRIS T, GUIMAR?魨ES-CAMBOA N, YUTZEY K E, et al. Cardiac fibroblasts: From development to heart failure[J]. Journal of Molecular Medicine, 2015, 93(8): 823-830.
[19] 谭伟江,李 想,郑 双,等.压力超负荷心衰小鼠模型的心脏结构和功能病理进程特征[J].中国实验动物学报,2020,28(5):583-592.
[20] RICHARDS D A, ARONOVITZ M J, CALAMARAS T D, et al. Distinct phenotypes induced by three degrees of transverse aortic constriction in mice[J]. Scientific Reports, 2019, 9(1): 5844.
[21] BOSCH L, DE HAAN J J, BASTEMEIJER M, et al. The transverse aortic constriction heart failure animal model: A systematic review and meta-analysis[J]. Heart Failure Reviews, 2021, 26(6): 1515-1524.
[22] KE Q J, LIU F, TANG Y X, et al. The protective effect of isosteviol sodium on cardiac function and myocardial remodelling in transverse aortic constriction rat[J]. Journal of Cellular and Molecular Medicine, 2021, 25(2): 1166-1177.
[23] 鐘森杰,熊霞军,张 倩,等.主动脉弓缩窄术建立心力衰竭大鼠模型的病理过程观察与非靶向代谢组学分析[J].中国实验方剂学杂志,2022,28(9):117-124.
[24] 胡咏梅,李法琦,罗羽慧,等.腹主动脉缩窄大鼠模型制作及临床意义[J].重庆医科大学学报,2004,29(3):322-324.
[25] 王瑞芳,何昆仑,杨 泉,等.压力负荷诱导的大鼠舒张性心力衰竭模型的建立[J].中华保健医学杂志,2009,11(2):92-95,171.
[26] KU H C, LEE S Y, WU Y A, et al. A model of cardiac remodeling through constriction of the abdominal aorta in rats[J]. Journal of Visualized Experiments, 2016(118): 54818.
[27] LIU B L, LI A Q, GAO M, et al. Modified protocol for a mouse heart failure model using minimally invasive transverse aortic constriction[J]. STAR Protocols, 2020, 1(3): 100186.
[28] RIEHLE C, BAUERSACHS J. Small animal models of heart failure[J]. Cardiovascular Research, 2019, 115(13): 1838-1849.
[29] TANG Y, MI C J, LIU J K, et al. Compromised mitochondrial remodeling in compensatory hypertrophied myocardium of spontaneously hypertensive rat[J]. Cardiovascular Pathology, 2014, 23(2): 101-106.
[30] 高 可,杨 蕾,姚新叶,等.射血分数保留性心力衰竭动物模型的研究进展[J].心血管病学进展,2020,41(8):834-838.
[31] CHAN V, FENNING A, LEVICK S P, et al. Cardiovascular changes during maturation and ageing in male and female spontaneously hypertensive rats[J]. Journal of Cardiovascular Pharmacology, 2011, 57(4): 469-478.
[32] YOSHIMOTO M, ONISHI Y, MINEYAMA N, et al. Renal and lumbar sympathetic nerve activity during development of hypertension in dahl salt-sensitive rats[J]. Hypertension, 2019, 74(4): 888-895.
[33] KLOTZ S, HAY I, ZHANG G P, et al. Development of heart failure in chronic hypertensive Dahl rats: Focus on heart failure with preserved ejection fraction[J]. Hypertension, 2006, 47(5): 901-911.
[34] SILBERMAN G A, FAN T H, LIU H, et al. Uncoupled cardiac nitric oxide synthase mediates diastolic dysfunction[J]. Circulation, 2010, 121(4): 519-528.
[35] 许 涵,王琼英,杨米娜,等.四氢生物蝶呤通过蛋白激酶Cε途径对醋酸脱氧皮质酮-盐型高血压小鼠左心室舒张功能的影响[J].中华高血压杂志,2015,23(3):245-251.
[36] DEVIKA P T, STANELY MAINZEN PRINCE P. Protective effect of (-)-epigallocatechin-gallate (EGCG) on lipid peroxide metabolism in isoproterenol induced myocardial infarction in male Wistar rats: A histopathological study[J]. Biomedicine & Pharmacotherapy, 2008, 62(10): 701-708.
[37] ZHANG X J, TAN H, SHI Z F, et al. Growth differentiation factor 11 is involved in isoproterenol?induced heart failure[J]. Molecular Medicine Reports, 2019, 19(5): 4109-4118.
[38] 罗时珂,李 萍,程晓曙.异丙肾上腺素诱导慢性心力衰竭大鼠模型的建立[J].重庆医学,2012,41(4):352-354.
[39] SCHMITTO J D, COSKUN K O, COSKUN S T, et al. Hemodynamic changes in a model of chronic heart failure induced by multiple sequential coronary microembolization in sheep[J]. Artificial Organs, 2009, 33(11): 947-952.
[40] LI S M, FANG J, CHEN L L. Pyrrolidine dithiocarbamate attenuates cardiocyte apoptosis and ameliorates heart failure following coronary microembolization in rats[J]. Balkan Medical Journal, 2019, 36(4): 245-250.
[41] RAJBHANDARI J, FERNANDEZ C J, AGARWAL M, et al. Diabetic heart disease: A clinical update[J]. World Journal of Diabetes, 2021, 12(4): 383-406.
[42] GRUBI■ ROTKVI■ P, PLANINI■ Z, LIBERATI PR?譒O A M, et al. The mystery of diabetic cardiomyopathy: From early concepts and underlying mechanisms to novel therapeutic possibilities[J]. International Journal of Molecular Sciences, 2021, 22(11): 5973.
[43] 佟紅娜,张晨阳,韩美欣,等.糖尿病心肌病的发病机制及药物干预研究进展[J].中国实验方剂学杂志,2022,28(2):257-265.
[44] JOFFE I I, TRAVERS K E, PERREAULT-MICALE C L, et al. Abnormal cardiac function in the streptozotocin-induced non-insulin-dependent diabetic rat: Noninvasive assessment with Doppler echocardiography and contribution of the nitric oxide pathway[J]. Journal of the American College of Cardiology, 1999, 34(7): 2111-2119.
[45] 董世芬,洪 缨,孙建宁,等.实验性糖尿病心肌病大鼠模型建立及心脏功能和结构相关性分析[J].中国实验动物学报,2010,18(6):457-462,432.
[46] 陈 军,陈小林.射血分数保留的心力衰竭动物模型研究进展[J].中华心力衰竭和心肌病杂志,2021,5(3):206-209.
[47] JUN M R, PATEL V B, ABO ALROB O, et al. Angiotensin 1-7 ameliorates diabetic cardiomyopathy and diastolic dysfunction in db/db mice by reducing lipotoxicity and inflammation[J]. Circulation Heart Failure, 2014, 7(2): 327-339.
[48] CONCEI■?魨O G, HEINONEN I, LOUREN■O A P, et al. Animal models of heart failure with preserved ejection fraction[J]. Netherlands Heart Journal, 2016, 24(4): 275-286.
[49] 钟森杰,李 静,李 琳,等.病证结合动物模型研究思路述评[J].中国中医药信息杂志,2021,28(8):141-144.
[50] 钟森杰,李 静,李 琳,等.证候动物模型的构建思路与评价方法述评[J].时珍国医国药,2021,32(3):712-714.
[51] 钟森杰,李 琳,胡思远,等.中医病因型证候模型建立的思考[J].中国中医基础医学杂志,2022,28(2):310-314.
[52] 崔晓云,范文英,周 鹍,等.从益气活血论治高血压心脏舒张功能障碍[J].环球中医药,2015,8(11):1404-1406.
[53] 廉洪建,于 雪,郑 磊,等.后负荷增加所致心力衰竭模型小鼠气虚证评价[J].中国中西医结合杂志,2018,38(5):594-597.
[54] 廉洪建.主动脉弓缩窄术制备小鼠心力衰竭模型的中医证候评价研究[D].北京:北京中医药大学,2015.
[55] 钟森杰,熊霞军,张 倩,等.基于“方证对应”理论探讨主动脉弓缩窄致心力衰竭大鼠模型的中医证型与代谢标志物[J].中国实验方剂学杂志,2022,28(16):130-139.
[56] 冯玄超,郭淑贞,武志黔,等.慢性心力衰竭模型大鼠气虚血瘀证相关信息的评价[J].中华中医药杂志,2014,29(5):1563-1567.
[57] 李琪琳,胡元会,霍艳明,等.曲美他嗪干预气虚血瘀证心衰大鼠心肌线粒体蛋白质组学研究[J].世界科学技术-中医药现代化,2018,20(11):2001-2007.
[58] 李万芳,陈守强.高血压致慢性心力衰竭中医证型危险因素的Logistic分析[J].世界中医药,2019,14(5):1330-1334.
[59] 贺泽龙,郭振球.参附液和参麦液对实验性心衰大鼠血流动力学和心肌β受体影响的比较研究[J].中国中医基础医学杂志,2003,9(5):36-38.
[60] 李欣春,梁 昊,胡志希,等.高血压心衰大鼠证候本质及药物干预研究[J].湖南中医药大学学报,2018,38(8):853-857.
[61] 王大伟,杨 喆,严 夏.温阳救心方对阳虚型慢性心衰大鼠心功能的影响[J].中药新药与临床药理,2011,22(4):410-414.
[62] 杨 喆,柴洪佳,王大伟.阳虚型慢性心力衰竭SD大鼠模型的制备及指标判定[J].中西医结合心脑血管病杂志,2016,14(14):1593-1596.
[63] 余洁英,林育浩,周凤华,等.葛根芩连汤对糖尿病湿热型小鼠心脏舒张功能的影响[J].中国中药杂志,2022,47(10):2705-2711.
[64] 吴智春,于华芸,季旭明,等.晚期自发性高血压大鼠肝肾阴虚证候特征评价[J].中国中医药信息杂志,2016,23(3):58-61.
[65] BRENES-CASTRO D, CASTILLO E C, V?譧ZQUEZ-GARZA E, et al. Temporal frame of immune cell infiltration during heart failure establishment: Lessons from animal models[J]. International Journal of Molecular Sciences, 2018, 19(12): 3719.
[66] RESPRESS J L, VAN OORT R J, LI N, et al. Role of RyR2 phosphorylation at S2814 during heart failure progression[J]. Circulation Research, 2012, 110(11): 1474-1483.
[67] TAN W S, MULLINS T P, FLINT M, et al. Modeling heart failure risk in diabetes and kidney disease: Limitations and potential applications of transverse aortic constriction in high-fat-fed mice[J]. American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2018, 314(6): R858-R869.
[68] RAHER M J, THIBAULT H B, BUYS E S, et al. A short duration of high-fat diet induces insulin resistance and predisposes to adverse left ventricular remodeling after pressure overload[J]. American Journal of Physiology Heart and Circulatory Physiology, 2008, 295(6): H2495-H2502.
[69] 李玉波,于 眉,李君玲,等.方剂反证在构建病证结合动物模型中的作用:以逍遥散反证抑郁症肝郁脾虚证为例[J].中国实验方剂学杂志,2021,27(23):44-50.
[70] 梁茂新,范 穎.中医证和病证结合动物模型研制的利弊与症结[J].世界科学技术-中医药现代化,2013,15(7):1656-1664.
〔收稿日期〕2022-11-16
〔基金项目〕国家自然科学基金项目(82274412,81774208);湖南省自然科学基金项目(2020JJ4062,2020JJ5408)。
〔第一作者〕钟森杰,男,博士,在站博士后,研究方向:心血管疾病证本质与诊治规律研究。
〔通信作者〕*胡思远,男,博士,讲师,E-mail:6484808@qq.com;胡志希,男,博士,教授,博士研究生导师,E-mail:003405@hnucm.edu.cn。

