不同抗寒性小麦品种生长点发育进程及生理指标差异分析
刘 畅,杜羽晨,李宁辉,陆霄光,赵 烈,付连双,刘 鑫,刘 君,王晓楠
(东北农业大学农学院,黑龙江哈尔滨 150030)
低温是限制冬小麦生长的主要逆境胁迫因素之一[1]。冬小麦的抗寒性是遗传与环境因子相互作用的结果,不同品种的抗寒能力有所差异。中国高寒地区冬季寒冷漫长,导致冬小麦无法安全越冬。东农系列小麦品种的育成,为高寒地区开展冬小麦高产育种提供了优良的抗寒材料[2]。筛选抗寒性强的冬小麦品种,可丰富高寒地区抗寒种质资源。
小麦生理指标的变化更能直观地反映小麦品种的抗寒性。刘艳阳等[3]采用室内低温冷冻法处理双单倍体群体的133个株系,发现幼苗叶片中丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性可作为小麦抗寒性鉴定的理化指标。姜丽娜等[4]通过测定小麦拔节期低温胁迫下叶片的生理指标,发现可溶性糖、脯氨酸和MDA含量以及过氧化物酶(POD)活性可作为小麦拔节期抗寒性鉴定的评价指标。小麦的生长点分化状态影响其抗寒性,小麦生长点分化包括营养生长阶段和生殖生长阶段。生长点伸长是小麦通过春化阶段的标志[5-6]。黄淮麦区冬小麦生长点在越冬阶段的分化进程一般在二棱期[7],但寒地冬小麦在越冬过程中生长点的分化状态尚不清楚,且抗寒性不同的小麦品种之间生长点分化进程和生理指标的差异也有待探索。
本研究在大田条件下种植抗寒性不同的3个小麦品种,调查越冬期小麦生长点的分化进程,并检测相对电导率、叶绿素荧光参数、MDA含量以及SOD、POD和过氧化氢酶(CAT)活性的变化,以期明确小麦生长点分化进程对其抗寒性的影响,为抗寒性小麦品种的选育提供参考。
1 材料与方法
1.1 试验材料
供试材料为抗寒性不同的3个小麦品种,分别为东北农业大学农学院小麦研究所育成的强抗寒性冬小麦品种东农冬麦1号(在高寒地区越冬返青率高于80%)、山东省农科院育成的在黄淮麦区主推的弱抗寒性冬小麦品种济麦22号(在高寒地区越冬返青率低于40%)和不抗寒性春小麦品种中国春(在高寒地区越冬返青率低于20%)。
1.2 试验设计
试验材料于2019年9月10日种植在黑龙江省哈尔滨市东北农业大学校内试验基地。试验采用随机区组设计,3次重复,小麦行长3 m,行距30 cm,5行区,种植密度均为200万株·hm-2。郑 维等[8]提出,白天温度在0 ℃以上,晚间温度在-2 ℃以下,日平均温度低于10 ℃,土壤表面成昼消夜冻的状态,即为低温驯化阶段;环境最高温度在0 ℃以下,则为封冻阶段。根据本试验期间哈尔滨市的气温变化情况,分别于2019年10月10日(生长期)、11月1日(驯化期)、11月20日(封冻期)取样,进行相关指标的测定,封冻前记录每个品种的植株数,于次年4月下旬记录每个品种的返青成活植株数并计算返青率。返青率=返青成活植株数/封冻前植株数×100%。2020年种植时间、种植方式及返青率调查同2019年。
1.3 测定项目及方法
1.3.1 植株外部形态特征及生长点分化进程的观察
于2019和2020年生长期、驯化期和封冻期,随机从大田中选取5株小麦样品,水洗后用滤纸吸干水分,取主茎分蘖节,参照Guo等[9]的方法剥取生长点后,利用Olympus-DP电子显微镜进行观察,拍照记录生长点的分化状态。
1.3.2 相对电导率的测定
参照高京草等[10]和邹 琦[11]的方法测定相对电导率,略作改动。具体方法:于2019和2020年生长期、驯化期和封冻期,选取长势一致的5株小麦,水洗后用滤纸吸干水分,用打孔器取0.2 g小麦叶片样品,置于去离子水中,真空泵抽15 min,用电导率仪测定其电导率值(S1)。然后放入沸水浴中20 min,样品冷却后再次测量其电导率(S2)。相对电导率=S1/S2×100%。
1.3.3 MDA含量及抗氧化酶活性的测定
取2020年生长期、驯化期和封冻期的小麦叶片和分蘖节,采用硫代巴比妥酸(TBA)法[12]测定MDA含量;采用NBT还原法[13]测定SOD活性;参考Wei等[14]的方法测定POD活性,参考豆昕桐等[15]的方法测定CAT活性。
1.3.4 叶绿素荧光参数的测定
于2020年生长期、驯化期和封冻期,使用便携式调制叶绿素荧光仪PAM-2500进行叶绿素荧光参数的测定,每次测定均选取植株完全展开的新叶中间部位,叶片经暗适应30 min后进行初始荧光(Fo)测定,打开饱和脉冲进行最大荧光(Fm)测定,根据所测数据计算可变荧光(Fv=Fm-Fo)和PSⅡ最大量子产额(Fv/Fm)。每个处理3次重复。
1.4 数据处理
采用SPSS Statistics进行数据处理,采用Excel 2016和Adobe Photoshop制作图表。
2 结果与分析
2.1 不同抗寒性小麦品种的返青率
从表1可以看出,中国春和济麦22在2020年的返青率均为0,在2021年的返青率分别为15.28%和35.62%;而强抗寒品种东农冬麦1号在2020和2021年的返青率均在98%以上。说明3个品种的抗寒性差异明显。

表1 抗寒性不同的3个小麦品种的越冬返青率Table 1 Overwintering survival rate of the three varieties with different cold resistance
2.2 不同抗寒性小麦品种的分蘖节生长点分化进程
从图1可以看出,2019年中国春和济麦22在生长期时,其生长点均已分化进入二棱期,而东农冬麦1号的生长点在封冻期仍处于单棱期。2020年三个品种在生长期时,生长点均处于单棱期,但中国春和济麦22的生长点在封冻期已进入二棱期,而东农冬麦1号的生长点在封冻期仍处于单棱期,说明越冬过程中,东农冬麦1号的生长点分化明显滞后于济麦22和中国春。

DM1:东农冬麦1号;JM22:济麦22;CS:中国春。图2~7同。DM1: Dongnongdongmai 1; JM22: Jimai 22; CS: Chinese Spring. The same in figures 2-7.图1 3个小麦品种的分蘖节生长点分化进程Fig. 1 Growth point differentiation process of the three varieties with different cold resistance
2.3 不同抗寒性小麦品种叶片的相对电导率
相对电导率可衡量细胞电解质的外渗状况,反映细胞膜受伤害的程度[16]。从图2可以看出,2019和2020年田间小麦叶片的相对电导率趋势一致,从生长期至封冻期,叶片的相对电导率均呈现出逐渐上升的变化趋势。2019年在生长期和驯化期,3个品种的相对电导率差异均不显著;而在封冻期,东农冬麦1号的相对电导率均显著低于中国春和济麦22(图2A)。2020年在生长期和驯化期,东农冬麦1号的相对电导率显著低于中国春和济麦22;而在封冻期,3个品种的相对电导率差异不显著(图2B)。

同一时期图柱上不同字母表示不同品种间在0.05水平上差异显著。图3~7同。Different letters above the columns at the same stage indicate significant differences among different varieties at 0.05 level. The same in figures 3-7.图2 不同时期3个小麦品种的相对电导率Fig. 2 Relative electrical conductivity of the three wheat varieties at different stage
2.4 不同抗寒性小麦品种的MDA含量
MDA是膜脂过氧化产物,可反映植物受逆境伤害的程度[17]。从图3可以看出,东农冬麦1号叶片中MDA含量从生长期至封冻期无明显变化,而其分蘖节中MDA含量以及中国春和济麦22叶片和分蘖节中MDA含量从生长期至封冻期均呈逐渐升高的变化趋势。叶片中,3个时期中国春的MDA含量均显著高于济麦22和东农冬麦1号,且生长期、驯化期济麦22和东农冬麦1号之间的MDA含量差异均不显著,封冻期东农冬麦1号的MDA含量显著低于济麦22(图3A)。分蘖节中,生长期和驯化期3个品种的MDA含量差异均不显著,封冻期东农冬麦1号的MDA含量显著低于中国春和济麦22(图3B)。

图3 不同时期3个小麦品种的MDA含量(2020)Fig. 3 MDA content of the three wheat varieties at different stages (2020)
2.5 不同抗寒性小麦品种的抗氧化酶活性
植物在遭受低温胁迫时体内会产生并积累活性氧,从而破坏植物结构与功能。SOD、POD、CAT是植物体内重要的活性氧清除酶[18]。从图4 可以看出,3个小麦品种叶片和分蘖节中SOD活性从生长期至封冻期均呈逐渐降低的变化趋势。叶片中,生长期和封冻期3个小麦品种的SOD活性均无显著差异;驯化期东农冬麦1号的SOD活性显著高于济麦22和中国春,且济麦22与中国春差异不显著(图4A)。分蘖节中,生长期3个品种的SOD活性差异不显著;驯化期东农冬麦1号的SOD活性显著低于中国春和济麦22,且中国春和济麦22差异不显著;封冻期东农冬麦1号的SOD活性显著高于济麦22,但与中国春差异不显著(图4B)。
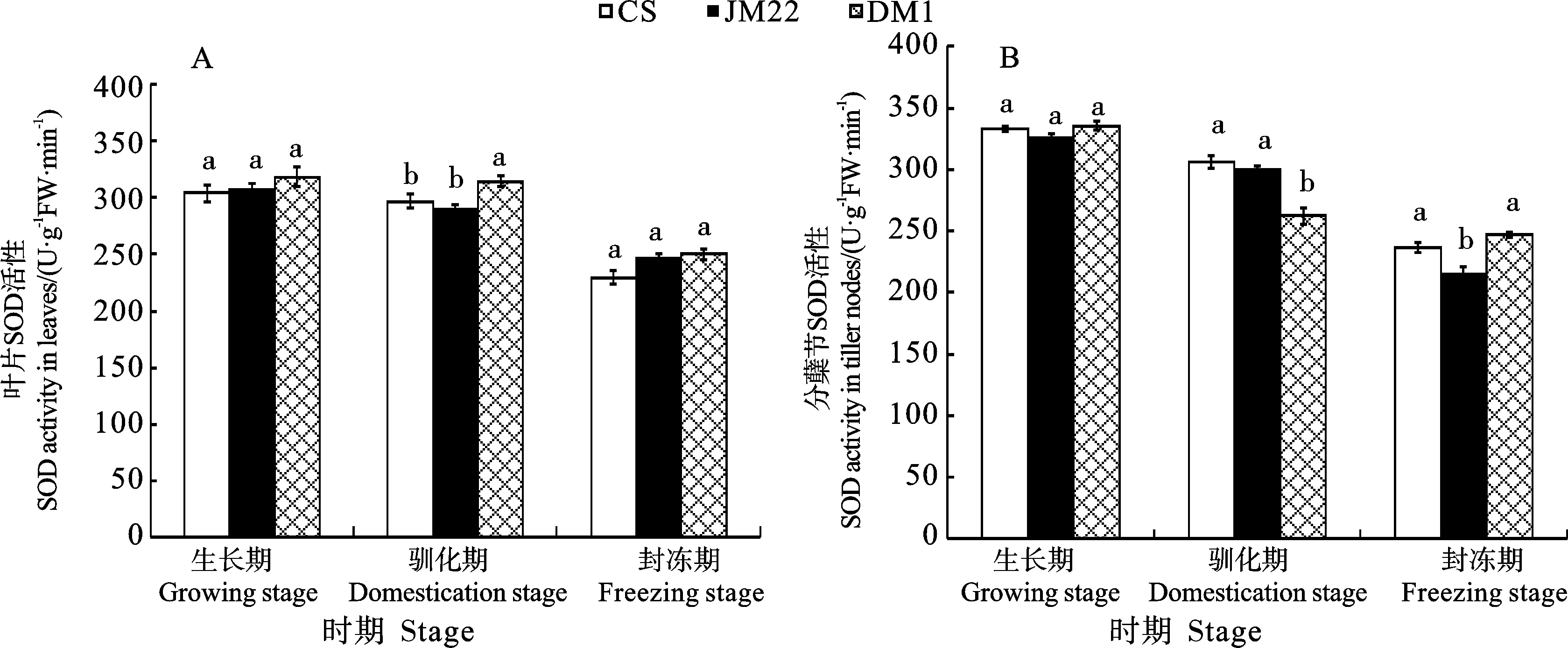
图4 不同时期3个小麦品种的SOD活性(2020)Fig.4 SOD activity of the three wheat varieties at different stages (2020)
从图5可以看出,3个小麦品种叶片中POD活性从生长期至封冻期总体上均呈逐渐升高的变化趋势;分蘖节中POD活性变化趋势则表现不一致,中国春呈先升高后降低的变化趋势,而济麦22和东农冬麦1号呈先降低后升高的变化趋势。

图5 不同时期3个小麦品种的POD活性(2020)Fig.5 POD activity of the three wheat varieties at different stages (2020)
叶片中,3个时期东农冬麦1号的POD活性均显著高于中国春和济麦22,在生长期和封冻期济麦22的POD活性显著高于中国春,而在驯化期两个品种间差异不显著(图5A)。分蘖节中,生长期和驯化期东农冬麦1号的POD活性显著低于中国春,但与济麦22差异不显著;封冻期东农冬麦1号的POD活性显著高于中国春和济麦22,且中国春的POD活性显著高于济麦22(图5B)。
从图6可以看出,3个小麦品种叶片和分蘖节中CAT活性从生长期至封冻期均呈逐渐升高的变化趋势。叶片中,生长期和驯化期3个小麦品种的CAT活性差异均不显著;封冻期东农冬麦1号的CAT活性显著高于中国春和济麦22,且济麦22显著高于中国春(图6A)。分蘖节中,生长期东农冬麦1号的CAT活性显著高于中国春,但与济麦22差异不显著;驯化期和封冻期东农冬麦1号的CAT活性均显著高于中国春和济麦22,且封冻期济麦22的CAT活性显著高于中国春,而驯化期两品种间差异不显著(图6B)。
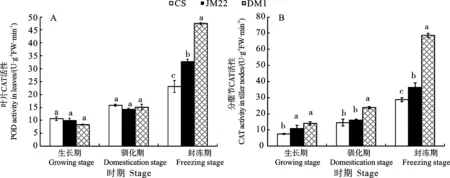
图6 不同时期3个小麦品种的CAT活性(2020)Fig. 6 CAT activity of the three wheat varieties at different stages (2020)
2.6 不同抗寒性小麦品种的叶绿素荧光参数
叶绿素荧光参数是衡量非生物胁迫下植物光合生理状态的有效指标[19-20]。从图7A可以看出,中国春和济麦22叶片的F0从生长期至封冻期均呈先降低后升高的变化趋势,而东农冬麦1号则呈先升高后降低的变化趋势。生长期和封冻期济麦22的F0显著高于中国春和东农冬麦1号,且中国春和东农冬麦1号之间无显著差异;驯化期东农冬麦1号的F0显著高于中国春和济麦22,且中国春和济麦22之间差异不显著。从图7B可以看出,中国春和济麦22叶片的Fm从生长期至封冻期均呈逐渐降低的变化趋势,而东农冬麦1号则呈先升高后降低的变化趋势。生长期和封冻期济麦22的Fm显著高于中国春和东农冬麦1号,且生长期中国春显著高于济麦22,而封冻期两个品种间差异不显著;驯化期东农冬麦1号的Fm显著高于中国春和济麦22,且济麦22显著高于中国春。从图7C可以看出,3个小麦品种叶片的Fv/Fm从生长期至驯化期总体上均呈逐渐降低的变化趋势。生长期3个品种的Fv/Fm差异不显著;驯化期东农冬麦1号的Fv/Fm显著低于中国春和济麦22,且中国春和济麦22之间差异不显著;封冻期东农冬麦1号的Fv/Fm显著高于中国春,但与济麦22之间差异不显著。

1:生长期; 2:驯化; 3:封冻封。1:Growing stage; 2:Domestication stage; 3:Freeezing stage.图7 不同时期3个小麦品种的叶绿素荧光参数(2020)Fig. 7 Chlorophyll fluorescence parameter of the three wheat varieties at different stages (2020)
3 讨论
越冬期和返青期是冬小麦能否安全越冬和产量形成的关键时期,对该时期小麦的生长点分化进程和生理指标进行检测,可为小麦的抗寒性鉴定提供一定的理论基础[21]。低温可导致小麦体内相对电导率、生长点分化进程、抗氧化酶活性以及叶绿素荧光参数发生变化,进而影响翌年的返青率。本研究发现,2020年济麦22和中国春的返青率比2019年有所提高,且济麦22的返青率增幅较大。2019年济麦22和中国春的生长点分化进程较快,生长期时其生长点已分化至二棱期;在2020年其生长点分化进程较慢,在封冻期时仍处于二棱期,而2019和2020年封冻期时东农冬麦1号的生长点仍处于单棱期。说明东农冬麦1号的生长点分化进程较慢,能够安全度过越冬期,从而保证翌年的返青率。
相对电导率是反映植物组织受冻后细胞原生质膜透性的重要指标,且电导率越高植株受损越严重[22]。本研究中2019和2020年3个品种的相对电导率从生长期至封冻期均呈逐渐升高的变化趋势。但2020年变化幅度较2019年小,推测这与2020年雪层覆盖较厚有关,且研究结果也显示,连续2年抗寒品种东农冬麦1号的相对电导率增幅均低于中国春和济麦22。前人研究发现,低温胁迫下,植物体内会产生大量的活性氧自由基,引发膜脂过氧化[23],产生膜脂过氧化产物丙二醛(MDA),且膜脂过氧化的程度随温度降低和胁迫时间延长而加重[24]。本研究中,封冻期东农冬麦1号的MDA含量均显著低于济麦22和中国春,表明抗寒品种的膜脂过氧化程度较低。随着负积温的不断增加,MDA的含量整体表现为上升趋势,即超氧阴离子的含量超出抗氧化保护系统的清除能力,细胞膜不能够修复低温对细胞膜的损害,细胞膜脂质过氧化产物增多[25]。为了保护细胞免受活性氧自由基的毒害,植株形成了酶保护机制[26],抗氧化酶活性的增加可以减轻低温对生物膜的损伤[27]。分蘖节是冬小麦安全越冬的关键部位,本研究中,封冻期小麦POD、CAT的活性均明显高于生长期,且东农冬麦1号的增幅大于济麦22和中国春,分蘖节的增幅也大于叶片。这进一步证明东农冬麦1号的抗寒性优于济麦22和中国春。这与前人对东农冬麦1号的抗寒生理特性研究结果一致[28-29]。
叶绿素荧光参数也是抗寒性鉴定的重要指标之一,被称为测定叶片光合功能快速、无损伤的探针,能较好地反映植株生长以及受胁迫时的生理状况[30]。Fv/Fm是指没有遭受环境胁迫并经过暗适应的植物叶片PSⅡ最大光化学效率,是植物潜在的最大光合能力[31]。高等植物的Fv/Fm在0.75~0.85之间,在逆境条件下迅速下降[31]。本研究中,生长期3个品种的Fv/Fm值均在0.70~0.75之间,驯化期Fv/Fm值均有所下降,表明此时叶片已经遭受低温胁迫,但下降趋势不明显;进入封冻期后Fv/Fm迅速降低,济麦22和东农冬麦1号分别是0.45和0.42,显著高于中国春(0.35)。说明封冻期东农冬麦1号和济麦22的Fv/Fm仍能保持较高水平。这与张 娅等[32]的研究结果一致。

