七氟醚后处理通过调节FTO/KCNJ2对缺氧/复氧所致心肌细胞损伤的保护作用*
邓方方, 李继勇, 张 力, 邹高锐, 陈治军, 乐 薇
华中科技大学同济医学院附属武汉市中西医结合医院,武汉市第一医院 1麻醉科 2针灸科,武汉 430022
心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)指的是缺血的心肌在恢复灌注时其结构被进一步破坏甚至出现心肌梗死范围扩大等现象,对患者预后造成严重影响[1-2]。探索MIRI中的分子机制对揭示其复杂病理机制,提高MIRI患者生存率具有重要意义。
在临床实践中,七氟醚作为一种吸入麻醉剂已被广泛应用,已发现七氟醚可在体内外诱导缺血耐受[3],然而七氟醚对心肌细胞的保护作用及潜在机制仍有待进一步研究。N6-甲基腺苷(m6A)是真核生物中最常见的mRNA修饰,研究表明m6A甲基化与心脏功能的维持密切相关[4]。脂肪和肥胖相关蛋白(fat mass and obesity-associated protein,FTO)是一种RNA去甲基化酶,也被称为“擦除蛋白”,已有研究表明FTO在老年小鼠缺血性心脏中表达降低[5]。另外,FTO也被发现能够促进Yes相关蛋白1(Yes-associated protein 1,YAP1)的稳定性进而改善缺氧/复氧(hypoxia/reoxgenation,H/R)诱导的心肌细胞损伤[6]。内向整流型钾离子通道亚家族J成员2(potassium inwardly rectifying channel subfamily J member 2,KCNJ2)以往被证实在MIRI中表达下调[7],但是其在MIRI中的机制仍有待进一步探讨。
本研究通过构建MIRI细胞模型,探究七氟醚在MIRI中的具体机制,揭示七氟醚/FTO/KCNJ2通路在MIRI中发挥的可能作用。
1 实验方法
1.1 仪器与试剂
人心肌细胞系AC16购自中国科学院(上海)细胞库。DMEM培养液(货号PM150210B)购自武汉普诺赛生命科技有限公司。七氟醚购自上海阿拉丁生化科技股份有限公司。MTT细胞增殖及细胞毒性检测试剂盒(货号C0009S)购自上海碧云天生物技术有限公司。乳酸脱氢酶(LDH)检测试剂盒(货号A020-2-2)购自南京建成生物工程研究所。Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒(货号40302ES20)和核糖体RNA去除试剂盒(货号12253ES)购自翌圣生物科技(上海)股份有限公司。LipofectamineTM3000转染试剂(货号L3000015)购自北京诚聚德生物技术有限公司。FTO抗体(货号ab280081)、KCNJ2抗体(货号ab109750)、IgG抗体(货号ab205718)和m6A抗体(货号ab151230)购自英国Abcam公司。Trizol试剂(货号R1030)购自北京普利莱基因技术有限公司。cDNA合成试剂盒(货号YB-S052)购自上海钰博生物科技有限公司。SYBR Green Supermix(货号1725124)购自北京智杰方远科技有限公司。RIPA裂解液(货号P0013K)、BCA试剂盒(货号P0012)购自碧云天生物。放线菌素D购自Sigma公司。RIP免疫沉淀试剂盒购自Millipore。CytoFLEX流式细胞仪购自贝克曼库尔特国际贸易(上海)有限公司。SpectraMax M5e多功能酶标仪购自美谷分子仪器(上海)有限公司。ABI 7000型定量PCR仪购自苏州亚凡生物技术有限公司。
1.2 生物信息学分析
在基因表达综合数据库(Gene Expression Omnibus,GEO)(https://www.ncbi.nlm.nih.gov/gds/)获取MIRI相关数据集GSE160516,分析4例假手术组及12例MIRI大鼠心肌组织中的差异表达基因,差异筛选条件为adj.P.Value<0.05和|Log FoldChange|>1。通过DAVID数据库对GSE160516芯片中差异表达基因做GO分析。在SRAMP网站(http://www.cuilab.cn/sramp)预测KCNJ2的m6A修饰位点。RPISeq网站(http://pridb.gdcb.iastate.edu/RPISeq/)预测KCNJ2和FTO的结合。
1.3 细胞培养及H/R损伤模型建立
将AC16细胞置于37℃细胞培养箱培养,分为Control组(空白对照组,以含10%胎牛血清的DMEM培养液在95%空气和5% CO2混合气体条件下培养);H/R组:将细胞置于缺氧室(含95% N2和5% CO2)中以无血清DMEM培养液培养3 h,之后将无血清DMEM培养液更换为含10%胎牛血清的DMEM培养液,在95%空气和5% CO2的条件下复氧处理3 h;七氟醚组:接受上述H/R处理,并在复氧前以97.6% O2和2.4%七氟醚处理20 min。
1.4 细胞转染
设计并合成FTO和KCNJ2的小干扰RNA(si-FTO,si-KCNJ2),以各自的阴性对照si-NC作为对照。使用qRT-PCR扩增KCNJ2的互补DNA(cDNA)序列,将cDNA克隆至pcDNA3.1载体上,构建KCNJ2的过表达载体(pcDNA3.1-KCNJ2),以空载体(pcDNA3.1)为对照。AC16细胞在37℃、5%CO2的DMEM培养液中培养,直到细胞达到90%融合,使用LipofectamineTM3000将上述siRNA或载体转染至AC16细胞,48 h后进行相应处理,并采用qRT-PCR检测转染效率。
1.5 MTT法检测细胞活力
将处理后的AC16细胞接种在48孔板(1×105个细胞/孔)中。将10 μL MTT试剂添加至各孔中,37℃孵育4 h后弃去培养上清液,每孔加入100 μL Formazan溶解液,混匀后孵育直至Formazan全部溶解。使用多功能酶标仪记录570 nm处的吸光度(A570nm)值。
1.6 微板法检测LDH的释放
将处理后的AC16细胞接种于96孔板(2×104个细胞/孔)中。在收集细胞上清液后,在测定孔中添加20 μL待测样本、25 μL基质缓冲液和5μL辅酶Ⅰ,其余各孔依据试剂盒说明书进行添加,各孔混匀后在37℃温浴15 min。各孔分别添加25 μL 2,4-二硝基苯肼,混匀后在37℃温浴15 min。各孔分别添加250 μL NaOH溶液,混匀后在室温下静置5 min,在450 nm处测定吸光度值。
1.7 流式细胞术检测细胞凋亡率
收集处理后的AC16细胞,300×g,4℃离心5 min,用预冷的PBS洗涤2次,吸弃PBS,加入100 μL 1×Binding buffer重悬细胞,加入5 μL Annexin Ⅴ-FITC和10 μL PI混匀,避光反应15 min,加入400 μL 1×Binding buffer,混匀后置于冰上,在1 h内使用流式细胞仪分析细胞凋亡率。
1.8 实时荧光定量PCR(qRT-PCR)
使用Trizol试剂提取总RNA。使用第一链cDNA合成试剂盒将1 μg总RNA合成cDNA。随后,使用SYBR Green Supermix在ABI 7000型定量PCR仪上进行qRT-PCR。反应体系包括12.5 μL SYBR Green Supermix,上下游引物各1 μL,DNA模板2 μL和双蒸水8.5 μL。反应程序为:95℃ 3 min,95℃ 5 s,60℃ 1 min,共40个循环。采用2-ΔΔCt法计算基因的相对表达水平。引物序列为:FTO正向5′-ACCTATGCTGACCATTCCAA-G-3′,反向5′-CTGTTGGTTCAGAAGGCTCTC-3′;KCNJ2正向5′-AGCACAATTCCAAAGGATGG-3′,反向5′-ATTGCGGGGAACTCTACCTT-3′;GAPDH正向5′-TGACCACAGTCCATGCC-ATCAC-3′,反向5′-GCCTGCTTCACCACCTTC-TTGA-3′。
1.9 蛋白免疫印迹实验(Western blot)
RIPA裂解液裂解细胞,PBS冲洗、离心后借助BCA试剂盒测定蛋白浓度,行SDS-PAGE聚丙烯酰胺凝胶电泳,电泳电压80 V转120 V,采用湿转移法100 V恒压转膜,时间为30~60 min,之后采用5%脱脂奶粉封闭1 h,加入一抗FTO(1∶1000)、KCNJ2(1∶1000),孵育过夜后PBS冲洗,加入对应的二抗IgG(1∶2000)并在室温条件下孵育1 h,洗膜后行ECL显影、定影后借助Image J软件测定蛋白浓度。
1.10 RNA结合蛋白免疫沉淀(RNA binding protein immunoprecipitation,RIP)
RIPA裂解缓冲液对心肌细胞进行裂解,之后将FTO抗体、m6A抗体和IgG抗体与A/G琼脂糖珠在4℃孵育2 h。总RNA与IP缓冲液中的抗体一起孵育,然后洗脱沉淀RNA。采用qRT-PCR进行定量分析。
1.11 放线菌素D(Actinomycin D,Act D)测定KCNJ2 mRNA的稳定性
将心肌细胞接种在96孔板中(每孔1×105个细胞)常规培养。24 h后向培养细胞中添加2 μg/mL的Act D,并在3、6 h收集细胞,使用qRT-PCR分析未与Act D结合的KCNJ2 mRNA水平来判定RNA稳定性,该水平与0 h的检测水平做标准化。
1.12 统计学方法
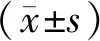
2 结果
2.1 七氟醚后处理减轻H/R后心肌细胞损伤
如图1A所示,与Control组相比,H/R组细胞活力下降,而七氟醚组细胞活力较H/R组升高(均P<0.01)。此外,H/R组细胞LDH的释放增加(P<0.01),而七氟醚后处理降低了LDH释放水平(P<0.05,图1B)。H/R组的细胞凋亡率较Control组显著升高(P<0.01),而七氟醚组凋亡率较H/R组降低(P<0.01,图1C、1D)。上述结果表明七氟醚后处理可有效减轻H/R诱导的心肌细胞损伤。

1:Control组,2:H/R组,3:七氟醚组;A:MTT法检测细胞活力;B:LDH释放量检测;C~D:流式细胞术检测细胞凋亡;与Control组比较,**P<0.01;与H/R组比较,#P<0.05 ##P<0.01 图1 七氟醚后处理提高H/R处理心肌细胞的存活率并减轻损伤和凋亡Fig.1 Sevoflurane postconditioning improves survival rate of H/R-treated cardiomyocytes,and attenuates cell injury and apoptosis
2.2 生物信息学分析结果
GSE160516中的差异表达基因如图2A所示。本研究将重点放在284个在MIRI中下调的基因上,对下调基因进行GO富集分析。在生物过程分析结果中发现,KCNJ2富集在3个心脏相关通路中,因此选择KCNJ2进行分析(图2B)。对H/R组AC16细胞中KCNJ2的表达进行检测,发现相对于Control组,H/R组细胞KCNJ2的表达量降低,而七氟醚处理后,经过H/R处理的AC16细胞KCNJ2的表达增强(均P<0.01)(图2C、2D)。

1:Control组,2:H/R组,3:七氟醚组;A:GSE160516芯片差异表达基因火山图;B:MIRI中下调基因的GO分析结果;C:H/R处理的AC16细胞中KCNJ2 mRNA的表达情况;D:H/R处理的AC16细胞中KCNJ2的蛋白表达;与Control组比较,**P<0.01;与H/R组比较,##P<0.01图2 七氟醚后处理对H/R心肌细胞中KCNJ2表达的调节Fig.2 Regulation of KCNJ2 expression in H/R cardiomyocytes by sevoflurane postconditioning
2.3 敲减KCNJ2抑制七氟醚后处理对H/R心肌细胞的保护作用
MTT实验结果显示,相对于Control组,H/R组细胞的活力显著降低,七氟醚处理后H/R细胞活力增强;而相对于七氟醚+si-NC组,七氟醚+si-KCNJ2组的细胞活力降低(图3A)。此外,七氟醚能够抑制H/R诱导的心肌细胞LDH释放和细胞凋亡,但这一作用也可被转染si-KCNJ2逆转(图3B、3C)。上述结果提示敲减KCNJ2能够抑制七氟醚后处理对H/R心肌细胞的保护作用。

1:Control组,2:H/R组,3:七氟醚组,4:七氟醚+si-NC组,5:七氟醚+si-KCNJ2组;A:各组细胞活力;B:各组细胞LDH释放水平;C:各组细胞凋亡情况;与Control组比较,**P<0.01;与H/R组比较,##P<0.01;与七氟醚+si-NC组比较,△P<0.05 △△P<0.01 图3 敲减KCNJ2对七氟醚后处理的H/R心肌细胞的影响Fig.3 Effects of KCNJ2 knockdown on sevoflurane-treated H/R cardiomyocytes
2.4 FTO调控KCNJ2的表达
对KCNJ2在H/R诱导心肌细胞损伤中的机制进行探讨,借助SRAMP网站预测KCNJ2的m6A修饰情况,发现KCNJ2存在多个高可信度m6A修饰位点(图4A)。已被证实,FTO的表达下调能够增强其修饰基因的m6A甲基化,进而降低其修饰基因的稳定性。鉴于KCNJ2在H/R心肌细胞中表达下调且RPISeq网站分析提示FTO和KCNJ2存在较强结合分数,因此本研究推测FTO能够对KCNJ2的表达进行调控。RIP实验进一步验证了FTO和KCNJ2的结合(图4B)。进一步分析过表达FTO对KCNJ2表达的影响,结果显示,与Vector组比较,过表达FTO后(oe-FTO组)KCNJ2的m6A甲基化水平降低(P<0.01,图4C),KCNJ2的稳定性和蛋白表达量均提高(P<0.01,图4D、4E),证实FTO能够通过减少KCNJ2的m6A修饰进而增强其稳定性。对H/R心肌细胞中m6A和FTO的表达水平进行检测,结果显示,与Control组比较,H/R组m6A水平增加而FTO表达水平降低,加入七氟醚处理后,m6A水平下降而FTO表达提高(P<0.01,图4F、4G)。综上,七氟醚处理能够通过影响FTO的表达水平,进而对KCNJ2的表达进行调控,最终参与H/R诱导的心肌细胞损伤。
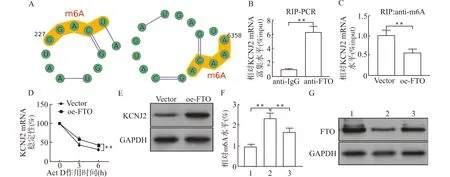
A:KCNJ2的m6A修饰位点预测结果;B:RIP检测FTO和KCNJ2的结合;C:过表达FTO对KCNJ2和m6A结合情况的影响;D:过表达FTO对KCNJ2 mRNA稳定性的影响;E:过表达FTO对KCNJ2蛋白表达的影响;F:各组细胞m6A水平检测结果,1:Control组,2:H/R组,3:七氟醚组;G:各组细胞中FTO蛋白表达;Vector:空载体,oe-FTO:FTO过表达载体;**P<0.01图4 FTO和KCNJ2的关系验证Fig.4 Verification of the relationship between FTO and KCNJ2
2.5 敲减FTO能够抑制七氟醚对H/R心肌细胞的保护作用且该作用可被KCNJ2过表达挽救
相对于七氟醚+si-NC组,七氟醚+si-FTO组的KCNJ2表达下调,细胞活力降低,LDH释放量和细胞凋亡率增加(均P<0.01),提示敲减FTO能够抑制七氟醚对H/R心肌细胞的保护作用。但相对于七氟醚+si-FTO+pcDNA3.1组,七氟醚+si-FTO+pcDNA3.1-KCNJ2组的细胞活力增强,LDH释放水平和细胞凋亡率降低(均P<0.05),提示过表达KCNJ2能够部分挽救si-FTO对七氟醚处理的H/R心肌细胞的影响。见图5。
3 讨论
本研究显示,在MIRI体外细胞模型中,七氟醚通过促进FTO/KCNJ2的表达,减轻H/R诱导的心肌细胞损伤,为七氟醚后处理改善MIRI的机制做出新的解释。
七氟醚作为吸入类麻醉药物的一种,近年来其对心肌损伤的保护作用不断被揭示,如有研究发现七氟醚对行冠状动脉旁路移植术的患者具有心肌保护作用,且2%七氟醚吸入的抗炎效果最佳[8]。动物及细胞实验也证实,七氟醚能够通过AMPK途径抑制由H/R引起的心肌细胞凋亡,从而在MIRI大鼠及细胞模型中发挥保护作用[9]。此外,七氟醚还可通过抑制PI3KC3介导的自噬减少H/R诱导的心肌细胞凋亡[10]。本研究为进一步阐明七氟醚对MIRI的保护作用机制,借助MIRI相关芯片筛选在MIRI中差异表达的基因,之后在表达下调基因中发现了KCNJ2,且KCNJ2被发现富集在3个心脏相关通路中。以往有研究表明KCNJ2表达的下调与心房颤动有关[11]。此外,KCNJ2功能的改变也被证实与遗传性心脏猝死综合征有关[12]。本研究发现,相对于Control组细胞,H/R组细胞中KCNJ2的表达降低,但加入七氟醚后其表达上调。此外,敲减KCNJ2能够抑制七氟醚对H/R诱导心肌细胞损伤的保护作用,提示上调KCNJ2可能对H/R诱导的心肌损伤发挥保护作用,这与Niu等[7]的研究结论一致。LDH是糖酵解酶的一种,其存在于机体的所有组织和细胞中,也是细胞损伤的一个重要标志物,当细胞损伤或者疾病发生的时候往往会出现LDH释放水平的升高,其也被常用于心肌梗死、心肌损伤等多种病理情况的监测[13-15]。

1:七氟醚+si-NC组,2:七氟醚+si-FTO组,3:七氟醚+si-FTO+pcDNA3.1组,4:七氟醚+si-FTO+pcDNA3.1-KCNJ2组;A:qRT-PCR检测各组KCNJ2的表达;B:MTT法检测细胞活力;C:LDH释放量检测;D~E:流式细胞术检测细胞凋亡;F:研究机制示意图;与七氟醚+si-NC组比较,**P<0.01;与七氟醚+si-FTO+pcDNA3.1组比较,#P<0.05 ##P<0.01 图5 过表达KCNJ2可部分挽救敲减FTO对七氟醚后处理的H/R心肌细胞的作用Fig.5 Overexpression of KCNJ2 partially reverses the effects of si-FTO on H/R myocardial cells after sevoflurane treatment
m6A修饰被证实影响多种疾病的进展,FTO是m6A系统中关键的去甲基化酶,当前已有研究表明FTO过表达对于保护H/R引起的心肌细胞损伤具有积极作用,如Shen等[16]发现FTO过表达可通过调节MHRT的m6A修饰进而抑制H/R导致的心肌细胞凋亡。此外,也有研究证实FTO能帮助维持钙稳态,改善H/R导致的心肌细胞能量代谢改变[17]。本研究为证实KCNJ2在H/R心肌细胞中低表达是否与m6A修饰有关,借助SRAMP预测了其m6A修饰位点,结果显示其存在多个m6A修饰位点,之后进一步借助RPISeq网站推测KCNJ2和FTO可能直接存在较强作用关系。鉴于以往研究提示FTO能够解除其修饰基因的甲基化进而增强其修饰基因的稳定性[6],我们推测KCNJ2在H/R诱导的心肌细胞中低表达或许与FTO表达下调有关。本研究首先通过RIP实验证实了FTO和KCNJ2可以相互结合,进一步研究表明相对于Control组,H/R心肌细胞中FTO的表达被抑制,而加入七氟醚处理后FTO的表达增加,这也进一步提示FTO在H/R诱导的心肌细胞中表达失调并且能够受七氟醚处理的影响。而过表达FTO后,KCNJ2的m6A修饰减少,KCNJ2的稳定性和表达增强;敲减FTO后KCNJ2的表达降低,进一步揭示了FTO对KCNJ2表达的调控作用可能是通过影响其m6A修饰水平而实现。功能实验进一步证明,在七氟醚后处理的H/R心肌细胞中敲减FTO能够抑制心肌细胞活力,增加LDH释放和凋亡,进而加重心肌细胞损伤;过表达KCNJ2后,这一情况部分改善,这也进一步揭示了FTO/KCNJ2参与七氟醚对H/R心肌细胞损伤的作用。
本研究也存在一定局限性,如未进一步探讨七氟醚调控FTO/KCNJ2轴参与H/R诱导的心肌损伤中可能影响的信号通路,未进一步做更多体内实验等,这也是我们后续需完善的方向。综上所述,本研究揭示了七氟醚后处理能够通过调节FTO/KCNJ2轴进而影响H/R诱导的心肌细胞损伤,联合七氟醚处理以及FTO/KCNJ2轴干预对于改善H/R导致的心肌损伤具有重要意义。

