耐热甘薯品种筛选及生理机理探析
施小梅

摘 要:為了筛选获得甘薯耐热品种,以4个优质甘薯品种为研究对象,将叶片耐热评价值、SPAD值、过氧化氢(H2O2)含量、丙二醛(MDA)含量、过氧化氢酶(CAT)活性以及抗坏血酸过氧化物酶(APX)活性作为耐热指标,对比35℃和40℃高温胁迫下 4个品种甘薯叶片各指标间的差异,探究高温胁迫对甘薯叶片生理及抗氧化酶活性的影响。结果表明:35℃高温胁迫下,4个品种甘薯叶片形态无明显变化,在 40℃高温胁迫下,龙薯116和莆薯23的叶片出现明显的失水卷曲,SPAD值较金山57和广薯87显著降低;叶片中产生的H2O2含量高达2.53 μmol·g-1和4.21 μmol·g-1,造成CAT以及APX的活性增强,且MDA含量较金山57和广薯87显著增加,高达10.06 nmol·g-1和14.94 nmol·g-1。综合评价,参试品种中广薯87为耐热性优秀的甘薯品种,金山 57 次之。研究结果可为甘薯种植产业提供耐热品种资源,为甘薯耐热品种的选育提供理论依据。
关键词:耐热甘薯品种;叶片;高温胁迫;生理;抗氧化酶
中图分类号:S 531 文献标志码:A 文章编号:0253-2301(2023)01-0037-06
DOI: 10.13651/j.cnki.fjnykj.2023.01.006
Screening and Physiological Mechanism Analysis of Heat-resistant Sweet Potato Varieties
SHI Xiao-mei
(Sanming Academy of Agricultural Sciences/Fujian Key Laboratory of Crop Genetic Improvement
and Innovation Utilization in Mountainous Areas, Sanming, Fujian 365509, China)
Abstract: In order to screen and obtain the heat-resistant varieties of sweet potato, four high-quality sweet potato varieties were used as the research objects. The heat resistance evaluation value, SPAD value, hydrogen peroxide (H2O2) content, malondialdehyde (MDA) content, catalase (CAT) activity and ascorbate peroxidase (APX) activity of leaves were used as the heat resistance indexes. Then, the effects of high temperature stress on the leaf physiology and antioxidant enzyme activity of sweet potatoes were investigated by comparing the differences of various leaf indexes of four varieties of sweet potatoes under the high temperature stress of 35℃ and 40℃. The results showed that there was no significant change in leaf morphology of the four sweet potato varieties under the high temperature stress of 35℃. Under the high temperature stress of 40℃, the leaves of Longshu 116 and Pushu 23 showed obvious water loss curl, and the SPAD value was significantly lower than that of Jinshan 57 and Guangshu 87. The content of H2O2 in leaves was as high as 2.53 nmol·g-1 and 4.21 nmol·g-1, which resulted in the increase of CAT and APX activity, and the content of MDA was significantly higher than that of Jinshan 57 and Guangshu 87, which were up to 10.06 nmol·g-1 and 14.94 nmol·g-1. According to the comprehensive evaluation, Guangshu 87 was the best sweet potato variety with excellent heat resistance in the the tested varieties, followed by Jinshan 57. The results could provide the heat-resistant variety resources for the planting industry of sweet potato and provide theoretical basis for the breeding of heat-resistant varieties of sweet potato.
Key words: Heat-resistant sweet potato varieties; Leaf; High temperature stress; Physiology; Antioxidant enzymes
甘薯Ipomoea batatas为旋花科甘薯属番薯种草本块根类植物,又名白薯、红薯、山芋、红苕、地瓜等[1]。甘薯对生产条件的要求较低,具有耐旱、耐贫瘠、适应性强、易栽培等特点,是我国重要的经济作物、粮食作物及工业原料[2-3],其生产及加工对我国国民经济的发展举足轻重。甘薯产量高,富含淀粉、蛋白质、维生素、氨基酸等,适当食用甘薯不仅可以保持人体血液的酸碱平衡,还能够满足人体对各种维生素的需求。此外,甘薯还具有非常高的药用价值,在抗癌、抗氧化、稳定胆固醇与血糖[4-5]等方面发挥重要功能,广泛应用于食品、医药、保健等领域[4]。
甘薯的生长过程受诸多外界因素影响,如栽培方式、施肥、温度、湿度等,其中温度的影响最为直接。已有研究报道,一般甘薯品种形成块根的最适温度为24℃,在此温度下甘薯形成层活动旺盛,中柱木质化程度较小,有利于块根的形成;当温度低于15℃,生长停滞;若高于30℃,块根形成渐慢,呼吸消耗增大,不利于同化作用[6]。当环境温度高于植物正常生长发育所需的温度阈值时,称植物处于高温胁迫,高温胁迫会对植物的生长发育造成可恢复性或不可恢复性的破坏[7]。在我国南方,由于夏季炎热易造成高温胁迫,使甘薯叶细胞失水、膜系统损坏、酶活性改变、光合作用降低等,导致不耐热品种不结薯块,对甘薯的生长发育造成巨大影响[8-9],严重降低甘薯產业的经济效益。
近年来,对甘薯品种的筛选不胜枚举,但多是针对其食用性[10]、耐旱性[11]、耐盐性[12]、抗病虫害[13]等方面的筛选,针对甘薯耐热性方面的筛选鲜少报道。因此,本研究选用4种优质品种金山57、广薯87、龙薯116以及莆薯23为试验对象,综合当地夏季高温环境,设置35℃和40℃高温胁迫,以叶片的耐热评价值、SPAD值、过氧化氢(H2O2)含量、丙二醛(MDA)含量、过氧化氢酶(CAT)活性以及抗坏血酸过氧化物酶(APX)活性为耐热指标,评估各指标间的差异,阐明高温胁迫对不同品种甘薯叶的生长发育、抗逆性及抗氧化特性的影响,旨在为甘薯耐热品种的选育、栽培技术的改良以及生态栽培技术的应用提供理论依据。
1 材料与方法
1.1 试验材料
参试品种为金山57、广薯87、龙薯116和莆薯23,在三明市农业科学院旱作所沙县富口基地试验基地大棚中采用薯块育苗,2021年6月经田间假植后从苗圃中选长势基本一致的甘薯苗,剪取顶端4~5个茎节移入盆栽后取45日龄甘薯苗为试验材料。
1.2 仪器与试剂
1.2.1 供试仪器
离心机[赛默飞世尔科技(中国)有限公司];低温离心机[艾本德(上海)国际贸易有限公司];紫外可见分光亮度计(莱恩生物科技有限公司);旋涡震荡仪(无锡沃信仪器有限公司);SPAD-502 Plus叶绿素仪[柯尼卡美能达办公系统(中国)有限公司]。
1.2.2 供试药剂
过氧化氢(H2O2)含量检测试剂盒、丙二醛(MDA)含量检测试剂盒、过氧化氢酶(CAT)活性检测试剂盒、抗坏血酸过氧化物酶(APX)活性检测试剂盒购自北京索莱宝科技有限公司。
1.3 试验方法
1.3.1 样品处理
试验分别选取生长健壮、长势一致的植株移入智能玻璃温室大棚中,设置35℃(作为对照)和40℃作为高温胁迫的温度条件,每个品种各温度条件下分别处理3盆,每个处理3 个重复。在处理3 d时观察不同处理条件下的植株形态变化(叶片的褪绿、枯萎程度),并取其叶片测定相应的生理指标及抗氧化酶活性。
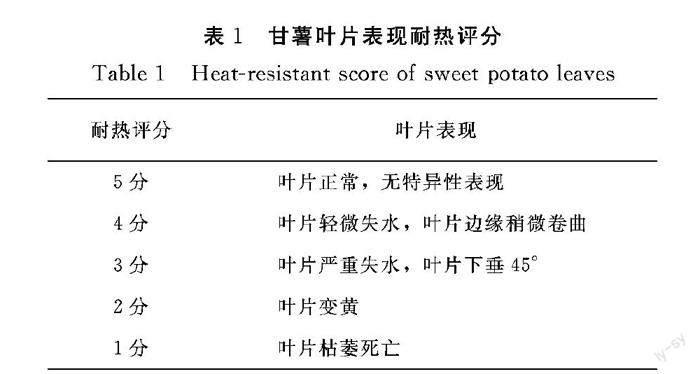
1.3.2 耐热评价分析
测定方法:对移入人工气候箱的4个品种甘薯植株分别进行耐热评价打分,由5位专业研究人员针对各小区4个甘薯品种表观现象,参照耐热评分表(表1)分别进行一对一打分。
1.3.3 指标测定
SPAD 值:参照苏云松等[14]所述方法测定。采用SPAD-502叶绿素仪测量,每个叶片测6个点,取平均值。
H2O2含量、MDA 含量、CAT活性以及APX 活性均采用索莱宝公司检测试剂盒进行检测,对不同品种甘薯地上部叶片进行试验,每个处理3次重复。
1.4 数据统计分析
采用Excel 2016软件进行数据处理,采用SPSS 20.0软件进行数据方差分析(LSD)。
2 结果与分析
2.1 高温胁迫对甘薯叶片耐热性的影响
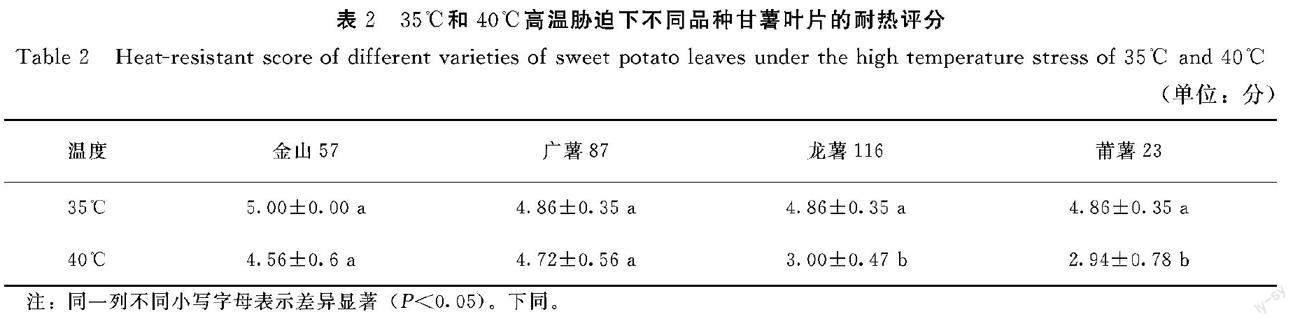
由表2可知,在35℃高温胁迫下,4个品种甘薯叶片形态无明显变化,耐热评分差异不显著。在40℃高温胁迫下,金山57和广薯87的耐热评分较高,分别为4.56分和4.72分,叶片形态无明显变化;龙薯116和莆薯23的耐热评分显著低于金山57和广薯87,叶片严重失水出现下垂、黄化等现象。结果表明,参试品种在35℃高温胁迫下均表现出较好的耐热性,但处于40℃高温胁迫下,金山57和广薯87的耐热性显著优于龙薯116和莆薯23。
2.2 高温胁迫对甘薯叶片SPAD值的影响
由表3可知,在35℃高温胁迫下,广薯87的SPAD值最高,为54.19;金山57次之,为53.44;莆薯23最低,为50.13。在40℃高温胁迫下,金山57与广薯87的SPAD值显著高于龙薯116与莆薯23,随着温度的升高,4个参试品种的SPAD值均呈下降趋势,结果表明,高温胁迫可造成甘薯叶片叶绿素含量降低。
2.3 高温胁迫对甘薯叶片H2O2含量的影响
植物在逆境胁迫下会产生大量自由基,进而导致植株代谢异常甚至死亡。由表4可知,在35℃高温胁迫下,龙薯116的H2O2含量为1.79 μmol·g-1,显著高于金山57、广薯87和莆薯23。在40℃高温胁迫下,莆薯23的H2O2含量高达4.21 μmol·g-1,显著高于其余 3 个参试品种,广薯87的H2O2含量最低,为1.24 μmol·g-1。结果表明,在高温胁迫下,莆薯23产生大量的H2O2,而广薯87则产生较少的H2O2。
2.4 高温胁迫对甘薯叶片MDA含量的影响
膜脂过氧化产物丙二醛(MDA)是衡量氧化胁迫程度的常用指标之一,用来反映植物膜脂过氧化的程度。由表5可知,在35℃高温胁迫下,参试品种的MDA含量均无显著性差异。在40℃高温胁迫下,莆薯23的MDA含量为6.47 nmol·g-1,显著高于金山57、广薯87和龙薯116,金山57与广薯87的MDA累积量最低,分别为6.85 nmol·g-1和 6.72 nmol·g-1。结果表明,在高温胁迫下,金山57与广薯87的质膜损伤程度显著轻于莆薯23。
2.5 高温胁迫对甘薯叶片CAT活性的影响
由表6可知,在35℃高温下,龙薯116的CAT活性高达40.10 U·g-1 FW,显著高于其余3 个品种,莆薯23 的CAT活性最低,为27.69 U·g-1 FW;在40℃ 高温胁迫下,龙薯116、莆薯23的CAT活性较高,分别为56.07 U·g-1 FW 和72.40 U·g-1 FW,显著高于龙薯116、金山57 和广薯87。
2.6 高温胁迫对甘薯葉片APX活性的影响
由表7可知,在35℃高温胁迫下,龙薯116的APX活性高达69.31 U·g-1 FW,显著高于其余3个参试品种;在40℃高温胁迫下,莆薯23的APX活性高达201.08 U·g-1 FW,显著高于其余3 个参试品种。
3 讨论与结论
植物具有在高于适宜生长温度存活的基本耐热性以及抵抗致死热胁迫的获得性耐热性,这两种能力使得植物体能在数小时内迅速获得耐热性,以抵御致死高温[15],但是同种作物不同品种间所能耐受的最高温度各有差异。本研究通过比较4个参试品种甘薯高温胁迫下耐热评价指标、生理指标及抗氧化特性发现,在35℃高温下,参试品种甘薯叶片形态无明显变化,但随着温度增高,达到40℃时,龙薯116和莆薯23的叶片严重失水出现下垂、黄化等现象,而金山57和广薯87叶片形态则无明显变化。由此可见,当热胁迫所造成的伤害超过生物体自身的调控能力时,植物就开始表现出外观形态的热害症状。
随着胁迫程度的不断增强,高温将导致植物细胞膜损伤、光合作用受抑制、抗氧化系统、细胞老化死亡等生理变化[16],通过测量不同高温胁迫下参试品种的SPAD值可知,当胁迫温度在35℃及40℃时,金山57与广薯87的SPAD值均显著高于龙薯116与莆薯23,其中莆薯23的SPAD值最低,表明高温胁迫使莆薯23的叶绿素含量遭到严重破坏,从而影响光合作用,因此推测这是造成其耐热性差的原因之一。已有的研究表明,植物的耐热性与膜脂成分、抗氧化系统等[17]有关。因此,本研究通过进一步分析高温胁迫下参试品种叶片MDA累积量,研究表明当处于40℃高温胁迫时,莆薯23的MDA含量显著高于金山57、广薯87和龙薯116,而金山57与广薯87的MDA累积量最低,由此可见,在高温胁迫下,金山57与广薯87的质膜损伤程度显著轻于莆薯23,表现出更强的耐热性。
植物体在进行生命活动过程中、受到逆境胁迫以及受病原菌侵染过程中均会产生大量的自由基,直接或间接的引起植物的衰变[18],使平衡受到破坏,造成植物细胞凋亡[19]。本研究通过检测在高温胁迫下甘薯叶片产生活性氧的含量,来反映其抗逆水平。在35℃高温下,龙薯116产生的H2O2显著高于金山57、广薯87和莆薯23;当温度达40℃时,莆薯23的H2O2含量较其余3个参试品种显著增加,而参试品种中广薯87则产生较低的H2O2,可见其在应对高温胁迫下表现出更强的抗逆水平。莆薯23与龙薯116在高温胁迫下均产生了大量的H2O2,导致叶片细胞的过氧化,扰乱细胞的正常代谢,因此推测高温逆境所造成的氧化伤害可能是导致其耐热性较差的主要原因。
在高温胁迫条件下,植物细胞膜系统感受到胁迫信号,通过信号传递途径将胁迫信号传递到细胞内,引起植物体内酶活性的变化,进而影响一系列热胁迫相关的生理生化反应及逆境诱导基因的表达和调控[15]。其中,CAT与APX 广泛存在于植物中,是植物活性氧代谢过程中重要的抗氧化酶,也是重要的H2O2清除酶,在活性氧清除系统中起着至关重要的作用。本研究进一步分析来高温胁迫下参试品种叶片中CAT与APX的活性,我们发现,在 35℃高温胁迫下,龙薯116的CAT与APX活性最高,显著高于其余3个品种;在40℃高温胁迫下,龙薯116与莆薯23的CAT活性显著高于金山57和广薯87,且莆薯23的 APX 活性显著高于其余3个参试品种,推测在高温胁迫下,莆薯23与龙薯116产生大量H2O2引发了细胞的应激反应,激活抗氧化系统,为了及时清除活性氧,从而产生较高水平的抗氧化活性[20]。
综上所述,高温胁迫使植物体的生理与抗氧化过程发生不同程度的变化,本研究以甘薯叶片耐热评价值、SPAD值、H2O2含量、MDA含量、CAT活性以及APX活性作为耐热性鉴定指标,探究高温胁迫对甘薯叶片生理及抗氧化酶活性的影响,在参试品种中,广薯87较其余的3个品种表现出更强的耐热性,金山57次之,莆薯23最差。本研究针对不同品种甘薯叶片在高温胁迫下生理与抗氧化特性的研究,对研究甘薯耐热机理以及甘薯耐热新品种的选育具有重要意义,为甘薯种植产业提供耐热品种资源,同时对甘薯栽培技术的改良、生态栽培技术的应用以及甘薯耐热品种的选育提供理论依据。
参考文献:
[1]中国科学院中国植物志委员会.中国植物志第五十八卷[M].北京:科学出版社, 1979.
[2]SENANAYAKE S A, RANAWEERA K K D S, GUNARATNE A, et al.Comparative analysis of nutritional quality of five different cultivars of sweet potatoes (Ipomea batatas (L) Lam) in Sri Lanka[J].Food Science & Nutrition, 2013, 1(4): 284-291.
[3]SALAWU I S, MUKHTAR A A.Reducing the Dimension of Growth and Yield Characters of Sweet Potato (Ipomoea batatas L.) Varieties as Affected by Varying Rates of Organic and Inorganic Fertilizer[J].Asian Journal of Agricultural Research,2008, 2(1): 41-44.
[4]张立明, 王庆美, 王荫墀.甘薯的主要营养成分和保健作用[J].杂粮作物, 2003, 23(3):162-166.
[5]薛友林, 孟宪军, 孙艳丽, 等.四种甘薯蛋白粉品质比较[J].食品研究与开发, 2006, 27(2): 51-53.
[6]张瑞明.气象条件对甘薯栽培和品质的影响[D].合肥:安徽农业大学, 2008.
[7]周蓉.番茄种质资源耐热性评价及幼苗响应热胁迫的microRNAs分析[D].南京: 南京农业大学, 2015.
[8]田治国, 王飞, 张文娥, 等.高温胁迫对孔雀草和万寿菊不同品种生长和生理的影响[J].园艺学报, 2011(10): 1947-1954.
[9]阳燕娟, 来可可, 陈文明, 等.砧用葫芦种质资源耐热性评价[J].南方农业学报, 2015, 46(6): 1047-1052.
[10]谢秀梅, 陈竺, 李云, 等.食用甘薯优良品种筛选评价[J].耕作与栽培, 2019, 39(2): 5-7.
[11]袁振, 汪宝卿, 姜瑶, 等.甘薯耐旱性品种苗期筛选及耐旱性指标研究[J].山东农业科学, 2015, 36(3): 22-26.
[12]王文婷, 侯夫云, 王庆美, 等.耐盐性甘薯品种的初步筛选[J].山东农业科学, 2012, 44(11): 35-37.
[13]林敏, 郑良, 杨秀娟, 等.抗根结线虫甘薯品种的初步筛选[J].福建农业科技, 1994, 2(4): 4-5.
[14]苏云松, 郭华春, 杨雪兰.甘薯、薯蓣和魔芋叶片SPAD值与叶绿素含量的相關性研究[J].西南农业学报, 2009, 22(1): 3-7.
[15]屠小菊, 汪启明, 饶力群.高温胁迫对植物生理生化的影响[J].湖南农业科学, 2013, 25(7): 3-9.
[16]SHENG X, LI J, ZHANG X, et al.Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation, antioxidant metabolites, and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress[J].Environmental & Experimental Botany, 2006, 56(3): 274-285.
[17]孙永江, 付艳东, 杜远鹏, 等.不同温度/光照组合对‘赤霞珠葡萄叶片光系统Ⅱ功能的影响[J].中国农业科学, 2013,46(6): 1191-1200.
[18]林文洁, 陈丽晖.植物体中的自由基[J].海南大学学报:自然科学版, 1998, 16(4): 6-10.
[19]张俊霞, 刘晓鹏, 向极钎.植物抗氧化系统对逆境胁迫的动态响应[J].湖北民族学院学报:自然科学版, 2015, 2(4): 5-11.
[20]李冰, 刘宏涛.植物热激反应的信号转导机理[J].植物生理与分子生物学学报, 2002, 27(1): 1-10.
(责任编辑:柯文辉)

