基于网络药理学和实验验证探讨雷公藤红素抗血管重塑的作用机制
谷 佳,石雅宁, 3,邱 韵,何 鹏,贺卫和, 2,覃 丽, 2, 4*
基于网络药理学和实验验证探讨雷公藤红素抗血管重塑的作用机制
谷 佳1,石雅宁1, 3,邱 韵1,何 鹏1,贺卫和1, 2,覃 丽1, 2, 4*
1. 湖南中医药大学 干细胞中药调控与应用实验室,湖南 长沙 410208 2. 湖南中医药大学药学院药理学教研室,湖南 长沙 410208 3. 湖南中医药大学 科技创新中心,湖南 长沙 410208 4. 血管生物学与转化医学湖南省高校重点实验室,湖南 长沙 410208
基于网络药理学和实验验证探讨雷公藤红素抗血管重塑的潜在靶点和作用机制。通过SwissTargetPrediction、PharmMapper数据库筛选出雷公藤红素作用靶点。采用NCBI Gene、GeneCards及OMIM数据库预测血管重塑相关靶点,聚焦共同靶标,借助Cytoscape 3.8.1及STRING数据库构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)并筛选核心靶点。通过构建体外血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖模型和小鼠股动脉拉伤模型,考察雷公藤红素对VSMCs增殖、促炎细胞因子水平及关键靶点表达的影响。共获得雷公藤红素靶点56个,血管重塑靶点737个,药物疾病共同靶点20个,核心靶点有细胞周期蛋白D1(cyclin D1)、原癌基因c-Myc、核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)等。体外细胞实验表明,雷公藤红素显著抑制A7r5血管平滑肌细胞增殖能力(<0.01),显著下调cyclin D1、c-Myc、NLRP3和半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)的蛋白表达(<0.05、0.01)。动物实验结果显示,雷公藤红素显著抑制股动脉拉伤小鼠模型股动脉NLRP3和Caspase-1的蛋白表达水平(<0.01、0.001),降低血清中白细胞介素-6(interleukin-6,IL-6)和IL-1β水平(<0.01、0.001)。雷公藤红素可抑制VSMCs增殖,减轻损伤血管的重塑,其作用机制可能与改善血管炎症有关。
雷公藤红素;血管重塑;网络药理学;增殖;炎症
心血管疾病位居各种疾病死亡率之首,并且仍然处于上升的趋势[1]。经皮冠状动脉介入治疗、支架植入和搭桥手术等,在心血管疾病治疗中得到了广泛应用,但术后再狭窄仍然是最突出的临床问题[2]。血管重塑是指因损伤而引起血管壁结构和功能的异常变化,是动脉粥样硬化、高血压、肺动脉高压等疾病的主要病理改变[3]。其中血管平滑肌细胞(vascular smooth muscle cells,VSMCs)异常增殖导致的内膜增生在血管重塑发病过程中起着关键作用。因此,有效抑制VSMCs增殖是防止血管再狭窄发生的关键途径。目前,临床上用于防止血管再狭窄的药物,主要有抗增殖药物紫杉醇、西罗莫司等,但由于内皮细胞毒性导致患者血管愈合不佳及预后不良[4]。
雷公藤红素是从雷公藤Hook. f.根皮中分离出的五环三萜类化合物,具有祛风除湿、活血通络、消肿止痛的功效。现代药理学研究表明,雷公藤红素具有抗炎、抗氧化、抑制细胞增殖、诱导细胞凋亡和自噬的作用,可用于治疗肿瘤、炎性相关疾病[5]。研究发现,雷公藤红素可显著抑制VSMCs增殖,在冠心病及再狭窄中具有潜在应用价值[6]。课题组前期研究也证实雷公藤红素通过激活无翅型MMTV整合位点家族成员5a(wingless-type MMTV integration site family member 5a,Wnt5a)/蛋白激酶C(protein kinase C,PKC)/ 雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路促进VSMCs自噬,抑制VSMCs增殖,从而改善内膜增生,在抗动脉粥样硬化过程中发挥重要作用[7]。然而,目前关于雷公藤红素在血管重塑中的研究仍处于初级阶段,其潜在靶点及药理学作用机制有待进一步阐明。
网络药理学是一种基于系统生物学理论将药物与疾病相关靶点联系起来,初步预测药物作用机制的新型药物研发模式[8]。克服了以往“一个药物、一个靶点、一种疾病”传统药物研究范式,通过多靶点和多途径的方式阐明药物治疗疾病的潜在机制。对于中药成分作用机制的研究、开发及应用开辟了新道路[9]。目前,尚无雷公藤红素抗血管重塑的网络药理学相关研究。本研究拟通过网络药理学初步预测药物作用靶点,进而通过体内外实验对相关靶点进行验证,以期为雷公藤红素抗血管重塑的机制研究提供新思路。
1 材料
1.1 动物
SPF级雄性C57BL/6小鼠,6~8周龄,体质量(20±2)g,购自湖南斯莱克景达实验动物有限公司,许可证号ZS-202007280005。动物饲养于湖南中医药大学实验动物房,温度25 ℃,相对湿度(50±20)%,适应性饲养3 d。动物实验经湖南中医药大学实验动物伦理委员会批准(批准号LLBH-202007220002)。
1.2 细胞
大鼠胸大动脉平滑肌A7r5细胞购自中国科学院细胞库。
1.3 药品与试剂
雷公藤红素(批号C0869,质量分数≥98%)、二甲基亚砜(dimethyl sulfoxide,DMSO,批号D2650)购自美国Sigma公司;血小板衍生生长因子-BB(platelet-derived growth factor-BB,PDGF-BB,批号315-18)购自美国PeproTech公司;DMEM培养基(批号C11995500BT)购自美国Gibco公司;BCA蛋白定量试剂盒(批号CW0014)购自北京康为世纪生物科技有限公司;EdU试剂盒(批号C6017)购自美国US Everbright公司;二步法免疫组化检测试剂盒(批号PV-9005)购自北京中杉金桥生物技术有限公司;白细胞介素-1β(interleukin-1β,IL-1β)、IL-6 ELISA试剂盒(批号分别为ab197742、ab222503)购自英国Abcam公司;原癌基因c-Myc抗体(批号10828-1-AP)、细胞周期蛋白D1(cyclin D1)抗体(批号26939-1-AP)、核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)抗体(批号19771-1-AP)、半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)抗体(批号22915-1-AP)、β-肌动蛋白(β-actin)抗体(批号20536-1-AP)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号10494-1-AP)、HRP标记的山羊抗兔二抗(批号SA00001-2)均购自美国Proteintech公司。
1.4 仪器
DENLEY DRAGON Wellscan MK型多功能酶标仪、BB5060型CO2培养箱、ST8R型高速冷冻离心机(美国Thermo Fisher Scientific公司);蛋白电泳系统(美国Bio-Rad公司);CKX41型倒置显微镜(日本Olympus公司);5200型荧光及化学发光成像系统(上海天能有限公司)。
2 方法
2.1 网络药理学分析
2.1.1 雷公藤红素靶点和血管重塑靶点的预测 通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库采集雷公藤红素的三维结构并将其导入SwissTargetPrediction(http://www.swisstarget prediction.ch/)和PharmMapper(http://www.lilab-ecust.cn/pharmmapper/)数据库,预测雷公藤红素可能作用的靶点;以“vascular remodeling”为关键词通过NCBI Gene(https://www.ncbi.nlm.nih.gov/)、OMIM(https://omim.org/)、GeneCards(https://www. genecards.org/)等数据库获取血管重塑相关疾病的靶点。将雷公藤红素靶点与疾病靶点相互映射,得到共有靶点。
2.1.2 “雷公藤红素-共有靶点-血管重塑”网络构建及关键靶点获取 将共有靶点导入STRING(https://STRING-db.org),物种选择“Homo sapiens”,得到蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络。将PPI网络导入Cytoscape 3.8.1软件进行可视化分析,Network analyzer计算度值,获得雷公藤红素治疗血管重塑的关键靶点,构建“雷公藤红素-共有靶点-血管重塑”网络模型,并对该网络模型进行深度分析。
2.2 细胞实验
2.2.1 细胞培养及分组 A7r5细胞用含10%胎牛血清(fetal bovine serum,FBS)、1%青霉素-链霉素的DMEM培养基,在37 ℃、5% CO2的培养箱中培养。设置对照组、模型组(30 ng/mL PDGF-BB)和雷公藤红素低、中、高剂量组,各给药组在模型组的基础上,分别给予1.5、2.0、2.5 μmol/L雷公藤红素处理,对照组加入0.1% DMSO溶液。
2.2.2 EdU法检测雷公藤红素对PDGF-BB诱导的A7r5细胞增殖的影响 A7r5细胞经PBS洗涤后,胰酶消化,以5×103个/孔接种于6孔板中,培养24 h使其贴壁。用含1% FBS的DMEM完全培养基饥饿A7r5细胞24 h,按“2.2.1”项下方法处理24 h。每孔加入500 µL完全培养基和500 µL EdU工作液(20 nmol/L),在37 ℃培养箱中孵育2 h。弃去培养基,每孔加入1 mL的4%多聚甲醛,室温放置15 min;弃去4%多聚甲醛,每孔加入1 mL PBS洗涤细胞,洗涤3次,每次3~5 min;弃去PBS,每孔加入1 mL通透液(含3% Triton X-100的PBS),室温放置10~15 min。每孔加入1 mL PBS洗涤细胞,洗涤2次,每次3~5 min;每孔加入500 µL的Click反应混合物,轻轻摇匀,室温避光放置30 min;弃去Click反应混合物,每孔加入1 mL PBS洗涤细胞3次。每孔加入1 mL稀释后的Hoechst 33342,避光室温孵育10 min。弃去Hoechst 33342,加入1 mL PBS洗涤细胞3次,弃去洗涤液。于倒置荧光显微镜下观察细胞荧光情况。
2.2.3 Western blotting检测细胞cyclin D1、c-Myc、NLRP3和Caspase-1蛋白表达 收集处理后的细胞,PBS洗涤3次,使用RIPA蛋白裂解液抽提总蛋白质,采用BCA蛋白定量法测定蛋白质浓度。蛋白样品经6%~15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭3 h;分别加入一抗,4 ℃孵育膜过夜;洗涤后,加入二抗,室温孵育2 h。洗涤后采用化学发光试剂显影,使用Image-Pro Plus软件分析条带灰度。
2.3 动物实验
2.3.1 动物分组及给药 将50只雄性C57BL/6小鼠按数字表法随机分为对照组、模型组、DMSO组和雷公藤红素低、高剂量(1、2 mg/kg)[7]组,每组10只,全部小鼠普通饲料喂养2周后,进行小鼠股动脉导丝拉伤实验。DMSO组小鼠在股动脉手术后ip 200 μL溶剂,雷公藤红素低、高剂量组ig相应药物,隔天给药,30 d后,通过吸入CO2的方式处死小鼠,取损伤的股动脉和血液进行处理和后续检测。
2.3.2 小鼠股动脉拉伤实验 参照课题组前期研究造模[7],3%异氟烷对小鼠进行吸入性麻醉,将小鼠固定于无菌泡沫板上,手术脱毛膏局部去毛,碘伏局部消毒,置于显微镜下;高压灭菌的手术剪刀沿左腿腹股中线剪开皮肤,分离切口处的局部粘膜和肌肉,找到动脉分支并使其与静脉分离,无菌手术线结扎远心端。无菌手术线结扎腹股叉大动脉及小分支,暂时阻止血流。显微手术剪在动脉分支中打开一个小口,将导丝反复进出一次后撤离导丝并结扎股动脉。术后将小鼠置于无菌热垫上,苏醒后置入动物房单笼喂养。
2.3.3 免疫组化染色检测小鼠股动脉中NLRP3、Caspase-1蛋白表达 取各组小鼠损伤的股动脉,固定、脱水、透化、包埋后切片。按照二步法免疫组化检测试剂盒说明,将石蜡切片脱蜡、水化、抗原修复、阻断、封闭后,滴加一抗于37 ℃恒温箱中孵育2 h,用PBS清洗3次,每次3 min。滴加反应增强液,室温孵育20 min,PBS清洗3次,每次3 min。滴加增强酶标山羊抗小鼠/兔IgG聚合物,室温孵育20 min,PBS清洗3次,每次3 min,DAB显色,苏木素复染,常规脱水、透明、封片,显微镜下观察、拍照。
2.3.4 ELISA检测小鼠血清中炎症因子IL-1β和IL-6水平 取各组小鼠血清,按照ELISA试剂盒说明测定IL-1β和IL-6的含量。
2.4 统计学分析
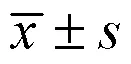
3 结果
3.1 网络药理学分析
3.1.1 雷公藤红素靶点和血管重塑靶点的预测 通过SwissTargetPrediction和PharmMapper数据库得到56个雷公藤红素相关靶点。通过NCBI Gene、OMIM、GeneCards等数据库删除重复后最终得到血管重塑737个相关靶点。
3.1.2 “雷公藤红素-血管重塑”共有靶点 通过构建Venn图预测“雷公藤红素-血管重塑”共有靶点。结果显示,雷公藤红素对应的56个靶基因与血管重塑相关的737个靶基因相互映射,得到交集基因20个(图1)。
3.1.3 “雷公藤红素-血管重塑”交集基因的PPI网络 将获得的20个交集基因导入STRING数据库,得到PPI网络(图2),利用Cytoscape对交集基因进行可视化分析(图3),这20个靶基因可能是雷公藤红素抗血管重塑的关键基因。此外,20个靶蛋白相互作用,其中相互作用的连接边有121条,平均局部聚类系数0.86,平均节点度值12.1(图4)。其中,cyclin D1、c-Myc、NLRP3等蛋白与血管重塑中VSMCs增殖、炎症等生物过程关系密切。

图1 “雷公藤红素-血管重塑”交集基因Venn图

图2 PPI网络
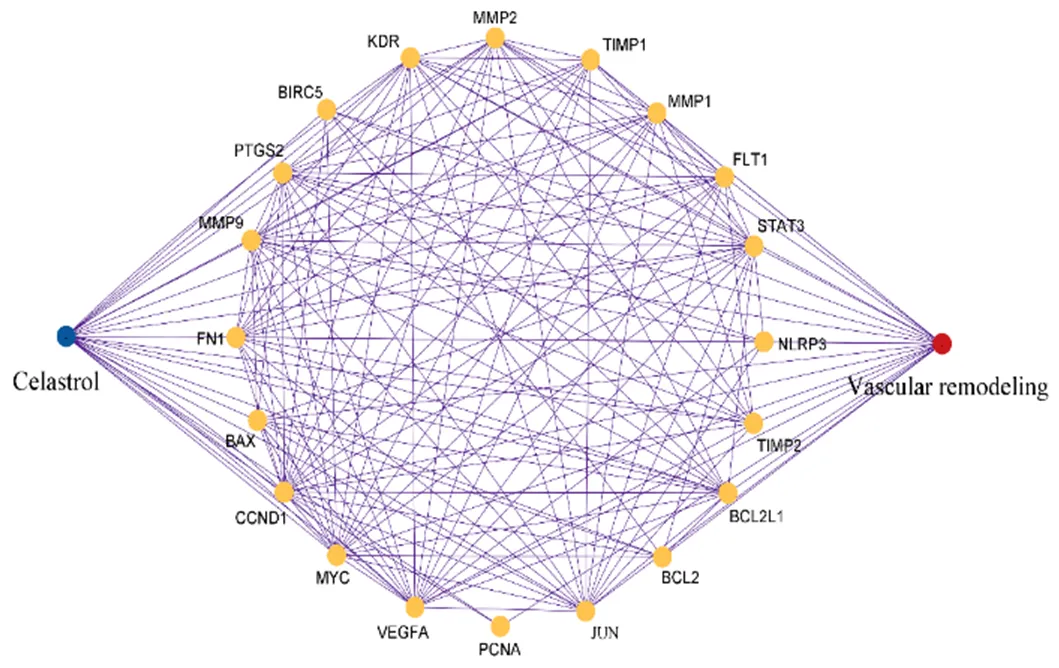
图3 “雷公藤红素-共有靶点-血管重塑”网络
3.2 细胞实验验证
3.2.1 雷公藤红素对PDGF-BB诱导的A7r5细胞增殖的影响 如图5所示,与模型组比较,各给药组增殖率明显降低(<0.01),表明雷公藤红素对PDGF-BB诱导的A7r5细胞增殖具有明显的抑制作用。
3.2.2 雷公藤红素对PDGF-BB诱导的A7r5细胞c-Myc和cyclin D1蛋白表达的影响 如图6所示,与模型组比较,雷公藤红素各剂量组c-Myc蛋白表达水平明显降低(<0.01),雷公藤红素中、高剂量组cyclin D1蛋白表达水平明显降低(<0.01)。
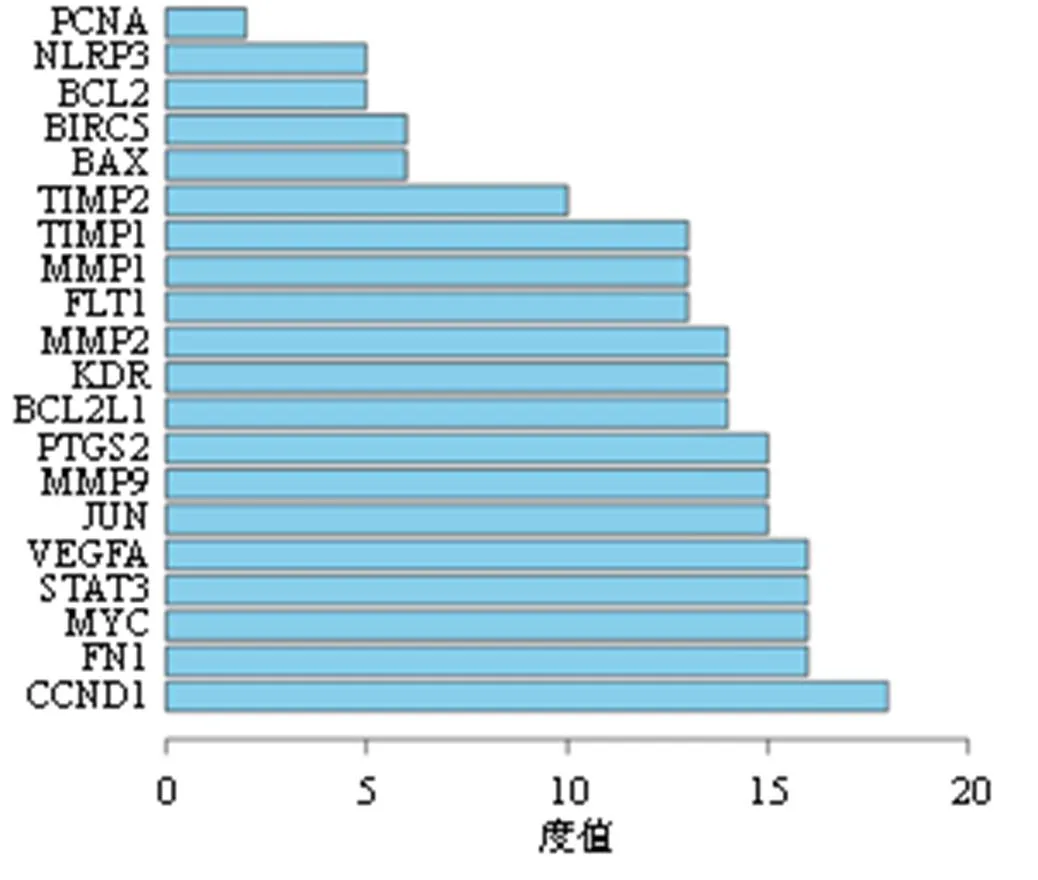
图4 PPI网络靶点分析

与对照组比较:#P<0.05;与模型组比较:*P<0.05 **P<0.01,图6、7同
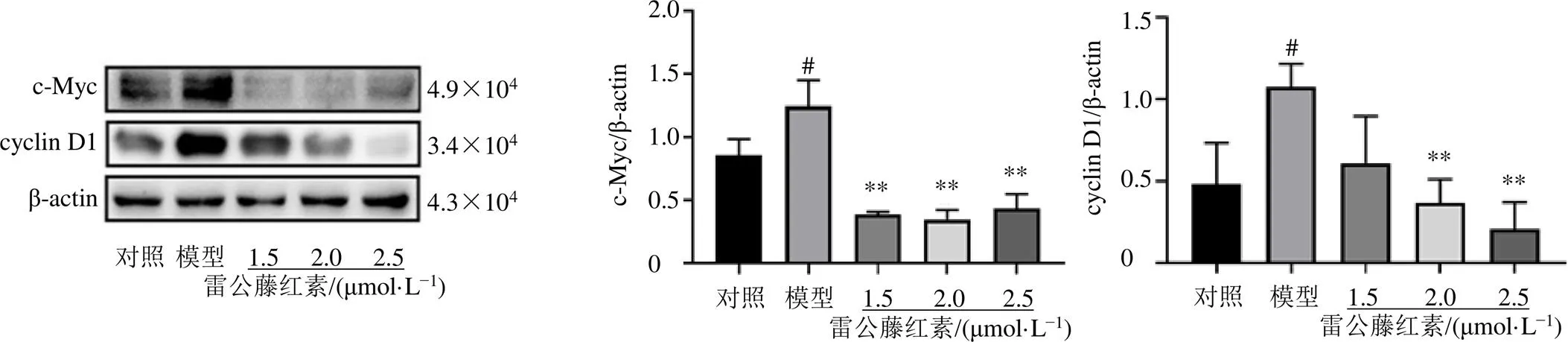
图6 雷公藤红素对PDGF-BB诱导的A7r5细胞c-Myc和cyclin D1蛋白表达的影响(, n = 3)
3.2.3 雷公藤红素对PDGF-BB诱导的A7r5细胞NLRP3和Caspase-1蛋白表达的影响 为了进一步研究雷公藤红素抑制A7r5细胞增殖的分子机制,测定网络药理学预测关键靶点NLRP3及其下游Caspase-1蛋白表达。如图7所示,与模型组比较,各给药组NLRP3和Caspase-1蛋白表达水平明显降低(<0.05、0.01)。提示雷公藤红素可通过改善炎症反应抑制A7r5细胞增殖。

图7 雷公藤红素对PDGF-BB诱导的A7r5细胞NLRP3和Caspase-1蛋白表达的影响(, n = 3)
3.3 动物实验验证
3.3.1 雷公藤红素对股动脉拉伤模型小鼠股动脉NLRP3、Caspase-1蛋白表达的影响 如图8所示,与DMSO组比较,各给药组NLRP3和Caspase-1蛋白表达水平明显降低(<0.05、0.01、0.001),与“3.2.3”项下结果一致。
3.3.2 雷公藤红素对股动脉拉伤模型小鼠血清中IL-1β和IL-6水平的影响 如图9所示,与对照组比较,模型组IL-1β和IL-6水平明显升高(<0.05、0.01);与DMSO组比较,各给药组IL-1β和IL-6水平明显降低(<0.05、0.01、0.001)。

与对照组比较:#P<0.05 ##P<0.01;与DMSO组比较:*P<0.05 **P<0.01 ***P<0.001,图9同
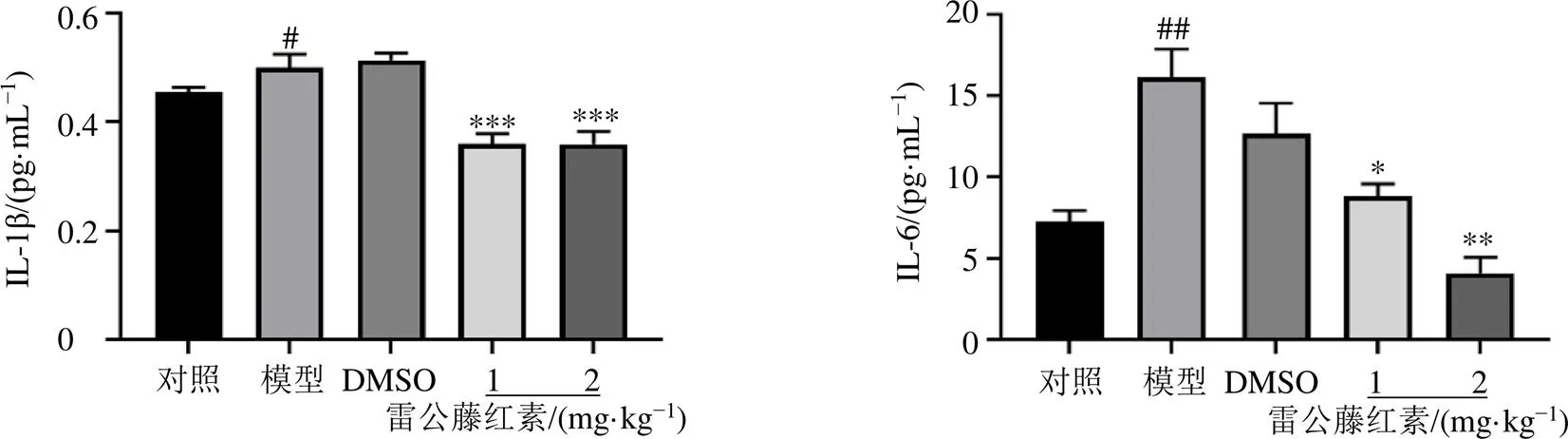
图9 雷公藤红素对股动脉拉伤模型小鼠血清中IL-1β和IL-6水平的影响(, n = 3)
4 讨论
本研究通过网络药理学初步预测雷公藤红素抗血管重塑的作用靶点。最终筛选出cyclin D1、c-Myc、NLRP3等蛋白为雷公藤红素调控血管重塑的重要靶蛋白。随后采用VSMCs增殖模型和股动脉拉伤小鼠模型作为研究对象,探讨雷公藤红素是否通过影响细胞增殖和炎症进而调控血管重塑病理进程。体内外实验验证结果均表明雷公藤红素对PDGF-BB诱导的VSMCs细胞增殖和股动脉拉伤诱导的内膜增生具有明显的抑制作用,并呈剂量相关性。此外,雷公藤红素在体外显著抑制PDGF-BB诱导的VSMCs中c-Myc、cyclin D1的蛋白表达,与网络药理学预测结果一致。c-Myc通常在血管损伤时被活化,与VSMCs异常增殖密切相关[10]。研究报道,microRNA let-7g可通过靶向抑制c-Myc,阻滞G0/G1细胞周期,进而抑制缺氧诱导的VSMCs增殖[11]。Cyclin D1主要参与调控细胞G1期的进程,对细胞周期和增殖的调控至关重要。研究表明,白藜芦醇可通过抑制核转录因子-κB(nuclear factor-κB,NF-κB)/cyclin D1通路,抑制VSMCs的增殖,进而改善野百合碱诱导的肺血管重塑及肺动脉高压[12]。这些结果表明雷公藤红素可通过减少c-Myc、cyclin D1的表达抑制VSMCs增殖和血管重塑。
静脉旁路移植失败率很高的最重要原因——炎症和内皮细胞损伤促进VSMCs快速迁移和增殖导致内膜增厚[13]。慢性炎症通常伴随着血管生成,炎症可促进血管重塑性相关疾病的发生发展[14]。NLRP3炎症体是一种参与炎症反应的大分子复合物,由NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)和Caspase-1组成[15]。NLRP3激活后,与其衔接子ASC形成复合物,促进前体Caspase-1转化为活性Caspase-1。活化的Caspase-1将前IL-1β加工成其成熟形式IL-1β,从而触发炎症反应[16]。已有研究通过体内外实验表明基因缺失可减轻血管紧张素II诱导的炎症、VSMCs表型转化、增殖进而缓解血管重塑进程[17]。反之,激活NLRP3炎性小体可促进高血压患者VSMCs表型转化和增殖[18]。在高血压的发病机制中,Toll样受体4(Toll-like receptor 4,TLR4)通过触发NLRP3炎症体介导VSMCs增殖[19]。Fan等[20]研究表明microRNA-24的过表达可通过抑制NLRP3/Caspase-1/IL-1β信号通路减轻糖尿病血管重塑。本研究结果表明,雷公藤红素显著抑制了PDGF-BB诱导的VSMCs模型和小鼠股动脉拉伤模型中NLRP3、Caspase-1表达。此外,ELISA结果表明,雷公藤红素显著减少了股动脉拉伤模型小鼠血清中炎症因子IL-1β、IL-6水平。这些结果表明雷公藤红素可能通过介导炎症反应调节VSMCs增殖,从而在防止损伤引起的血管重塑中具有明显作用。总之,NLRP3可作为干预VSMCs炎症和增殖的生物标志物和潜在的治疗靶点。探讨VSMCs增殖和炎症的关系也有利于为慢性疾病的抗炎和抗血管重塑治疗提供新的思路和机遇。
综上,本研究通过网络药理学结合实验验证,探讨了雷公藤红素对血管重塑的作用及机制。雷公藤红素可减轻VSMCs增殖,这一效应可能与其抗炎作用相关。本研究拓展了雷公藤红素抗血管重塑的机制,为血管重塑相关性疾病的治疗和新药研发提供了一种思路。
利益冲突 所有作者均声明不存在利益冲突
[1] Roger V L, Go A S, Lloyd-Jones D M,. Heart disease and stroke statistics: 2012 update: A report from the American Heart Association [J]., 2012, 125(1): e2-e220.
[2] Gareri C, De Rosa S, Indolfi C. MicroRNAs for restenosis and thrombosis after vascular injury [J]., 2016, 118(7): 1170-1184.
[3] Díaz del Campo L S, Rodrigues-Díez R, Salaices M,. Specialized pro-resolving lipid mediators: New therapeutic approaches for vascular remodeling [J]., 2022, 23(7): 3592.
[4] Melnik T, Jordan O, Corpataux J M,. Pharmacological prevention of intimal hyperplasia: A state-of-the-art review [J]., 2022, 235: 108157.
[5] Kannaiyan R, Shanmugam M K, Sethi G. Molecular targets of celastrol derived from Thunder of God Vine: Potential role in the treatment of inflammatory disorders and cancer [J]., 2011, 303(1): 9-20.
[6] 陈星, 丰美福, 朱国英. 雷公藤红素对培养的动脉平滑肌细胞增殖的抑制作用 [J]. 中国中西医结合杂志, 1998, 18(S1): 39-41.
[7] Shi Y N, Liu L P, Deng C F,. Celastrol ameliorates vascular neointimal hyperplasia through Wnt5a-involved autophagy [J]., 2021, 17(10): 2561-2575.
[8] 牛明, 张斯琴, 张博, 等. 《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[9] Nogales C, Mamdouh Z M, List M,. Network pharmacology: Curing causal mechanisms instead of treating symptoms [J]., 2022, 43(2): 136-150.
[10] Sun L Q, Cairns M J, Gerlach W L,. Suppression of smooth muscle cell proliferation by a c-myc RNA-cleaving deoxyribozyme [J]., 1999, 274(24): 17236-17241.
[11] Zhang W F, Xiong Y W, Zhu T T,. MicroRNA let-7g inhibited hypoxia-induced proliferation of PASMCs via G0/G1cell cycle arrest by targeting c-myc [J]., 2017, 170: 9-15.
[12] Shi W, Zhai C, Feng W,. Resveratrol inhibits monocrotaline-induced pulmonary arterial remodeling by suppression of SphK1-mediated NF-κB activation [J]., 2018, 210: 140-149.
[13] Wadey K, Lopes J, Bendeck M,. Role of smooth muscle cells in coronary artery bypass grafting failure [J]., 2018, 114(4): 601-610.
[14] Whiteford JR, De Rossi G, Woodfin A. Mutually supportive mechanisms of inflammation and vascular remodeling [J]., 2016, 326: 201-278.
[15] Zhou R B, Yazdi A S, Menu P,. A role for mitochondria in NLRP3 inflammasome activation [J]., 2011, 469(7329): 221-225.
[16] Sharma A A, Jen R, Kan B,. Impaired NLRP3 inflammasome activity during fetal development regulates IL-1β production in human monocytes [J]., 2015, 45(1): 238-249.
[17] Ren X S, Tong Y, Ling L,.gene deletion attenuates angiotensin II-induced phenotypic transformation of vascular smooth muscle cells and vascular remodeling [J]., 2017, 44(6): 2269-2280.
[18] Sun H J, Ren X S, Xiong X Q,. NLRP3 inflammasome activation contributes to VSMC phenotypic transformation and proliferation in hypertension [J]., 2017, 8(10): e3074.
[19] Qi H M, Cao Q, Liu Q. TLR4 regulates vascular smooth muscle cell proliferation in hypertension via modulation of the NLRP3 inflammasome [J]., 2021, 13(1): 314-325.
[20] Fan Z, Yang J, Yang C,. MicroRNA‑24 attenuates diabetic vascular remodeling by suppressing the NLRP3/ caspase‑1/IL‑1β signaling pathway [J]., 2020, 45(5): 1534-1542.
Mechanism of celastrol against vascular remodeling based on network pharmacology and experimental validation
GU Jia1, SHI Ya-ning1, 3, QIU Yun1, HE Peng1, HE Wei-he1, 2, QIN Li1, 2, 4
1. Laboratory of Stem Cell Regulation with Chinese Medicine and Its Application, Hunan University of Chinese Medicine, Changsha 410208, China 2. The department of Pharmacology, School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China 3. Science and Technology Innovation Center, Hunan University of Chinese Medicine, Changsha 410208, China 4. Hunan Key Laboratory of Vascular Biology and Translational Medicine, Changsha 410208, China
To explore the potential targets and mechanism of celastrol against vascular remodeling through network pharmacology and experimental verification.The targets of celastrol were mined by SwissTargetPrediction, Pharmmapper databases, and then the targets related to vascular remodeling were predicted by NCBI Gene, Genecards and OMIM databases. Protein-protein interaction (PPI) network was constructed to take the common targets of them, visualize and search core targets by Cytoscape 3.8.1 software and STRING database. The effects of celastrol on vascular smooth muscle cells (VSMCs) proliferation, levels of pro-inflammatory cytokines and expressions of core targets were investigated by constructing VSMCs proliferation modelsand a mouse model with femoral artery strain.A total of 56 targets of celastrol and 737 targets related to vascular remodeling were obtained, and 20 cross targets between celastrol and vascular remodeling were obtained. Key targets such as cyclin D1, proto-oncogene c-Myc, nucleotide-binding oligomerization domain-like receptor protein 3 (NLRP3) were obtained.cell experiments showed that celastrol significantly inhibited the proliferation of A7r5 cells (< 0.01), significantly down-regulated the protein expressions of cyclin D1, c-Myc, NLRP3 and cystein-asparate protease-1 (Caspase-1) (< 0.05, 0.01). Animal experiment results showed that celastrol significantly inhibited the protein expressions of NLRP3 and Caspase-1 in femoral artery of mice with femoral artery strain (< 0.01, 0.001), decreased the levels of interleukin-6 (IL-6) and IL-1β in serum (< 0.01, 0.001).Celastrol can inhibit the proliferation of VSMCs and reduce the remodeling of injured vessels, and its mechanism may be related to the amelioration of vascular inflammation.
celastrol; vascular remodeling; network pharmacology; proliferation; inflammation
R285.5
A
0253 - 2670(2023)15 - 4874 - 08
10.7501/j.issn.0253-2670.2023.15.013
2023-03-03
国家自然科学基金项目面上项目(82274159);国家自然科学基金项目面上项目(81973668);国家自然科学基金项目面上项目(81774130);湖南省自然科学基金科药联合基金资助项目(2022JJ80088);湖南省教育厅项目(20A375,22B0355);湖南省卫生健康委员会重点指导课题(202213055529);长沙市科技局科研项目(No.kq2004060);中药粉体与创新药物省部共建国家重点实验室培育基地开放基金项目(21PTKF1004);湖南中医药大学研究生创新课题立项项目(2022CX76)
谷 佳,硕士研究生,研究方向为中医药防治动脉粥样硬化。Tel: 18867355372 E-mail: 5837677211@qq.com
通信作者:覃 丽,博士,教授,博士生导师,研究方向为心血管疾病的发病机制及其中医药防治。Tel: 15173172436 E-mail: lqin@hnucm.edu.cn
[责任编辑 李亚楠]

