基于UPLC-Q-TOF-MS技术白术多糖干预溃疡性结肠炎的代谢组学研究
杨 慧,蒋且英,刘 漩,李龚龙,廖正根*
基于UPLC-Q-TOF-MS技术白术多糖干预溃疡性结肠炎的代谢组学研究
杨 慧1,蒋且英2,刘 漩2,李龚龙1,廖正根1*
1. 江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004 2. 江西中医药大学 实验动物科技中心,江西 南昌 330004
研究白术多糖对溃疡性结肠炎(ulcerative colitis,UC)小鼠的影响,探讨白术多糖干预UC的代谢途径及可能的作用机制。采用葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导小鼠UC模型,给予白术多糖或美沙拉嗪干预后,测定小鼠体质量、疾病活动指数(disease activity index,DAI)评分及结肠长度;采用ELISA检测小鼠血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-10(interleukin-10,IL-10)水平及超氧化物歧化酶(superoxide dismutase,SOD)、髓过氧化物酶(myeloperoxidase,MOP)活性;采用苏木素-伊红(HE)染色观察结肠组织病理变化;采用超高效液相色谱-串联三重四极杆飞行时间质谱(UPLC-Q-TOF-MS)检测小鼠血清内源性代谢物水平,并结合主成分分析和正交偏最小二乘法判别分析对差异代谢物进行表征,筛选出潜在的差异代谢物;采用MetaboAnalyst 5.0网址分析可能的代谢通路。白术多糖显著改善UC小鼠的症状和结肠组织病理损伤,提高血清中IL-10水平和SOD活性(<0.05、0.01),降低TNF-α水平和MPO活性(<0.05、0.01),并通过α-亚麻酸代谢通路、类固醇激素生物合成通路、初级胆汁酸生物合成通路、甘油磷脂代谢、泛酸和辅酶A生物合成通路、不饱和脂肪酸生物合成通路等代谢途径回调UC小鼠的异常代谢产物。白术多糖具有防治UC的作用,其机制可能与平衡促炎因子与抗炎因子、增强抗氧化和调节脂质代谢等通路相关。
白术多糖;溃疡性结肠炎;代谢组学;促炎因子;抗炎因子;氧化应激;脂质代谢
溃疡性结肠炎(ulcerative colitis,UC)是一种肠道非特异性、慢性、复发性、炎症性疾病,主要特征为结肠黏膜上皮损伤和肠道内稳态破坏,表现为体质量减轻、腹痛、带血黏液腹泻、直肠萎缩,严重影响患者生活质量,UC在我国患病率逐年增加[1]。目前常用的UC治疗药物包括氨基水杨酸盐、皮质类固醇和免疫抑制剂[2],然而,这些药物往往伴随着不良反应,且部分患者仍需要手术,因此,迫切需要开发安全有效的防治UC的药物。
白术具有健脾益气、燥湿利水的功效,用于脾虚食少、腹胀泄泻等有近数千年历史,其主治证候与UC一致,动物实验证明白术具有抗UC的作用[3]。白术作为一种重要的补益类中药,多糖是其重要活性成分,主要由葡萄糖、鼠李糖、阿拉伯糖、甘露糖、果糖、木糖和半乳糖等组成[4]。UC发病机制复杂,具有定性定量准确、覆盖面广、灵敏度高、高通量等优点的非靶向代谢组学检测技术为从整体上揭示药物作用机制提供了可能。故本研究在证实白术多糖具有抗UC作用的基础上,进一步采用代谢组学技术探讨其对UC的作用机制,为白术多糖用于UC防治提供理论和实践基础。
1 材料
1.1 动物
SPF级雄性BALB/c小鼠72只,8周龄,体质质量18~22 g,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2019-0004。动物饲养于温度22~24 ℃、相对湿度50%~60%的屏障环境中,12 h光照/黑暗交替,自由进食饮水,适应性饲养7 d。动物实验经江西中医药大学动物实验科技中心伦理委员会批准(批准号JZLLSC20230350)。
1.2 药材
白术饮片(批号04)产地为安徽省鹿邑县郑集市,经江西中医药大学张寿文教授鉴定为菊科植物白术Koidz.的干燥根茎。
1.3 药品与试剂
-无水葡萄糖(批号110833~201908)购自中国食品药品检定研究院;右旋葡聚糖硫酸钠(dextran sulfate sodium,DSS,批号160110)购自美国MP公司;美沙拉嗪肠溶片(批号210706)购自葵花药业佳木斯鹿灵制药有限公司;粪便隐血定性检测试剂盒(匹拉米洞法,批号1031A22)购自北京雷根生物技术有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号20221206)、髓过氧化物酶(myeloperoxidase,MOP)试剂盒(批号20221205)、白细胞介素-10(interleukin-10,IL-10)试剂盒(批号H009-1-2)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(批号H052-1-2)均购自南京建成生物有限公司;苏木素-伊红(HE)染液(批号20221129)购自江苏凯基生物技术股份有限公司。
1.4 仪器
TripleTOF5600型高分辨飞行时间质谱联用仪(美国AB SCIEX公司);BAS124S型电子天平(赛多利斯科学仪器北京有限公司);Tecan Spark多功能酶标仪(南昌树森实业有限公司);PLUS-E2-10TH型实验室级超纯水机(南京易普易达科技发展有限公司);真空干燥箱(上海新苗医疗器械制造有限公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司)。
2 方法
2.1 白术多糖的制备
取白术饮片100 g,粉碎,加10倍量蒸馏水,回流提取3次,每次2 h,趁热滤过,合并滤液,减压浓缩至含生药0.2 g/mL,乙醇醇沉,醇沉终体积分数为80%,4 ℃静置24 h后真空抽滤,依次用无水乙醇-丙酮-石油醚(60~90 ℃)-无水乙醇洗涤沉淀,挥干有机试剂得淡黄色白术粗多糖。白术粗多糖用100 mL蒸馏水溶解,并与Sevage试剂(氯仿-正丁醇4∶1)按1∶3混合搅拌25 min,4000 r/min离心10 min,重复多次,直至无蛋白沉淀物。将上清液转移到透析袋(截留相对分子质量8000~14 000)中,分别在自来水、双蒸水中各透析24 h,透析过程中每隔2 h换水。透析结束后进行冷冻干燥,最终得到白色粉末状白术多糖,采用相同的方法制备3次,共得到白术多糖12.78 g。
2.2 多糖含量的测定
2.2.1 葡萄糖标准曲线的绘制 精密称取105 ℃干燥至恒定质量的无水葡萄糖标准品10 mg,蒸馏水溶解并定容至100 mL,得到质量浓度为0.1 mg/mL的葡萄糖标准溶液。精密量取无水葡萄糖标准溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,分别置于具塞试管中加水至2 mL,各精密加入5%苯酚溶液1 mL,摇匀,迅速加入浓硫酸5 mL,摇匀,放置10 min,置40 ℃水浴保温15 min,取出后冰水浴10 min,放置室温作为样品。以水经过相同处理后为空白对照,用紫外-可见分光光度计在490 nm波长处测定吸光度()值,以葡葡萄糖含量为横坐标(),以490值为纵坐标(),绘制标准曲线。
2.2.2 多糖含量的测定 精密称取干燥多糖样品5 mg,蒸馏水定容至100 mL量瓶中,采用苯酚-硫酸法,移取白术多糖溶液0.8 mL,按照“2.2.1”项下方法操作,用紫外-分光光度计在490 nm波长处测定,平行3次,取平均值,测得值,带入标准曲线的回归方程,计算总糖含量。
2.3 动物造模与给药
BALB/c小鼠适应性喂养7 d后,随机分为对照组、模型组及白术多糖低、中、高剂量(60、100、200 mg/kg)组和美沙拉嗪(300 mg/kg)组,实验组每组12只。对照组每日饮用蒸馏水,其余组连续12 d自由饮用2.5% DSS溶液。从造模第1天起,各给药组ig相应药物(20 mL/kg),对照组和模型组ig等体积蒸馏水,1次/d,连续12 d。
2.4 小鼠一般状态及疾病活动指数(disease activity index,DAI)评分测定
每日记录小鼠体质量、精神活动状态、毛发光泽、大便性状和便血情况,进行DAI评分[5],评分标准见表1。
DAI=体质量降低评分+大便性状评分+便血评分

表1 DAI评分
2.5 小鼠血清炎性因子及氧化应激指标检测
末次给药后,小鼠禁食不禁水12 h,摘眼球取血于抗凝管中,3500 r/min(离心半径10 cm)离心15 min,取上清液,−80 ℃保存备用。按试剂盒说明书检测血清中TNF-α、IL-10水平及SOD、MPO活性。
2.6 小鼠结肠组织病理学观察
小鼠给予异氟烷安乐死,迅速取出结肠,称定质量并记录结肠长度,经固定、脱水、包埋、切片、HE染色后封片,于显微镜下观察并拍照。
2.7 代谢组学血清样本制备
取−80 ℃保存的血清样本,4 ℃解冻。取100 μL血清样本于2 mL离心管中,加入300 μL含0.1%甲酸的甲醇,涡旋60 s,4 ℃、12 000 r/min离心15 min,取上清液,转移至2 mL离心管中,室温下真空浓缩干燥至干。残渣加入50 μL 70%甲醇复溶,4 ℃、12 000 r/min离心15 min,取上清液,待测。
2.8 质谱条件
利用UHPLC-Q-TOF-MS正离子模式采集血清样本,Ultimate UHPLC XB-C18色谱柱(100 mm×2.1 mm,1.8 μm),流动相为0.1%甲酸水溶液(A)- 乙腈(B),梯度洗脱:0~8 min,10%~60% B;8~30 min,60%~95% B;30~32 min,95% B;32~37 min,95%~10% B;柱温30 ℃;体积流量0.3 mL/min;进样量10 μL。采用ESI电喷雾离子源,扫描范围/100~1500;喷雾电压5.5 kV;离子源温度500 ℃;去簇电压100 V;碰撞能量45 eV;碰撞能量叠加15 eV;气帘气压力275.8 kPa;雾化气(GS1)和辅助气(GS2)压力均为344.8 kPa;数据采集时间37 min,采用TOF-MS-IDA-MS/MS方式采集数据。
2.9 数据处理及统计学分析
3 结果
3.1 多糖含量测定
采用苯酚硫酸法检测白术多糖的总糖含量,标准曲线的回归方程为=0.007 8+0.199,2=0.998 1,计算得到白术多糖质量分数为75.9%。
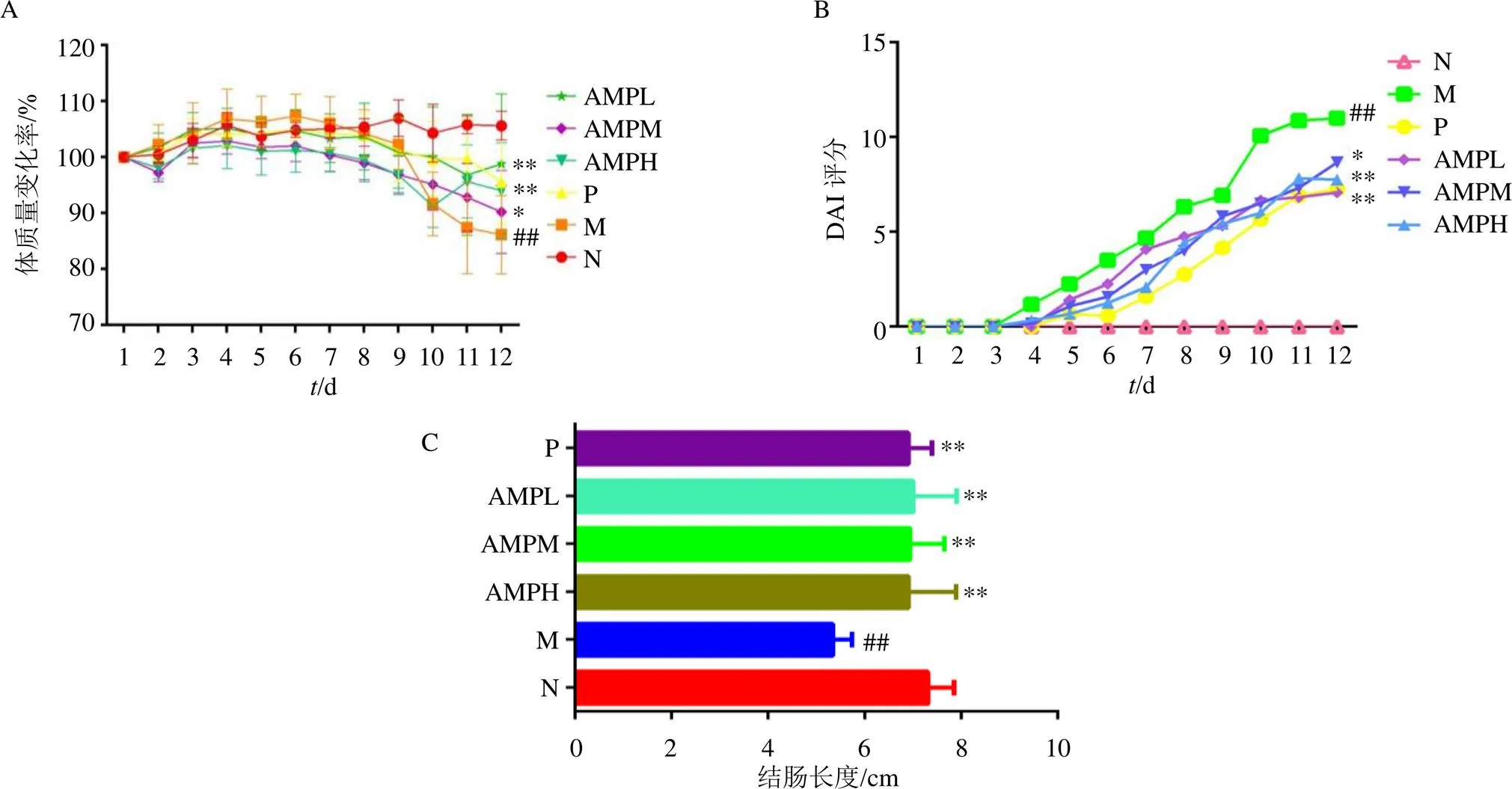
3.2 白术多糖对UC小鼠体质量变化率、DAI评分和结肠长度的影响
实验期间,对照组小鼠状态良好;模型组小鼠毛色暗淡,出现懒动、血便、稀便等状况。经美沙拉嗪及白术多糖干预后,UC小鼠上述状况均有所改善。如图1所示,与对照组比较,模型组小鼠体质量显著降低(<0.01),DAI评分显著升高(<0.01),结肠长度显著缩短(<0.01);与模型组比较,美沙拉嗪组小鼠体质量显著升高(<0.01),DAI评分显著降低(<0.01),结肠长度显著增加(<0.01);白术多糖各剂量组小鼠体质量均显著升高(<0.05),白术多糖中、高剂量组小鼠DAI评分均显著降低(<0.05、0.01),结肠长度均显著增加(<0.01)。
3.3 白术多糖对UC小鼠血清中炎症因子及氧化应激指标的影响
如图2所示,与对照组比较,模型组小鼠血清中MPO活性和TNF-α水平均显著升高(<0.01),SOD活性和IL-10水平均显著降低(<0.01);与模型组比较,各给药组小鼠血清中MPO活性和TNF-α水平均显著降低(<0.05、0.01),SOD活性和IL-10水平均显著升高(<0.05、0.01)。
3.4 白术多糖对UC小鼠结肠组织病理变化的影响
如图3所示,模型组小鼠结肠黏膜可见溃疡,隐窝消失,杯状细胞溶解,并伴有大量炎性细胞浸润;白术多糖中剂量组黏膜充血,但杯状细胞结构较为完整;美沙拉嗪组及白术多糖高、低剂量组小鼠结肠黏膜未见溃疡及充血,炎性细胞浸润减少,炎症得到改善。
N-对照组 M-模型组 P-美沙拉嗪组 AMPH-白术多糖高剂量组 AMPM-白术多糖中剂量组 AMPL-白术多糖低剂量组 与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同

图2 白术多糖对UC小鼠血清中炎症因子及氧化应激指标的影响(, n = 12)

箭头表示炎症细胞浸润
3.5 白术多糖对UC小鼠血清代谢组学的影响
3.5.1 血清代谢图谱 应用UPLC-Q-TOF/MS进行血清样品的分离和数据采集,得到各组小鼠血清代谢图谱(图4),各组样品总离子流图基本相似,但各组峰形及峰面积存在一定差异,表明小鼠体内部分代谢物发生变化。
3.5.2 代谢轮廓分析 采用PCA分别对血清的代谢轮廓进行分析,结果见图5。各组样本聚集在95%的置信区间内,分为3类,其中对照组、美沙拉嗪组和白术多糖高、低剂量组为1类,模型组为1类,白术多糖中剂量组为一类,分离程度较高,说明3组代谢物组间差异较大。经DSS诱导后,模型组独自位于一侧,提示代谢物的种类或水平发生了显著变化;给予药物干预后,白术多糖高、低剂量组及美沙拉嗪组明显向对照组靠近。白术多糖中剂量组被分为另外一类,但和模型组还是存在明显的分类差别,说明白术多糖中剂量组也对DSS诱导的小鼠存在治疗作用,只是和白术多糖高、低剂量组表达程度不同,代谢轮廓结果与体质量变化率、炎症因子测定和病理切片的结果相呼应,说明给药无量效关系。
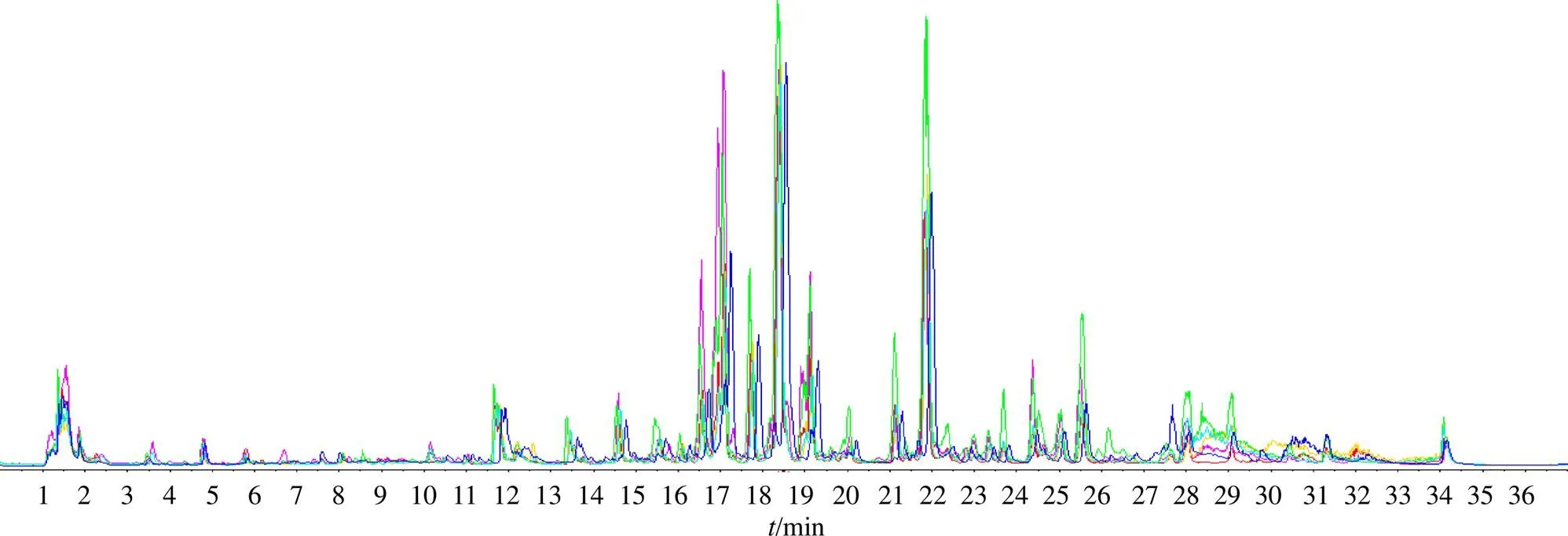
图4 各组样品总离子流图

图5 各组样品PCA得分图
3.5.3 OPLS-DA 在PCA的基础上进行OPLS-DA,模型组与各给药组完全分离,为防止模型出现过拟合,对模型进行200次随机置换检验,血清样品的2所在回归线与轴的截距均小于0,表明模型质量良好。S-plot载荷图能够鉴定出导致组间差异的代谢物,图中的点距离原点越远,表明此化合物对分组的影响越大,Scatter图综合了VIP值,其离原点越远,表明此化合物为显著的差异代谢物,二者可以同时表征血清组间的差异代谢物(图6)。
3.5.4 差异代谢物的鉴定 根据峰面积、FC及值构建火山图,见图7,根据VIP>1筛选出差异代谢物,再根据文献及HMDB数据库在小鼠血清中鉴定出59个差异代谢物,见表2。
3.5.5 代谢通路分析 将获得的差异代谢物导入MetaboAnalyst 5.0进行通路分析,结果见图8,以impact>0.1、<0.05为目标,筛选出与白术多糖干预UC小鼠相关通路,影响最强的分别为α-亚麻酸代谢通路、类固醇激素生物合成通路、初级胆汁酸生物合成通路、甘油磷脂代谢、泛酸和辅酶A生物合成通路、不饱和脂肪酸的生物合成通路。

图6 各组OPLS-DA得分图、200次置换检验图、S-plot载荷图及Scatter图

A-对照组vs模型组 B-模型组vs美沙拉嗪组 C-模型组vs白术多糖高剂量组 D-模型组vs白术多糖中剂量组 E-模型组vs白术多糖低剂量组

表2 各组样品血清差异代谢物

续表2
“↑”表示模型组上调,“↓”表示模型组下调
“↑” means that the model group is up-regulated, and “↓” means that the model group is down-regulated
4 讨论
4.1 白术多糖对UC小鼠血清氧化应激的影响
炎症反应和氧化应激是UC发展的重要因素,在结肠炎症区域,由于炎症介质的增多和抗炎因子的减少[6],一方面,会刺激机体产生和释放大量活性氧;另一方面又会使清除自由基的SOD等酶活性降低,两者均会使活性氧不断积累,从而引起结肠组织的损伤,这是UC的一种潜在致病因素[7]。MPO是单核细胞和中性粒细胞的一种成分,可产生高水平的活性氧。MPO在临床上常被用作观察中性粒细胞浸润到肠黏膜的标志物[8]。本研究结果显示,白术多糖能够显著降低UC小鼠MPO活性,提高SOD活性,表明抗氧化损伤是白术多糖防治UC的机制之一。
4.2 白术多糖对UC小鼠血清炎性因子的影响
TNF-α是一种由巨噬细胞、淋巴细胞和嗜中性粒细胞等多种细胞分泌的强促炎细胞因子,可促进氧氮介质释放,或直接激发上皮-间质转化,促使上皮细胞恶变,在细胞增殖、分化和凋亡中起重要作用[9]。IL-10是由Treg细胞、Th2细胞、肠道上皮细胞、巨噬细胞等多种细胞分泌的抑炎因子[10],本研究结果表明白术多糖能够显著抑制UC小鼠血清中TNF-α水平,并明显提高抗炎因子IL-10水平,抑制机体的炎症反应,因此,调节抗炎与促炎因子的平衡,可能是白术多糖防治UC的又一机制。
4.3 白术多糖对UC小鼠血清代谢产物及代谢通路的影响
基于UHPLC-Q-TOF-MS对UC小鼠血清样本进行代谢组学分析,在样本中鉴定得到59个差异代谢物,主要包括7种脂肪酸衍生物、3种胆汁酸、4种类固醇脂质分子、7种不饱和脂肪酸、12种酰基肉碱、9种溶血磷脂酰胆碱、5种溶血磷脂酰乙醇胺和其他化合物。与对照组比较,模型组59种代谢物均异常表达,提示UC小鼠体内代谢水平紊乱;经白术多糖以及美沙拉嗪干预后,发生改变的代谢物水平均有不同程度的回调,主要涉及α-亚麻酸代谢通路、类固醇激素生物合成通路、初级胆汁酸生物合成通路、甘油磷脂代谢、泛酸和辅酶A生物合成通路、不饱和脂肪酸的生物合成通路等代谢通路。通过对比模型组和白术多糖给药组的代谢物水平,发现白术多糖给药后小鼠血清代谢物水平整体趋向于对照组和美沙拉嗪组,提示白术多糖与美沙拉嗪类似,可能通过改善相关代谢过程,发挥治疗UC的作用。
4.4 白术多糖影响的UC小鼠血清代谢产物及代谢通路与表型的关系
磷脂酰胆碱(phosphatidylcholines,PC)和磷脂酰乙醇胺(phosphatidylethanolamine,PE)等甘油磷脂是生物膜的主要脂质成分,在维持膜结构、保证膜结合蛋白、离子通道和受体的正常运作过程中发挥重要作用,由不同长度和饱和度的脂肪酸组合而成[11-12],在肠炎过程中常发生甘油磷脂代谢异常[13-14]。PC在磷脂酶A2作用下水解产生溶血磷脂酰胆碱[15]。溶血磷脂酰胆碱作为趋化介质,可通过特异性G蛋白偶联受体对免疫细胞活化的修饰从而参与炎症过程[16]。溶血磷脂酰胆碱含量过高时会对细胞膜造成损伤,进一步导致磷脂代谢紊乱[17],并进一步损伤细胞膜,从而导致组织损伤。由于甘油磷脂的C-2通常连接不饱和脂肪酸,因此,甘油磷脂在磷脂酶A2的作用下导致溶血磷脂增加的同时,也会导致不饱和脂肪酸增加。本研究发现,与对照组比较,模型组不饱和脂肪酸、溶血磷脂酰胆碱和溶血磷脂酰乙醇胺差异代谢物表达均升高,而白术多糖给药后其含量显著下调,提示白术多糖可通过调节甘油磷脂和不饱和脂肪酸代谢,减轻细胞膜损伤,稳定细胞结构,增强结肠的屏障功能,从而改善UC小鼠的体质量变化率、DAI评分、结肠长度和结肠组织病理变化等表型。
类固醇激素和初级胆汁酸合成途径从胆固醇开始,本研究中模型组19-去甲雄甾酮、硫酸表雄酮、醛固酮等4种类固醇代谢物以及考胆酸、3α,7α-二羟基考前列烷酸、10-氧代十八烷酸3种胆汁酸代谢物显著上调。类固醇激素通过与特定的细胞内受体相结合,通过刺激核因子-κB(nuclear factor-κB,NF-κB)等多种信号转导途径[18]来促进TNF-α的形成,抑制IL-10的形成,从而促进炎症发生;胆汁酸代谢紊乱在肠道炎症中起着重要作用[19],可激活与NF-κB信号通路密切相关的法尼醇X受体(farnesoid X receptor,FXR)[20-21]。NF-κB调节免疫和炎症反应,可诱导TNF-α的生成[22]。TNF不仅可以诱导炎症介质的表达,还可触发细胞死亡,调控炎症性疾病的发病机制[23]。本研究结果表明,给予白术多糖后,以上代谢产物均回调,提示白术多糖可通过调节类固醇激素和初级胆汁酸生物合成通路抑制NF-κB途径,调节抑炎与促炎因子的平衡,减少炎症细胞损伤,从而改善UC。
中药量效关系仍处于经验积累阶段[24],白术多糖高、中、低剂量组在防治DSS诱导的UC均有明显的效果,但是白术多糖不同剂量组在体质量变化率、DAI评分、结肠长度、氧化应激、病理损伤、和代谢组学分类结果方面没有显示出明显的剂量相关性,白术多糖中剂量组代谢轮廓结果与体质量变化率、DAI评分和氧化应激等表型结果相呼应,提示白术多糖给药不存在明显的量效关系。
综上,白术多糖可以通过调节内源性代谢产物来平衡促炎因子与抗炎因子,增强抗氧化和调控脂质、类固醇等相关代谢通路,从而干预UC的发展,为多糖用药的开发提供了理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 张孟爽, 郑晓者, 牛敏, 等. 益生菌治疗结肠炎大鼠前后肠道菌群变化及毒力因子检测分析 [J]. 中国抗生素杂志, 2018, 43(10): 1257-1262.
[2] 张孟爽, 牛敏, 刘淑敏, 等. 益生菌VSL#3对DSS大鼠结肠炎TLR4-NF-κB通路的调节作用 [J]. 中国抗生素杂志, 2019, 44(5): 643-647.
[3] 杨丹阳, 于欢, 吴晓莹, 等. 白术化学成分及其生物活性研究进展 [J]. 中华中医药学刊, 2023, 41(5): 171-182.
[4] 杨颖, 魏梦昕, 伍耀业, 等. 白术多糖提取分离、化学组成和药理作用的研究进展 [J]. 中草药, 2021, 52(2): 578-584.
[5] Cooper H S, Murthy S N, Shah R S,. Clinicopathologic study of dextran sulfate sodium experimental murine colitis [J]., 1993, 69(2): 238-249.
[6] Li B L, Du P L, Du Y,. Luteolin alleviates inflammation and modulates gut microbiota in ulcerative colitis rats [J]., 2021, 269: 119008.
[7] Dong L L, Du H L, Zhang M Y,. Anti-inflammatory effect of rhein on ulcerative colitis via inhibiting PI3K/Akt/mTOR signaling pathway and regulating gut microbiota [J]., 2022, 36(5): 2081-2094.
[8] Sanchez-Munoz F, Dominguez-Lopez A, Yamamoto-Furusho J K. Role of cytokines in inflammatory bowel disease [J]., 2008, 14(27): 4280-4288.
[9] Bischoff S C, Barbara G, Buurman W,. Intestinal permeability: A new target for disease prevention and therapy [J]., 2014, 14: 189.
[10] 刘岚, 郑玉强, 景春梅, 等. 儿童全身炎症反应综合征内毒素水平与IL-6、IL-10、TNF-α及PCT的动态监测 [J]. 中国抗生素杂志, 2008, 33(5): 297-299.
[11] Fokina N N, Ruokolainen T R, Bakhmet I N,. Role of lipids in adaptation of musselsL. of the White Sea to rapid changes in temperature [J]., 2014, 457: 155-157.
[12] Kertys M, Grendar M, Kosutova P,. Plasma based targeted metabolomic analysis reveals alterations of phosphatidylcholines and oxidative stress markers in guinea pig model of allergic asthma [J]., 2020, 1866(1): 165572.
[13] Martin F P, Rezzi S, Philippe D,. Metabolic assessment of gradual development of moderate experimental colitis in IL-10 deficient mice [J]., 2009, 8(5): 2376-2387.
[14] 赵丽丽. NSAIDs干预RAW264.7细胞炎症模型甘油磷脂代谢的UPLC-Q/TOF MS分析 [D]. 广州: 广东药学院, 2012.
[15] 贾冰洁. 基于UPLC-QTOF-MS技术的炎症性肠病的血浆代谢组学研究 [D]. 广州: 华南理工大学, 2020.
[16] Nietgen G W, Durieux M E. Intercellular signaling by lysophosphatidate [J]., 1998, 5(3): 221-235.
[17] Cho W H, Yeo H J, Yoon S H,. Lysophosphatidylcholine as a prognostic marker in community-acquired pneumonia requiring hospitalization: A pilot study [J]., 2015, 34(2): 309-315.
[18] Edwards D P. Regulation of signal transduction pathways by estrogen and progesterone [J]., 2005, 67: 335-376.
[19] Wong B S, Camilleri M, Carlson P,. Increased bile acid biosynthesis is associated with irritable bowel syndrome with diarrhea [J]., 2012, 10(9): 1009-1015.
[20] Gadaleta R M, van Erpecum K J, Oldenburg B,. Farnesoid X receptor activation inhibits inflammation and preserves the intestinal barrier in inflammatory bowel disease [J]., 2011, 60(4): 463-472.
[21] Gadaleta R M, Oldenburg B, Willemsen E C,. Activation of bile salt nuclear receptor FXR is repressed by pro-inflammatory cytokines activating NF-κB signaling in the intestine [J]., 2011, 1812(8): 851-858.
[22] Ji G Q, Chen R Q, Zheng J X. Macrophage activation by polysaccharides fromKoidz. through the nuclear factor-κB pathway [J]., 2015, 53(4): 512-517.
[23] van Loo G, Bertrand M J M. Death by TNF: A road to inflammation [J]., 2023, 23(5): 289-303.
[24] 李冀, 郭钟秀, 徐佳悦, 等. 中药干预心肌缺血再灌注损伤量效关系研究进展 [J]. 中华中医药学刊, 2022, 40(10): 8-11.
Metabolomic study ofpolysaccharide intervention in ulcerative colitis based on UPLC-Q-TOF-MS technology
YANG Hui1, JIANG Qie-ying2, LIU Xuan2, LI Gong-long1, LIAO Zheng-gen1
1. Key Laboratory of Modern Preparation of Traditional Chinese Medicine, Ministry of Education, Jiangxi University of Chinese Medicine, Nanchang 330004, China 2. Experimental Animal Science and Technology Center, Jiangxi University of Chinese Medicine, Nanchang 330004, China
To study the effects ofpolysaccharide (AMP) on ulcerative colitis (UC) mice, and investigate the metabolic pathways and possible mechanisms of AMP intervention in UC.A mice UC model was induced with dextran sulfate sodium (DSS), after the intervention of AMP or mesalazine, body weight, disease activity index (DAI) score and colon length were recorded; Levels of tumor necrosis factor-α (TNF-α), interleukin-10 (IL-10) and activities of superoxide dismutase (SOD), myeloperoxidase (MOP) in serum of mice were measured by ELISA; HE staining was used to observe the pathological changes of colon tissue; The levels of endogenous metabolites in serum of mice were detected by ultra performance liquid chromatography-tandem triple quadrupole time-of-flight mass spectrometry (UPLC-Q-TOF-MS), the differential metabolites were characterized by principal component analysis and orthogonal partial least squares-discriminant analysis, and the potential differential metabolites were screened out. The website of MetaboAnalyst 5.0 was used to analyze the possible metabolic pathways.AMP significantly improved the symptoms and pathological damage of colon tissue in UC mice, increased IL-10 level and SOD activity in serum (< 0.05, 0.01), decreased TNF-α level and MPO activity (< 0.05, 0.01), modulated the abnormal metabolites in UC mice by α-linolenic acid, steroid hormone biosynthesis, primary bile acid biosynthesis, glycerophospholipid metabolism, pantothenic acid and coenzyme A biosynthesis and unsaturated fatty acid biosynthesis metabolic pathways.AMP has a preventive and curative effect on UC, and its mechanism may be related to balancing pro-inflammatory factors and anti-inflammatory factors, enhancing antioxidation and regulating lipid metabolism.
polysaccharide; ulcerative colitis; metabolomics; pro-inflammatory factors; anti-inflammatory factors; oxidative stress; lipid metabolism
R285.5
A
0253 - 2670(2023)15- 4895 - 10
10.7501/j.issn.0253-2670.2023.15.015
2023-04-18
国家自然科学基金资助项目(81660757);江西中医药大学校级创新创业训练计划项目(x202310412247)
杨 慧(1999—),女,硕士研究生,从事中药新剂型与新技术研究。Tel: 18228548353 E-mail: 2316359352@qq.com
通信作者:廖正根(1967—),男,博士生导师,教授,从事中药新剂型新技术与体内过程评价研究。 Tel: (0791)87118658 E-mail: lyzlyg@163.com
[责任编辑 李亚楠]

