基于指纹图谱和网络药理学的秦皮质量标志物(Q-Marker)预测分析
徐蓓蕾,孙文斌,王 昊, 2, 3,王金宏, 2, 3,胡 扬, 2, 3,杨 波, 2, 3,刘晶晶,杨娜娜,周恩宝,韩晓宇,刘树森,武文琪,李文兰, 2, 3*
基于指纹图谱和网络药理学的秦皮质量标志物(Q-Marker)预测分析
徐蓓蕾1, 2, 3, 4,孙文斌1,王 昊1, 2, 3,王金宏1, 2, 3,胡 扬1, 2, 3,杨 波1, 2, 3,刘晶晶5,杨娜娜1,周恩宝6,韩晓宇1,刘树森1,武文琪1,李文兰1, 2, 3*
1. 哈尔滨商业大学药学院,黑龙江 哈尔滨 150076 2. 抗肿瘤天然药物教育部工程研究中心,黑龙江 哈尔滨 150076 3. 黑龙江省预防与治疗老年性疾病药物研究重点实验室,黑龙江 哈尔滨 150076 4.中药制药与新药开发教育部工程研究中心,北京 102488 5.中国食品药品检定研究院,北京 100050 6. 鲁南制药集团股份有限公司医学部,山东 临沂 276000
在中药质量标志物(quality marker,Q-Marker)“五原则”指导下,基于指纹图谱和网络药理学方法,从可测性和有效性角度分析预测秦皮潜在的Q-Marker。建立15批秦皮饮片指纹图谱,进行聚类分析(hierarchical cluster analysis,HCA)、主成分分析(principal component analysis,PCA)和偏最小二乘判别分析(partial least-squares discrimination analysis,PLS-DA),运用网络药理学方法构建“成分-靶点-通路”网络图,并预测秦皮饮片的Q-Marker,同时进行定量分析。建立了15批秦皮饮片指纹图谱,在21个共有峰中指认出4号峰为秦皮苷、6号峰秦皮乙素、7号峰秦皮素、9号峰秦皮甲素,HCA、PCA和PLS-DA结果大体相符,网络药理学筛选出潜在的21个活性成分、129个核心靶点、159条关键通路,整合指纹图谱、模式识别及网络药理学方法,共同辨识出可测性、有效性、特有性原则的潜在Q-Marker为秦皮苷、秦皮乙素、秦皮素、秦皮甲素,四者含量依次为0.93%~2.51%、0.98%~1.41%、0.71%~1.09%、0.66%~1.25%。整合指纹图谱、模式识别和网络药理学分析预测了秦皮潜在的Q-Marker,为全面控制和评价秦皮饮片质量提供科学依据,为多基原中药质量标准的研究提供理论参考。
秦皮饮片;质量标志物;指纹图谱;网络药理学;多元统计分析;秦皮苷;秦皮乙素;秦皮素;秦皮甲素
秦皮始载于《神农本草经》,列为中品,为木犀科植物苦枥白蜡树Hance、白蜡树Roxb.、尖叶白蜡树Lingelsh.、宿柱白蜡树Lingelsh.的干燥枝皮或干皮。其苦、涩,性寒,归肝、胆、大肠经。具有清热燥湿、收涩止痢、止带、明目等功效,主要用于治疗湿热泻痢、赤白带下、目赤肿痛、目生翳膜、细菌性痢疾、慢性支气管炎、牛皮癣等症。秦皮主要分布在辽宁、吉林、河北、河南、内蒙古、陕西、山西、四川等地。其化学成分主要包括香豆素类、木脂素类、裂环环烯醚萜类、苯乙醇苷类、黄酮类、酚酸类、三萜类等,现代药理学研究表明秦皮具有抗菌、抗炎镇痛、抗肿瘤、止咳祛痰、降低血尿酸等作用[1-2]。
刘昌孝院士秉持着“传承不泥古,创新不离宗,论证以求真”的理念,提出了中药质量标志物(quality marker,Q-Marker)的概念,是中药质量评价与质量控制领域的重大突破,其基于溯源与传递性、特有性、可测性、有效性以及处方配伍5条核心原则,将中药有效性(药性和药效)-物质基础-质量控制标志性成分相整合,与中药的功能属性密切相关,且能够反映中药安全性和有效性,为中药质量控制提供科学依据,成为本领域的有利“抓手”[3-4]。中药指纹图谱是目前较为成熟的发现共有成分的方法,化学模式识别技术可较好地迎合指纹图谱的整体性和模糊性要求,能够客观地反映中药整体性和差异性[5]。网络药理学能够从整体观角度构建药物靶点间互作关系的生物网络,有效预测相关靶点和通路的分析手段,发现药物作用机制,呈现系统性与整体性,对于有效挖掘Q-Marker具有重要意义[6]。本研究基于Q-Marker理论,整合高效液相色谱指纹图谱结合化学模式识别技术及网络药理学方法,从生物信息学和化学角度分析预测多基原多产地中药秦皮潜在的Q-Marker,建立秦皮饮片的质量控制研究方法,以期为秦皮整体质量控制研究提供参考依据。
1 仪器与试药
1.1 仪器
Waters alliance acquity-e2695高效液相色谱仪,包括四元泵、柱温箱、自动进样器、PDA检测器、Empower工作站(美国Waters公司);JM型电子分析天平(超泽公司);SK3310HP型超声波清洗器(上海科导公司)。
1.2 试药
对照品秦皮甲素(批号110740-201806)、秦皮乙素(批号110741-202109)、秦皮素(批号111731- 202103)均购自中国食品药品检定研究院,秦皮苷(批号wkq-00435)购买自四川维克奇有限公司,所有对照品质量分数均大于98%;甲醇(色谱级,默克公司);乙腈(色谱级,默克公司);娃哈哈纯净水(杭州娃哈哈集团有限公司);秦皮饮片(编号S1~S15)经哈尔滨商业大学药学院金哲雄教授鉴定为白蜡树Roxb.、苦枥白蜡树Hance.、尖叶白蜡树Lingelsh.、宿柱白蜡树Lingelsh. 的干燥枝皮,收集到的样品具体信息见表1及图1。
2 方法与结果
2.1 秦皮指纹图谱定性分析
2.1.1 色谱条件 采用Welch Ultimate&Reg XB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱:0~10 min,10%~16% A;10~13 min,16% A;13~23 min,16%~22% A;23~28 min,22%~30% A;28~48 min,30%~55% A;48~53 min,55%~90% A。体积流量1.0 mL/min,检测波长280 nm,柱温25 ℃,进样量10 µL。

图1 15批秦皮饮片性状鉴定(S1~S15)
2.1.2 对照品溶液的制备 分别取秦皮甲素、秦皮乙素和秦皮素、秦皮苷对照品适量,精密称定,加入甲醇溶解制成质量浓度分别为3.0、2.0、2.0、2.7 mg/mL混合对照品溶液,备用。
2.1.3 供试品溶液的制备 取秦皮饮片5 g,加7倍体积水浸泡30 min,回流提取30 min,滤过,残余药渣再加6倍体积水,继续提取20 min,滤过。合并滤液,加热至剩余20 mL。取10 mL秦皮水提液浓缩至浸膏状,将其以乙腈-水(1∶9)再次定容至10 mL,溶液过0.22 µm微孔滤膜,即得,其生药量为0.25 g/mL。
2.1.4 方法学考察
(1)参照峰的选择:《中国药典》2020版将秦皮甲素、秦皮乙素作为评价秦皮质量的指标性成分,其中秦皮甲素在对照色谱图中分离良好,峰形稳定,峰面积大,故确定秦皮甲素为参照峰(S),计算各共有峰的相对保留时间和相对峰面积。
(2)精密度试验:取S7号供试品溶液,在“2.1.1”项条件下连续进样6次,记录色谱图,结果表明S7各共有峰的相对保留时间RSD<2.31%,相对峰面积RSD<2.66%。
(3)重复性试验:取同一批S7号样品,按照“2.1.3”项下方法平行制备6份供试品溶液,按照“2.1.1”项下色谱条件进样,记录色谱图,结果表明S7各共有峰的相对保留时间RSD<2.08%,相对峰面积RSD<2.41%。
(4)稳定性试验:取S7号供试品溶液,分别0、2、4、6、8、10、12、24 h时按照“2.1.1”项下色谱条件进样,记录色谱图。结果表明S7各共有峰相对保留时间RSD<2.53%,相对峰面积RSD<2.33%,表明供试品溶液24 h内稳定。
2.1.5 指纹图谱的建立 将15批秦皮饮片的HPLC色谱图导入《中药指纹图谱相似度评价系统》(2012.130723版),得到21个共有峰,以S7为参照谱图,采用中位数法,进行多点校正和全谱峰匹配,生成对照指纹图谱(R),见图2。以对照指纹图谱为参照,计算共有峰相似度。结果表明,秦皮饮片指纹图谱相似度在0.991~0.998,分别为0.993、0.998、0.995、0.997、0.998、0.997、0.997、0.991、0.997、0.998、0.998、0.998、0.997、0.996、0.991,说明秦皮饮片质量稳定。将检测到21个共有峰与混合对照品溶液图谱比对,指认其中4个色谱峰,4号峰为秦皮苷、6号峰为秦皮乙素、7号峰为秦皮素、9号峰为秦皮甲素,见图3。
2.2 化学模式识别分析
2.2.1 层次聚类分析(hierarchical cluster analysis,HCA) 利用SPSS 20.0软件,聚类方法选择组间连接法,聚类距离采用欧式平方距离。依照“2.1”项下方法对S1~S15号秦皮饮片HPLC指纹图谱进行HCA,见图4。可以看出,当聚类距离为20时,15批秦皮饮片可分为3类,其中S3为第1类,样品为产自湖北的白蜡树;S2、S4、S5、S8~S10、S15为第2类,样品分别覆盖陕西、黑龙江、甘肃、河北、湖北等多个产地,样品基原以白蜡树和宿柱白蜡树为主;其他样品为第3类,大部分样品产于甘肃和陕西,但其基原均为苦枥白蜡树。当聚类距离为25时,15批秦皮饮片可分为2类,S2~S5、S8~S10、S15为第1类,多产于陕西、湖北和黑龙江,基原多为白蜡树和宿柱白蜡树;其他样品第2类,多产于陕西和甘肃,基原均为苦枥白蜡树。HCA结果能够直观地表明样品的基原和产地特征,其中基原一致的样品往往更倾向于聚为一类,说明对于多基原中药而言基原可以作为聚类的内在属性将样品进行较好地区分,但仍可能存在产地交叉的现象。

图2 15批秦皮饮片HPLC指纹图谱叠加图(S1~S15)

P4-秦皮苷 P6-秦皮乙素 P7-秦皮素P9-秦皮甲素

图4 15批秦皮饮片聚类分析树状图
2.2.2 主成分分析(principal component analysis,PCA) PCA是无监督学习的降维算法,可解释多个变量间的内部结构,即从原始变量中导出少数几个主要变量,同时使它们尽可能多地保留原始变量信息的多元统计的分析方法。利用SPSS 20.0软件,对15批秦皮饮片指纹图谱共有峰进行PCA分析,计算主成分特征值和方差贡献率,主成分1特征值9.441,主要反映第1、3、4(秦皮苷)、5、6(秦皮乙素)、9(秦皮甲素)、11、12、14~16、18~21号峰的信息,方差贡献率44.958%;主成分2特征值3.231,主要反映第10、17号峰的信息,方差贡献率15.386%;主成分3特征值2.199,主要反映第13号峰的信息,方差贡献率10.471%。前6个主成分的特征值均>1,累积方差贡献率>88.481%,能够代表15批秦皮饮片中21个成分的大部分信息,具有较好的代表性。因此可用该6个主成分代替指纹图谱21个共有峰来对秦皮进行评价,其中主成分1的特征值及贡献率最高,且能够反映15个峰值信息。
2.2.3 偏最小二乘法分析(partial least-squares discrimination analysis,PLS-DA) PLS-DA是有监督模式的数据分析方法,其包含了PCA、典型相关分析等多种思想,利用降维思想使提取后得到的特征变量不仅能很好地概括原始变量信息,也能对因变量有很强的解释能力,具有计算量小,预测精准度高,易于定性解释的特点,尤其是结合变量投影重要性分析(variable importance in the projection,VIP),能够较好地解决变量间的多重共线性问题。将15批秦皮饮片指纹图谱中各共有峰面积导入SIMPA-P 14.0软件,以15批样品中21个共有峰的峰面积为变量,组成1个15×21的新矩阵,采用SIMCA 14.1软件对新组成的矩阵进行PLS-DA。已建立的PLS-DA模型2(cum)=0.755,2(cum)=0.914,2(cum)=0.534,均大于0.5,说明该模型具有良好的预测与解释能力且未出现过拟合现象。根据VIP>1,筛选出峰1、4(秦皮苷)、5、6(秦皮乙素)、9(秦皮甲素)、11~13、15、18~21对组间差异影响较大的13个成分,与PCA主成分1所包含峰大体一致,结果见图5。说明上述成分可能是引起不同产地及基原秦皮饮片间差异的主要成分,其中,通过HPLC指纹图谱共有峰已指认的4(秦皮苷)、6(秦皮乙素)、9(秦皮甲素)号峰,能够秦皮潜在的Q-Marker,用于秦皮饮片的质量控制。
根据PLS-DA中图5-A的结果,表明15批秦皮饮片可分为4类,S3为单独一类,S2、S4、S5、S8~S10、S15为一类,与聚类距离为20时HCA结果完全一致。另外2类,样品基原均都来自苦枥白蜡树,但S7、S11~S13明显为一类,除了S7产地为陕西外,其余样品产地均为甘肃,S1、S6、S14为一类,其中样品S1和S16来自于陕西,S14产地为黑龙江。与HCA相比,PLS-DA能够将 HCA聚类距离为20的结果中,没有分开的第3类进行了更细化的分类,能够大致区分为甘肃和陕西2组。说明PLS-DA能够更直观显示出各组间差异,结果更准确、客观,能够与HCA结果实现互补。
2.3 网络药理学对秦皮饮片的Q-Marker预测分析
2.3.1 秦皮活性成分的筛选 通过中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)数据库(https://old.tcmsp-e.com/ tcmsp.php)检索秦皮所有的化学成分[7-8]。所得共21个化合物,分别为反-3,5-二甲氧基-4-羟基肉桂、芥子醇、3,4-二羟基肉桂酸、对羟基苯乙醇、丁香醛、刺五加苷、西托糖苷、β-谷甾醇、秦皮乙素、东莨菪内酯、秦皮甲素、秦皮素、2,6-二甲氧基-1,4-苯醌、熊果酸、三十烷酸、-苯基-2-萘胺、(2,3, 4,5,6)-2-[4-[(1,3a,4,6a)-6a-hydroxy-4-(4- hydroxy-3-methoxyphenyl)-3,3a,4,6-tetrahydro-1- furo[4,3-c]furan-1-yl]-2-methoxyphenoxy]-6-(hydroxy methyl)oxane-3,4,5-triol、8-羟基松脂醇、秦皮苷、osmanthuside H、芥子醛配糖物。以所得的化合物为数据基础,对成分的潜在靶点进行整理分析,共得到129个潜在靶点。同时通过Uniprot数据库(https://www.uniprot.org/)对已筛选的潜在靶点进行名称校对并对基因名称进行整理。

图5 PLS-DA的得分图(A)、3D图(B) 和VIP值图(C)
2.3.2 蛋白互作网络(protein-protein interaction networks,PPI)的构建 将所获得的129个潜在靶点信息,导入到STRING 11.5在线数据分析程序(https://cn.string-db.org/cgi/input.pl),设置物种为Homo sapines,蛋白交互分数高于0.4,其他参数不变,隐藏网络中没有连接的节点,获得PPI图,见图6。将所得到的PPI网络分析数据导入Cytoscape软件,利用CytoNCA插件对数据结果进行分析,选取“度中心性”(degree)、“介数中心性”(betweenness)、“接近中心性”(closeness)3个参数作为分析标准[9],选取前10个共同高分的点作为核心靶点,共得到7个核心靶点。分别是肿瘤坏死因子(tumor necrosis factor,TNF,degree=65)、白细胞介素-6(interleukin 6,IL6,degree=64)、血管内皮生长因子(vascular endothelial growth factor A,VEGFA,degree=58)、半胱氨酸蛋白酶-3(Caspase-3,CASP3,degree=57)、环磷酸腺反应元件结合蛋白(cyclic AMP-responsive element-binding protein 1,CREB1,degree=55)、c-Fos蛋白(FOS,degree=50)、雌激素受体(estrogen receptor,ESR1,degree=50),结果表明,以上潜在靶点主要与秦皮素(fraxetin)、β-谷甾醇(β-sitosterol)、秦皮乙素(esculetin)、咖啡酸(caffeic acid)、熊果酸(ursolic acid)有关。
2.3.3 基因本体(gene ontology,GO)功能富集分析与京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析
(1)GO功能富集分析:运用David分析程序对已整理的潜在靶点进行GO富集的生物过程(biological process,BP)、细胞组成(cellular component,CC)、分子功能(molecular function,MF)3个项目进行分析,共得到689条富集结果。其中MF 114条,主要富集在蛋白质结合、酶结合、大分子复合物结合、神经递质受体活性等;CC 66条,主要富集到质膜、核质、神经元投影、细胞质等;BP 509条,主要富集到对信号转导、药物的反应、细胞增殖正调控、炎症反应、RNA聚合酶II启动子转录的正调控、凋亡过程的正调控等过程。本研究针对基因富集度高的前30个结果进行绘图展示,见图7。
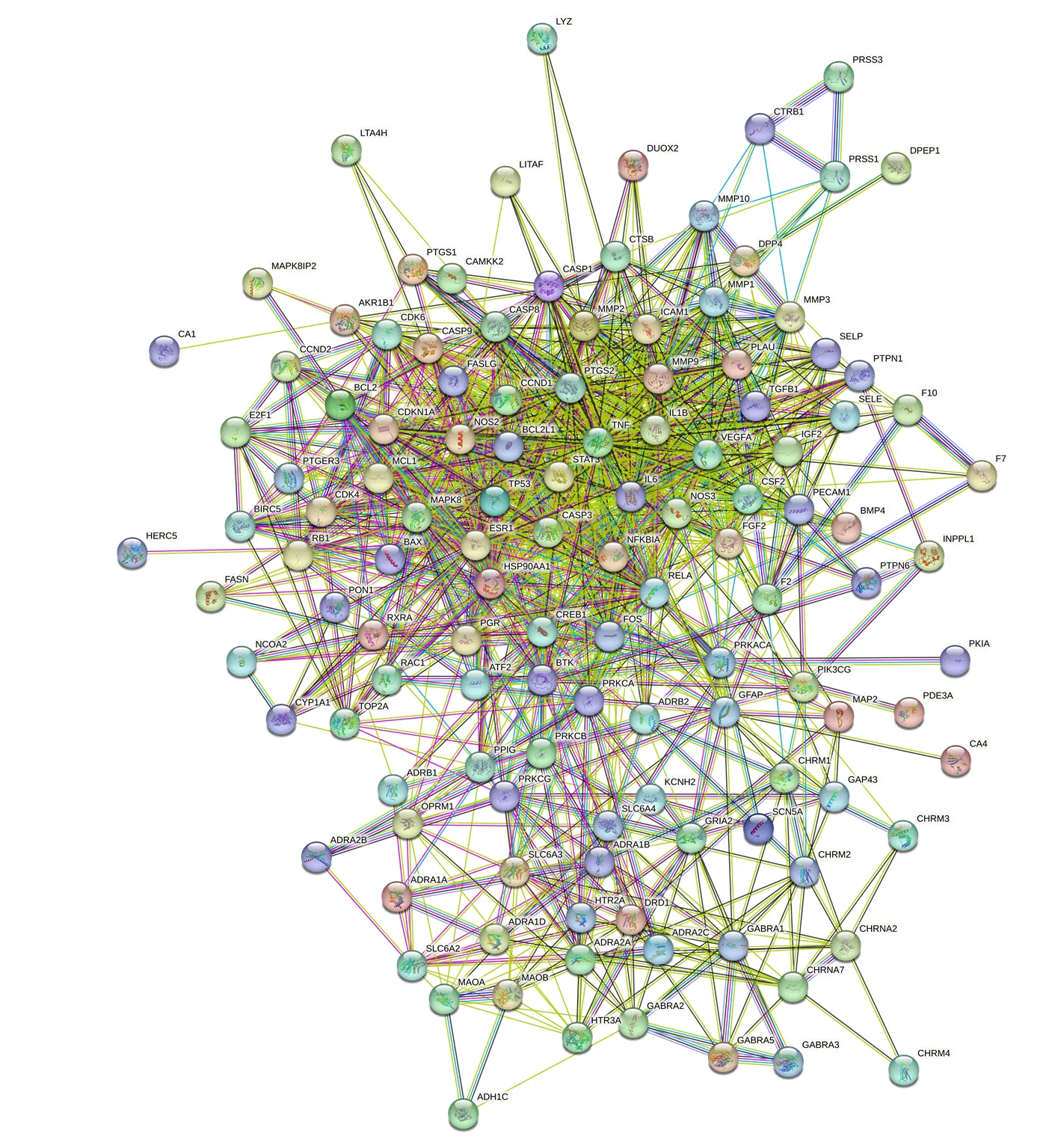
图6 秦皮相关潜在靶点PPI网络结构
(2)KEGG通路富集分析:通过David对潜在靶点进行KEGG通路富集分析,共得到159条富集通路数据结果,其中主要富集到的通路为癌症通路(pathways in cancer)、脂质与动脉粥样硬化(lipid and atherosclerosis)、人类巨噬细胞感染(human cytomegalovirus infection)、神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)、乙型肝炎(hepatitis B)、疱疹病毒感染(Kaposi sarcoma- associated herpesvirus infection)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、化学致癌作用-受体激活(chemical carcinogenesis-receptor activation)、神经变性途径-多种疾病(pathways of neurodegeneration- multiple diseases)等。本研究选取富集程度最高的30条KEGG通路展示,其中圆点大小表示通路所关联的基因数,颜色为通路富集分析结果值的负对数(-lg),数值越大颜色越红,反之越绿。其中癌症通路的值较小颜色偏红,且相比其他通路效果显著,见图8。
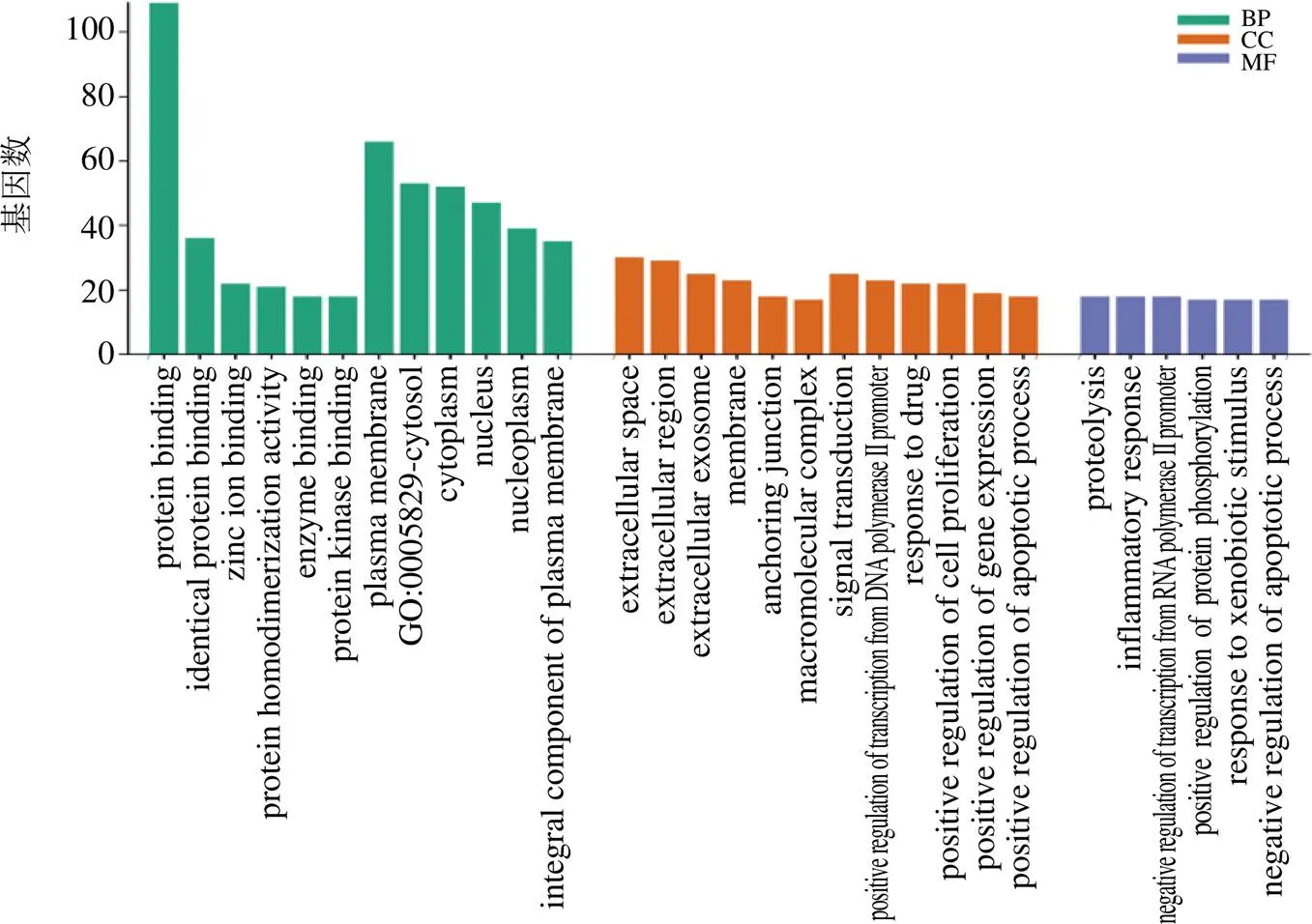
图7 秦皮GO富集分析结果

图8 秦皮KEGG通路富集分析结果
以上结果表明秦皮具有多成分、多靶点的作用特点,能够通过调节多种通路从而达到治疗疾病的目的。
2.3.4 有效成分相关网络关系构建 通过Cytoscape软件对整理的有效成分、潜在靶点、富集通路进行网络关系构建并绘图。用蓝色长方形表示有效成分,红色椭圆形表示潜在靶点,黄色菱形代表富集通路。利用边将各节点相连接以表示各节点间的关联性。其中,Pathways in cancer具有最高的富集相关基因数41个,degree最高的前10个潜在靶点分别为大鼠转录因子P65(transcription factor p65,RELA,degree=76)、蛋白激酶Cβ抗体(protein kinase Cβ type,PRKCB,degree=66)、蛋白激酶Cα抗体(protein kinase Cα type,PRKCA,degree=66)、丝裂原激活蛋白激酶8(mitogen-activated protein kinase 8,MAPK8,degree=65)、蛋白激酶Cγ抗体(protein kinase C γ type,PRKCG,degree=58)、人cAMP依赖性蛋白激酶α催化亚基(cAMP-dependent protein kinase catalytic subunit α,PRKACA,degree=57)、TNF(degree=57)、人细胞凋亡调节因子BAX(apoptosis regulator BAX,BAX,degree=50)、人核因子κB抑制蛋白α(NF-κB inhibitor alpha,NFKBIA,degree=49)、肿瘤抑制基因P53蛋白(cellular tumor antigen p53,TP53,degree=49)。以上靶点多与秦皮素(fraxetin)、β-谷甾醇(β-sitosterol)、秦皮乙素(esculetin)、咖啡酸(caffeic acid)、熊果酸(ursolic acid)有关。与PPI结果一致。见图9。
2.3.5 成分-靶点-通路分析 通过数据库筛选得出秦皮21个活性成分,包括秦皮苷、秦皮素、秦皮乙素、秦皮甲素、β-谷甾醇、8-羟基松脂醇等进行网络药理学分析,建立“成分-靶点-通路”的网络图,获得129个核心靶点、159条关键通路。PPI以及活性成分相关网络关系构建结果均显示秦皮素、β-谷甾醇、秦皮乙素、咖啡酸及熊果酸与潜在靶点关系密切。但由于β-谷甾醇广泛存在于富含脂质的植物中,具有多种生物活性[10],咖啡酸广泛存在于多种植物种,如升麻、薄荷、杜仲、蒲公英等。熊果酸广泛分布于女贞、熊果、枇杷等62种植物种。此3类成分不符合Q-Marker筛选的特有性原则,故以上三者不作为秦皮的Q-Marker。秦皮素和秦皮乙素作为秦皮具有一定专属性的香豆素类成分。同时,秦皮素、秦皮乙素可通过调节如癌症、脂质与动脉粥样硬化、乙型肝炎病毒、神经配体-受体相互作用信号通路、巨细胞病毒感染、沙门氏菌感染等通路从而达到防治癌症、心血管病、神经性疾病,抗炎、抗菌及抗病毒感染等,能够作为秦皮与药效相关联的潜在Q-Marker,后期可通过分子对接技术对该化合物与核心靶点展开进一步分析。

图9 有效成分-潜在靶点-富集通路网络关系图
2.4 秦皮饮片潜在的Q-Marker含量测定
通过指纹图谱结合模式识别得出4号峰秦皮苷、6号峰秦皮乙素、9号峰秦皮甲素均为不同基原秦皮的共有峰,且具有良好的代表性和差异性,符合Q-Marker的可测性和溯源性原则;网络药理学结果显示秦皮素和秦皮乙素与治疗癌症、抗炎、心血管病等疾病的治疗相关,与秦皮的药效相符合,具有良好的有效性;同时,秦皮中的秦皮素和秦皮乙素为具有一定专属性的香豆素类成分,满足Q-Marker中的特有性。故可作为秦皮与药效相关联的潜在Q-Marker。
综合考虑到Q-Marker辨识的可测性、溯源性、有效性及特有性原则,以及秦皮现行质量标准,可最终确认秦皮苷、秦皮乙素、秦皮素、秦皮甲素作为秦皮潜在的Q-Marker,进行含量测定。
2.4.1 色谱条件 同“2.1.1”项下色谱条件。
2.4.2 对照品溶液的制备 按“2.1.2”项下对照品溶液的制备方法进行制备。
2.4.3 供试品溶液的制备 按“2.1.3”项下供试品溶液的制备方法进行制备。
2.4.4 方法学考察
(1)线性关系考察:精密吸取各对照品溶液。按“2.1.1”项色谱条件进样并记录结果。以其质量浓度为横坐标(),相对应的峰面积为纵坐标(),计算标准曲线方程,见表2。
(2)精密度试验:取秦皮S7批次供试品溶液,按“2.1.1”项色谱条件连续进样6次,记录色谱图。秦皮苷、秦皮乙素、秦皮素、秦皮甲素的峰面积RSD分别为1.78%、0.75%、1.88%、1.89%,表明仪器精密度良好。

表2 4个指标性成分的线性回归方程
(3)重复性试验:平行制备6份秦皮S7批次供试品溶液,按“2.1.1”项色谱条件进行测定,记录色谱图。秦皮苷、秦皮乙素、秦皮素、秦皮甲素的峰面积RSD分别为1.43%、0.88%、2.22%、0.76%,表明该方法重复性良好。
(4)稳定性试验:取秦皮S7批次供试品溶液,按“2.1.1”项色谱条件分别在0、2、4、8、12、24 h进行测定,秦皮苷、秦皮乙素、秦皮素、秦皮甲素的峰面积RSD分别为1.39%、0.66%、1.73%、2.77%,表明秦皮供试品溶液在24 h内稳定性良好。
(5)加样回收率试验:精密称定6份已知含量的秦皮饮片样品S7批次粉末2.5 g,加入4种成分对照品适量,按“2.1.3”项下方法制备供试品溶液,按“2.1.1”项色谱条件进样分析,记录各成分峰面积。计算秦皮苷、秦皮乙素、秦皮素、秦皮甲素平均加样回收率分别为99.37%、101.34%、94.78%、100.96%,RSD分别为1.64%、2.13%、2.71%、2.27%,表明实验结果准确。
2.4.5 秦皮样品含量测定 分别精密称取15批秦皮样品,按照“2.1.3”项下的方法进行供试品溶液的制备,并按“2.1.1”项下的色谱条件进样,测定峰面积,计算样品中Q-Marker秦皮苷、秦皮乙素、秦皮素、秦皮甲素的含量,结果见表3。
3 Q-Marker预测分析
基于Q-Marker“五原则”,本研究采用指纹图谱结合化学模式识别、网络药理学方法对秦皮Q-Marker进行辨识。
从生源途径来看,秦皮苷、秦皮甲素、秦皮素和秦皮乙素属于香豆素类化学成分[11],多由莽草酸途径合成而来。由磷酸戊糖途径中间产物4-磷酸赤藓糖(erythrose 4-phosphate,E4P)和糖酵解中间产物磷酸烯醇式丙酮酸(phosphoenolpyruvic acid,PEP),化合后经几步反应生成葬草酸,莽草酸经磷酸化形成5-磷酸莽草酸后,再与PEP反应,以后生成分支酸,分支酸可以合成色氨酸,也可以转变为预苯酸,由预苯酸可生成苯丙氨酸和酪氨酸,二者是苯丙烷类化合物生物合成的起始分子,由苯丙氨酸解氨酶催化苯丙氨酸脱氨形成肉桂酸,进一步转化为香豆素[12],具有一定特有性。

表3 15批秦皮饮片中Q-Marker的含量测定
从传统功效来看,秦皮味苦、涩、寒,归肝、胆经、大肠经,具有清热燥湿,清肝明目,收涩止痢、止带的功效。秦皮苷、秦皮甲素、秦皮乙素和秦皮素均具有抗菌、抗病毒、抗炎镇痛,抗氧化、抗肿瘤、保肝和抗纤维化等作用[2]。同时,网络药理学结果表明多数靶点与秦皮素和秦皮乙素有关,二者所对应的信号通路能够与秦皮疗效相符,亦可作为秦皮潜在的Q-Marker,具有有效性。
从可测性来看,Wang等[13]采用UPLC-MS测定了秦皮素在血浆中的药动学过程;Kim等[14]采用HPLC技术测定了秦皮乙素在大鼠血浆中的水平以及体内组织分布;叶皓等[15]通过HPLC方法测定了秦皮中的秦皮甲素及秦皮苷的含量。同时,本研究首先建立了不同基原及产地15批秦皮饮片的HPLC指纹图谱,在21个共有峰中指认出4号峰(秦皮苷)、6号峰(秦皮乙素)、7号峰(秦皮素)、9号峰(秦皮甲素),通过PCA和PLS-DA得出秦皮苷、秦皮乙素、秦皮甲素具有较好的代表性及差异性,可作为秦皮潜在的Q-Marker,符合Q-Marker筛选的可测性及溯源性原则。
因此,本研究最终确定了将秦皮苷、秦皮甲素、秦皮素、秦皮乙素作为秦皮潜在的Q-Marker,进而进行Q-Marker的含量测定。
4 讨论
中药质量是中医药产业所面临的瓶颈问题,也是中药临床安全有效的基础。中药Q-Marker的提出,针对中药的中医药体系特点,能够从根本上解决中药质量评价的共性问题直接与中药质量属性的本质内涵及其有效性完整表达、特有性和专属性要求以及质量传递与溯源角度统领中药质量研究[4]。
本研究结果表明,依据Q-Marker可测性、有效性、特有性的筛选原则,整合HPLC指纹图谱、模式识别及网络药理学方法对多基原多产地的秦皮进行Q-Marker的辨识及测定,筛选出秦皮苷、秦皮甲素、秦皮素、秦皮乙素作为秦皮潜在的Q-Marker。一方面,由于在数据库中,秦皮苷与秦皮甲素所关联的靶点较少,导致网络药理学结果并未得出,秦皮苷和秦皮甲素的有效性数据,推测其可能原因是数据库内容更新不及时,因此网络药理学数据结果也具有一定的时效性,但大量研究已经证明二者与秦皮有效性密切相关。例如,秦皮苷能够改善肺部组织炎症,减轻脂多糖诱导的肺组织炎症和氧化损伤[16],抑制炎症因子,分解代谢基因表达,促进软骨特异性基因上调,清除活性氧(reactive oxygen species,ROS),对外骨关节炎具有抗炎和抗氧化的作用[17]。秦皮苷能够抑制脂多糖诱导的小鼠炎性细胞因子,并保护小鼠免受内毒素导致的休克[18],对大鼠缺血性再灌注急性肾损伤具有一定的预防作用[19]。秦皮甲素能够抑制鼻咽癌细胞增殖、糖酵解以及迁移和侵袭[20]。能够通过调节核因子κB(nuclear factor kappa-B,NF-κB)抑制心肌损伤[21],对蛋氨酸胆碱缺乏诱导的非酒精性脂肪肝炎具有保护作用[22]。通过下调原癌基因FBI-1(factor that binds to inducer of short transcripts-1,FBI-1)抑制乳腺癌细胞的增殖[23]。秦皮甲素还能够改善实验性糖尿病肾病的认知功能损伤,并通过调节丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路诱导抗氧化应激和抗炎作用[24]。上述研究能够充分说明秦皮苷及秦皮甲素与有效性的关系,为二者能够作为秦皮的Q-Marker提供有力依据。
另一方面,虽然HPLC结合模式识别技术仅筛选出秦皮苷、秦皮甲素、秦皮乙素作为秦皮Q-Marker,但网络药理学结果表明秦皮素能够通过多途径多靶点参与秦皮的药理作用,考虑到Q-Marker筛选有效性原则,将其纳入潜在Q-Marker的辨识范围。研究表明,秦皮素可以通过抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)及蛋白激酶B (protein kinase B,AKT)信号通路从而发挥抗癌作用[25]。秦皮素能够通过磷脂酰肌醇-3-激酶(phosphatidylinositol kinase/protein kinase B,PI3K/Akt)通路下调氨酸蛋白激酶(polo-like kinase 4,PLK4)以抑制前列腺癌细胞的增殖、迁移和侵袭[26],通过蛋白质酪氨酸激酶2(janus kinase 2,JAK2)/转录激活因子3(transcription activation factor 3,TAF3)信号通路抑制结肠腺癌细胞的生长[27],还能通过阻止信号通路转导因子和TAF3的激活来抑制非小细胞肺癌细胞的增殖[28],通过拮抗信号转导和转录激活因子-3(signal transducer and activator of transcription 3,STAT3)激活增强吉西他滨抗肿瘤效果并抑制胰腺癌发展[29]。秦皮素在较低浓度下可以阻止低密度脂蛋白氧化,浓度较高时通过核因子相关因子2(nuclear factor E2 related factor 2,Nrf2)/抗氧化响应元件(antioxidant response element,ARE)激活诱导抗氧化酶,从而达到抗动脉粥样硬化的作用[30]。另外,秦皮素能够通过PI3K/Akt通路抑制活性氧依赖的自噬,从而抑制海马神经元细胞的神经毒性[31],还能减轻缺血性卒中后小胶质细胞介导的神经炎症[32],同时对脑缺血再灌注具有保护作用,促进脑修复和血管生成[33]。抑制肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)和白细胞介素-1β(interlenkin-1β,IL-1β)诱导的软骨细胞凋亡并抑制炎症介质释放导致的半胱氨酸蛋白酶caspase-8和caspase-3活化降低,从而达到对软骨的保护和对骨质疏松症预防的作用[34-35]。研究显示,秦皮乙素可抑制STAT3磷酸化而达到抗肿瘤的目的[36]。能够将细胞周期阻滞在G0/G1和G2/M期,下调周期素D1(Cyclin D1)等的表达,诱导细胞凋亡,增加caspase 3表达,从而抑制肾透明细胞癌细胞(clear cell renal cell carcinoma,ccRCC)的增殖、迁移和侵袭[37]。秦皮乙素还能够通过影响磷酸甘油酸激酶2(porcine phosphoglycerate kinase 2,PGK2)、甘油磷酸酯脱氢酶2(glycerol-3-phosphate dehydrogenase 2,GPD2)、葡萄糖磷酸异构酶(glucose phosphate isomerase,GPI)的活性而具有抗癌作用[38],还可以在体内外抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导的血管生成,从而对肿瘤组织的扩散转移产生抑制作用[39]。秦皮乙素还可通过调节细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)/ NF-κB/AKT以及维甲酸相关孤儿受体γt抗体(ROR gamma T protein,RORγt)/IL-17的表达产生抗炎作用[40],通过血红素氧合酶-1(heme oxygenase-1,HO-1)表达抑制促炎细胞因子产生[41]。秦皮乙素还能通过沉默调节蛋白3(recombinant sirtuin 3,SIRT3)调节STAT3和miR-19b的活性从而抑制纤溶酶原激活物抑制物-1(plasminogen activator inhibitor-1,PAI-1)的水平,达到对急性冠状动脉综合征的治疗作用[42],通过苷酸活化的蛋白激酶(adenosine 5′-monophosphate activated protein kinase,AMPK)介导的STAT3还对动脉粥样硬化存在潜在影响[43],亦或通过降低低密度脂蛋白,从而降低动脉粥样硬化的发生率[44]。秦皮乙素还能以剂量相关性方式对脑I/R损伤起到保护作用,能够降低Caspase-3水平,其保护作用机制主要是通过上调B细胞淋巴瘤/白血病-2的表达和下调促细胞凋亡基因的表达来发挥抗凋亡活性[45]。秦皮乙素在体内体外均对乙型肝炎病毒的表达具有抑制作用,可有效抑制乙型肝炎病毒复制[46]。
HPLC指纹图谱建立过程中,本实验发现色谱柱温度略高时,秦皮中某些组分分离度不够,因此,最终确定柱温25 ℃,各峰分离效果得到较好的改善。另外,本研究中还存在着保留时间略向后漂移的现象,导致相对保留时间RSD略大于2%,但均小于3%的实验结果,可能是由于流动相中使用了磷酸,实验过程中平衡色谱柱时间不足有关。在模式识别中,本实验选择HCA、PCA和PLS-DA 3种手段,三者能够从不同角度对秦皮饮片的产地和基原进行深层次解析。HCA与PLS-DA对样品进行分类的结果大体相同,PLS-DA较HCA分类更为准确,不但能够对样品基原进行分类,对于HCA尚无法实现准确产地区分的样品,亦可进行大致分类,可对HCA结果进行补充。PLS-DA与PCA结果亦基本相符,体现在通过VIP筛选的主要差异性成分与PCA主成分1所涵盖的主要峰大体相同,由于PLS-DA包含了PCA的思想,同时又对因变量有较强的解释能力,更适合Q-Marker的准确筛选。
本研究整合指纹图谱、模式识别及网络药理学手段,辨识出符合“五原则”的秦皮苷、秦皮素、秦皮甲素、秦皮乙素作为秦皮潜在的Q-Marker,能够为多基原多产地的秦皮质量评价奠定基础,该研究模式能够为多基原多产地中药饮片的Q-Marker辨识合质量控制提供研究思路。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 282.
[2] 聂安政, 林志健, 张冰. 秦皮化学成分和药理作用研究进展 [J]. 中草药, 2016, 47(18): 3332-3341.
[3] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念 [J]. 中草药, 2016, 47(9): 1443-1457.
[4] 刘昌孝. 中药质量标志物 (Q-marker): 提高中药质量标准及质量控制理论和促进中药产业科学发展 [J]. 中草药, 2019, 50(19): 4517-4518.
[5] 谢培山. 中药色谱指纹图谱鉴别的概念、属性、技术与应用 [J]. 中国中药杂志, 2001, 26(10): 653-655.
[6] Wang Y L, Cui T, Li Y Z,. Prediction of quality markers of traditional Chinese medicines based on network pharmacology [J]., 2019, 11(4): 349-356.
[7] 李泮霖, 苏薇薇. 网络药理学在中药研究中的最新应用进展 [J]. 中草药, 2016, 47(16): 2938-2942.
[8] 刘树森, 孙文斌, 李文兰, 等. 基于网络药理学的黄连-吴茱萸药对抗癌及治疗心脑血管疾病机制研究 [J]. 中草药, 2020, 51(1): 109-117.
[9] 梅茜, 夏金鑫, 郭爽, 等. 基于指纹图谱及网络药理学的白芍质量标志物 (Q-marker) 预测分析 [J]. 中草药, 2020, 51(10): 2627-2633.
[10] Babu S, Jayaraman S. An update on β-sitosterol: A potential herbal nutraceutical for diabetic management [J]., 2020, 131: 110702.
[11] 叶迎, 柏冬, 包强, 等. 秦皮提取物中香豆素类成分含量测定方法研究 [J]. 中国中医药信息杂志, 2015, 22(8): 83-87.
[12] 刘良叙, 李朝风, 王嘉伟, 等. 芳香类天然产物的合成生物学研究进展 [J]. 生物工程学报, 2021, 37(6): 2010-2025.
[13] Wang H D, Xiao B X, Hao Z Q,. Simultaneous determination of fraxin and its metabolite, fraxetin, in rat plasma by liquid chromatography-tandem mass spectrometry and its application in a pharmacokinetic study [J]., 2016, 1017/1018: 70-74.
[14] Kim J S, Ha T Y, Ahn J,. Analysis and distribution of esculetin in plasma and tissues of rats after oral administration [J]., 2014, 19(4): 321-326.
[15] 叶皓, 李敬伟, 曾博文, 等. HPLC法测定秦皮4种有效成分的含量 [J]. 沈阳药科大学学报, 2019, 36(12): 1087-1092.
[16] 徐宜全, 蔡忠贵, 潘延成. 秦皮苷减轻LPS诱导的肺炎小鼠肺组织炎症和氧化损伤 [J]. 免疫学杂志, 2021, 37(9): 809-815.
[17] 詹彦婷, 覃再嫩, 郑立. 秦皮苷对脂多糖诱导的软骨细胞氧化应激和炎症因子的影响 [J]. 广西医科大学学报, 2021, 38(1): 28-34.
[18] Li W F, Li W Q, Yu J J,. Fraxin inhibits lipopolysaccharide-induced inflammatory cytokines and protects against endotoxic shock in mice [J]., 2020, 34(1): 91-101.
[19] Topdağı Ö, Tanyeli A, Akdemir F N E,. Preventive effects of fraxin on ischemia/reperfusion-induced acute kidney injury in rats [J]., 2020, 242: 117217.
[20] 沈永华, 汪峻峰, 程泽星, 等. 秦皮甲素抑制人鼻咽癌细胞系HNE-3增殖 [J]. 基础医学与临床, 2022, 42(8): 1237-1242.
[21] 吴暖, 黄婧文, 王志胜, 等. 秦皮甲素通过调节TLR/NF-κB途径抑制脂多糖诱导的心肌损伤 [J]. 中国现代应用药学, 2021, 38(24): 3143-3148.
[22] Yang X D, Chen Z, Ye L,. Esculin protects against methionine choline-deficient diet-induced non-alcoholic steatohepatitis by regulating the Sirt1/NF-κB p65 pathway [J]., 2021, 59(1): 922-932.
[23] Mo M, Chen M J, Huang Y,. Esculin inhibits proliferation of triple negative breast cancer cells by down-regulating FBI-1 [J]., 2020, 42(8): 629-634.
[24] Song Y, Wang X C, Qin S K,. Esculin ameliorates cognitive impairment in experimental diabetic nephropathy and induces anti-oxidative stress and anti-inflammatory effects via the MAPK pathway [J]., 2018, 17(5): 7395-7402.
[25] 赵婧晖, 谢鲲鹏, 隋佳琪, 等. 秦皮素通过抑制EGFR及其下游AKT信号通路抑制MCF-7细胞增殖及迁移 [J]. 中国生物化学与分子生物学报, 2016, 32(1): 56-63.
[26] Ma Z, Sun Y F, Peng W X. Fraxetin down-regulates polo-like kinase 4 (PLK4) to inhibit proliferation, migration and invasion of prostate cancer cells through the phosphatidylinositol 3-kinase (PI3K)/protein kinase B (Akt) pathway [J]., 2022, 13(4): 9345-9356.
[27] Ren S, Xing Y W, Wang C B,. Fraxetin inhibits the growth of colon adenocarcinoma cells via the2/signal transducer and activator of transcription 3 signalling pathway [J]., 2020, 125: 105777.
[28] Zhang Y, Wang L, Deng Y,. Fraxetin suppresses proliferation of non-small-cell lung cancer cells via preventing activation of signal transducer and activator of transcription 3 [J]., 2019, 248(1): 3-12.
[29] Guo Y Y, Xiao Y Y, Guo H C,. The anti-dysenteric drug fraxetin enhances anti-tumor efficacy of gemcitabine and suppresses pancreatic cancer development by antagonizing STAT3 activation [J]., 2021, 13(14): 18545-18563.
[30] Thuong P T, Pokharel Y R, Lee M Y,. Dual anti-oxidative effects of fraxetin isolated from[J]., 2009, 32(9): 1527-1532.
[31] Zhang T Y, Zhou B T, Sun J Y,. Fraxetin suppresses reactive oxygen species-dependent autophagy by the PI3K/Akt pathway to inhibit isoflurane-induced neurotoxicity in hippocampal neuronal cells [J]., 2022, 42(4): 617-628.
[32] Deng S J, Ge J W, Xia S N,. Fraxetin alleviates microglia-mediated neuroinflammation after ischemic stroke [J]., 2022, 10(8): 439.
[33] Cui Y H, Liu M H, Zuo L,. Fraxetin protects rat brains from the cerebral stroke via promoting angiogenesis and activating PI3K/Akt pathway [J]., 2022, 44(3): 400-409.
[34] Wang Q, Zhuang D, Feng W C,. Fraxetin inhibits interleukin-1β-induced apoptosis, inflammation, and matrix degradation in chondrocytes and protects rat cartilage[J]., 2020, 28(12): 1499-1506.
[35] Kuo P L, Huang Y T, Chang C H,. Fraxetin inhibits the induction of anti-Fas IgM, tumor necrosis factor-alpha and interleukin-1beta-mediated apoptosis by Fas pathway inhibition in human osteoblastic cell line MG-63 [J]., 2006, 6(7): 1167-1175.
[36] 李朝燕, 丁亚杰, 李佳, 等. 秦皮乙素抗肿瘤作用及机制 [J]. 中华中医药学刊, 2019, 37(7): 1620-1623.
[37] Duan J Y, Shi J, Ma X,. Esculetin inhibits proliferation, migration, and invasion of clear cell renal cell carcinoma cells [J]., 2020, 125: 110031.
[38] Wu S T, Liu B, Ai Z Z,. Esculetin inhibits cancer cell glycolysis by binding tumor PGK2, GPD2, and GPI [J]., 2020, 11: 379.
[39] Park S L, Won S Y, Song J H,. Esculetin inhibits VEGF-induced angiogenesis bothand[J]., 2016, 44(1): 61-76.
[40] Lee H C, Liu F C, Tsai C N,. Esculetin ameliorates lipopolysaccharide-induced acute lung injury in mice via modulation of the AKT/ERK/NF-κB and RORγt/IL-17 pathways [J]., 2020, 43(3): 962-974.
[41] Kim Y, Park Y, Namkoong S,. Esculetin inhibits the inflammatory response by inducing heme oxygenase-1 in cocultured macrophages and adipocytes [J]., 2014, 5(9): 2371-2377.
[42] Katta S, Karnewar S, Panuganti D,. Mitochondria- targeted esculetin inhibits PAI-1 levels by modulating STAT3 activation and miR-19b via SIRT3: Role in acute coronary artery syndrome [J]., 2018, 233(1): 214-225.
[43] Karnewar S, Vasamsetti S B, Gopoju R,. Mitochondria-targeted esculetin alleviates mitochondrial dysfunction by AMPK-mediated nitric oxide and SIRT3 regulation in endothelial cells: Potential implications in atherosclerosis [J]., 2016, 6: 24108.
[44] Lee M J, Chou F P, Tseng T H,.protocatechuic acid or esculetin can inhibit oxidative LDL induced by either copper ion or nitric oxide donor [J]., 2002, 50(7): 2130-2136.
[45] Wang C, Pei A J, Chen J,. A natural coumarin derivative esculetin offers neuroprotection on cerebral ischemia/reperfusion injury in mice [J]., 2012, 121(6): 1007-1013.
[46] Huang S X, Mou J F, Luo Q,Anti-hepatitis B virus activity of esculetin fromand[J]., 2019, 24(19): 3475.
Predictive analysis of quality markers ofbased on fingerprint and network pharmacology
XU Bei-lei1, 2, 3, 4, SUN Wen-bin1, WANG Hao1, 2, 3, WANG Jin-hong1, 2, 3, HU Yang1, 2, 3, YANG Bo1, 2, 3, LIU Jing-jing5, YANG Na-na1, ZHOU En-bao6, HAN Xiao-yu1, LIU Shu-sen1, WU Wen-qi1, LI Wen-lan1, 2, 3
1. School of Pharmacy, Harbin University of Commerce, Harbin 150076, China 2. Engineering Research Center of Natural Anti-cancer Drugs, Ministry of Education, Harbin 150076, China 3. Heilongjiang Key Laboratory of Preventive and Therapeutic Drug Research of Senile Diseases, Harbin 150076, China 4. Engineering Research Center of Chinese Medicine Production and New Drug Development, Beijing 102488, China 5. National Institutes for Food and Drug Control, Beijing 100050, China 6. Department of Medicine, Lunan Pharmaceutical Group Co., Ltd., Linyi 276000, China
To research the potential quality marker (Q-Marker) of Qinpi () based on “five principles” of Q-Markers combined with fingerprint and network pharmacology methods from the perspective of measurability and effectiveness.The fingerprints of 15 batches ofwere established and subjected to clustering analysis (HCA), principal component analysis (PCA) and partial least squares discriminant analysis (PLS-DA). The network diagram of “components-targets-pathways” was constructed using network pharmacology. Q-Marker ofwas predicted and quantitative analysis was conducted simultaneously.The fingerprints of 15 batches ofwere established. Among the 21 common peaks, peak 4 fraxin, peak 6 esculetin, peak 7 fraxetin, and peak 9 esculin were identified. HCA, PCA, and PLS-DA results were generally consistent. Network pharmacology screened out 21 potential active components, 129 core targets and 159 key pathways. The fingerprint, pattern recognition and network pharmacology methods were integrated to jointly identify the potential Q-Marker of the principles of testability, effectiveness and uniqueness—fraxin, esculetin, fraxetin and esculin. The contents of that four components were 0.93%−2.51%, 0.98%−1.41%, 0.71%−1.09%, 0.66%−1.25%.The potential Q-Marker ofwas predicted by the integration of fingerprint, pattern recognition and network pharmacology. This study provided a scientific basis for the comprehensive control and evaluation of the quality ofdecoction pieces, and a theoretical reference for the study of quality standards for multi-base traditional Chinese medicine.
; Q-Marker; fingerprint; network pharmacology; multivariate statistical analysis; fraxin; esculetin; fraxetin; esculin
R284.1
A
0253 - 2670(2023)15 - 5019 - 14
10.7501/j.issn.0253-2670.2023.15.027
2022-12-09
黑龙江省自然科学基金联合指导计划(LH2020H069);哈尔滨商业大学青年学术骨干支持计划(2020CX12);中央支持地方高校改革发展资金人才培养项目
徐蓓蕾(1983—),女,博士,副教授,研究方向为中药药效物质与质量评价研究。Tel: 15124515866 E-mail: xubeilei2006@163.com
通信作者:李文兰(1967—),女,博士,教授/院长,研究方向为中药药效物质与质量评价研究。Tel: 13936169153 E-mail: lwldzd@163.com
[责任编辑 王文倩]

