调控果实大小相关基因的研究进展
李杰 罗奕 张琪悦 潘腾飞 于远 佘文琴 潘东明 潘鹤立

摘 要: 果实大小是果实的重要经济性状之一,直接影响作物产量、品质以及商品性。果实的生长发育过程既受到作物种类、品种固有的遗传背景的影响,也受到环境因素和栽培管理因素等方面的影响,而前者的影响是更为直接和深刻。综述了近年来与园艺植物果实大小调控相关的功能基因和转录因子的研究概况,着重介绍了番茄、黄瓜、梨、葡萄、苹果和柑橘等园艺作物中 POS1、FW、YABBY、WOX、OFP、NCED、YUC、GAox20、AREB 等基因的研究进展,为今后研究果实大小调控提供理论参考。
关键词: 果实;大小;相关基因;调控
中图分类号: S 66 文献标志码: A 文章编号: 0253-2301(2023)05-0028-09
DOI: 10.13651/j.cnki.fjnykj.2023.05.005
Research Progress on the Genes Related to the Regulation of Fruit Size
LI Jie 1,2 , LUO Yi 1, ZHANG Qi-yue 1, PAN Teng-fei 1,2 , YU Yuan 1,2 , SHE Wen-qin 1,2 , PAN Dong-ming 1,2 , PAN He-li 1,2*
(1. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China;
2. Institute of Storage Transportation and Preservation of Horticulture Products,
Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Abstract: Fruit size was one of the important economic traits of fruits, which directly affected the yield, quality and commodity of crops. The growth and development process of fruit was not only affected by the inherent genetic background of crop species and varieties, but also by the environmental factors and cultivation management factors. And the influence of the former was more direct and profound. The research status of the functional genes and transcription factors related to the regulation of fruit size in horticultural plants in recent years was reviewed in this paper. And the research progress of POS1, FW, YABBY, WOX, OFP, NCED, YUC, GAox20 and AREB genes in horticultural crops such as tomato, cucumber, pear, grape, apple and citrus was emphatically introduced, which could provide theoretical reference for the future research on the regulation of fruit size.
Key words: Fruit; Size; Related genes; Regulation
果实作为一个器官,其发育过程极其复杂,果实大小决定其经济价值。因此,探求合适的果实大小性状是育种学家的重要研究方向之一。研究表明,果實发育受到亲本遗传、激素、形态、外部环境、人为栽培措施等多方面影响。研究清楚果实大小相关影响因素,不仅能够提高育种者选育品种效率,降低育种成本;还可进一步提高作物产量和品质,促进相关产业的发展。据现有研究,调控果实大小的内在遗传因素,导致大果芽变的原因可以分为两类。一类为染色体加倍,梨多倍体品种与二倍体比较,表现在花、叶、果实、枝都有巨大性 [1] 。通过显微镜等观察可以发现细胞增大导致果实增大,而非细胞分裂旺盛所致。例如巴梨四倍体芽变品种平度大巴梨就是由于细胞体积变大导致的组织器官变大,细胞数目与普通的巴梨相比较并没有较大差异 [2] 。另一类是大果芽变控制果实大小的基因变异导致。舒莎珊等 [3] 通过流式细胞仪检测其染色体倍性,发现潘庄大翠冠是翠冠的芽变体,导致其果实变大的机理是发育过程中细胞分裂过于旺盛,促进了细胞数量的增长。蒋爽等 [4] 研究证实梨果实大小差异是由幼果发育过程中细胞数量决定的。而后Wang等 [5] 的研究说明细胞数量和细胞大小共同决定了梨果实大小,进一步完善了结论。其他研究者观察发现梨果实外部形态与种子的数量多少、种子的分布状况都有影响,种子数目越多,果实越大,果型越饱满,反之则相反 [6] 。吴应荣等 [7] 研究认为,授粉水平可影响果实发育、种子形成。卜海东等 [8] 利用农杆菌介导的遗传转化,发现生长素信号基因Mdux/IA42是果实和细胞大小的负调节因子。华南农业大学枇杷团队 [9] 通过多组学方法确定了乙烯不敏感4(EjEIN4)和TORNADO 1(EjTRN1)的两个同源物作为控制果实重量的候选者。此外,3个单核苷酸多态性(SNP)标记与果实重量密切相关。Yusts-Lisbona等 [10] 通过结合测序图谱和CRISPR/Cas9基因组编辑方法,分离出过量数量的花器官(ENO),ENO突变以花特异性方式导致SlWUS表达域的实质性扩增,为现代番茄果室数和果实大小的显著增加奠定了基础。
有关果实大小、果实形状相关基因的研究报道相对较少。但在番茄模式植物和梨、葡萄、苹果和柑橘等园艺作物中已对 POS1、YABBY、SUN、OVATE、FAS、LC、WOX、CRC、WUSCHEL(WUS)、CLAVATA(CLV)、SlAS2、SlTKN3 等基因进行了相关研究 [11-15] ,证实了这些基因对果实的大小和形状都有调控作用。以番茄为模式体系的研究,已经鉴定出 FAs、fw2.2、fw3.2、WUS和POS1 等基因,
对果实大小具有调控作用,前4个基因分别隶属 CLA、CNR、CYP78A和WOX 基因家族,通过对细胞分裂次数和子房室数目改变等方面来调控果实的大小。这些基因及其各自的基因家族,起源古老,在植物中广泛存在,且每个家族成员在功能上均享有高度的特异性,都可以对果实的大小产生影响 [16-17] 。为进一步阐明果实大小相关基因调控机制,本文对与果实大小相关的功能基因和转录因子研究进展进行综述,旨在为育种者提供参考依据。
1 POS1 基因与果实大小
内含子调控序列拷贝数与果实大小有关,揭示了由于内含子调控区变异导致调控基因自身表达量的改变在器官大小自然变异中的重要作用。研究发现,植物器官大小基因 Physalis Organ Size 1(POS1)的表达水平与P.philadelphica 生殖器官如花、浆果和种子的大小正相关 [16] 。与其野生型对照相比, POS1基因导致花和浆果较小。反之,POS1基因过表达促进器官增大,但细胞数量不增加。POS1 基因编码一个AP2类的转录因子,其第1个内含子来自大、中、小tomatillo群的等位基因,分别含有1~3个37 bp调控序列。研究结果还显示, POS1 等位基因的第1个内含子中重复的拷贝变异,这一序列拷贝数在大、中、小3组中分别为1、2和3个串联重复序列,导致该基因的差异表达。因此,tomatillo生殖器官大小的共同变化可归因于 POS1基因中新的调节变异。结果表明,在POS1 等位基因的第1个内含子中重复序列的复制变异导致该基因的差异表达。该调控序列拷贝数的变异与 POS1 基因在生殖器官中的表达量呈显著负相关,而基因的表达量与器官大小呈显著正相关。研究揭示了由于内含子调控区变异导致调控基因自身表达量的改变在器官大小自然变异中的重要作用,发现了一个与番茄大小驯化遗传调控不同的新基因与新机制。 POS1 基因及其调控机制在酸浆属高产新品种培育中具有重要应用前景。
2 FW基因与果实大小
有关细胞分裂和细胞大小的调控因子列于表1。TIAN等分离出 fw2.2-like (PbFWL)基因, PbFWls 基因编码富含Cys的蛋白, 属于plac8 超家族 [17] 。此外,亚细胞定位结果表明 pbwls 基因定位于质膜上。Grandillo等 [18]研究结果表明,在细胞分裂期间, PbFWL 基因在小果型品种中的表达高于大果型品种,提示这两个 PbFWL 基因的表达可能与梨果实的细胞分裂呈负相关。这些研究结果为阐述关于调控果实大小的基因提供了方向。由于番茄染色体简单,前人对其研究较为深入,通过研究番茄品种可以探究普遍性规律。控制番茄大小的性状受到自身遗传物质跟环境共同影响,这对研究其单基因对于性状的影响造成了极大的不便。经过长期研究表明主要有4个数量性状位点被认为主要参与果实大小的调控, fw2.2基因与fw3.2基因控制果实重量,FAS基因与WUS基因 参与控制子房数量。番茄重量控制基因的过程中,在染色体上大概发现了30多个相关基因位点-QTLS被证明参与调控果实大小的过程 [19] 。进一步研究指出,其中 fw2.2基因与fw3.2基因 是主效调控基因 [20] 。
Frary等对 fw2.2基因进行了深入分析,将fw2.2基因 离体分离、纯化、克隆与转化,通过两个近等位基因系配置的F 2群体进行精准定位确定 fw2.2 基因片段长度为22 kb,并进行遗传转化验证其功能,顺利克隆出 fw2.2 基因,结果表明其为细胞分裂的负调控基因,为小果控制基因,该基因对现在番茄果重变异贡献率为30%,是番茄进化的关键性基因。在此之后,Cong等 [21] 进一步验证该基因功能,通过先后对比基因表达量的差异指出,具有 FW2.2 基因的小番茄相应的表达量比大果型番茄的更多,便猜测其在细胞分裂过程当中起到负调控作用。陈裕坤等 [22] 在龙眼研究中发现。龙眼胚性愈伤组织 DlFW 2.2-1基因与DlFW2.2-2基因与 番茄和油梨中 FW2.2基因 在氨基酸序列上具备较高的相似度,在系统发育树中与番茄和油梨中 FW2.2 基因的距离最近,推测龙眼中 FW2.2基因 的2个成员是番茄 FW2.2 的同源基因。当前 FW2.2 基因在大豆 [23] 、水稻 [24] 等作物中皆起到負调控效能。 FW3.2 基因是参与控制果实重量的一个重要基因,一直被研究人员所关注。 FW3.2基因与拟南芥中KLUH基因位于较近进化分支中,是CYP78A 亚基因家族重要组成部分 [25] 。Kazama等 [26] 通过计算机技术及分子技术,创造性提出 KLUH 基因是参与调控移动生长因子生物合成,并采取 mgf 进行细胞分裂方式调控。之后研究者进一步表明是 FW3.2 基因序列中的多态 SNP 发生顺式元件突变,使其表达增强 [27] 。该基因在果实发育期间,细胞数量的增加导致隔膜组织的增大使果实质量增加,并调控果树整体平衡,控制地上部枝条生长量及果实生长量,保持两者之间总量的恒定。
番茄心室受环境影响,加性性状明显。调控番茄心室的基因当前较为深入的是 fas基因与lc 基因。近年来关于番茄心室数目的研究进展显著。刘莹等 [28] 对比多心室番茄MLK1与少心室番茄FL1,两者基因间的区别,指出多心室番茄MLK1的 fas 基因及上游发生倒位变异而少心室 FL1 基本未发生改变,但仍可以少量表达,野生型即少心室番茄 lc基因及fas 基因均未发生突变,而多心室番茄 lc基因及fas 基因发生突变,表明多心室的形成与这两者基因突变有关。刘爽 [29] 进一步指出当 LC与Fas 基因同时突变时将产生更多心室、更大尺寸的番茄。调控番茄果实大小的途径可能是 FW2.2 基因对番茄心室细胞分裂次数、程度起到负调控作用,和 LC、fas 基因调控番茄心皮数目及大小。二者配合影响番茄果实大小及内部生理生化活动,但具体机制不清。关于番茄基因内部相互关系及机理尚不明确,进化的先后顺序对番茄影响有待进一步深入研究。
3 转录因子与果实大小
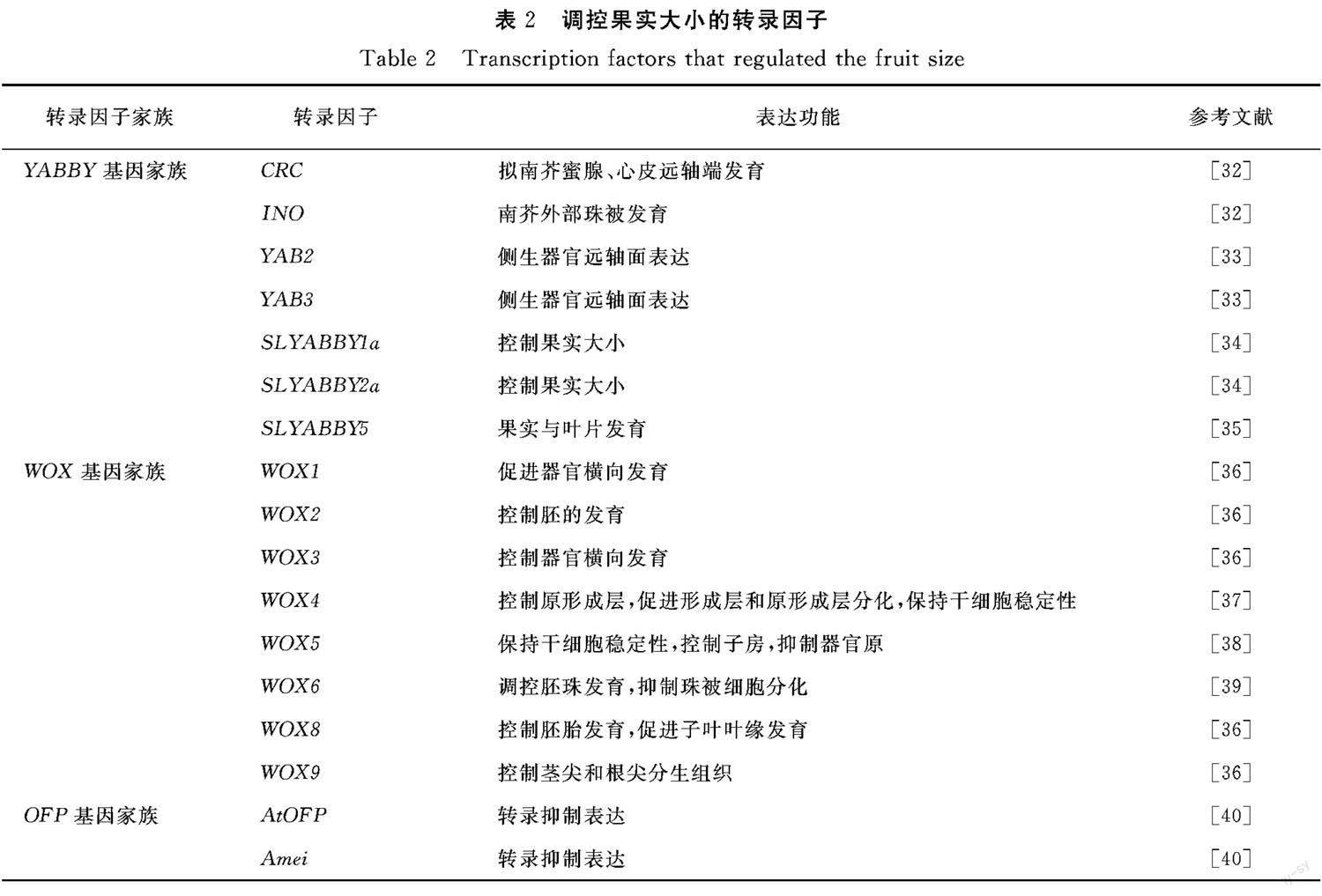
转录因子能特定识别目的基因上的启动子,沿着中心法则进而控制生物生长。依据转录子跟DNA结合位置不同,因此转录子存在不同类型 [30-31] 。根据其结构及特性可以将其归类成为动植物共有,或者单方面特有。目前对果实的大小研究较为深入的有 YABBY基因家族、WOX基因家族、OFP基因 家族等(表2)。
3.1 YABBY 基因家族
YABBY 基因家族是植物特有的转录因子之一,归属于锌指蛋白超家族的亚家族,家族包含C2H2锌指蛋白与YABBY结构域,分别位于C链N端与C端,两者之间具有极强的保守性,不易突变,剩余区域不具备相关同源性 [33-34,41-42] 。在西红柿、拟南芥等植物中, YABBY 基因家族包含5个亚族,分别为 CRC、FIL/YAB3、INO、YAB2与YAB5。CRC 参与拟南芥蜜腺及心皮远轴端发育, INO 影响拟南芥外部珠被发育 [43] , YAB2与YAB3 参与侧生器官远轴面表达 [44] 。 YABBY 基因家族对植物生长发育起到非常重要的作用,尤其在园艺作物上, YABBY 基因家族在拟南芥、苹果、水稻、大白菜、玉米中的研究较为深入,分别测得其家族成员在6、13、8、11、13染色体上 [34,45-49] 。
有研究表明, YABBY 基因家族在植物侧生组织发育过程中起着极其重要的作用 [35] ,影响侧枝生长量。在多心室大番茄和2心室小番茄不同组织的基因表达分析中发现,有8个 YABBY 基因家族中的基因参与调控花和果实的发育,仅 SlYAB5b 基因参与叶发育调控。其中, SlD 基因具有正调控作用,而 SlYAB1、SlFAS和SlINO 基因则具有负调控作用。以病毒诱导基因沉默方式,对茄子 YABBY基因家族中SmFAS、SmYAB2、SmYAB3、SmYAB5和SmCRC 基因单个成员分别进行基因沉默,结果表明 SmFAS和SmYAB5基因在控制果实宽度上影响最大,其次为SmCRC基因,而SmYAB2基因和SmYAB3基因 表型不明显。有研究指出, SLYABBY1a基因在调控番茄果实大小与形状有不可替代的作用,SLYABBY2a基因 调控果实极端大小 [50] 。通过对番茄深入研究,发现 YABBY 基因分布不均,分布于5、6、7、8、11、12染色体中,分别编码158~218个氨基酸,内含子个数保守,不易突变,通过分子遗传学发现在染色体上存在 YABBY 基因多对平行线性同源基因对,从而说明 YABBY 基因随物种特异性扩张 [42-48] 。根据基因树分析,可将其分为4个亚组,根据特定程序分析测出其内部包含5~6个内含子,结构完整,拥有 YABBY 基因的锌指结构与特定结构域,从功能上分析表明其内部存在顺式元件,且作用与生长发育逆境密切相关,对植物根茎叶花果实蜜腺心皮等皆有极其重要的调控作用,进一步功能表达分析表明 YABBY1、YABBY3、YABBY4基因在番茄生长发育中都无表达,YABBY2、YABBY9基因表达较为特异。SLYABBY5 基因参与番茄果实与叶片发育, SLYABBY5基因在低温环境下或在 IAA、ABA、GA3、ASA表达量会下降,在受到损伤或者高盐高渗环境下表达量上升, SLYABBY5 基因参与番茄等植物的生长发育及非生物逆境胁迫 [51-53] 。
FAS 位点最早被认为隶属于 YABBY 基因家族,该家族基因可以通过影响远轴细胞的分化,以一种极性的形式促进侧生器官发生 [35,49] 。在番茄中,Cong等 [54-55] 通过分析11号染色体上的 FAS 位点的基因分布和结构,推测 YABBY 基因最可能是引发心室数目发生变化的功能基因,并认为正是该基因在花发育时期的下调表达促进了番茄多心室的发生。通过和野生番茄的比较,Cong等进一步指出,该 YABBY 基因在栽培番茄中的下调表达可能和其在第一内含子内插入了1个6~8 kb的DNA片段有关。但是,随后,Huang等 [11] 对 FAS 位点基因组结构和所涉及基因进行了更为細致的研究和精细定位,结果发现,除了Cong等提到的片段插入之外, FAs 位点在11号染色体上还包括1个294 kb片段的倒位,该倒位发生在 YABBY 基因的第1内含子和 SICLV3 基因上游的1 kb区域之间;通过比较 YABBY 基因两侧重组子的频率,认为正是这个倒位造成了 FAS 基因表型突变。随后,Xu等 [12] 研究表明,造成 FAS 基因表型变化的直接遗传原因是 SICLV3 基因,并不是YABBY 基因。染色体片段的倒位引起前者启动子上发生了小的调控突变,使其功能部分丧失,因此对心皮室的数目产生了影响。从功能上看, SICLV3基因是配体基因CLV 家族的重要成员,该基因的突变可以使分生组织过度增值,从而引起分生组织增大,造成器官的发育缺陷 [13-15] 。
以中国野生华东葡萄株系白河-35-1为材料,采用RACE克隆技术,分离得到了 YABBY 基因家族2个基因 Vp YABBY1和VpYABBY2基因。序列进化分析表明,VpYABBY1和VpYABBY2基因分属于YABBY基因家族中的FIL子家族、YAB2 子家族。亚细胞核中定位结果表明二者均为核蛋白。组织特异性表达分析表明 VpYABBY2 基因在葡萄的茎、花、卷须和叶中均表达 [54] 。据研究报道,通过葡萄全基因组鉴定出7个 YABBY 基因,依据进化树可分成5个亚族,同一亚族的基因拥有相似的内含子外显子和蛋白结构。对有核无核品种中胚珠 YABBY 基因在发育时期的表达分析,在胚珠败育的关键时期 VvYABBY4 表达差异明显,揭示其在无核葡萄形成过程中的作用不可或缺,并与转录组结果一致。此外,在各组织器官中 YABBY 基因也有一定程度的表达,提示 YABBY 基因家族还参与调控多种器官的生长发育 [56] 。
3.2 WOX 基因家族
WUSCHEL-related homebox(WOX) 转录因子家族是植物独有的一种转录因子,试验探明较为透彻。尤其是在拟南芥、番茄、小麦等植物上获得重大研究进展。在植物发育的关键时期尤其是花、叶、果实、胚等器官形成中影响普遍。前人研究的 WOX 家族具有控制细胞分裂分化动态平衡,以及胚前与胚后发育等多种生物学功能 [57] 。近些年来,从拟南芥等植物中发现 WUSCHEL(WUS)和WOX1-15 基因,结果表明, WOX 基因家族参与了分生组织干细胞的维持,胚胎的根尖-基极极性模式的维持以及侧器官的发育 [58-62] 。
WOX转录因子在植物各个部位都有表达,据研究表明其表达的强度有所区别,生命活动旺盛的器官内WOX转录因子的表达量特别高,在植物特殊发育阶段如胚、种子等内部干细胞增殖中起到信使调节作用。WOX不同的表达影响细胞的分裂作用。在拟南芥、金鱼草中研究表明 WUS 基因在顶端分生组织及子房处表达,保持干细胞正常生理活动及子房与花芽的发育;同时拟南芥中发现 WOX1 基因在植物侧生原基处表达,促进器官横向发育, WOX2 基因在胚胎顶端区域表达,控制胚的发育, WOX3 基因在顶端分生组织处表达,控制器官横向发育 [39] ; WOX4 在维管束形成层表达,控制原形成层促进形成层和原形成层分化 [2] 。 WOX5 在根尖分生组织表达,保持干细胞稳定性 [64] ; WOX6 在调节性抑制器官原基的分化,成熟和分化过程中表达器官原基,调节性子房发育、低温反应 [40] ; WOX8 在胚胎的基底区域表达,并促进胚胎发育; WOX9 在胚胎基部区域表达,控制茎尖和根尖分生组织 [65] 胚胎发育促进细胞增殖 WOX11 木质部细胞、根尖分生组织表达,控制冠根的发育,促进体外根的发育和形成愈伤组织 [66] ; WOX13在根、花序中表达,促进根的发育和花器官的形成;WOX14在根以及发育中的花药中表达,促进侧根和花器官的发育。WUS、WOX1、WOX3、WOX6、WOX9基因 都有促進器官细胞增殖,促进器官横向扩增,有促进果实发育成熟的功能。
3.3 OFP 基因家族
OFP(OVATE family protein)蛋白质家族是一种植物生长抑制蛋白,它在植物生长史中不可或缺,一种含有c-端子的植物特异性转录因子家族保守的OVATE结构域 [67-68] 。针对拟南芥、番茄和水稻中的OFP蛋白的研究较为深入。在苹果中, OFP 基因的分散、系统的进化、组织的遗传结构、组织的表达和表达的细微差别,为更深入探讨其在植物逆境中生长发育的作用提供理论依据。 OVATE 已被确定为一种位点定量特征,它在很大程度上控制着番茄果实的形状,影响茄子叶片和花朵生长的蛋白质抑制剂分别是18、31和31个 OFP 因子家族的成员,并且具有调节植物生长的多个方面 [69-72] 。
据番茄生物信息学分析,发现SlOFP20的DNA序列无内含子,定位在细胞核中且OVATE结构域,位于第259~315个氨基酸。在ATG上游2 kb区域,有22个顺式作用元件,其中有3个能够参与调控生长素、赤霉素生物合成的顺式作用位点和1个能够与MYB转录因子结合的顺式作用位点。在野生型番茄开花当天,SlOFP20在子房中的表达量很高,其次是幼叶和根中的表达量,在茎中的表达量最低。与野生型相比,SlOFP20过表达株系的单果重显著降低 [73] 。
4 与果实激素合成相关基因
果实大小与细胞分裂和膨大有关,而植物激素是影响细胞分裂和膨大的主要因素之一 [74] ,在果树光合作用、碳素同化、产物的运输和分配等过程中至关重要,与果实发育关系密切 [75] 。研究表明,果实的发育与成熟,是多种内源激素综合作用的结果 [76] 。早花荔枝形成大果,与果皮中ZR含量和ZRs/ABA比值较高有关 [77] 。果实中ABA含量的升高,抑制了果实细胞的分裂,并最终影响果实的大小 [74,78-79] 。
据报道,以大果锦橙( Citrus sinensis L.Osbeck)和变异品种小果型长叶橙( Citrus sinensis L.Osbeck)为试材,利用HPLC研究了这2个品种不同发育阶段果实的内源激素差异。结果显示,在果实细胞分裂期,大果锦橙较长叶橙的果皮IAA、ZT和GA 3含量高。在细胞膨大期,大果锦橙较长叶橙的果皮ZT含量低,而IAA和GA 3含量高;两个品种果肉中GA 3和ZT含量无显著差异,长叶橙的IAA含量较低,而ABA含量较高。因此推断,锦橙果实大小差异可能是由内源激素含量差异造成的。对脱落酸合成关键基因( CsNCED)、生长素合成关键基因(CsYUC )和赤霉素合成关键基因( CsGAox20 )进行实时定量PCR分析其在果实发育过程中的表达水平。结果显示,在果实生长素合成过程中 CsYUC6、CsYUC7 基因发挥了重要作用;在ABA的合成过程中 CsNCED3、CsNCED8 基因发挥了重要作用;在赤霉素合成过程中 CsGAox20-2基因发挥了重要作用。 CsGAox20-2 、CsYUC6和CsYUC7基因在大果锦橙中高表达以及CsNCED8、CsNCED3基因低表达,是引起大果锦橙中 IAA、GA 3含量高和GA 3/ABA与IAA/ABA比值较高的原因,是大果锦橙果实比长叶橙大的分子基础 [80] 。
以长叶橙和大果锦橙为材料,对转录因子 CsAREB1和CsAREB2 基因进行了生物信息学及时空表达分析;采用ELISA测定了果实不同发育时期内源激素(GA、ABA、IAA和ZR)含量。结果表明, CsAREB1 和CsAREB2 基因其转录水平可能受ABA调控,且通过参与了柑橘果实ABA生成,从而影响了柑橘果实大小的发育过程 [81] 。
5 结语
果实发育膨大的本质是由细胞数量的增加及细胞体积膨大两方面共同影响。除了其本身遗传特性影响外,还受制于外部环境、栽培技术等方面的影响。如今,研究人员通过基因组学、转录组学和代谢组学,对调控果实大小的功能基因、转录因子、激素以及环境因子等进行了有益的探索,但主要集中在番茄上的相關研究,而对其他园艺作物的研究相对较少。随着人们研究的不断深入,对于明确果实大小相关基因的调控机理、与激素的互作机制以及对环境因素和栽培技术的相应等方面将取得更多的研究成果,为经济作物高产、优质生产提供有益的理论支持。
参考文献:
[ 1] 黄礼森,李树玲,丛佩华.梨多倍体与二倍体性状比较 [J]. 中国果树,1990(3):30-31.
[ 2]尹永胜,徐增凯,张爱波,等.巴梨四倍体芽变品种的选育[J].中国农学通报,1996(5):22-23.
[ 3]舒莎珊,李鑫,骆军,等.翠冠梨大果型芽变的细胞学及相关基因表达研究[J].果树学报,2017,34(6)660-669.
[ 4]JIANG S,AN H S,LUO J,et al.Comparative Analysis of Transcriptomes to Identify Genes Associated with Fruit Size in the Early Stage of Fruit Development in Pyrus pyrifolia [J]. Int J Mol Sci ,2018,19(8):2342-2357.
[ 5]WANG G M,GAO X,WANG X P,et al.Transcriptome analysis reveals gene associated with fruit size during fruit development in pear [J]. Scientia Horticulturae ,2022,305(50):111367.
[ 6]王荣敏.梨果实内种子数量对果实大小及可溶性固形物的影响[J].河北果树,2017(2):13-15.
[ 7]吴应荣,杨玉华,陈宇晖,等.砂梨花期授粉受精对种子形成及果个大小的影响[J].湖北农业科学,1995(1) : 40-43.
[ 8]COWAN A K,CRIPPS R F,RICHINGS E W,et al.Fruit size:towards an understanding of the metabolic control of fruit growth using avocado as a model system [J]. Physiologia Plantarum ,2001,111(2):127-136.
[ 9]SALIH ULGER,SAHRIYE SONMEZ,MUSTAFA KARKACIER,et al.Determination of endogenous hormones,sugars and mineral nutrition levels during the induction,initiation and differentiation stage and their effects on flower formation in olive [J]. Plant Growth Regulation ,2004,42(1): 89-95.
[10]YUSTE-LISBONA F J,FERNNDEZ-LOZANO A,PINEDA B,et al.ENO regulates tomato fruit size through the floral meristem development network [J]. Proceedings of the National Academy of Sciences ,2020,117(14):8187-8195.
[11]HUANG Z,VAN DER KNAAP E.Tomato fruit Weigh 11.3 mape close to fasciiated on the bottom of chromosomell [J]. THEROR APPL GENET ,2011,123(3):465-474.
[12]XU C,LIBERATORE K L,MACALISTER C A,et al.A cascade of arbinosyl transferases cotrols shoot meristem size into mato [J]. shoot meristem size in tomato [J]. Nat Genet ,2015,47(7):784-792.
[13]RODRIGUEZ-LEAL D,LEMMON Z H,MAN J,et al. Engineeing Quantitative trait varation for crop Improvement by genome editing [J]. IMprovemeent by genome editing [J]. cell ,2017,171(2):470-480.
[14]WANG L,HE L L,LI J,et al.Regulatory change at Physalis Organ Size 1correlates to natural variation in tomatillo reproductive organ size [J]. Nature Communications, 2014(5):4271,DOI:https://doi.org/10.1038/ncomms5271.
[15]刘洪岩,包颖.葫芦 fw3.2 基因的克隆及表达差异分析 [J]. 曲阜师范大学学报(自然科学版),2018,44(4):81-86.
[16]刘洪岩,岳淑婷,張琳,等.影响番茄果实大小相关基因的研究进展 [J]. 曲阜师范大学学报(自然科学版),2018,44(2):81-85.
[17]TIAN J,ZENG B,LUO S P,et al.Cloning,localization and expression analysis of two fw2.2-like genes in small-and large-fruited pear species [J]. Journal of Integrative Agriculture ,2016,15(2):282-294.
[18]GRANDILLO S,KU H,TANKSLEY S,et al.Identifying theloci responsible for natural variation in fruit size andshape in tomato [J]. Theor Appl Genet ,1999,99:978-987.
[19]ZHANG N,BREWER M T,VAR DER KNAAP E,et al.Fine mapping of fw 3.2 controlling fruit weight in tomato [J]. TheorAppl Genet, 2012,125:273-284.
[20]ANNE F,NESBITT T C,AMY F,et al.fw 2.2 :A quantitative trait locus key to the evolution of 10-mato fruit size [J]. Science ,2000,289:85-88.
[21]CONG B,LIU J P,TANKSLEY S D.Natural alleles at a tomato fruit size quantitative trait locus differ by heterochronic regulatory mutations [J]. Proc Natl Acad Sci USA ,2002,99:13606-13611.
[22]陈裕坤,林玉玲,赖钟雄.龙眼胚性愈伤组织 fw2.2 家族2个基因的克隆与分析 [J]. 热带作物学报,2012(9):1-6.
[23]QIAO Z Z,BRECHENMACHER L,SMITH B,et al.The fGmF-WL1 (FW2-2-like) f nodulation gene encodes a plasmamem brane microdomain associated protein [J]. Plant Cell and Environment ,2017,40(8):1442-1455.
[24]XU J,XIONG W T,YAN T Z.Molecular characterization and functional analysis of ″fruit-weight 2. 2-like″ gene family in rice [J]. Planta ,2013,238:643-655.
[25]ANASTASIOU E,KENZ S,GERSTUNG M,et al.Control of plant organ size by KLUH /CYP 78A 5- dependenttercellular signaling [J]. Dev Cell ,2007,13:843-856.
[26]KAZAMA T,ICHIHASHI Y,MURATA S,et al.The mechanism of cell cycle arrest front progression explained by a KLUH/CYP78A5 dependent mobile growth factor indeveloping leaves of Arabidopsis thaliana [J]. Plant Cell Physiol ,2010,51(6):1046-1054.
[27]CHAKRABARTI M,ZHANG N,SAUVAGE C,et al.A cytochrome P450 regulates a domestication trait in cultivated tomato [J]. Proc Natl Acad Sci USA ,2013,110:17125-17130.
[28]刘莹,张庆波,李会,等.番茄多心室形成与调控位点 fas和lc 序列变异的关系[J].分子植物育种,2013,11(5): 546-551.
[29]刘爽.番茄心室形成研究进展[J].农学学报,2018,8(12):58-61.
[30]NATHALIE G,G VAUDANT F,HERNOULD M,et al. The cell cycle-associated protein kinase WEE1 regulates cell size in relation to endored uplicationin developing tomato fruit [J]. Plant J ,2007,51:642-655.
[31]SU L,BASSA C,AUDRAN C,et al.The auxin Sl-IAA17 transcriptional repressor controls fruit size via the regulation of endoreduplication related cell expansion [J]. Plant Cell Physiol ,2014,55:1969-1976.
[32]BOGGON T J,SHAN W S,SANTAGATA S,et al.Implication of tubby proteins as transcription factors by structure based functional analysis [J]. Science ,1999,286(5447):2119-2125.
[33]TATUSOV R L,KOONIN E V,LIPMAN D J.A genomic perspective on protein families [J]. Science ,1997,278(5338): 631-637.
[34]李曉波,杨翠翠,邱念伟.拟南芥和大白菜 YABBY 蛋白家族的生物信息学分析[J].山东农业科学,2012,44(12): 1-6.
[35]TANAKA W,TORIBA T,OHMORI Y,et al.The YABBY gene TONGARI-BOUSHI1 is involved in lateral organ development and maintenance of meristem organization in the ricespikelet [J]. Plant Cell ,2012,24(1):80-95.
[36]MUKHERJEE K,BROCCHIERI L,BRGLIN T R.A comprehensive classification and evolutionary analysis of plant homeobox genes [J]. Molecular Biology and Evolution ,2009,26(12):2775-2794.
[37]MUKHERJEE K,BROCCHIERI L,BRGLIN T R.Analysis of the WUSCHEL-RELATED HOMEOBOX gene family in the coniferpicea abies reveals extensive conservation as well as dynamicpatterns [J]. BMc Plant Biology ,2013(13):89.
[38]NARDMANN J,REISEWITZ P,WERR W.Discrete shootand root stem cell promoting WUS/WOX5 functions are anevolutionary innovation of angiosperms [J]. Molecular Biology & Evolution ,2009,26(8):1745-1755.
[39]ZHANG X,ZONG J,LIU J,et al.Genome-wide analysis of WOX gene family in rice,sorghum,maize,Arabidopsis andpoplar [J]. Journal of Integrative Plant Biology ,2010,52(11):1016-1026.
[40]SARKAR A K,LUIJTEN M,MIYASHIMA S,et al.Conserved factors regulate signalling in Arabidopsis thaliana shoot and root stem cell organizers [J]. Nature ,2007,446:811-814.
[41]MATHIEU-RIVET E, GéVAUDANT F,SICARD A,et al.Functional analysis of the anaphase promoting complex activator CCS52A highlights the crucialrole of endo-reduplication for fruit growth in tomato [J]. Plant J ,2010,62:727-741.
[42]PATRICK SIEBER,MICHAEL PETRASCHECK,ALCIDE BARBERIS,et al.Organ polarity in Arabidopsis NOZZLE physically interacts with members of the YABBY family [J]. Plant Physiolgy ,2004,135(4):2172-2185.
[43]JOHN F G,MARIO R,ROBERT K,et al.GRAMINIFOLIZ promotes growth and polarity of Antirrhinum leaves [J]. Development ,2004,131(15):3661-3670.
[44]ZHANG X L,YANG Z P,ZHANG J,et al.Ectopic expression of BraYAB1-702,a member of YABBY gene family in Chinese cabbage causes;leaf curling,inhibition of development of shoot apical meristem and flowering stage delaying in Arabidopsis thaliana [J]. International Journal of Molecular Sciences, 2013,14(7):14872-14891.
[45]SIEGFRIED K R,ESHED Y,BAUM S F,et al.Members of the YABBY gene family specify abaxial cell fate in Arabidopsis [J]. Development ,1999,126(18):4117-4128.
[46]JOHN L B.The YABBY gene family and abaxial cell fate [J]. Current Opinion in Plant Biology ,2000,3(1):17-22.
[47]邵紅霞,陈鸿飞,张东,等.苹果 YABBY 基因家族的鉴定、进化及表达分析[J].浙江农业学报,2017,29(7): 1129-1138.
[48]TORIBA T,HARADA K,TAKAMURA A,et al.Molecular characterization the YABBY gene family in Oryza sativa and expression analysis of OsYABBY1 [J]. Molecular Genetics and Genomics ,2007,277(5):457-468.
[49]葛敏,吕远大,张体付,等.玉米 YABBY 基因家族的全基因组鉴定与分析[J].江苏农业学报,2014,30(6):1267-1272.
[50]韩洪强.控制茄子果型相关性状关键基因的克隆及功能研究[D].上海:上海交通大学,2014.
[51]HAN H Q,LIU Y,JIANG M M,et al.Identification and expression analysis of YABBY family genes associated with fruit shape in tomato ( Solanumly copersicum L.) [J]. Genetics & Molecular Research Gmr ,2015,14(2):7079-7091.
[52]陈秀玲,刘思源,孙婷,等.番茄 YABBY 基因家族的生物信息学分析[J].东北农业大学学报,2017,48(10): 11-19.
[53]王苏苏,陈国平,张彦杰,等.番茄转录因子 fSIYABBY5 f的克隆与表达分析[J].2015,35(2):240-249.
[54]CONG B,BARRERO L S,TANSLEY S D.Regulatory change in YABBY -like transcription factor led to evolution of extreme fruit size during tomato domescation [J]. Nat Genet ,2008,40:800-804.
[55]SIEGFRIED K R,ESHED Y,BAUM S F,et al.Member of the YABBY gene family specifyabxial cell fate in Arabidob opsis [J]. Development ,1999,126:4117-4128.
[56]向江.华东葡萄 VpYABBY 基因功能分析[D].杨凌:西北农林科技大学,2013.
[57]张松霖.葡萄 YABBY 家族生物信息学分析及 fVvYABBY4 f功能研究[D].杨凌:西北农林科技大学,2018.
[58]GRAAFF E V D,LAUX T,RENSING S A.The WUS hom-eobox-containing ( WOX ) protein family [J]. Genome Biol ,2009,10(12):248.
[59]ZHAO Y,HU Y F,DAI M Q,et al.The WUSCHEL-related homeobox gene fWOXl1 f is required to activate shoot-borne crown root development in rice [J]. Plant Cell ,2009,21(3):736-748.
[60]LIN H,NIU L,MCHALE N A,et al.Evolutionarily conserved repressive activity of WOX proteins mediates leaf blade out growth and floral organ development in plants [J]. PNAS ,2013,110(1):366-371.
[61]IKEDA M,MITSUDA N,OHME-TAKAGI M.Arabidopsis WUSCHEL is a bifunctional transcription factor that acts asa repressor in stem cell regulation and as an activator in floral patterning [J]. Plant Cell ,2009,21(11):3493-3505.
[62]LIE C,KELSOM C,WU X. WOX2 and STIMPY-LIKE/WOX8 promote cotyledon boundary formation in Arabidopsis [J]. Plant Journal ,2012,72(4):674-682.
[63]HAECKER A,GROβ-HARDT R,GEIGES B,et al.Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana [J]. Development ,2004,131(3): 657-668.
[64]HIRAKAWA Y, KONDO Y,FUKUDA H.TDIF peptide signaling regulates vascular stem cell proliferation via the WOX4 homeobox gene in Arabidopsis [J]. The Plant Cell, 2010,22(8):2618-2629.
[65]PARK S O,ZHENG Z,OPPENHEIMER D G,et al.The PRETTY FEW SEEDS2 gene encodes an Arabidopsis homeodomain protein that regulates ovule development [J]. Development ,2005,132(4): 841-849.
[66]ZHAO Y,HU Y,DAI M,et al.The WUSCHEL related homeobox gene WOX11 is required to activateshoot-borne crown root development in rice [J]. The Plant Cell, 2009,21(3):736-748.
[67]ZHAO Y,HU Y,DAI M,et al.A new class of regulatory gene sunderlying the cause of pear-shaped tomato fruit [J]. Proceedings of the National Academy of Sciences of the USA ,2002,99:13002-13306.
[68]WANG S,CHANG Y,GUO J,et al.Arabidopsis ovate family proteins,a novel transcriptional repressor family,control multiple aspects of plant growth and development [J]. PLoS ONE ,2011,6:e23896.
[69]HUANG Z,VAN HOUTEN J,GONZALEZ G,et al.Genome wide identification,phylogeny and expression analysis of SUN,OFP and YABBY gene family in tomato [J]. Genetics Genomics ,2013,288:111-129.
[70]YU H,JIANG W,LIU Q,et al.Expression pattern and subcellular localization of the ovate protein family in rice [J]. PLoS ONE ,2015,10:e118966.
[71]赵春燕.番茄 OFP20 基因的克隆及功能初步分析[D].泰安:山东农业大学,2017.
[72]HACKBUSCH J,RICHTER K,MLLER J,et al.A central role of Arabidopsis thaliana ovate family proteins in networking and subcellular localization of 3-aa loop extension homeodomain proteins [J]. Proceedings of the National Academy of Sciences of the United States of America ,2005,102:4908-4912.
[73]COWAN A K,CRIPPS R F,RICHINGS E W,et al.Fruit size:towards an understanding of the metabolic control of fruit growth using avocado as a model system [J]. Physiologia Plantarum ,2001,111 (2):127-136.
[74]李秀菊,刘用生,束怀瑞.不同成熟型苹果果实生长发育过程中几种内源植物激素含量变化的比较[J].植物生理学通讯,2000,36 (1):7-10.
[75]李建国,周碧燕,黄旭明,等.‘妃子笑荔枝不同花期果实大小与激素含量的关系[J].园艺学报,2004,31 (1): 73-75.
[76]TERRY L A,CHOPE G A,BORDONABA J G.Effect of water deficit irrigation and inoculation with Botrytis cinereaon strawberry( Fragaria×ananassa )fruit quality [J]. Journal of Agricultural and Food Chemistry ,2007,55:10812-10819.
[77]NITSCH L,KOHLEN W,OPLAAT C,et al. ABA-deficiency results in reduced plant and fruit size in tomato [J]. Journal of Plant Physiology ,2012,169 (9):878-883.
[78]袁亚钦.SlAS2和SlTKN3调控番茄果实发育的功能研究 [D]. 北京:中国农业科学院,2019.
[79]田嘉.梨 PbFWLs和PsPL 基因的克隆表达与功能初步分析[D].乌鲁木齐:新疆农业大学,2015.
[80]庞少萍.甜橙果实体积发育影响因子研究[D].重庆:西南大学,2017.
[81]庞少萍,董翠翠,馬岩岩,等. CsAREB 转录因子在柑橘果实发育中的作用[J].园艺学报,2017,44(3):441-451.
(责任编辑:林玲娜)

