弗里德赖希共济失调YG8R转基因小鼠的运动行为学及病理变化比较
张晓静, 林培彬, 欧文倩
弗里德赖希共济失调(friedreich ataxia,FRDA)是由编码Frataxin (FXN)蛋白的基因出现隐性突变引起的神经退行性疾病[1,2],为最常见的遗传性共济失调。FRDA的病理改变首先发生在背根神经节(dorsal root ganglia,DRG)伴随感觉神经元丢失,其次是脊髓、后柱、锥体和脊髓小脑束轴索变性和神经元丢失[3]。Frataxin基因第一个内含子中三联体GAA扩增导致Frataxin蛋白水平降低[4,5]。Frataxin是一种参与铁硫簇和血红素生物合成的线粒体蛋白[6]。研究表明,Frataxin表达减少会导致DRG和小脑齿状核神经元发生氧化应激、线粒体铁积累和相应的细胞死亡[7]。迄今为止,FRDA尚无有效治疗方法,很重要的原因就是缺乏合适的FRDA动物模型且其发病机制不清楚。根据GAA三核苷酸序列重复数目不同,目前主要有3种转基因FRDA小鼠模型,包括YG8R、YG22R和YG8sR[8]。研究发现,3种转基因小鼠运动协调性都会逐渐下降,但YG8R小鼠的损伤程度最为显著[9]。然而,先前的研究,一方面由于FRDA转基因小鼠需长时间饲养,导致对模型小鼠FXN的神经表型分析不够彻底,包括从未测试FRDA小鼠的步态异常变化;另一方面对FRDA小鼠不同时间不同行为学差异并不清楚。因此,本研究将以YG8R小鼠为研究对象,进一步分析不同时间YG8R小鼠的运动行为学及病理差异,为进一步明确YG8R小鼠的给药时间及药物筛选奠定基础。
1 材料与方法
1.1 试剂、耗材和实验动物
TRIzol试剂、SYBR Green I核酸凝胶染料、Random primer、High Capacity RNA-to-cDNA反转录试剂盒购自赛默飞公司;多聚甲醛购自广州化学试剂厂;异氟烷购自深圳瑞沃德生命科技有限公司;PBS粉末、乙醇、氯仿、异丙醇、Nuclease-free H2O购自Sigma公司;引物由上海捷瑞生物工程有限公司合成;Anti-NeuN抗体购自abcam公司;过氧化物酶HRP标记山羊抗兔IgG抗体购自CST公司;免疫组化试剂购自上海碧云天生物公司。
B6.Cg-Fxntm1MknTg YG8Pook/J (Strain #:012253)转基因小鼠购自Jackson Laboratories公司;所有小鼠均按照暨南大学动物饲养管理规程饲养,房间温度(23±2) ℃,湿度为50%~70%,房间12 h光照/12 h黑暗交替,小鼠自由进食和饮水,所有小鼠在实验前至少适应5 d,实验分为两组,野生对照组(WT组)和YG8R组,每组均含雌性小鼠8只,雄性小鼠8只。
1.2 实验方法
1.2.1 体重记录 利用大小鼠体重称量天平(上海玉研科学仪器有限公司),每月称量记录一次各组小鼠体重(g)。
1.2.2 加速转棒实验 该实验用于评估小鼠的协调平衡能力。将小鼠放在旋转棒(安徽正华生物仪器设备有限公司)上,旋转速度从4 r/min逐渐增加到40 r/min,记录4 min内每只小鼠从棒上掉落的时间。重复测量3次,每次间隔10 min,取3次结果的平均值作为该小鼠的在棒时间,每2个月检测一次。
1.2.3 旷场实验 该实验用于评估小鼠的自发行为活动量及运动轨迹。将小鼠置于矿场实验箱(安徽正华生物仪器设备有限公司)中,启动自主摄影系统记录小鼠在箱内的活动,每只小鼠连续记录5 min,软件分析小鼠运动总距离。重复测量3次,每次实验间隔10 min,取3次结果的平均值作为评估值,每2个月检测一次。
1.2.4 四肢抓力实验 该实验用于评估小鼠的四肢肌肉力量。将小鼠置于抓力板(安徽正华生物仪器设备有限公司)中央台,轻轻拉动小鼠尾部,记录小鼠抓力最大值。重复3次,每次间隔5 min,取3次结果的平均值作为评估值,每2个月检测一次。
1.2.5 步态检测 MSI DigiGait动物步态成像分析系统(MOUSE SPECIFICS公司)是一个完整的定量评估鼠类模型中动物脚步和步态的工具。将小鼠放于传送带上,仪器速度设置为20 r/min,记录5 s,分析小鼠的步态长度、步宽、触地和摆动时间。
1.2.6 免疫组化染色 实验终点,切取脊髓组织,4%多聚甲醛固定后,利用全自动脱水机(德国徕卡公司)进行脱水,石蜡包埋后,切片,厚度5 μm,二甲苯脱蜡复水后,经柠檬酸缓冲液抗原修复后,5%BSA封闭,加入一抗稀释液稀释的抗Neuro N抗体(1∶1000稀释),4 ℃冰箱放置过夜,第二天PBS清洗后加入二抗,最后将组织片放入苏木素染液中,染色2 min,PBS清洗,经酒精脱水和二甲苯透明后,加入中性树胶封片,干燥后,利用荧光显微镜分别在100X和200X拍照。
1.2.7 实时荧光定量PCR 利用Trizol试剂从小鼠DRG和小脑中提取总的RNA,根据High Capacity RNA-to-cDNA反转录试剂盒说明书制备cDNA。使用Applied Biosystems实时荧光定量PCR仪器(赛默飞公司)和SYBR Green探针检测人类转基因FXN mRNA表达水平。FXN正向引物:5’-TTGAAGACCTTGCAGACAAG-3’和 FXN反向引物:5’-AGCCAGATTTGCTTGTTTGG-3’,GAPDH正向引物:5’-ACCCAGAAGACTGTGGATGG-3’,GAPDH反向引物:5’-GGATGCAGGGATGATGTTCT-3’。以GAPDH为内参,采用2-ΔΔCt计算目的基因mRNA的相对表达量。
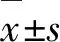
2 结 果
2.1 YG8R小鼠体重未发生显著变化 每间隔1个月称量一次小鼠体重,不同时间点两组小鼠体重无显著差异(见图1)。
2.2 YG8R小鼠在棒时间显著下降 每2个月测量一次小鼠的在棒时间(见图2),从第4个月开始,与WT组相比,YG8R小鼠的在棒时间明显下降(P<0.05)。

图2 各组小鼠在棒时间比较。与WT组相比*P<0.05
2.3 YG8R小鼠运动距离显著下降 每2个月测量一次小鼠的自主运动距离,对自主运动轨迹(见图3A)进行统计分析(见图3B),从第4个月开始,与WT组相比,YG8R小鼠的运动距离明显下降(P<0.05)。

A:自主运动轨迹;B:运动总距离(% of WT)。与WT组相比*P<0.05和***P<0.001。
2.4 YG8R小鼠抓力显著下降 每2个月测量一次小鼠的前肢抓力(见图4)。从第4个月开始,与WT组相比,YG8R小鼠的抓力明显下降(P<0.05)。

与WT组相比*P<0.05和****P<0.0001。
2.5 YG8R小鼠步态异常 在第6个月,检测各组小鼠步态情况(见图5)。与WT组相比,YG8R小鼠左后肢和右后肢步长距离显著下降(P<0.05),YG8R小鼠两前肢和两后肢步宽显著增加(P<0.01),右后肢的摆动时间显著下降(P<0.01),左后肢及右后肢触地时间显著增加(P<0.05)。

与WT组相比*P<0.05,**P<0.01,***P<0.001和****P<0.0001。
2.6 YG8R小鼠脊髓神经元数量及脊髓中Frataxin mRNA水平下降 免疫组化检测脊髓神经元损伤情况(见图6A、图6B)。YG8R小鼠脊髓中神经元数量显著降低(P<0.01);利用qRT-PCR检测FRDA小鼠GAA重复扩增对脊髓和DRG中FXN表达的影响(见图6C),与WT组相比,YG8R小鼠脊髓和DRG中FXN mRNA水平均显著降低(P<0.0001)。

与WT组相比**P<0.01和****P<0.0001。
3 讨 论
目前临床前研究主要使用具有不同重复次数GAA三联体扩增的人类FXN转基因小鼠,其中YG8R小鼠的损伤程度更为显著。然而,现有研究缺乏对YG8R小鼠不同时间运动及病理改变的研究。啮齿类动物在转棒上停留的时间长度是衡量耐力、平衡协调、身体状况和运动情况的评价指标,转棒检测对评价小脑功能障碍特别敏感[10]。开放场检测是一种简单的感觉运动测试,用于确定啮齿动物中枢神经系统疾病模型的一般活动水平、总体运动活动和探索习惯[11]。
研究发现,从4~12个月,YG8R小鼠的体重显著增加,在棒协调能力显著降低,平均速度及运动总距离显著降低,同时YG8R小鼠的抓力明显下降[8]。这与我们的研究相一致,我们推测体重增加可能是YG8R小鼠运动不协调的重要原因之一;同时不同脑区Frataxin表达差异导致小鼠出现不同运动差异表型。一般来说,步态是由运动皮质、基底神经节、丘脑、中脑、髓质、脑桥、小脑和脊髓中央模式发生器之间的复杂通讯控制的[12,13]。步态异常与额叶皮质、基底节、海马、小脑和感觉运动皮质的损伤特别相关[14]。足迹分析结果显示,与B6和Y47R对照相比,FRDA小鼠的步态模式不均匀,步幅长度显著降低[8]。
我们的研究发现,在第6个月,与WT小鼠相比,YG8R小鼠的左后肢和右后肢步长距离显著下降,YG8R小鼠两前肢和两后肢步宽显著增加,右后肢的摆动时间显著下降,左后肢及右后肢触地时间显著增加。这将进一步提供一种新的实验评价手段,能够检测FRDA小鼠中Frataxin水平降低的表型后果,使它们能够接受新的治疗策略。
综上,考虑到可以进行的不同功能研究,我们建议将步态测试作为评估这些FRDA小鼠协调能力的有价值测试,其操作简单,可提供良好的重现性和显著的统计,通过评价小鼠步态异常为将来临床针对性治疗FRDA提供帮助。
研究报道发现,Frataxin表达减少使细胞内出现氧化应激、线粒体铁积累,导致DRG和小脑齿状核神经元细胞死亡,进而出现进行性共济失调、肌肉无力和感觉障碍等症状[8,15~17]。与内源性小鼠水平相比,YG22R和YG8R FRDA小鼠表达的人类Frataxin水平相对降低。我们的研究同样发现,在YG8R小鼠的脊髓中神经元数量显著降低;与WT组小鼠相比,YG8R小鼠脊髓和DRG中Frataxin mRNA水平均明显下降,这与相关研究报道相一致。因此,我们认为导致小鼠运动障碍的更重要原因是脊髓及DRG中Frataxin表达降低,导致线粒体功能障碍、氧化损伤和铁积累,进一步导致脊髓和小脑的齿状核神经元死亡。综上,FRDA小鼠模型中已确定的运动功能缺陷可能是由于Frataxin水平降低,从而诱导了类似FRDA的运动障碍。
总之,本研究进一步明确了FRDA小鼠的运动和协调缺陷是由不稳定的GAA重复序列引起的,导致Frataxin水平降低,这为增加Frataxin疗法带来了新的希望。研究还进一步证实了YG8R小鼠作为基于GAA重复的理想FRDA小鼠模型,适用于研究多种不同的治疗策略,其中包括可能使用铁螯合剂和抗氧化剂,优先针对线粒体,以及旨在上调Frataxin表达的新型药物。

