猪场PRRSV攻毒试验探索及阳性血清的制备
施莹 谢孟娟

摘要:良圻原种猪场长期采用血清驯化的方式进行猪蓝耳病的防控,并摸索出一定的经验,在此基础上开展本试验。近期,经PRRSV阳性样品采集、PRRSV测序和同源性对比确认猪场可能存在2种以上的PRRSV毒株,为了制备优势毒株血清,本试验对双阴性猪只(35日龄)进行PRRSV攻毒试验,在对PRRSV攻毒试验进行探索的同时,为后期血清驯化提供技术支持。
关键词:PRRSV;攻毒试验;阳性血清;制备
猪蓝耳病又称猪繁殖与呼吸综合征(PRRS),是由猪蓝耳病病毒(PRRSV)引起的一种高接触性传染病,其感染性无品种、年龄和用途的差异,对所有猪均能造成不同程度的危害,为猪场的发展带来直接和间接经济损失的同时,还致使猪场长期发展受到制约。多年来,本猪场也一直采用血清驯化的方式来控制猪蓝耳病,取得了较好的防控效果。一是通过人为干预控制猪群的感染时间,切实做好监控和应对措施,尽可能使猪群保持一致的状态。二是选用本场的病毒株来进行血清驯化,借助驯化血清的单一性获得一致性的抗体,提升猪群的免疫力,提升母猪的繁殖性能和生产性能,为猪场长期健康发展夯实基础。
1 试验目的
1.1 PRRSV攻毒试验
经过猪场血清驯化的宝贵经验,现已掌握猪蓝耳病样本Ct值在23左右的时候,直接将血清稀释500倍进行血清驯化效果最佳。为进一步验证是否CT值为23的血清稀释后攻毒效果更佳,并更明确PRRSV攻毒试验的要点,特开展此试验,用两个不同Ct值的血清对抗原抗体双阴性猪(35日龄)进行攻毒,跟踪攻毒后临床症状和抗原抗体的变化情况,为猪场血清驯化提供技术指导和数据支持。
1.2 阳性血清的制备
近期,本猪场血清驯化不稳定,为了确认猪场存在的PRRSV毒株种类,采集阳性样品进行测序、同源性比对,发现猪场可能存在2种以上的PRRSV毒株。为满足血清驯化的血清要求,决定重新进行攻毒并制备血清。选用PRRSV双阴性猪进行PRRSV攻毒试验,对攻毒前后的PRRSV进行测序和基因比对,确定同源性一致、Ct值满足要求后杀猪取血制备血清,为后期猪场的血清驯化提供安全血清。
2 试验材料
猪场制备的PRRSV血清,选取2022年9月29日与本猪场优势毒株序列一致的流产母猪耳号2B26-Y333702血清(CT值19.92),公司内部保存;PRRS抗原抗体双阴猪,35日龄,来源于本猪场;抗原检测试剂盒(ANIMAL-20220919),抗体检测试剂盒(ID.Vet-I0701,IDEXX-EU610);仪器ABI 7500、ABI QuantsudioTM5、BioTek 50TS、BioTek酶标仪ELX800。
3 试验方法
3.1 猪场毒株种类鉴定
采集6份阳性样品进行PCR扩增后送测序公司进行测序,用DNAstar lasergene与本猪场优势毒株进行同源性对比。
3.2 PRRSV攻毒方法
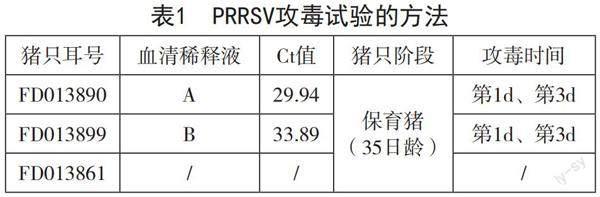
每只猪编号、对应的血清及攻毒时间如表1,另设置一只猪(FD013861)不进行攻毒,与FD013890、FD013899共同饲喂,观察其能否被自然感染,作为血清制备的备选。
3.3 采血检测
攻毒后每天进行采血和检测,时间为12d,检测Ct值,以此判断抗原结果;检测抗体S/P值,以此判断抗体结果。需要注意,由于本试验进行两次攻毒,第二次攻毒(第3d)前要先采血测定后再进行攻毒,以免攻毒影响当日检测结果。
3.4 攻毒前后同源性对比
对两只试验猪的阳性样品进行PCR扩增后送测序公司进行测序,用DNAstar lasergene与本猪场优势毒株进行同源性对比。
4 结果和分析
4.1 猪场毒株鉴定结果
本场6个样品测序后,跟现用驯化血清进行两两相互比对,同源性从83.0%~100%不等(见图1),整体分为两大类,表明猪场内至少存在2种不同PRRSV,为防沿用自存的血清导致血清驯化失败,猪场决定重新制备血清。
4.2 攻毒前猪只PRRS监测情况
PRRS双阴猪检测情况见表2,通过检测抗原抗体双阴性,证明试验动物符合PRRS攻毒要求;通过检测证明猪只不存在非瘟、PED、TGE、PDCV、豬瘟、猪伪狂犬等影响PRRS血清制备的疾病因素,证明试验动物符合制备血清的要求。
4.3 攻毒后PRRS抗原监测情况
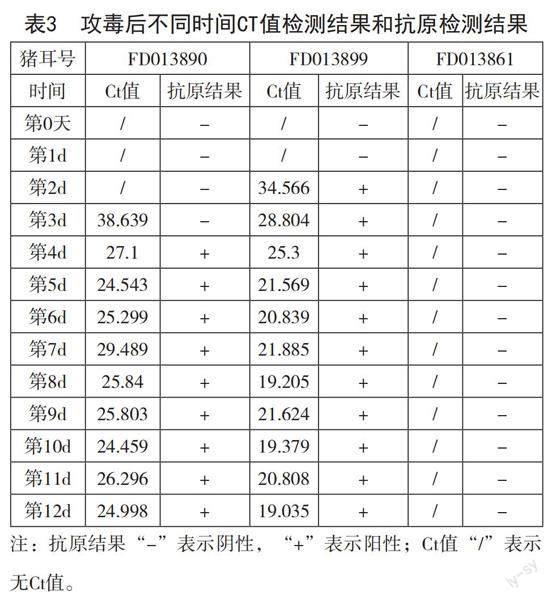
PRRS双阴性猪攻毒后Ct值检测结果及PRRS抗原结果见表3。本试验中通过试剂盒Ct值的测定对抗原结果进行判定,结合本试验检测结果,Ct值≤38或有明显的指数增长期判定为阳性;Ct值>38的样本建议重做,重做后无CT值判定为阴性,否则判为阳性。由表3分析,PRRSV攻毒后,FD013890第4d开始呈抗原阳性;FD013899从第2d起即开始呈现抗原阳性;阴性对照则截至12d抗原皆为阴性。
4.4 攻毒后PRRS抗体监测情况
PRRS双阴性猪攻毒后PRRS抗体检测情况见表4。由表4分析,PRRSV攻毒后,FD013890第12天开始呈抗体阳性;FD013899从第6d起即开始呈现抗体阳性;阴性对照至试验结束未呈现抗体阳性。
4.5 攻毒后临床症状
FD013890攻毒后第3d开始出现嗜睡、喘气异常等症状并伴随体温升高至40℃以上;FD013899攻毒后第5d开始出现嗜睡、喘气异常等症状并伴随体温升高至40℃以上;阴性对照未出现临床症状。
4.6 攻毒前后同源性比对
第12d杀猪取血,对两只攻毒猪的血清进行测序后,和本猪场优势毒株两两相互比对,同源99.9%、100%,表明攻毒前后同源性一致,可以用于血清制备。
4.7 血清制备
第12d,以Ct值为判定依据(表3),Ct值<23的猪只作为血清制备的选择,确定攻毒猪FD013899用来制备血清,按照血清制备方法制备,血清制备量及处理保存方式见表5。
5 讨论
5.1 PRRS抗原方面
通过本试验发现,攻毒猪13890和13899抗原转阳均早于抗体转阳;猪只13899攻毒后较13890攻毒后抗原、抗体转阳更早;猪只13899抗原与抗体转阳间隔时间更短。证明,CT值23左右的血清用于本场血清驯化,猪只更早感染,可以缩短感染时间,降低生产成本,提高血清驯化的效率。阴性对照猪FD013861抗原至试验结束仍未转阳,分析原因可能是猪蓝耳病的潜伏期差异较大,引入感染后,最短3d,最长能达到37d,并且感染时间也受病毒株影响,此毒株可能毒性较弱,且健康猪只抵抗力强,因此自然感染时间相对长甚至不感染。在后期试验中可以延长试验周期或增加平行样品数量,以此增加检测数据量,通过分析提高可信度。
5.2 PRRS抗體方面
攻毒猪13890抗体转阳较抗原转阳延后8d,13899抗体转阳较抗原转阳延后4d,鉴于抗体转阳较抗原转阳的滞后性,在临床中抗原检测更可靠,并常将抗体检测作为是否感染过PRRSV的依据。在临床检测中,要综合判断,不要只依赖于单一的检测手段来判定猪只的感染状态,以免造成误判。
5.3 PRRSV同源性检测的意义
一般来说,PRRSV序列分析同源性越高,变异越小,对猪场造成的危害相对较小。为了提高防控效果,应该对猪场PRRSV的种类有一个清晰的认识,加强对驯化血清的管理,对病料进行测序分析,选择优势毒株,筛选同源性高的血清进行血清驯化,保证驯化效果。
5.4 血清驯化的优点和注意事项
血清驯化选用本猪场的毒株,防控时具有很好的交叉保护能力,能够有效防控;对于猪蓝耳病毒活跃的母猪场,血清驯化可以快速控制蓝耳病,及时清除猪群的病毒量,大大降低损失;血清驯化后的猪场能够维持较长时间的稳定性,降低猪蓝耳病的管控难度;血清驯化成本低,对于猪场效益提升和其他疾病的防控有很大的借鉴作用。
参考文献
[1] 刘英杰,齐六卫,董彦龙,等.吉林某规模化猪场的猪蓝耳病抗原抗体分析及防控建议[J].猪业科学,2022,39(11):77-79.
[2] 张天宝,薛忠,张振玲.某猪场猪蓝耳病暴发案例调查与防治[J].猪业科学,2022,39(8):78-80.
[3] 沈叶盛,耿国芹,李焱,等.猪蓝耳病的防控要点[J].山东畜牧兽医,2022,43(6):36-37.

