季铵盐化N,N-二甲基-2-噁唑啉聚合物 对表皮葡萄球菌的抗菌活性和生物相容性研究
朱佶鹏,周 敏,陈 胜,2,江伟男,宋恭华,刘润辉,4
(1. 华东理工大学药学院,上海 200237)
(2. 华东理工大学 超细材料制备与应用教育部重点实验室,上海 200237)
(3. 华东理工大学材料科学与工程学院,上海 200237)
(4. 华东理工大学深圳研究院,深圳 518063)
1 前 言
细菌引起的微生物感染是困扰人类健康的严重问题[1]。为了解决这一问题,研究人员发现和开发了许多治疗细菌感染的抗生素。然而,抗生素的大量和过度使用使某些细菌产生了严重的耐药性,增加了感染患者并发症和死亡的风险[2]。美国疾病控制和预防中心2021年的一份报告显示,美国每年有280多万感染患者表现出抗生素耐药性,其中35 000人因感染耐药菌而死亡。因此,急需发展在医学和公共卫生领域能有效对抗耐药菌的抗感染药物和高效的抗菌手段。研究发现,抗菌肽[3,4]和阳离子化合物[5,6]通常不易使细菌产生耐药性[7]。其中季铵盐是最常用的阳离子抗菌剂之一。一般认为,季铵盐的杀菌作用机制包括:① 化合物吸附和渗透至细菌细胞壁,② 化合物与细菌细胞质膜(主要是细胞膜上脂质或蛋白质)反应,导致膜破裂,③ 细菌细胞内低分子质量物质的泄漏以及蛋白质和核酸降解,④ 自溶酶引起的细菌细胞壁裂解[7,8]。在众多季铵盐类化合物中,季铵盐化的聚合物具有无挥发性、高化学稳定性、强抗菌性和低残留毒性等优点[9]。已有的研究结果表明,基于聚乙烯基吡啶[10]、聚丙烯酸酯[11]、聚丙烯酰胺[12]、聚甲基丙烯酸二甲氨基乙酯[13]、聚苯撑乙炔[14]、聚噻吩[15]、聚硅氧烷[16]、聚乙烯亚胺[17]、甲基丙烯酸羧基甜菜碱[18]、聚降冰片烯[19]、聚乙烯基咪唑[20]、聚(N-(2-羟丙基)甲基丙烯酰胺)[21]和改性天然多糖[22]为主体骨架结构的季铵盐化的聚合物,在抗菌方面均表现出不错的潜力。
自1960年代以来,聚噁唑啉类化合物的聚合及应用研究受到了广泛关注[23-28]。有大量文献报道了2-取代噁唑啉类化合物的开环聚合反应[29-32]。聚噁唑啉具有优异的生物相容性,聚(2-乙基-2-噁唑啉)是被美国食品与药品监督管理局批准使用的间接食品添加剂[33]。通过侧链或链末端的取代基R,可以很容易地把手性和功能性基团引入到聚噁唑啉中,其理化性质(亲水性、疏水性、手性、生物功能性等)也可以通过侧链的性质进行调整,从而为合成具有复杂层次结构的仿生自组装材料开辟了新思路。
基于聚噁唑啉类化合物的生物相容性,早在2005年,Tiller课题组[34,35]制备了接枝不同链长季铵盐末端基团的聚噁唑啉聚合物,该聚合物对大肠杆菌和金黄色葡萄球菌展现出了较好的抗菌效果。Liu课题组[36]以宿主防御肽为模型,发现基于聚2-噁唑啉的甘氨酸类肽聚合物可以模拟宿主防御肽,在体外和体内对耐甲氧西林的金黄色葡萄球菌均具有较好的抗菌活性。由于该聚合物具有与活性氧物种相关的抗菌机制,所以金黄色葡萄球菌不会对合成的聚合物产生耐药性。经该聚合物处理后的金黄色葡萄球菌对常用抗生素仍然敏感,表明在常用抗菌剂和聚2-噁唑啉的甘氨酸类肽聚合物之间没有明显的抗菌压力或交叉耐药性[37]。在此基础上,受细胞穿透肽结构的启发,2022年,Jiang等[38]又报道了侧链为胍基的聚2-噁唑啉聚合物抗真菌剂,该抗真菌剂拥有较低的哺乳动物细胞毒性,且在治疗局部和系统性真菌感染方面具有强疗效。
如图1所示,本文设计、合成了一系列侧链为不同季铵盐的N,N-二甲基-2-取代噁唑啉聚合物,并对该聚合物进行了一系列抗菌研究和生物相容性评价。该季铵盐化的聚合物具有较好的抗菌活性,对血红细胞溶血率较低,对多重耐药菌菌株的抗菌活性略高于对标准菌株的抗菌活性。其中优选化合物H-(OctylMe2NMeOx)18-Pip对表皮葡萄球菌多重耐药菌菌株S.e0692的最低杀菌浓度(minimum bactericidal concentration,MBC)为12.5 μg/mL,且针对人血红细胞的10%溶血浓度(HC10)∶MBC>160∶1,显示出良好的选择性。
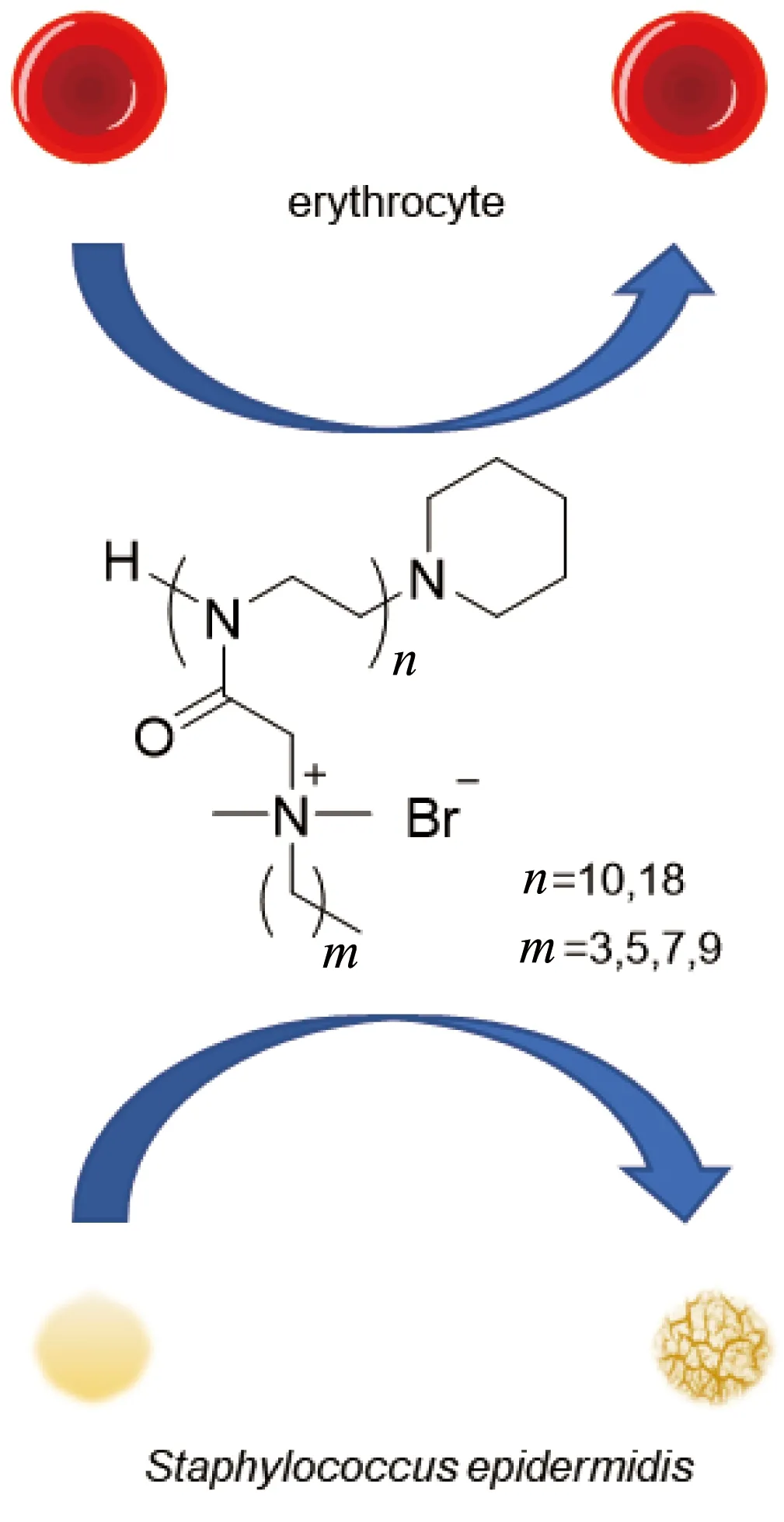
图1 季铵盐化的N,N-二甲基-2-噁唑啉聚合物对表皮葡萄球菌和血红细胞的选择性
2 实 验
2.1 原料与试剂
4-二甲氨基吡啶(DMAP)、超干N,N-二甲基乙酰胺(DMAc)、N,N-二甲基甘氨酸、2-氯乙基异氰酸酯、四氢呋喃(THF)、叔丁醇钾、三氟甲磺酸钪(Sc(OTf)3)、溴丙烷、溴戊烷、溴庚烷、溴壬烷、哌啶、无水硫酸镁、石油醚、甲醇均为分析纯,购自上海泰坦科技股份有限公司。酵母提取物、胰蛋白胨、Mueller-Hinton(MH)肉汤固体、琼脂、三羟甲基氨基甲烷(Tris)、曲拉通(Triton)X-100均购自上海麦克林生化科技股份有限公司。细菌S.eATCC49134为表皮葡萄球菌标准菌株,购自ATCC。细菌S.e0692为耐氨苄西林、环丙沙星和四环素的多重耐药表皮葡萄球菌菌株,自瑞金康复医院临床分离。
2.2 仪器与设备
Micromass LCT KC317型质谱分析仪(ESI),美国Waters公司;Bruker Magnet System 400 MHz型核磁共振波谱仪(NMR),德国Bruker公司;Super(1220/750/900)型超级净化手套箱,米开罗那(中国)有限公司;SpectraMax M2型酶标仪,美国Molecular Devices公司。
2.3 实验方法
2.3.1 单体N,N-二甲基-2-噁唑啉的合成
单体N,N-二甲基-2-噁唑啉(Me2NMeOx)的合成路线如图2所示。0 ℃下在1 L的三口瓶中依次加入91.5 mg DMAP(0.75 mmol)、3.1 g N,N-二甲基甘氨酸(30 mmol)、500 mL二氯甲烷,进行磁力搅拌,待反应液搅拌均匀后,于30 min内缓慢滴加250 mL含有3.9 g 2-氯乙基异氰酸酯(0.375 mmol)的二氯甲烷稀释液,滴加完成后移去冷却装置并将反应体系置于室温下反应。反应12 h后,于1 h内再向三口烧瓶中分3批加入10.1 g叔丁醇钾(90 mmol),并继续在室温下搅拌12 h。反应结束后,使用二氯甲烷(3×500 mL)萃取,合并有机相用500 mL饱和食盐水洗涤,二氯甲烷相用无水硫酸镁干燥后浓缩除去,再减压蒸馏得到无色油状液体Me2NMeOx 2.5 g,分离产率为65%。

图2 N,N-二甲基-2-噁唑啉的合成
2.3.2 N,N-二甲基-2-噁唑啉聚合物的合成
2.3.2.1 N,N-二甲基-2-噁唑啉的聚合
以三氟甲磺酸钪为引发剂、Me2NMeOx为单体,合成不同链长的N,N-二甲基-2-噁唑啉聚合物,合成路线如图3所示。具体制备过程依照之前文献报道的方法进行[39],在高纯N2保护的手套箱中,称取256.4 mg Me2NMeOx(2 mmol)置于干燥、放有磁力搅拌子的反应瓶中,并加入4 mL超干DMAc溶解。然后加入适当比例的Sc(OTf)3作为引发剂(n引发剂∶n单体=1∶10或1∶20或1∶40,物质的量比)。将反应瓶从手套箱中取出,在N2保护下于130 ℃下进行反应(n引发剂∶n单体=1∶10,反应6 h;n引发剂∶n单体=1∶20,反应12 h;n引发剂∶n单体=1∶40,反应24 h)。反应完成后加入引发剂3倍当量的哌啶在室温下搅拌12 h进行淬灭反应,之后加入2 mL THF,进一步将反应液倒入40 mL石油醚中混匀得到絮状沉淀,体系经过离心(4000 r/min,3 min)后收集固体并使用氮气流进行干燥。再次向收集的固体中加入2 mL THF,溶解后将该溶液加入40 mL石油醚中混匀,得到的含絮状沉淀混合物经离心(4000 r/min,3 min)分离后收集固体。重复上述溶解—沉淀—离心操作6次,真空干燥后得到N,N-二甲基-2-噁唑啉聚合物H-(Me2NMeOx)n-Pip。
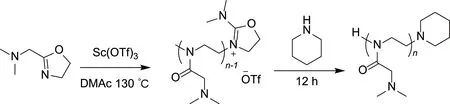
图3 N,N-二甲基-2-噁唑啉的聚合
2.3.2.2 N,N-二甲基-2-噁唑啉聚合物的季铵盐化
N,N-二甲基-2-噁唑啉聚合物H-(Me2NMeOx)n-Pip的季铵盐化合成路线如图4所示。称量适当比例的N,N-二甲基-2-噁唑啉聚合物H-(Me2NMeOx)n-Pip和烷基溴(n聚合物上的N,N二甲基∶n烷基溴=1∶2),使用2 mL甲醇作为溶剂(烷基溴的反应浓度为0.2 mol/L)回流反应12 h。反应结束冷却至室温后,加入2 mL THF并将反应液倒入40 mL石油醚中混合均匀即可得到絮状沉淀,体系经过离心(4000 r/min,3 min)后收集固体或液体并使用氮气流进行干燥(有部分样品中的甲醇和烷基溴可能未能通过一次操作完全带走,所以呈现液体)。再次加入2 mL THF溶解后将反应液加入40 mL石油醚中混匀,得到的含絮状沉淀混合物经离心(4000 r/min,3 min)分离后收集固体。重复上述溶解—沉淀—离心过程6次,真空干燥后得到侧链季铵盐化的N,N-二甲基-2-噁唑啉聚合物产物(H-(ButylMe2NMeOx)n-Pip、H-(HexylMe2NMeOx)n-Pip、H-(OctylMe2NMeOx)n-Pip、H-(DecylMe2NMeOx)n-Pip)。
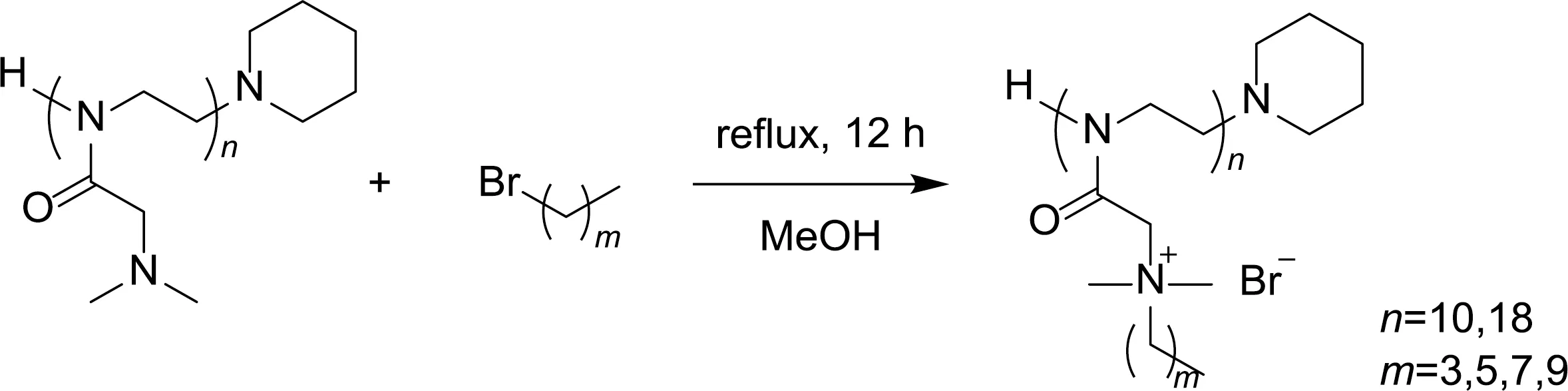
图4 N,N-二甲基-2-噁唑啉聚合物的季铵盐化
2.4 样品检测
2.4.1 凝胶渗透色谱测试
2.4.2 最低抑菌浓度测试
Luria-Bertani (LB)液体培养基的配制:依次称量2.5 g酵母提取物、5.0 g胰蛋白胨和5.0 g NaCI,加入500 mL去离子水中混合均匀,在高压灭菌锅中110 ℃下灭菌15 min。MH液体培养基的配制:称量10.5 g MH肉汤固体,加入500 mL去离子水混合均匀,在高压灭菌锅中110 ℃下灭菌15 min。
最低抑菌浓度(minimum inhibitory concentration,MIC)测试操作规程:细菌用LB液体培养基在37 ℃的摇床中以200 r/min转速培养10 h,培养所得的细菌通过离心收集并重新分散到MH培养基中。将菌液稀释成为2×105cfu/mL备用。将待测样品在96孔板中用MH培养基按两倍率逐级稀释,孔板中的待测样品浓度范围为1.56~200 μg/mL。在同一个96孔板中有4个孔只加入MH培养基作为阴性对照,4个孔加入MH培养基和菌液作为阳性对照(不含待测样品)。向每个孔中加入50 μL之前稀释好的菌液,全部加入后轻微摇晃10 s,并在37 ℃霉菌培养箱中静置培养9 h,然后再用酶标仪读取波长设定为600 nm时样品测定得到的光密度值(OD600)。在不同时间重复测试2次,每次测试都设置2个平行样。可用式(1)计算每个孔细菌生长百分比,其中不同的A值为酶标仪测得的对应OD600读数值:
(1)
把计算好的数据绘制成折线图,MIC为待测样品抑制细菌生长的最低浓度。
2.4.3 最低杀菌浓度测试
LB琼脂培养基的配制:依次称量2.5 g酵母提取物、7.5 g琼脂、5.0 g胰蛋白胨和5.0 g NaCl,加入500 mL去离子水混合均匀,在高压灭菌锅中110 ℃灭菌15 min。LB固体培养皿的制备:当LB琼脂培养基冷却到70 ℃后,向直径为150 mm的培养皿中倒入LB琼脂培养基(约28 mL),轻微晃动使液体铺满整个培养皿。自然冷却后,盖上培养皿盖子并倒置,使用紫外灭菌30 min,最后密封保存。
细菌的MBC测试在完成MIC测试后进行。MIC测试结束后,从测试过MIC的96孔板的每个孔中取出2.5 μL菌液滴到LB琼脂固体培养皿内,于37 ℃的霉菌培养箱中培养大于12 h,MBC为可杀死大于99.9%细菌的最低聚合物或抗菌剂浓度。
2.4.4 溶血测试
TBS缓冲液的配制:称取0.605 g三羟甲基氨基甲烷,4.385 g NaCI,加入500 mL去离子水,在高压灭菌锅中120 ℃灭菌15 min,所配置TBS缓冲液的pH值为7.2。Triton X-100溶液的配制:称量51.2 mg Triton X-100置于20 mL离心管内,加入16 mL TBS缓冲液,震荡混合均匀后,于4 ℃冰箱保存备用。
将新鲜的人体血液按1∶19的体积比分散于pH值为7.2的TBS缓冲液中并离心清洗3次(4000 r/min,3 min),最后用TBS缓冲液稀释人血红细胞得到体积分数为5%的人血红细胞悬浮液。采用TBS缓冲液将待测聚合物配置成4 mg/mL的溶液,之后在96孔板中用TBS缓冲液将聚合物溶液按2倍率逐级稀释,得到的聚合物浓度为15.6~2000 μg/mL。在同一平板上,将含有50 μL体积分数为0.1%的Triton X-100溶液和50 μL人血红细胞体积分数为5%的人血红细胞悬浮液的混合液作为阳性对照,将100 μL人血红细胞体积分数为2.5%的人血红细胞悬浮液作为阴性对照。向每个孔中加入50 μL稀释好的血红细胞悬浮液,全部加入后轻微摇晃10 s后,置于37 ℃霉菌培养箱中孵育1 h。将96孔板以3600 r/min转速离心5 min后,从每个孔中取80 μL上清液平行转移至新的96孔板中,转移后若出现气泡需用牙签沾取异辛醇戳破,然后用酶标仪读取每个孔的OD405值。采用式(2)计算每个孔中聚合物的溶血百分比:
(2)
把计算好的数据绘制成折线图,HC50即为导致50%的人血红细胞不裂解的最高浓度,HC10则为导致10%的人血红细胞不裂解的最高浓度。每次测试设置2组平行样,且在不同的时间重复测试3次。
3 结果与讨论
3.1 N,N-二甲基-2-噁唑啉聚合物的表征
以Sc(OTf)3为引发剂、Me2NMeOx为单体,合成了一系列侧链为N,N-二甲基的N,N-二甲基-2-噁唑啉聚合物H-(Me2NMeOx)n-Pip,聚合物的GPC图谱如图5所示,表征数据如表1所示。3种噁唑啉聚合物的聚合物分散性指数在1.05~1.13之间。当引发剂和单体的物质的量比在1∶10和1∶20时,噁唑啉聚合物的Mn按照理论值成倍增加,增长趋势明显,符合规律。当引发剂和单体的物质的量比为1∶40时,噁唑啉聚合物的Mn和Mw增加不明显,通过后期分析发现大量单体没有参与聚合,仍以单体的形式留在反应体系内,且延长反应时间或提高反应温度后情况依旧,说明应用于此反应体系单体的聚合度极限为18左右。季铵盐化的N,N-二甲基-2-聚合物通过NMR进行表征,发现NMR表征的聚合物聚合度与GPC表征的聚合度基本一致。

表1 N,N-二甲基-2-噁唑啉聚合物的凝胶渗透色谱表征数据
3.2 季铵盐化的N,N-二甲基-2-噁唑啉聚合物的抗菌活性
3.2.1 季铵盐化的N,N-二甲基-2-噁唑啉聚合物对表皮葡萄球菌的最低抑菌浓度
季铵盐化的N,N-二甲基-2-噁唑啉聚合物对表皮葡萄球菌的MIC如表2所示,其中表皮葡萄球菌S.eATCC49134为标准菌株,表皮葡萄球菌S.e0692为多重耐药菌。由表2可知,季铵盐化的N,N-二甲基-2-噁唑啉聚合物烷基链的增长有利于增强化合物的抗菌活性,聚合度较大的季铵盐化的N,N-二甲基-2-噁唑啉聚合物抗菌活性也较好。季铵盐化的N,N-二甲基-2-噁唑啉聚合物对于标准菌株和多重耐药菌都表现出了一定的抗菌活性。其中优选化合物H-(OctylMe2NMeOx)18-Pip对多重耐药的表皮葡萄球菌S.e0692的MIC效果最好,为12.5 μg/mL,优于对标准菌株S.eATCC49134的抗菌活性(MIC:50 μg/mL),显示了该化合物在多重耐药菌抗菌方面的潜力。
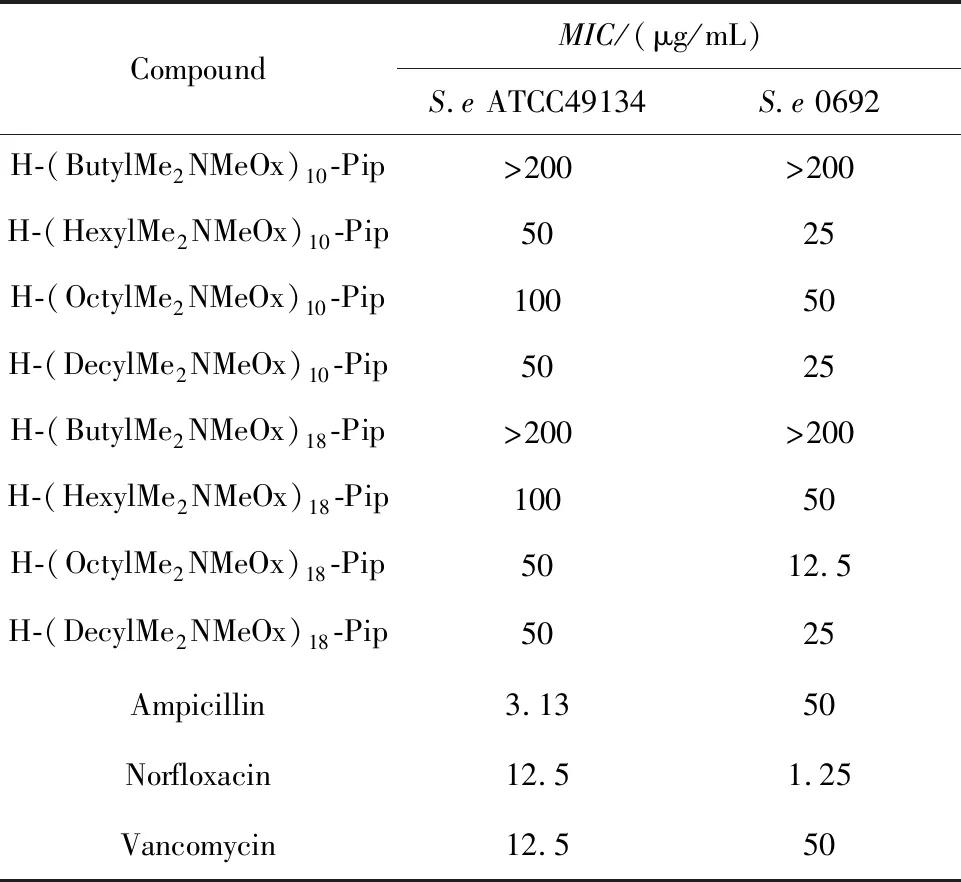
表2 季铵盐化的N,N-二甲基-2-噁唑啉聚合物对表皮葡萄球菌的最低抑菌浓度
3.2.2 季铵盐化的N,N-二甲基-2-噁唑啉聚合物优选化合物对表皮葡萄球菌的最低杀菌浓度
依据之前MIC测试结果,优选了3种活性最好的化合物H-(DecylMe2NMeOx)10-Pip、H-(OctylMe2NMeOx)18-Pip和H-(DecylMe2NMeOx)18-Pip对表皮葡萄球菌的2个不同菌株进行了MBC测试,结果如图6所示。图中季铵盐化的N,N-二甲基-2-噁唑啉聚合物的浓度从下至上逐渐提高,依次为1.56,3.13,6.25,12.5,25和50 μg/mL。从左至右依次为H-(DecylMe2NMeOx)10-Pip对S.eATCC49134、H-(DecylMe2NMeOx)10-Pip对S.e0692、H-(OctylMe2NMeOx)18-Pip对S.eATCC49134、H-(OctylMe2NMeOx)18-Pip对S.e0692、H-(DecylMe2NMeOx)18-Pip对S.eATCC49134以及H-(DecylMe2NMeOx)18-Pip对S.e0692的MBC测试结果。测试结果表明,季铵盐化的N,N-二甲基-2-噁唑啉聚合物对各所测菌株的MBC和MIC基本一致,说明该类化合物的主要抗菌机理是杀死细菌而不仅仅是抑制细菌生长。

图6 季铵盐化的N,N-二甲基-2-噁唑啉聚合物优选化合物对表皮葡萄球菌S.e ATCC49134和S.e 0692的最低杀菌浓度测试结果
3.3 季铵盐化的N,N-二甲基-2-噁唑啉聚合物的溶血毒性
溶血毒性是评价生物材料生物相容性的重要指标,溶血毒性强的生物材料应用范围将受到大大限制,高溶血毒性将限制抗菌剂直接用于全身给药。季铵盐化的N,N-二甲基-2-噁唑啉聚合物的溶血毒性测试结果如表3所示。总体来说,测试所用的季铵盐化的N,N-二甲基-2-噁唑啉聚合物对人血红细胞的毒性较低。对于所有被测季铵盐化的N,N-二甲基-2-噁唑啉聚合物而言,HC10均高于2000 μg/mL。其中化合物H-(OctylMe2NMeOx)18-Pip对多重耐药的表皮葡萄球菌S.e0692的HC10值是其MIC和MBC值的160倍,显示出优异的选择性。
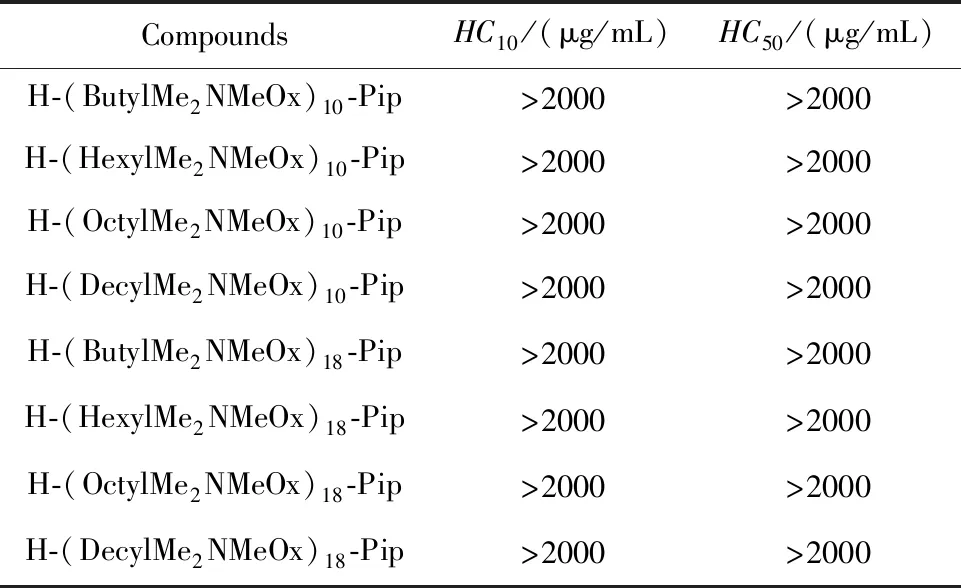
表3 季铵盐化的N,N-二甲基-2-噁唑啉聚合物的半数溶血浓度和10%溶血浓度测试
4 结 论
本文设计、合成了一系列侧链不同的季铵盐化N,N-二甲基-2-取代噁唑啉聚合物,并针对表皮葡萄球菌进行了抗菌测试以及生物相容性评价。实验结果表明,此类聚合物对于表皮葡萄球菌具有较好的抗菌活性,而对人体血红细胞的溶血率较低。其中季铵盐化的N,N-二甲基-2-噁唑啉聚合物H-(OctylMe2NMeOx)18-Pip对于多重耐药的表皮葡萄球菌S.e0692的最低抑菌浓度和最低杀菌浓度均为12.5 μg/mL,且其导致10%的人血红细胞不裂解的最高浓度大于2000 μg/mL,表现出良好的选择性。

