基于心康冲剂调控慢性心力衰竭大鼠JAK2/STAT3通路抗心肌纤维化的作用机制
徐丹,董朝阳,郭睿,郭冰,毛以林


〔摘要〕 目的 探討心康冲剂抗慢性心力衰竭大鼠心肌纤维化的机制。方法 48只雄性SD大鼠随机均分为正常组、模型组、心康冲剂治疗组(治疗组)、缬沙坦对照组(缬沙坦组)。除正常组外,其余各组经腹腔注射注射用盐酸多柔比星1.5 mg/kg制造慢性心力衰竭大鼠模型。治疗组给与1.2 g/(kg·d)心康冲剂;缬沙坦组给与1.62 mg/(kg·d)缬沙坦胶囊;正常组、模型组给予等体积灭菌注射用水灌胃。每日1次,连续灌胃8周。以超声心动图检测大鼠心功能[左室射血分数(left ventricular ejection fractions, LVEF)、左心室短轴缩短率(left ventricular fractional shortening, LVFS)],Masson染色观察心肌纤维化,RT-qPCR法检测心肌组织Ⅰ型胶原(collagen Ⅰ, ColⅠ)mRNA表达水平,Western blot法检测心肌ColⅠ、磷酸化酪氨酸激酶2(phospho-Janus kinase, p-JAK2)、磷酸化信号转导和转录激活子3(phoso-signal transducer and activator of transcription 3, p-STAT3)的蛋白含量。用Pearson相关及线性回归分析ColⅠ、p-JAK2、p-STAT3与左室收缩末期内径(left ventricular end systolic diameter, LVESD)之间的相关性。结果 与正常组比较,模型组大鼠LVEF、LVFS显著下降(P<0.01);与模型组比较,治疗组大鼠LVEF、LVFS均升高(P<0.01),LVESD下降(P<0.01),ColⅠmRNA及蛋白含量均下降(P<0.05,P<0.01),p-JAK2、p-STAT3蛋白含量均下降(P<0.05,P<0.01);与缬沙坦组比较,治疗组LVEF、LVFS升高(P<0.01),p-STAT3蛋白含量降低(P<0.05),而ColⅠmRNA、p-JAK2、ColⅠ蛋白含量差异无统计学意义(P>0.05)。ColⅠ、p-STAT3、p-JAK2均与LVESD具有明显线性关系。结论 心康冲剂可通过下调JAK2/STAT3信号通路激活,降低ColⅠmRNA表达与ColⅠ蛋白合成,从而抗慢性心力衰竭大鼠心肌纤维化。
〔关键词〕 慢性心力衰竭;心康冲剂;心肌纤维化;JAK2/STAT3信号通路;Ⅰ型胶原
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.08.007
Mechanism of action of Xinkang Granule against myocardial fibrosis
by regulating JAK2/STAT3 signaling pathway in rats with chronic
heart failure
XU Dan1,2, DONG Chaoyang1,2, GUO Rui1,2, GUO Bing1,2, MAO Yilin2*
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The Second Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410005, China
〔Abstract〕 Objective To investigate the mechanism of Xinkang Granule (XKG) against myocardial fibrosis in rats with chronic heart failure (CHF). Methods Forty-eight male SD rats were randomly divided into normal group, model group, XKG treatment group (treatment group), valsartan control group (valsartan group). Except for the normal group, the other groups were injected intraperitoneally with doxorubicin hydrochloride 1.5 mg/kg to establish a rat model of CHF. Then, the treatment group was given XKG 1.2 g/(kg·d), the valsartan group was given valsartan capsules 1.62 mg/(kg·d), and the normal group and the model group were given equal volumes of sterilized water for injection. All the rats received gavage once daily, continuously for 8 weeks. The cardiac functions of rats including left ventricular ejection fractions (LVEF) and left ventricular fractional shortening (LVFS) were measured by echocardiography, myocardial fibrosis was observed by Masson staining, the mRNA expression level of collagen Ⅰ (Col Ⅰ) in myocardial tissue was examined by RT-qPCR, and the protein level of myocardial ColⅠ, phospho-Janus kinase 2 (p-JAK2), phoso-signal transducer, and activator of transcription 3 (p-STAT3) were measured by Western blot. Moreover, Pearson's correlation and linear regression were used to analyze the correlation between ColⅠ, p-JAK2, p-STAT3, and left ventricular end systolic diameter (LVESD). Results Compared with the normal group, LVEF and LVFS in the model group significantly decreased (P<0.01); compared with the model group, LVEF and LVFS in the treatment group increased (P<0.01), LVESD decreased (P<0.01), and the mRNA expression and protein level of ColⅠ as well as the protein levels of p-JAK2 and p-STAT3 were reduced (P<0.05, P<0.01); compared with the valsartan group, LVEF and LVFS in the treatment group were higher (P<0.01), but the protein level of p-STAT3 was lower (P<0.05), and there was no significant difference in Col Ⅰ mRNA expression and the protein levels of p-JAK2 and Col Ⅰ(P>0.05). ColⅠ, p-STAT3, and p-JAK2 all had obvious linear relationships with LVESD. Conclusion XKG can inhibit myocardial fibrosis in rats with chronic heart failure by down-regulating the activation of JAK2/STAT3 signaling pathway and reducing the mRNA expression and protein synthesis of ColⅠ.
〔Keywords〕 chronic heart failure; Xinkang Granule; myocardial fibrosis; JAK2/STAT3 signaling pathway; collagenⅠ
慢性心力衰竭(chronic heart failure, CHF)是由于各种器质性或功能性的心脏疾病导致心功能不全,进而引起的一种临床综合征,是心脏疾病的终末阶段[1]。心力衰竭(简称心衰)时心脏负荷增加,心肌出现代偿性肥厚,表现为心肌胶原纤维沉积,心肌舒张和收缩僵硬异常,心肌顺应性下降[2],即出现心肌纤维化。Janus蛋白酪氨酸激酶2/信号转导和转录激活子3(Janus kinase 2/signal transducer and activator of transcription 3, JAK2/STAT3)信号通路的激活能调控心肌成纤维细胞的增殖、转移,使胶原蛋白过度沉积,从而影响心肌纤维化的发生发展[3]。JAK2磷酸化后可进一步使STAT3磷酸化[4],磷酸化后的STAT3可以上调Ⅰ型胶原蛋白(collagenⅠ, ColⅠ)合成[5],促进纤维化的发生发展。
心康冲剂(Xinkang Granule, XKG)是第七批全国老中医药专家学术经验继承工作指导老师、湖南省名老中医毛以林教授以《医学衷中参西录》之升陷汤、《伤寒论》之真武汤、苓桂术甘汤及时方参苓白术散、五皮饮为基础,融合化裁而出,具有“升补心肺宗气、温补脾肾阳气、利水渗湿”的功效,针对CHF后期“宗气下陷、脾肾阳虚、水饮内停”病机而设[6]。本实验通过腹腔注射盐酸多柔比星建立心衰模型,采用心康冲剂进行干预,与缬沙坦进行对照,研究心康冲剂调控CHF大鼠JAK2/STAT3信号通路激活抗心肌纤维化的作用机制,现报道如下。
1 材料
1.1 实验动物
48只健康雄性SPF级SD大鼠,购于湖南斯莱克景达实验动物有限公司(实验动物合格证编号:430727221100402072),体质量180~200 g。动物饲养于湖南中医药大学实验动物中心,室内温度(24±2) ℃,相对湿度50%~70%。大鼠均自由摄食、饮水,适应性喂养1周后开始实验。此实验由湖南中医药大学动物实验伦理委员会审核批准,伦理编号:LL2022030302。
1.2 主要药品及试剂
注射用盐酸多柔比星(浙江海正药业股份有限公司,批号:H33021979);缬沙坦胶囊(北京诺华制药有限公司,批号:H20040217);心康冲剂(广东一方制药有限公司);PCR引物(由北京擎科生物科技股份有限公司合成);mRNA、miRNA逆转录试剂盒、UltraSYBR Mixture、DM2000 Plus DNA Marker(中国北京康为世纪,货号:CW2569、CW2141、CW2601、CW0632);Trizol试剂盒(美国Thermo公司,货号:15596026);核酸染料(中国北京普利莱基因技术有限公司,货号:PB11141);抗体:ColⅠ、GAPDH(美国Proteintech公司,货号:14695-1-AP、10494-1-AP)、p-JAK2、p-STAT3(英国Abcam公司,货号:ab32101、ab76315);二抗 Goat anti-Rabbit IgG (H+L) Secondary Antibody, HRP(中国Abiowell公司,货号:AWS0002b);Masson染色试剂盒(上海威奥生物科技有限公司,货号:AWI0253a)。
1.3 主要仪器
便携式彩色多普勒超声仪(飞依诺科技股份有限公司,型号:VINNO6LAB);荧光定量RCP仪(美国ABI公司,型号:QuantStudio1);化学发光成像系统(中国上海勤翔科学仪器有限公司,型号:ChemiScope6100);台式高速冷冻离心机(中国湖南湘仪,型号:H1650R);显微镜(Motic,型号:BA210T)。
2 方法
2.1 动物分组及造模
动物适应性饲养1周后,随机取12只作为正常组,其余大鼠进行造模。有研究证实,阿霉素可通过JAK/STAT信号通路诱导大鼠左心室细胞死亡和纤维化[7]。故本实验选用阿霉素进行造模,造模方法同文献[8],大鼠按1.5 mg/kg阿霉素腹腔注射,每周2次,共7周[9]。以大鼠出现皮毛枯槁、竖立、踌卧扎堆、缩肩拱背、行动迟缓、精神萎靡、尾凉暗淡、腹水等症状,以及超声心动图检测左心室短轴缩短率(left ventricular fractional shortening, LVFS)<30%[10],为心力衰竭造模成功的标志。36只成模大鼠再按随机数字表法分为阿霉素模型组(模型组)、心康冲剂治疗组(治疗组)、缬沙坦对照组(缬沙坦组),每组12只。
2.2 药物制备及给药
心康冲剂组成:白参10 g,黄芪30 g,柴胡5 g,升麻5 g,桔梗5 g,茯苓15 g,薏苡仁30 g,生姜皮10 g,大腹皮10 g,陈皮10 g,桂枝6 g,制附片10 g,砂仁6 g。由廣东一方制药有限公司提供中药配方颗粒,根据前期研究已证明的最佳有效剂量[11],按成人2倍等效剂量即1 g/(kg·d),配制成浓度为1.2 g/mL的溶液。缬沙坦胶囊成人剂量80 mg/d,按人与动物体表面积折算[12],以缬沙坦胶囊配制成1.62 mg/mL的溶液,灌胃量=给药剂量/各组相应溶液浓度,每次灌胃量1~2 mL。正常组及模型组给予等量灭菌注射用水灌胃。每天1次,持续8周后结束实验进行取材。
2.3 指标及检测方法
2.3.1 心脏超声检测心功能 大鼠用动物用异氟烷经呼吸麻醉机麻醉后固定,前胸涂搽脱毛膏备皮后涂耦合剂,经飞依诺VINNO6lab彩色多谱勒超声诊断仪取大鼠左心室长轴切面后进行M超声检测,连续记录10个心动周期,测量左心室舒张末期内径(left ventricular end diastolic diameter, LVEDD)、左心室收缩末期内径(left ventricular end systolic diameter, LVESD)、左室射血分数(left ventricular ejection fractions, LVEF)、LVFS,所有数据均测量3次并取其平均值记录。
2.3.2 Masson染色 取大鼠左心室心肌组织,放入4%多聚甲醛溶液中固定标本,经石蜡包埋、切片(厚度约5 μm)后,行Masson染色,过程参照Masson染色试剂盒说明书。染色后每组样本分别在×100和×400镜下随机选取4个视野拍照。光学显微镜下观察肌纤维呈红色,胶原纤维呈蓝染或绿色。
2.3.3 RT-qPCR检测心肌组织ColⅠmRNA表达 取大鼠心肌组织约0.02 g,以Trizol提取心肌组织总RNA,以组织总mRNA为模板,逆转录cDNA(反应体系为20 μL),42 ℃孵育15 min,85 ℃孵育5 min,冰上冷却,5倍稀释后于-20 ℃保存。每个标本取2 μL进行PCR反应,反应体系为30 μL,检测基因上下游引物各1 μL,去离子水11 μL,PCR Master Mix15 μL。扩增条件为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,共40个循环,经GAPDH内参校正。收集每循环第3个步骤荧光信号量,以2-ΔΔCt反映各样品相对于对照组样品目的基因表达水平的比值,ΔCt=目的基因Ct-内参基因Ct,-ΔΔCt=(对照组)ΔCt-各样品ΔCt。每个样本重复3次后进行统计分析。引物设计首先在NCBI上搜索目的基因的序列,然后运用Primer5软件设计引物,最后由北京擎科合成引物。引物序列见表1。
2.3.4 Western blot法检测心肌ColⅠ、p-JAK2、p-STAT3蛋白表达水平 剪取冻存心肌组织0.025 g,加入300 μL RIPA裂解液冰上裂解10 min,4 ℃,12 000 r/min半径7 cm离心15 min后,将上清液转移到1.5 mL离心管中;按照BCA蛋白定量试剂盒(Abiowell)使用说明操作,测定蛋白浓度。每个样本取200 μL蛋白上清液,经电泳、转膜、封闭、一抗孵育,用1×PBST将一抗按照一定比例稀释,ColⅠ(1∶1 000),p-JAK2(1∶1 000),p-STAT3(1∶5 000),GAPDH(1∶5 000),将膜与一抗一起孵育,室温放置90 min。孵育结束,1×PBST洗3次,每次15 min。二抗孵育,用1×PBST稀释HRP标记的二抗,将按1∶5 000稀释后的二抗与膜共同室温孵育90 min。孵育结束,1×PBST洗3次,每次15 min。使用ECL化学发光液与膜孵育1 min,用滤纸吸尽液体,用塑封膜将膜包裹杂交膜,在凝胶成像系统成像。将曝光后的底片用Quantity One专业灰度分析软件进行分析。
2.4 统计学分析
采用GraphPad Prism 8.0.2统计学软件进行统计分析,计量资料均以“x±s”表示,先进行正态性和方差齐性检验,各组间比较采用one-way ANOVA分析;方差不齐时用方差分析Games-Howell检验;不满足正态性时选择秩和检验;变量间的相关性用Pearson相关分析及线性回归分析。均以P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠心功能指标比较
与正常组比较,模型组大鼠LVEDD、LVESD升高(P<0.05,P<0.01),LVEF、LVFS显著降低(P<0.01)。与模型组比较,治疗组LVEDD降低(P<0.01),而LVEF、LVFS升高(P<0.01);缬沙坦组LVEDD差异无统计学意义(P>0.05),而LVEF、LVFS升高(P<0.01)。与缬沙坦组比较,治疗组LVEDD、LVESD差异无统计学意义(P>0.05),而LVEF、LVFS升高(P<0.01)。详见表2。
3.2 各组大鼠心肌Masson染色结果
正常组大鼠心肌组织呈红色,细胞核呈蓝灰色,心肌纤维排列整齐、规则,细胞间见少量呈蓝色的胶原纤维沉积;模型组大鼠心肌纤维排列紊乱,视野中可见大量网状排列的胶原纤维;缬沙坦组相较于模型组心肌纤维排列紊乱有所改善,心肌纤维沉积减少;治疗组相较模型组心肌纤维排列紊乱有所改善,胶原纤维沉积明显减少,相较于缬沙坦组胶原纤维沉积减少明显。详见图1。
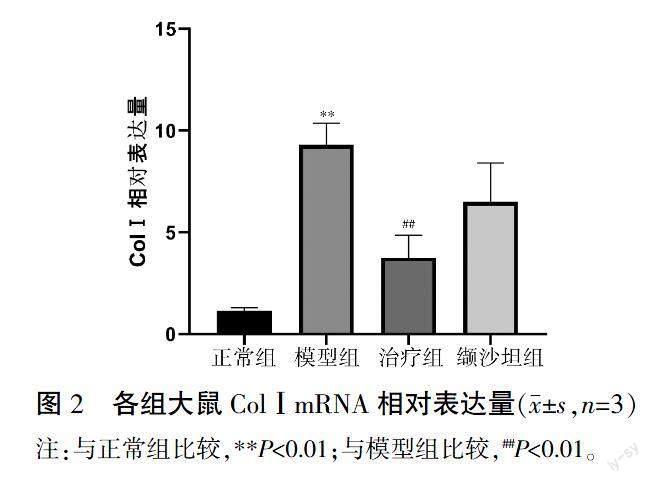
3.3 各组ColⅠmRNA表达比较
与正常组比较,模型组大鼠心肌ColⅠmRNA表达升高(P<0.01);与模型组比较,XKG治疗组大鼠心肌ColⅠmRNA表达下降(P<0.01);治疗组与缬沙坦组之间差异无统计学意义(P>0.05)。详见图2。
3.4 各组ColⅠ、p-JAK2、p-STAT3蛋白含量差异比较
与正常组比较,模型组大鼠心肌Col Ⅰ、p-STAT3、p-JAK2蛋白含量均升高(P<0.01);缬沙坦组p-STAT3、p-JAK2蛋白含量均升高(P<0.05,P<0.01)。与模型组比较,治疗组大鼠心肌ColⅠ、p-STAT3、p-JAK2蛋白含量均降低(P<0.05,P<0.01)。与缬沙坦组比较,治疗组大鼠心肌p-STAT3蛋白含量降低(P<0.05),p-JAK2、ColⅠ蛋白含量差异无统计学意义(P>0.05)。详见图3。
3.5 左室收缩末期内径与ColⅠ、p-STAT3、p-JAK2蛋白含量线性回归分析及Pearson相关分析
p-STAT3蛋白含量、p-JAK2蛋白含量、ColⅠ蛋白含量均与LVIDs具有明确线性关系(F=47、57.69、9.666;P<0.01,P<0.05),且p-STAT3、p-JAK2、ColⅠ与LVIDs均呈正相关。详见图4。LVIDs能被p-STAT3、p-JAK2、ColⅠ蛋白含量解釋的因素分别占82.4%、85.2%、49.1%,其中与p-JAK2、p-STAT3蛋白含量的相关系数较大(r=0.923、0.908)。详见表3。
4 讨论
CHF是多种心血管疾病发展的终末阶段。目前,西医采用“新四联”规范化心力衰竭药物治疗模式,即血管紧张素受体脑啡肽酶抑制剂或血管紧张素转换酶抑制剂(angiotension converting enzyme inhibitors, ACEI)/血管紧张素Ⅱ受体拮抗剂、钠-葡萄糖共转运蛋白2抑制剂、β受体阻滞剂和盐皮质激素受体拮抗剂[13]。其中,ACEI类代表药物缬沙坦经临床试验证明具有改善心脏结构和功能、治疗肥厚型心肌病的作用[14]。有实验研究证实,缬沙坦具有明确的抗心肌纤维化的作用[15]。
CHF依据其心悸、气喘、肢体水肿等症状体征,在中医学归属为“心胀”“心悸”“水肿”等范畴。毛以林教授在研究古今文献和临床实践的基础上,提出CHF的主要病机观念为宗气下陷、脾肾阳虚、水湿内停[6],由此拟方心康冲剂,该方以真武汤、升陷汤以及参苓白术散合并化裁而出,具有升补心肺宗气、温补脾肾阳气、利水渗湿化饮的功效,可用于CHF治疗,并获得显著的临床疗效,前期研究该方能抗心肌纤维化、延缓心力衰竭、抗心室重构[16]。
CHF的主要病理变化是心室重构,心力衰竭时由于心脏负荷增加,心肌代偿性肥厚,且心肌肥厚时心肌细胞数并不增多,而是心肌纤维增多,表现为心肌纤维化。细胞外基质的过度沉积是心肌纤维化的重要原因,细胞外基质主要是由Ⅰ型、Ⅲ型胶原构成,其中Ⅰ型胶原占心肌胶原的80%~85%,其含量与心脏功能密切相关。心肌纤维化时胶原沉积,各型胶原比例失调,其中Ⅰ型、Ⅲ型胶原比例升高、排列紊乱[14],心脏结构重塑、心肌肥大、心室壁顺应性下降,最终导致功能障碍。因此,Ⅰ型胶原的含量与排列可以用来评估心肌纤维化的程度。
近年来,关于JAK2/STAT3信号通路参与调控多种重要脏器纤维化的报道越来越多[17-19]。其在心肌纤维化中的作用也备受重视,研究表明,JAK2/STAT3信号通路的激活是导致左心室心肌纤维化的重要机制之一[20]。JAK2/STAT3信号通路激活的第一步是JAK2的激活,各种配体如白细胞介素-6与JAK2结合使其磷酸化,激活后的JAK2可使其下游的STAT3磷酸化,激活后的STAT3上调成纤维细胞,促进肌成纤维细胞的增殖[21],上调Ⅰ型胶原蛋白的合成[5]。
在本实验中,心脏彩超结果显示阿霉素腹腔注射造模后大鼠LVEED、LVESD明显升高,而LVEF、LVFS显著下降,Masson染色显示模型组大鼠心肌组织有明显的纤维化改变,且心肌组织中ColⅠmRNA的表达及蛋白含量均明显升高,纤维化的心肌组织中p-STAT3及p-JAK2蛋白含量均升高;而心康冲剂能够明显改善心肌纤维化,降低组织中ColⅠmRNA的表达和ColⅠ含量,作用途径可能是通过抑制JAK2磷酸化进而抑制STAT3的磷酸化,从而减轻心肌纤维化。通过相关分析及线性回归分析发现,p-STAT3、p-JAK2、ColⅠ含量与LVIDs呈正相关,且p-STAT3、p-JAK2对LVIDs的影响更大。以上结果表明,心康冲剂基于JAK2/STAT3信号通路调控,减少心肌ColⅠ的合成,从而抗心肌纤维化。
参考文献
[1] 卢健棋, 李苏依, 卢俊燊, 等. 中医药治疗慢性心力衰竭的研究进展[J]. 中华中医药学刊, 2020, 38(12): 145-148.
[2] WEBER K T, PICK R, JALIL J E, et al. Patterns of myocardial fibrosis[J]. Journal of Molecular and Cellular Cardiology, 1989, 21: 121-131.
[3] 鄭海清, 应苗法, 顾胜龙, 等. 心肌纤维化的信号转导机制及新型抑制剂的研究进展[J]. 中国细胞生物学学报, 2019, 41(2): 268-274.
[4] BHARADWAJ U, KASEMBELI M M, ROBINSON P, et al. Targeting Janus kinases and signal transducer and activator of transcription 3 to treat inflammation, fibrosis, and cancer: Rationale, progress, and caution[J]. Pharmacological Reviews, 2020, 72(2): 486-526.
[5] MAKINO Y, HIKITA H, KODAMA T, et al. CTGF mediates tumor-stroma interactions between hepatoma cells and hepatic stellate cells to accelerate HCC progression[J]. Cancer Research, 2018, 78(17): 4902-4914.
[6] 毛以林. 步入中医之门6: 疑难病证辨治思路详解[M]. 北京: 中国中医药出版社, 2018: 90-102.
[7] SHATI A A, EL-KOTT A F. Acylated ghrelin prevents doxorubicin-induced cardiac intrinsic cell death and fibrosis in rats by restoring IL-6/JAK2/STAT3 signaling pathway and inhibition of STAT1[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2019, 392(9): 1151-1168.
[8] 刘蓉芳, 杨 婷, 吴玲娇, 等. 心康冲剂调控miRNA-21/PTEN/Akt/MMP-2/Fasl表达抗心衰大鼠心肌纤维化研究[J]. 时珍国医国药, 2018, 29(12): 2862-2865.
[9] 徐建虎, 张 琦, 杨子庆, 等. 阿霉素诱导大鼠慢性心衰模型的制备[J]. 宁夏医科大学学报, 2016, 38(3): 348-351.
[10] XU K, GEORGE I, KLOTZ S, et al. Erythropoietin derivate improves left ventricular systolic performance and attenuates left ventricular remodeling in rats with myocardial infarct-induced heart failure[J]. Journal of Cardiovascular Pharmacology, 2010, 56(5): 506-512.
[11] 刘蓉芳, 张 辉, 谭 雄, 等. 心康冲剂调控慢性心衰大鼠miRNA-21/PTEN抗心肌纤维化研究[J]. 湖南中医药大学学报, 2018, 38(3): 270-274.
[12] 贺石林, 王 键, 王净净. 中医科研设计与统计学[M].长沙:湖南科学技术出版社, 2006: 48.
[13] 葛均波, 霍 勇, 杨杰孚, 等. 慢性心力衰竭“新四联”药物治疗临床决策路径专家共识[J]. 中国循环杂志, 2022, 37(8): 769-781.
[14] NEFF L S, BRADSHAW A D. Cross your heart? Collagen cross-links in cardiac health and disease[J]. Cellular Signalling, 2021, 79: 109889.
[15] SUI X Z, WEI H C, WANG D C. Novel mechanism of cardiac protection by valsartan: Synergetic roles of TGF-β1 and HIF-1α in Ang II-mediated fibrosis after myocardial infarction[J]. Journal of Cellular and Molecular Medicine, 2015, 19(8): 1773-1782.
[16] 刘蓉芳, 孙 玲, 张杼惠, 等. 心康冲剂对慢性心力衰竭大鼠心室重构的影响[J]. 中医杂志, 2017, 58(22): 1947-1952.
[17] QIN Y, ZHAO P, CHEN Y, et al. Lipopolysaccharide induces epithelial-mesenchymal transition of alveolar epithelial cells cocultured with macrophages possibly via the JAK2/STAT3 signaling pathway[J]. Human & Experimental Toxicology, 2020, 39(2): 224-234.
[18] LI Y F, GUO F, HUANG R S, et al. Natural flavonoid pectolinarigenin alleviated kidney fibrosis via inhibiting the activation of TGFβ/SMAD3 and JAK2/STAT3 signaling[J]. International Immunopharmacology, 2021, 91: 107279.
[19] ZHAO J, QI Y F, YU Y R. STAT3: A key regulator in liver fibrosis[J]. Annals of Hepatology, 2021, 21: 100224.
[20] KIM D, LEE I H, KIM S, et al. A specific STAT3-binding peptide exerts antiproliferative effects and antitumor activity by inhibiting STAT3 phosphorylation and signaling[J]. Cancer Research, 2014, 74(8): 2144-2151.
[21] SUN X X, ZHANG J, WANG L H, et al. Growth inhibition of human hepatocellular carcinoma cells by blocking STAT3 activation with decoy-ODN[J]. Cancer Letters, 2008, 262(2): 201-213.
(本文編辑 匡静之)

