miR-17-92 基因簇对骨肉瘤细胞增殖侵袭的影响
吴岳,要星辰,史湘君,徐子彧,任杰,时铭,黎萌,刘俊鹏,杜心如
(首都医科大学附属北京朝阳医院骨科,北京 100020)
骨肉瘤(osteosarcoma,OS)多源于间叶组织,在骨骼系统恶性肿瘤中发病率列第一,以青少年为主,血行转移后患者5 年存活率较低,具有恶性程度高、预后差特点,为临床难题[1~3]。微小RNA(microRNA,miRNA)被证实参与细胞生长、分化/裂、凋亡等过程,在肿瘤诊断、预后评估中有重要作用[4];不同肿瘤组织miRNA 表达谱不一,miR-494 或基因蛋白等参与OS 发病、进展[5,6]。miR-17-92 基因簇分布在人13q31.3 染色体,包括miR-17、miR-18a、miR-19a/b 等共7 个成熟miRNA,属于原癌基因miRNA 代表,参与多种恶性肿瘤发生、进展[7,8]。miR-17-92 基因簇被发现在人胃癌组织中高表达,与肿瘤直径、TNM 分期有关;其过表达可能通过上调Integrin β1 表达、增强基质金属蛋白酶(matrix metalloproteinase,MMP)-2 活性以促MGC-803 细胞侵袭[9]。有研究称miR-17-92 基因簇对肿瘤发展起抑制作用,有抑癌效应[10]。可见关于miR-17-92 基因簇在不同肿瘤中的表达趋势不一,尚无统一定论。Arabi 等[11]研究表明,miR-17-92 簇及其旁链106a-363/106b-25 在OS 细胞系中表达上调,与临床结局、促凋亡靶点等密切相关;认为miR-17-92簇及其2 个副链在OS 生物学中有致病、预后影响的关键作用。林金銮等[12]研究表明,人OS 组织中miR-17-92 基因簇相比正常骨组织均高表达,且与预后相关,认为miR-17-92 基因簇可能参与OS 发生、进展,有望成为OS 患者预后评估的新标志物。但由于OS 发病机制复杂,目前对于miR-17-92 基因簇在OS 发生、进展中的作用机制尚不清楚,且国内相关报道不多。对此本研究以OS 细胞进行实验,旨在探究miR-17-92 基因簇对OS MG-63 细胞增殖、侵袭的影响,并从相关信号通路方面分析其可能作用机制,为OS 诊断、治疗提供新的肿瘤标记物、靶点。
1 材料与方法
1.1 细胞与主要试剂
MG-63、hFOB1.19(正常细胞株)均购于中科院上海细胞研究所,本实验室内保存。胎牛血清(上海吉泰依科赛生物科技有限公司);PBS(美国Sigma);RPMI1640 培养基与DMEM/F12 培养液(武汉普诺赛生命科技有限公司);Lipofectamine 2000 试剂盒(赛默飞世尔科技(中国)有限公司);miR-17-92 基因簇模拟物与阴性对照(美国signosis公司);TaqMan miRNA Isolation Kit 反转录试剂盒(美国AB Applied Biosysytems 公司);miR-17-92 基因簇引物[生工生物工程(上海)股份有限公司] ;Trizol 裂解液与miRNA 分离试剂盒(美国Invotrogen 公司);CCK-8 试剂盒(北京沃比森科技有限公司);转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、Smad3、MMP-2、MMP-9 单克隆抗体与HRP 标记山羊抗兔IgG 二抗(日本Takara 公司)。
1.2 细胞分组与体外转染处理
OS 细胞MG-63、人成骨细胞hFOB1.19 分别在含10%胎牛血清的RPMI1640 培养基、DMEM/F12 培养液中培养,前者设置温度37℃,后者为34℃,均5% CO2。选择对数生长期细胞,依据Lipofectamine 2000 操作说明书将miR 模拟物转染到OS 细胞MG-63 细胞内,分为miR-17-92 基因簇模拟物组(miR-17-92 组)与阴性对照组(miR-NC 组)。
1.3 检测方法与指标
1.3.1 qRT-PCR 检测
对转染前MG-63、hFOB 细胞及转染MG-63 后的miR-17-92 组、miR-NC 组miR-17、miR-18a、miR-19a、miR-19b、miR-20、miR-92 相对表达量测定:OS 细胞MG-63、人成骨细胞hFOB1.19 应用PBS 洗涤2 次,离心提取细胞沉淀,依据反转录试剂盒行逆转录反应,于7500 Fast Real-Time PCR 仪上开展,20 μl 反应体系中进行,稀释逆转录产物cDNA 后取其2 μl 和TaqMan 引物2 μl 混合,95℃10 min 变性,接着95℃15 s,60℃60 s,共40 个循环,完成后记录各反应管Ct 值,选择U6 为内参,经由2-△△CT 法计算miR-17-92 基因簇相对表达量。相关引物序列:U6 正向、反向引物分别为CTCGCTTCGGCAGCACA、AACGCTTCACGAATTTGCGT、has-miR-17、has-miR-18a、has-miR-19a、has-miR-19b、hasmiR-20、has-miR-92;引物序列分别为5'-GCAAAG TGCTTACAGTGCAGGTAG-3'、5'-UAAGCUCGAUGU AGUGCAGUAAC-3'、5'-TGTGCAAATCTATGCAAA ACTG-3'、5'GCATCCCAGTGTGCAAATCC-3'、5'-G GTAAAGTGCTTATAGTGCAGGTAG-3'、5'-ATTGCA CTTGTCCCGGCCTGT-3'。
1.3.2 CCK-8 检测
测定转染后miR-17-92 组、miR-NC 组MG-63细胞增殖能力:转染后选择对数生长期细胞,经由胰酶消化,洗涤2 次,借助完全培养基调控细胞到3×103 个/ml,各孔(96 孔板)接种细胞液100 μl。培养1、2、3 d 时分别加入调配好的CCK-8 试剂(共100 μl,CCK-8 试剂、完全培养基分别10 μl、90 μl)孵育120 min,通过CLARIOstar 全功能多功能酶标仪对450 nm 处光密度(optical density,OD) 检测,OD450 代表细胞增殖能力。
1.3.3 Transwell 检测
测定转染后miR-17-92 组、miR-NC 组MG-63细胞侵袭数量:MG-63 细胞被消化后经由含血清DMEM 培养基调节细胞到3×105个/ml,提细胞液100 μl 接种至Transwell 小室之上室,下室则为20% FBS DMEM 培养基500 μl,随后Transwell 小室放入培养箱内1 d。CO2培养箱内取出Transwell 培养板,舍弃Transwell 小室上层液体,棉签对小室上层轻拭后倒扣之,室温放置180~300 s。舍弃孔内液体,无钙PBS 清洗2 次,4%甲醛固定0.5 h,1%结晶紫染色,时长10 min。显微镜下观察Transwell 培养板,随机选择5 个视野拍照且计数。
1.3.4 Western blot 检测
测定转染后miR-17-92 组、miR-NC 组MG63 细胞相关蛋白水平:转染MG-63 细胞、培养48 h 后通过Western blot 检测细胞内TGF-β1、Smad3、MMP-2、MMP-9 蛋白表达水平测定。依据1∶10(g/ml)比例滴进RIPA 裂解液,参考BCA 蛋白定量试剂盒对各组细胞总蛋白含量检测。裂解、提取各组蛋白后行SDS-PAGE 电泳分离,之后将其置于硝酸纤维素膜,处理后将该膜放入5%脱脂奶粉溶液中封闭120 min,常规室温。TBST 洗涤3 次。一抗滴入,4℃孵育过夜。再漂洗3 次,HRP 标记之而抗体滴入,室温孵育120 min,漂洗3 次。ECL 工作液显色,经由Image J 图像分析系统分析相关蛋白显影图,GAPDH为内参,测定相关蛋白水平。
1.4 统计学方法
应用SPSS 24.0 统计学软件对数据进行统计学处理。计量资料满足正态分布以±s表示,两组间行独立t检验;组内时间点比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结 果
2.1 两个细胞株miR 的mRNA 表达
MG-63 细胞miR-17、miR-18a、miR-19a、miR-19b、miR-20、miR-92 相对表达量均显著高于hFOB 细胞(P<0.05),见表1。
表1 两株细胞miR 的mRNA 表达(相对表达量,±s)与比较
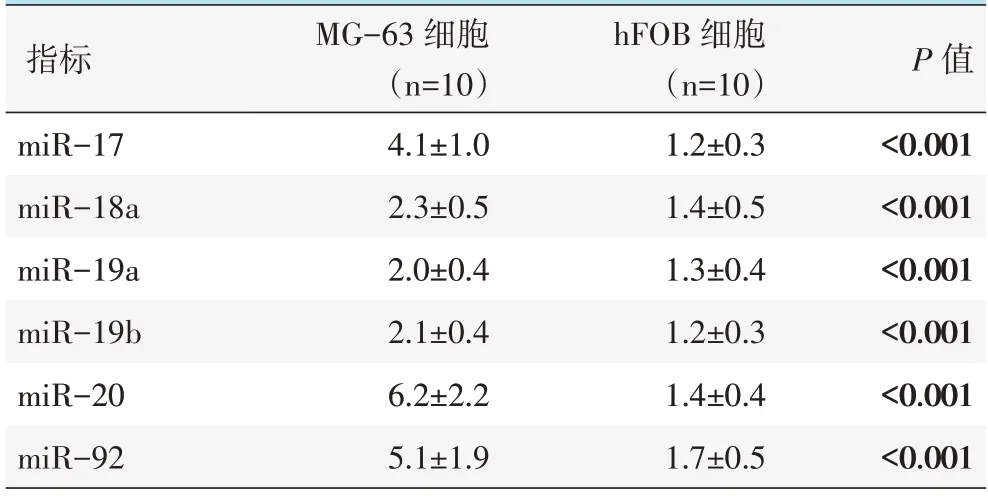
表1 两株细胞miR 的mRNA 表达(相对表达量,±s)与比较
指标miR-17 miR-18a miR-19a miR-19b miR-20 miR-92 MG-63 细胞(n=10)4.1±1.0 2.3±0.5 2.0±0.4 2.1±0.4 6.2±2.2 5.1±1.9 hFOB 细胞(n=10)1.2±0.3 1.4±0.5 1.3±0.4 1.2±0.3 1.4±0.4 1.7±0.5 P 值<0.001<0.001<0.001<0.001<0.001<0.001
2.2 转染后MG-63 细胞miR 的mRNA 表达
miR-17-92组miR-17、miR-18a、miR-19a、miR-19b、miR-20、miR-92 相对表达量均显著高于miRNC 组(P<0.05),见表2。
表2 MG-63 阳性与阴性转染miR-17-92 后检测结果(±s)与比较
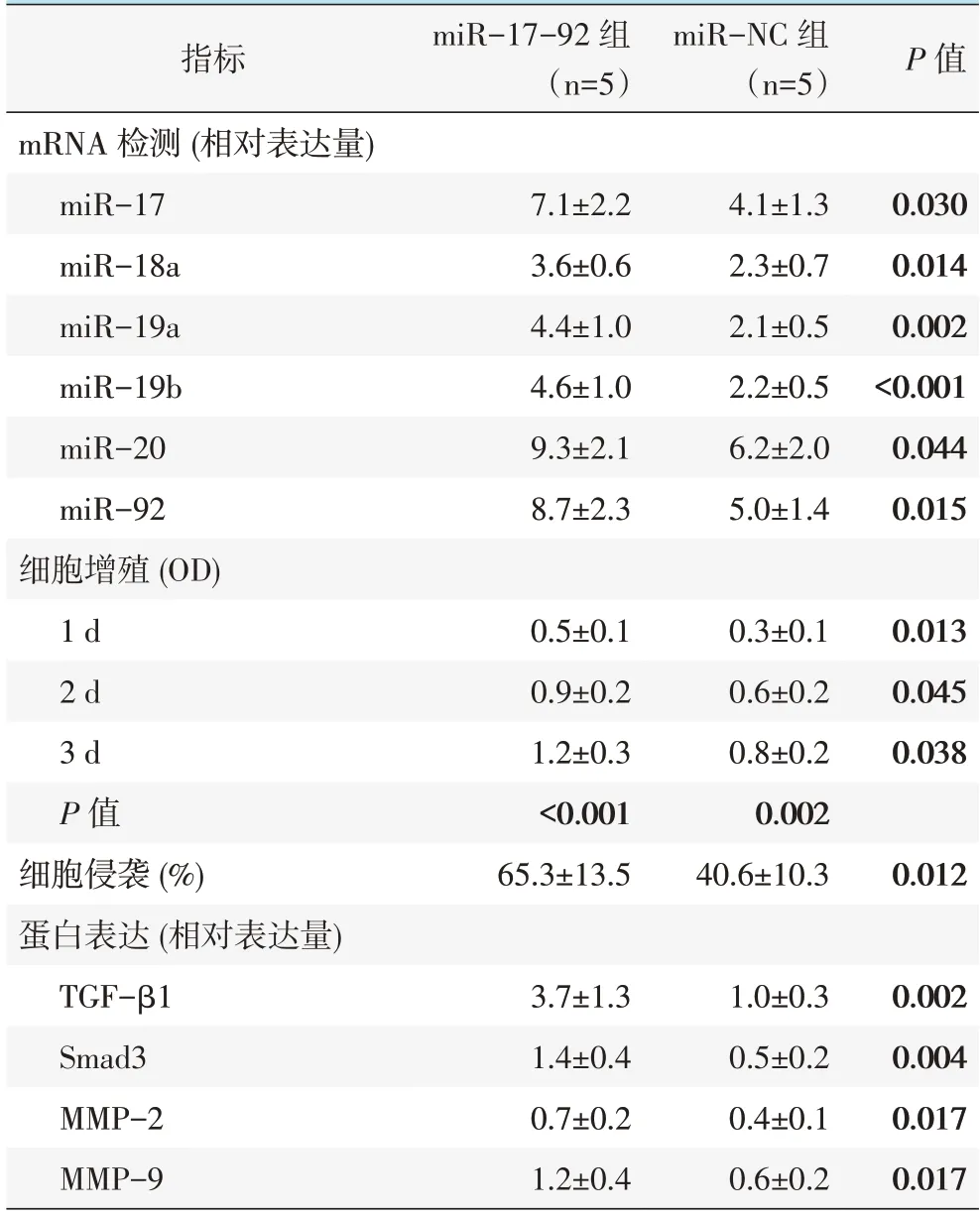
表2 MG-63 阳性与阴性转染miR-17-92 后检测结果(±s)与比较
指标mRNA 检测(相对表达量)miR-17 miR-18a miR-19a miR-19b miR-20 miR-92细胞增殖(OD)1 d 2 d 3 d P 值细胞侵袭(%)蛋白表达(相对表达量)TGF-β1 Smad3 MMP-2 MMP-9 miR-17-92 组(n=5)miR-NC 组(n=5)P 值7.1±2.2 3.6±0.6 4.4±1.0 4.6±1.0 9.3±2.1 8.7±2.3 4.1±1.3 2.3±0.7 2.1±0.5 2.2±0.5 6.2±2.0 5.0±1.4 0.030 0.014 0.002<0.001 0.044 0.015 0.013 0.045 0.038 0.5±0.1 0.9±0.2 1.2±0.3<0.001 65.3±13.5 0.3±0.1 0.6±0.2 0.8±0.2 0.002 40.6±10.3 0.012 3.7±1.3 1.4±0.4 0.7±0.2 1.2±0.4 1.0±0.3 0.5±0.2 0.4±0.1 0.6±0.2 0.002 0.004 0.017 0.017
2.3 转染后MG-63 细胞的增殖
miR-17-92 组与miR-NC 培养1、2 和3 d 的OD450 值均呈现上升趋势,且miR-17-92 组培养1、2 和3d 的OD450 值均显著高于miR-NC 组,见表2。
2.4 转染后MG-63 细胞的侵袭
miR-17-92 组侵袭细胞数显著多于miR-NC 组(P<0.05),见表2。
2.5 转染后MG-63 细胞蛋白表达
miR- 17- 92 组 TGF- β1、Smad3、MMP- 2、MMP-9 蛋白表达水平均显著高于miR-NC 组(P<0.05),见表2、图1。
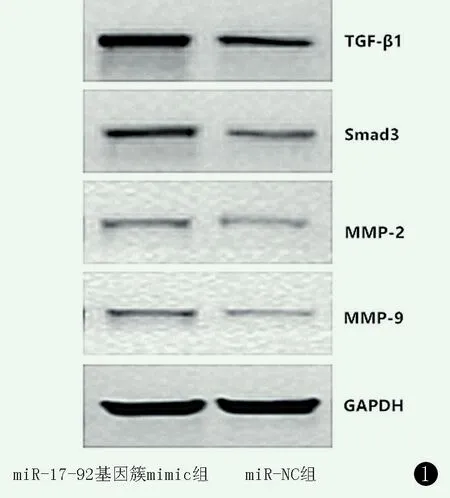
图1 Western blot 检测相关蛋白电泳图。
3 讨 论
目前关于circRNA-miRNA 在OS 中的研究较多,为临床热点之一[13]。miR-17-92 基因簇可产生miR-17、miR-92 等多个单独的miRNA,有报道称,OS 组织中多个miRNA 异常上升或下降,其中miR-17-92 基因簇各miRNA 表达均上升[14]。Arabi 等[15]报道称miR-19a、miR-19b、miR-92a 在OS 组织中高表达,且与TNM 分期有关,miR-17-92 基因簇高表达患者短期预后更差。Li 等[16]发现OS 患者中血清miR-17 水平相对健康者明显高,与预后相关。可见miR-17-92 基因簇可能促OS 发生、进展。对OS来说,恶性程度从高到低为143B、MG-63、U2OS、Saos-2,为此本研究选择恶性程度第二高的MG-63细胞进行实验,一方面与临床OS 恶性程度较高相符,另一方面仅选择一种细胞株研究可减少不同细胞株对数据的偏倚。结果显示相比正常人成骨细胞hFOB1.19,OS 细胞MG-63 中miR-17、miR-18a、miR-19a、miR-19b、miR-20、miR-92 表达水平显著升高。表明miR-17-92 基因簇于MG-63 细胞株中高表达,这与上述报道相符。同时对MG-63 细胞转染,发现相比miR-NC 组,miR-17-92 组MG-63 细胞株中miR-17-92 基因簇各独立miRNA 显著增高,提示将模拟物成功导入至MG63 细胞。
癌细胞侵袭是癌症转移的重要前提与关键;癌细胞明显增殖后借助侵袭作用经由细胞外基质转移至其他器官/组织,导致癌症转移,影响预后[17,18]。本研究中,转染miR-17-92 基因簇至MG-63 细胞后,CCK-8 检测发现miR-17-92 组不同时间点的OD450 值相比miR-NC 组显著升高,且随时间推移不断增强。同时miR-17-92 组细胞侵袭能力也显著总结。表明转染miR-17-92 基因簇模拟物能促进OS MG-63 细胞进一步增殖、侵袭。而关于miR-17-92对MG-63 细胞的作用机制较多且复杂。Yang 等[19]表明OS 发生、进展与miR-17-92 基因簇/QKI2/catenin 调控轴有关。Wu 等[20]研究表明OS 细胞系中miR-17 表达显著上调,敲除miR-17 后OS 细胞下游SASH1、MMP-2、MMP-9 等表达上升,其中SASH1 是miR-17 靶基因。认为miR-19 通过靶向SASH1 促细胞增殖、侵袭。TGF-β1 为肿瘤细胞常见信号通路之一,与细胞分化、生长、增殖等有关[21]。有研究表明,青花钙素A 通过对OS 中TGFβ1/Smad2/3 信号通路抑制以阻断TGF-β1 诱导的上皮-间质转化[22]。Smad3 被TGF-β 诱导会出现磷酸化,p-Smade3 形成至细胞核,和对应靶点结合以激活信号通路[23]。本研究中,通过Western blot 检测发现,相比miR-NC 组,miR-17-92 基因簇mimic 组MG-63 细胞TGF-β1、Smad3 蛋白水平显著升高。提示miR-17-92 基因簇可能通过TGF-β1/Smad3 信号通路促进MG-63 细胞增殖、侵袭。MMP-2、MMP-9与细胞外基质密切相关,被激活后可至细胞外基质最前端,参与细胞外基质降解过程。肿瘤细胞中MMP-2、MMP-9 水平均显著上调,促肿瘤侵袭转移。胡晓波等[24]研究表明,相比正常骨组织,OS 组织中MMP-9 mRNA 表达水平显著升高,通过沉默MMP-9 能显著减弱OS 细胞增殖、侵袭能力,且高表达MMP-9 者总生存率比低表达者显著低,表明MMP-9 与OS 增殖、侵袭、预后相关。本研究中相比miR-NC 组,miR-17-92 组MG-63 细胞MMP-2、MMP-9 蛋白水平显著升高。表明miR-17-92 基因簇对MG-63 细胞增殖、侵袭可能与上调MMP-2、MMP-9 蛋白水平有关。
综上所述,骨肉瘤MG-63 细胞株中miR-17-92基因簇各单独miRNA 表达均上升,它可能是通过增强TGF-β1/Smad3/MMP-9 信号通路以提高骨肉瘤MG-63 细胞增殖、侵袭能力。本研究仅于体外行细胞实验,且未涉及其他骨肉瘤细胞株,后续会于体内、增多不同类型细胞株进一步分析miR-17-92 基因簇的作用机制。

