基于RT-RAPID和CRISPR-Cas12a的诺如病毒GⅡ.6亚型核酸检测方法的建立
冉红志,樊 成,王雪飞,刘 静,康 婕,钱卫东,王 婷*
(1.陕西省动物疫病预防控制中心,陕西西安 710016;2.陕西省产品质量监督检验研究院,陕西西安 710048;3.陕西科技大学生物与医药学院,陕西西安 710021)
诺如病毒(Norovirus,NoV)又名诺瓦克病毒,为杯状病毒科诺如病毒属成员,是一种正链RNA病毒,基因组全长约7 600 bp[1]。诺如病毒根据VP1氨基酸序列可被分成10多个基因组型(如GⅠ-GⅦ),40多个基因亚型[2-4],其中GⅠ、GⅡ和GⅣ可感染人类,GⅡ可进一步分为22个基因型[5-7]。诺如病毒是一种重要的食源性病毒,能通过水源及贝类感染人类,造成急性胃肠炎[8]。近年来,许多国家均出现过诺如病毒疫情[9-10],经济贝类牡蛎是诺如病毒主要传播媒介之一。高温加热可有效杀灭牡蛎中的诺如病毒,但会破坏牡蛎的鲜美风味,人们倾向于生食或轻微烹煮牡蛎。如果牡蛎中存在活的诺如病毒,就会增加感染诺如病毒的风险[11]。
食品中诺如病毒的检测主要利用反转录实时荧光定量聚合酶链式反应(RT-qPCR),该方法操作繁琐,耗时长,工作量较大,且需要复杂的设备[12]。核酸恒温扩增技术,如重组酶介导的恒温扩增(RAA)、重组酶聚合酶恒温扩增(RPA)、依赖核酸序列的扩增(NASBA)、反转录重组酶和聚合酶等温检测(RT-RAPID)等技术,无需高温变性和梯度温度改变,借助特有的引物和酶可实现百万倍扩增靶标核酸。特别是CRISPR-Cas12a作为一种高精度生物识别工具[13],与RT-RPA组合使用,开发了RT-RPA-Cas12a检测平台[14],进一步提高了对病原体或突变位点的检测灵敏度和特异性。本研究建立的RT-荧光法和RT-Cas12a荧光法具有敏感、特异、耗时短、操作简便等优点,适用于现场快速检测。
1 材料与方法
1.1 材料
1.1.1 菌株和寡核苷酸 含有诺如病毒GⅡ.6保守序列的重组质粒的甘油大肠埃希氏菌菌株。RT-引物、用于合成crRNA的寡核苷酸和RT-RAPID荧光探针,生工生物工程(上海)股份有限公司产品。用于Cas12a检测的ssDNA荧光报告分子,金唯智(苏州)生物科技有限公司产品。
1.1.2 主要试剂 RT-等温扩增试剂盒,乐尚(无锡)生物科技有限公司产品;体外转录试剂盒和RT-PCR试剂,宝日医生物技术(北京)有限公司产品;Gene Green核酸染料、小质粒提取试剂盒、DL 2 000 Maker,天根生化科技(北京)有限公司产品;琼脂糖,贝晶(上海)生物技术有限公司产品;SacⅠ内切酶,碧云天(上海)科技有限公司产品;核酸快速提取试剂盒,QIAGEN产品;CRISPR-Cas12a蛋白,NEB(北京)有限公司产品;DEPC水和TE缓冲液,飞净生物科技有限公司产品;RNase抑制剂,赛默飞(上海)科技有限公司产品。
1.1.3 主要仪器 荧光PCR仪,赛默飞世尔科技(中国)有限公司;全自动核酸提取仪,江苏硕世生物科技有限公司;恒温摇床,上海蓝豹试验设备有限公司;恒温培养箱,上海博准电子科技有限公司;超净工作台,上海苏净实业有限公司;超微量紫外分光光度计,上海元析仪器有限公司;蒸汽灭菌锅,上海申安医疗器械厂;恒温扩增仪器,Axxin ISO-T8;电泳仪,美国Bio-Rad公司;超高速低温离心机,德国Sigma 3K15;电子天平,梅特勒-托利多仪器(上海)有限公司。
1.2 方法
1.2.1 诺如病毒GⅡ.6保守序列的确定和人工合成 从NCBI网站下载12株诺如病毒GⅡ.6亚型的全基因组序列,选用的诺如病毒GⅡ.6序列登录号为KU870455.1、MG571778.1、KY424348.1、KY424345.1、KY424346.1、KY424344.1、KY424341.1、HQ169542.2、KJ407072.2、JX989075.1、KX268709.1和LN854568.1。用Mega7.0的ClustalW功能对12株诺如病毒GⅡ.6亚型基因组序列进行比对,确定诺如病毒GⅡ.6亚型基因组中RdRp基因中的一段长492 bp保守序列作为靶标。诺如病毒GⅡ.6保守序列由生工生物工程(上海)有限公司合成,并被克隆至质粒pBluescript Ⅱ SK+中,重组质粒命名为pBlu-NOV-GⅡ.6,接着将重组质粒转化到大肠埃希氏菌TOP10感受态细胞中,构建重组菌株TOP10-GⅡ.6。将重组菌株TOP10-GⅡ.6培养至对数生长期,离心收集菌体细胞,并利用质粒小提取试剂盒提取质粒pBlu-NOV-GⅡ.6,接着利用超微量分光光度计测定质粒浓度,置于-20℃备用。
1.2.2 诺如病毒GⅡ.6亚型RT-RAPID反应引物和荧光探针的设计 与传统PCR反应相比,RT-RAPID无变性和退火过程,通过重组酶和单链结合蛋白作用实现模板解链及引物与模板的配对。RT-RAPID引物长度通常在30 nt-35 nt,GC含量为40%~60%。RT-RAPID荧光探针长度为46 nt-52 nt,GC含量为40%~60%,且经四氢呋喃(tetrahydrofuran,THF)修饰。当RT-RAPID反应延伸至荧光探针结合位点时,核酸内切酶误以为复制出现错误而启功修复功能,使荧光基团游离出来而产生荧光信号,以指示扩增产物的合成。基于这一基本原则,根据诺如病毒GⅡ.6亚型的保守序列设计6条RT-RAPID反应引物和1条荧光探针,相应的寡核苷酸序列信息如表1所示。

表1 RT-RAPID引物、探针序列、crRNA和ssDNA报告分子寡核酸序列Table 1 RT-RAPID primer,probe sequences,crRNA and ssDNA sequences
1.2.3 crRNA的设计和制备 从诺如病毒GⅡ.6亚型保守序列中找到原间隔序列邻近基序(PAM)位点,基于PAM位点设计5条crRNA。具体如下:先从保守序列中定位找到PAM位点(TTTN),进而按照5′→3′方向将PAM位点后24个碱基序列确定为crRNA结合位点。接着在crRNA的5′端添加1个富含腺嘌呤与尿嘧啶序列,该序列用于形成茎环结构促使Cas12a发挥作用[15],5′端茎环结构序列参照相关文献[16]。用于体外制备crRNA的单链寡核苷酸序列见表1,该序列由Songon Biotech公司合成。单链寡核苷酸序列包括:T7启动子(TAATACGACTCACTATAGG)+ Cas12a的scaffold序列(AATTTCTACTAAGTGTAGAT)+靶向序列,将此作为转录模板的F链,反向互补链为R链。F链和R链寡核苷酸序列经退火后得到crRNA的转录模板dsDNA,再利用转录体系对模板dsDNA进行体外转录,制备crRNA,并利用超微量分光光度计测定质粒浓度和纯度,置于-20℃备用。
1.2.4 诺如病毒GⅡ.6亚型保守序列标准RNA的制备 pBlu-NOV-GⅡ.6经SacⅠ酶切线化处理后,用通用型DNA纯化回收试剂盒对酶切产物回收处理,得到的线化质粒作为转录模板。由于载体pBluescript Ⅱ SK+自身具有T7启动子,可直接用体外转录试剂盒对纯化的线化质粒进行体外转录,得到含NOV GⅡ.6-RdRp靶向序列的诺如病毒GⅡ.6亚型保守序列标准RNA,作为RT-RAPID的模板标准品。制备的标准RNA经超微量分光光度计测定浓度,并计算拷贝数,置于-20℃备用。
1.2.5 诺如病毒GⅡ.6亚型RT-RAPID反应引物的筛选 将设计的3对引物按照不同组合(NOV-GⅡ.6-F1/NOV-GⅡ.6-R1、NOV-GⅡ.6-F1/NOV-GⅡ.6-R2、NOV-GⅡ.6-F1/NOV-GⅡ.6-R3、NOV-GⅡ.6-F2/NOV-GⅡ.6-R3、NOV-GⅡ.6-F3/NOV-GⅡ.6-R3)进行反应,筛选出最佳反应引物。利用RT-RAPID扩增试剂盒进行筛选,反应体系如下:25 μL缓冲液、2 μL(10 μmol/L)引物F、2 μL(10 μmol/L)引物R、10.5 μL无RNase水、5 μL标准RNA、2 μL(1 μmol/L)NOV-GⅡ.6-探针、0.5 μL(40 U)RNase抑制剂、3 μL启动剂,总反应体积为50 μL。将反应体系放入T8等温扩增仪中进行反应,反应条件为:39℃ 40 min,每隔10 s收集1次荧光信号。扩增产物用20 g/L琼脂糖凝胶进行观察,分析RT-RAPID的扩增效果。
1.2.6 诺如病毒GⅡ.6亚型RT-RAPID反应温度的优化 在最佳引物条件下,将反应温度定为35、37、39、42、44℃进行RT-RAPID反应。反应体系放入恒温扩增仪AxxinISO-T8中进行反应,确定RT-RAPID的最佳反应温度。
1.2.7 诺如病毒GⅡ.6亚型RT-RAPID荧光法的灵敏度和特异性分析 基于优化的反应引物和反应温度,分别用终浓度为1 000、100、10、1、0.1、0 copies/μL的诺如病毒GⅡ.6亚型保守序列标准品RNA作为模板进行RT-RAPID反应。扩增产物用荧光报告探针进行检测,以判断诺如病毒GⅡ.6亚型RT-RAPID荧光法的灵敏度。按照核酸提取试剂盒说明书,分别提取诺如病毒GⅡ.17、鼻病毒、博卡病毒、偏肺病毒等病毒核酸,并选取诺如病毒GⅡ.6亚型保守序列标准品RNA和ddH2O作为阳性和阴性对照,对提取的核酸用建立的诺如病毒GⅡ.6亚型RT-RAPID荧光法进行检测,分析其特异性。
1.2.8 crRNA的筛选 crRNA序列对RT-RAPID-Cas12a检测方法的灵敏度及特异性影响较大,筛选crRNA成为建立RT-RAPID-Cas12a荧光法的重要步骤。将5条crRNA分别加入到RT-RAPID-Cas12a反应体系中,反应体系为5 μL缓冲液、2 μL(1 μmol/L)crRNA、2 μL(1 μmol/L)ssDNA报告分子、0.5 μL(40 U)RNase抑制剂、33.5 μL无RNase/DNase水、2 μL(1 μmol/L)LbaCas12a蛋白和5 μL RT-RAPID扩增产物。将反应体系置于恒温扩增仪AxxinISO-T8中,在37℃条件下反应40 min,每隔10 s收集1次荧光信号。检测效果根据荧光曲线进行观察,分析RT-RAPID-Cas12a荧光法的检测效果,确定最佳的crRNA,用于后续研究。
1.2.9 RT-RAPID-Cas12a的灵敏度和特异性分析 将不同浓度的诺如病毒GⅡ.6亚型保守序列标准RNA(1000、100、10、1、0.5、0.1、0.05 copies/μL)作为模板进行RT-RAPID扩增,39℃反应30 min。然后将扩增产物转移到Cas12a检测体系中进行反应,37℃反应40 min。扩增产物用荧光信号进行检测,以判断诺如病毒GⅡ.6亚型RT-RAPID-Cas12a荧光法的灵敏度。将诺如病毒GⅡ.17亚型、鼻病毒、博卡病毒和偏肺病毒核酸,以及取诺如病毒GⅡ.6亚型保守序列标准RNA和ddH2O作为阳性和阴性对照模板,用建立的诺如病毒GⅡ.6亚型RT-RAPID-Cas12a荧光法进行检测,分析其特异性。
1.2.10 模拟临床样本分析 称取60 g牡蛎消化腺组织,用匀浆机处理得到均浆液。分别吸取1 mL均浆液加到25个无菌无RNase酶的epp管中,向其中20个epp管中分别加入诺如病毒GⅡ.6亚型RNA样品使其充分混匀,使GⅡ.6亚型RNA样品浓度为100 copies/μL。5个阴性对照组epp管不加RNA样品。用RNA提取试剂盒提取模拟临床样本中的RNA,再用RT-RAPID和RT-RAPID-Cas12a荧光法对每份样本核酸进行平行分析,荧光定量RT-PCR反应参照文献进行。
2 结果
2.1 诺如病毒GⅡ.6亚型RT-RAPID的最佳反应引物
5对引物都能扩增出相应的片段,其中第3对引物(NOV-GⅡ.6-F1/NOV-GⅡ.6-R3)扩增强度高、特异性好,因此选择第3对引物用于后续试验(图1)。
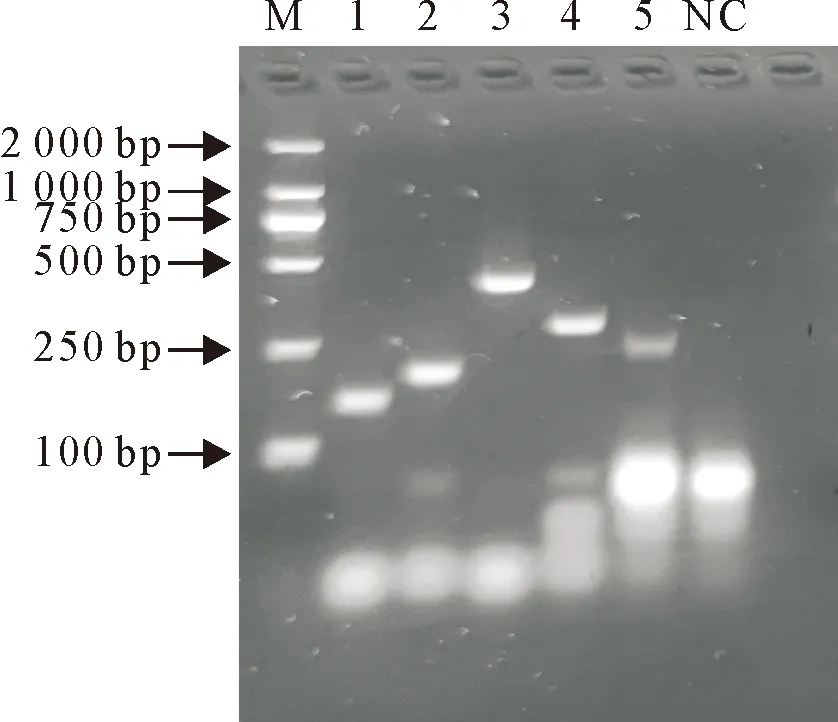
M.DNA标准DL 2 000;1.引物对NOV-GⅡ.6-F1/NOV-GⅡ.6-R1;2.引物对NOV-GⅡ.6-F1/NOV-GⅡ.6-R2;3.引物对NOV-GⅡ.6-F1/NOV-GⅡ.6-R3;4.引物对NOV-GⅡ.6-F2/NOV-GⅡ.6-R3;5.引物对NOV-GⅡ.6-F3/NOV-GⅡ.6-R3;NC.阴性对照扩增产物
2.2 诺如病毒GⅡ.6亚型RT-RAPID的最佳反应温度
当反应温度设定为35、37、39、42、44℃时,39℃时荧光曲线斜率最大,且荧光信号产生时间与其他温度差异不大,因此其最佳反应温度设定为39℃(图2)。

图2 诺如病毒GⅡ.6亚型RT-RAPID反应温度的筛选
2.3 诺如病毒GⅡ.6亚型RT-RAPID荧光特异性
以不同病毒的核酸作为模板进行RT-RAPID反应(图3),只有诺如病毒GⅡ.6亚型保守序列标准RNA扩增曲线为阳性,而其他病毒核酸样本及阴性对照均无扩增信号,即为阴性,表明建立的RT-RAPID荧光法具有良好的特异性。
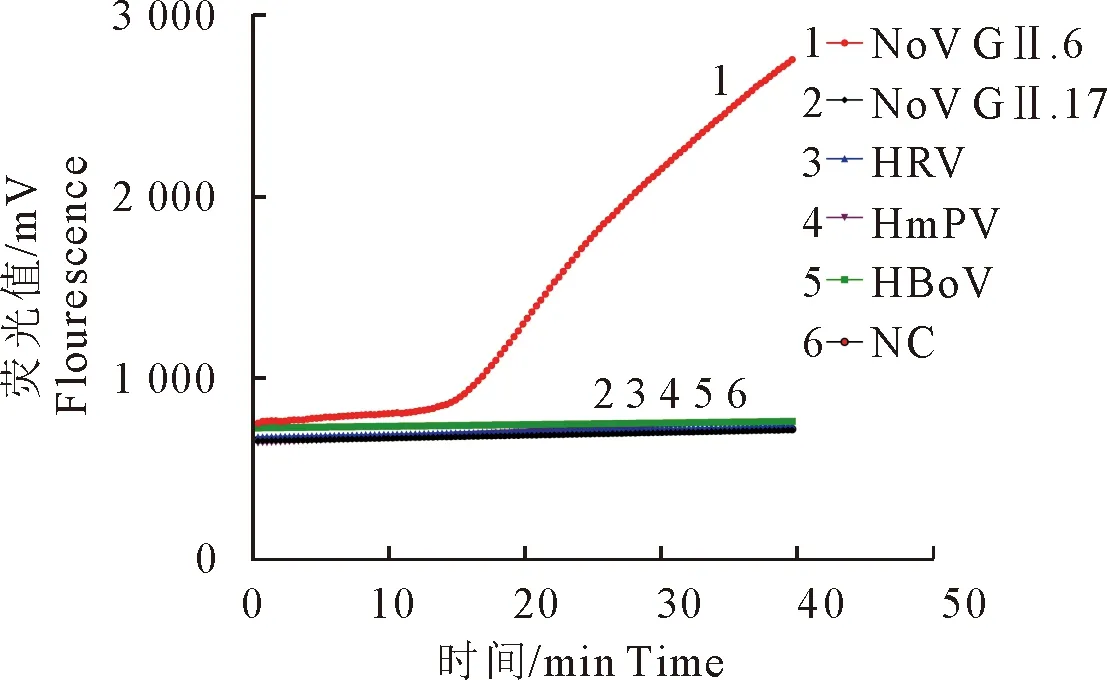
图3 诺病毒GⅡ.6亚型RT-RAPID荧光法的特异性分析
2.4 诺如病毒GⅡ.6亚型RT-RAPID荧光灵敏度
以不同拷贝数的诺如病毒GⅡ.6亚型保守序列标准RNA分别作为模板,以诺如病毒GⅡ.6亚型RT-RAPID荧光法进行检测(图4)。扩增产生的荧光信号随着诺如病毒GⅡ.6亚型保守序列标准RNA浓度下降逐渐减少,荧光曲线斜率也随着模板浓度降低而降低,最低检出限可达10 copies/μL,表明RT-RAPID荧光法的检测灵敏性较高。

图4 诺如病毒GⅡ.6亚型RT-RAPID荧光法的灵敏度分析
2.5 crRNA筛选
以不同crRNA作为引导序列,以建立的诺如病毒GⅡ.6亚型RT-RAPID-Cas12a荧光法进行反应分析(图5)。在有靶向序列存在时,3条crRNA能与Cas12a形成crRNA-Cas12a-靶向序列复合物,并能有效激活Cas12a核酸酶活性,发生剪切ssDNA报告分子,产生明显的荧光信号,而另外2条未能激活Cas12a核酸酶活性。cRNA1r介导产生的荧光信号最强,荧光曲线斜率最大。因此,crRNA1r设定为最佳的crRNA。

图5 不同crRNA序列对诺如病毒GⅡ.6亚型RT-RAPID-Cas12a反应灵敏度的影响
2.6 RT-RAPID-CRISPR-Cas12a荧光法的特异性
以不同病毒核酸作为模板进行RT-RAPID-Cas12a反应(图6),只有诺如病毒GⅡ.6亚型保守序列标准RNA作为模板的反应产生了阳性荧光信号,而其他病毒核酸样本及阴性对照作为模板的反应均未产生荧光信号,即为反应结果为阴性,表明建立的RT-RAPID-Cas12a荧光法具有良好的特异性。

图6 诺如病毒GⅡ.6亚型RT-RAPID-Cas12a荧光法的特异性分析
2.7 RT-RAPID-CRISPR-Cas12a荧光法的灵敏度
以不同拷贝数的诺如病毒GⅡ.6亚型保守序列标准RNA作为模板,利用建立的诺如病毒GⅡ.6亚型RT-RAPID-Cas12a荧光法进行分析(图7)。反应产生的荧光信号随着模板浓度升高逐渐增加,且荧光曲线斜率与模板浓度呈正相关,最低检出限可达到0.5 copies/μL,表明RT-RAPID-Cas12a荧光法的检测灵敏性高。
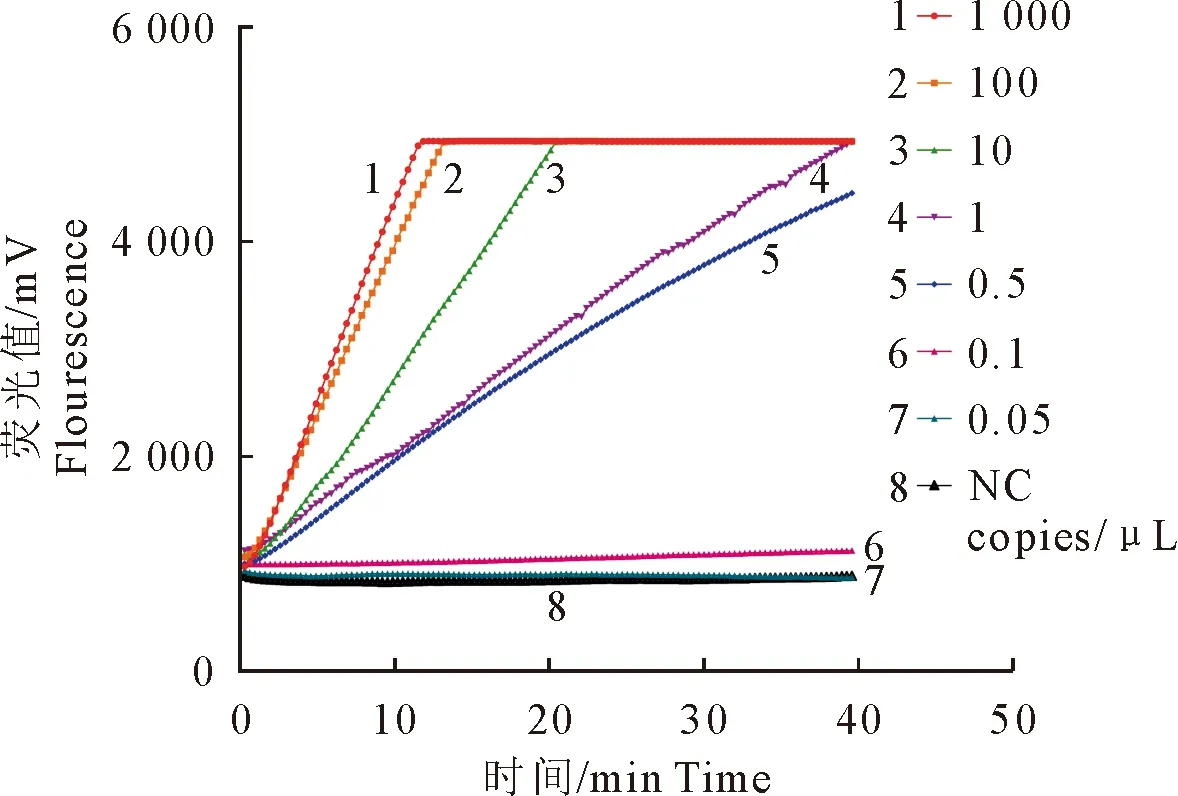
图7 诺如病毒GⅡ.6亚型RT-RAPID-Cas12a荧光法的灵敏度分析
2.8 模拟样本分析
模拟样本总量为25个,RT-RAPID荧光法检出阳性样本18个阴性样本5个;RT-RAPID-Cas12a荧光法检出阳性样本18个,阴性样本5个;RT-qPCR方法检出阳性样本20个,阴性样本5个。RT-RAPID荧光法和RT-RAPID-Cas12a荧光法与RT-qPCR方法的阳性样本一致率均为90%,阴性样本一致率均为100%,表明建立的RT-RAPID荧光法和RT-RAPID-Cas12a荧光法灵敏性好。
3 讨论
诺如病毒可以通过食物和水作进行传播引发急性肠胃炎[4],易在幼儿园、学校、医院和养老院等人口流动较大或人员密集场所引起聚集性疫情[17-18]。目前仍没有特效的抗病毒药物和疫苗,“早发现、早诊断、早隔离”是有效控制诺如病毒的关键[19]。诺如病毒的检测方法主要有电镜法、免疫学方法和核酸分子检测[20]。电镜法对于操作人员的水平要求较高,且灵敏度较低[12,21],不适合现场快速检测。基于抗原抗体特异性结合反应的免疫学检测,需要制备高质量的抗体或抗原,生产成本较高,且诺如病毒的抗原蛋白质易出现变异影响其灵敏度和特异性。基于实时荧光定量PCR的核酸分子检测是诺如病毒的金标准,但需要专业化的实验室才能进行分析[22]。RT-RAPID和RT-RAPID-Cas12a荧光法具有快速、灵敏、操作简单,且无需复杂设备等优势[23]。
本研究建立了一种可用于诺如病毒GⅡ.6亚型检测的RT-RAPID荧光方法,通过对诺如病毒GⅡ.6亚型基因组比对分析,确定基因组中RdRp基因片段为靶向检测序列;进而对RT-RAPID的最佳反应条件进行优化,发现最佳反应温度为39℃,该方法在39℃恒温培养30 min内即可完成检测,最低检测值为10 copies/μL,且与常见的几种病毒无交叉反应。为进一步提高检测灵敏性,Cas12a检测方法被组合使用,并对crRNA进行了优化,结果发现RT-RAPID-Cas12a荧光法的最低检测值可达0.5 copies/μL,且特异性强。文献报道诺如病毒常规的RT-PCR和荧光RT-qPCR最低检出限分别为103copies/μL和102copies/μL[21],表明本研究建立的诺如病毒GⅡ.6亚型RT-RAPID荧光法和RT-RAPID-Cas12a荧光法灵敏性均高于RT-PCR。
本研究建立的诺如病毒GⅡ.6亚型RT-RAPID荧光法和RT-RAPID-Cas12a荧光法具有灵敏度和特异性高,且易于操作和无需复杂设备,这为诺如病毒GⅡ.6亚型的快速检测提供了新方法。

