天津地区梨轮纹病病原菌的分离与鉴定
汪宇轩 周涛 周逸文 李齐升 王卉 单宏英
摘 要:梨是我國仅次于苹果的重要水果,随着种植面积的增大,在生产过程中梨树易遭受多种病害的威胁,其中轮纹病是严重威胁梨产业的病害之一,常造成重大经济损失。梨是天津蓟州区特色水果之一,轮纹病主要危害成熟期果实,化学防治效果不明显,且该病害病原菌种类呈多样化。为了明确致病菌种类,采用组织分离法、形态学比较分析、致病性检测和分子生物学手段对病原菌进行鉴定。结果表明:于病样组织中分离得到一株真菌ZT98,在PDA培养基上呈灰色圆形菌落,菌丝有隔膜,尖端较细,致病性分析结果显示,菌株ZT98接种2~3 d即出现同心浅褐色轮纹,发病后期果实呈黑褐色皱缩,表层布满一层深灰色菌丝和黑点,与田间症状基本一致;提取ZT98基因组DNA后进行 ITS基因扩增并测序,在NCBI获得基因序列登录号为OR054159,ITS基因系统发育分析结果显示,ZT98与葡萄座腔菌(Botryosphaeria dothidea)聚于同一分支,同源性为100%。综上,本研究分离得到了一株天津地区梨轮纹病致病菌ZT98,结合形态学特征和ITS序列比对分析,明确了ZT98的分类地位,为该病害的精确诊断和有效防治提供依据。
关键词:梨;轮纹病;葡萄座腔菌;ITS
中图分类号:S432.1 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2023.09.008
Isolation and Identification of A Pathogen Causing Pear Ring Spot in Tianjin
WANG Yuxuan ZHOU Tao ZHOU Yiwen LI Qisheng WANG Hui SHAN Hongying
(College of Horticulture and Landscape Architecture, Tianjin Agricultural University, Tianjin 300392, China)
Abstract: Pear, second only to apples, is an important fruit in China. Various diseases are prone to attack pear during cultivation and production with the increased planting area. Ring rot, causing significant economic losses frequently, is one of the serious diseases that endangers the pear industry. The pathogens of pear ring rot are a little diverse according to the previous studies. Therefore, this study tried to isolate and identify the pathogens of ring rot by tissue direct isolation, morphological analysis, pathogenicity detection and molecular determination. The results indicated that a strain ZT98 was obtained after isolation and purification of snow pear ring spot infected samples, which showed gray round colonies on PDA medium. Mycelia of ZT98 had diaphragm with a thinner top. Pathogenicity detection according to Koch's rules displayed that ZT98 was a pathogen caused serious symptoms on pear fruits. The concentric brown rings were consistent with the symptoms in the field. The infected sites became dark brown at the later infecting stage but without spores were observed. Phylogenetic analysis of ZT98 was performed by extracting the genomic DNA and amplifying ITS. The ITS Genebank accession number of ZT98 was OR054159. ZT98 was clustered in the same branch as Botryosphaeria dothidea with 100% homology. In conclusion, this study determined the pathogen causing pear ring rot in Tianjin, providing a basis for accurate diagnosis and effective control of this disease.
Key words: pear;pear ring rot;Botryosphaeria dothidea;ITS
梨是蔷薇科梨属的一种乔木植物,有“天然矿泉水”之称。梨在我国的种植历史十分悠久,最早可追溯到春秋战国时期。我国是梨种植大国,梨的种植面积仅次于苹果,在我国占有重要的经济地位[1-3],种植地区主要分布在16个省、直辖市,包括华北、华中、东北、西北、鲁东等地区,华南和西南地区种植面积相对较少。在种植生产过程中,梨常遭受多种病害的威胁,如梨锈病、黑星病、轮纹病和黑斑病等[4]。梨轮纹病又叫粗皮病或瘤皮病,是我国北方梨主产区的重要病害之一,该病害受湿度影响较大,在多雨年份危害严重。梨轮纹病主要由葡萄座腔菌属(Botryosphaeria)病原菌引起,在梨的树干、果实和叶片均造成严重同心轮纹症状,严重时导致叶片脱落、果实腐烂或树势衰弱,造成大面积烂果和果园绝产[1]。
梨轮纹病最早在日本被发现,后续在我国东北和西南地区报道[1, 3]。近年来梨轮纹病病害在亚洲扩展速度快,已遍布韩国等邻国梨产业园区[5]。化学防治梨轮纹病病害常造成严重的环境污染和农药残留,选育抗病品种已经成为优先选择,但针对梨轮纹病抗病品种和有效药剂的筛选报道较少,种质资源的收集和鉴定也需要大量的人力物力和时间。张璐等[6]发现,砀山酥梨和雪花梨抗轮纹病菌的能力显著优于丰水梨和南果梨,且通过药剂筛选发现咯菌腈、氟啶胺和咪鲜胺对梨轮纹病菌具有明显的抑制效果。
梨是天津的特色水果之一,种植面积达6万hm,其中静海区(约2万hm)、蓟州区(约3万hm)、北辰区、武清区和西青区共计种植约1万hm,主打优质精品梨的发展趋势进入市场。蓟州区具有悠久的梨树种植历史,种植区域覆盖11个乡镇100多个旅游村和景区。部分梨园近年发现较严重的轮纹病病害,平均发病率达30%~50%,大部分果园发病率在30%[7]。发病果实品质和产量均下降,影响树势和果园的长期发展,且化学药剂对该病害的防治效果不显著,给果农造成严重的经济损失。梨轮纹病的致病菌种类在不同梨产区呈多样化[8-9],同一病原菌在不同地区导致的症状有显著差别[10]。因此,确定轮纹病的致病菌对于该病害的防治至关重要。本研究通过对天津蓟州区下营镇梨园轮纹病致病菌的分离纯化、形态学比较、致病性检测和分子生物学鉴定等手段,明确了梨轮纹病致病菌种类和分类地位,为该病害的田间诊断和有效防治提供依据。
1 材料与方法
1.1 病害样品采集
梨果实轮纹病样品采集自天津市蓟州区下营镇梨园(N40°18′ ,E117°45′),采样梨园轮纹病发病程度约30%。
1.2 病原菌分离纯化和形态观察
选取有典型轮纹病病害症状的雪梨果实,将其病健交界处组织切成若干个0.5 cm×0.5 cm小块后,经75 % 酒精消毒45 s,无菌水润洗3次后,待组织风干水分时,置于马铃薯葡萄糖琼脂培养基(PDA)上,培养皿封口后于28 ℃ 培养3~5 d。PDA培养基配方如下:马铃薯200 g、琼脂20 g、葡萄糖20 g、蒸餾水定容至1 000 mL。将生长单一无污染菌落采用菌饼打孔法进行纯化,培养过程中观察记录分离菌株的生长特征,包括病原菌的菌丝、孢子、孢子梗和孢子囊等典型形态结构。
1.3 病原菌的致病性检测
依据柯赫氏法则(Koch's Rule)对分离菌株进行致病性检测。雪梨果实经1% 次氯酸钠和75% 酒精各消毒30 s,再置于无菌水中润洗3次,待表皮风干水分后,用无菌针于接种点刺伤雪梨果实表皮制造轻微伤口从而利于病原菌侵染。于PDA培养基上生长5 d的分离菌株菌饼置于大小一致的雪梨果实接种点上,每个果实接种一块菌饼,无菌培养基接种雪梨果实为阴性对照。接种后将梨果实置于无菌滤纸保湿的培养皿中,利用无菌膜封口利于保湿和防止杂菌污染,于28 ℃ 培养并观察和记录发病情况。在发病梨果实组织的病健交界处再次采用1.2中描述的方法分离纯化病原菌,通过形态学观察和分子生物学鉴定,确保与接种菌株是同一种菌[11]。
1.4 病原菌的分子生物学鉴定
将分离菌株于PDA培养基中培养7 d,用无菌牙签挑取收集菌丝于1.5 mL无菌管中,采用Biowott真菌DNA提取试剂盒提取菌株的基因组DNA,检测浓度后利用琼脂糖凝胶电泳验证DNA质量。通过形态学观察该致病菌属应是葡萄座腔菌属的真菌,利用真菌rDNA-ITS通用引物(ITS1F:CCGTAGGTGAACCTG;ITS4R:TCCTCCGCTTATTGATATGC),采用Takara的PrimeSTAR Max Premix试剂盒(R045A)对ITS基因进行PCR扩增,反应总体系50 μL:PrimeSTAR Max Premix 25 μL、ITS1F和ITS4R引物各2.0 μL、DNA模板溶液2.0 μL、ddH2O 19.0 μL。反应程序为98 ℃ 预变性1 min,98 ℃ 变性10 s,55 ℃ 退火30 s,72 ℃ 延伸1 min;共35个循环;最后一个循环结束后72 ℃ 延伸10 min;4 ℃ 条件下终止反应。PCR产物经1% 琼脂糖凝胶电泳检测后,委托华大基因有限公司进行序列测定。将ITS基因序列在NCBI中BLAST比对同源性,筛选同源性高的序列并利用MEGA 11.0中邻接法(neighnour joining)构建系统发育树,明确致病菌株的种类和分离地位[12]。
2 结果与分析
2.1 雪梨轮纹病危害症状
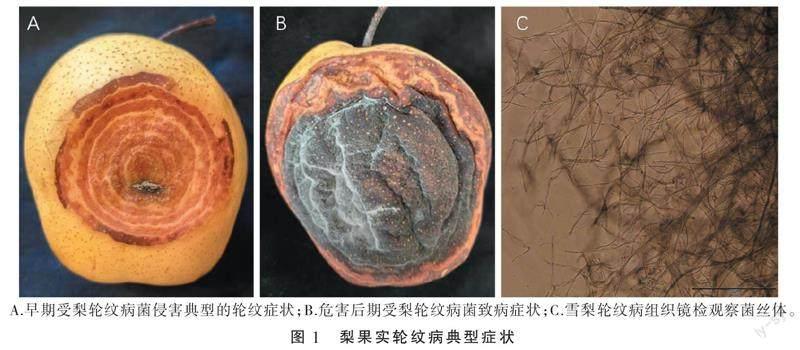
梨轮纹病病原菌可危害果树树干、枝条、叶片和果实,其中对于成熟期的果实危害较为严重,影响果实成熟和质量,给果农造成严重的经济损失。该病原菌危害初期形成浅褐色水渍斑点,逐渐扩大形成同心的浅褐色环形轮纹,环形轮纹间是健康雪梨组织颜色。果实发病处的表皮脆软,若果园湿度大,挤压易流出较为粘稠的褐色液体,并有酸臭味道。随着时间延长,发病点颜色由浅褐色逐渐变成深褐色,病果持续发病10 d左右即全部腐烂,病斑呈黑褐色皱缩,因失水而变成僵果,表层布满一层深灰色菌丝并且布满黑点(图1-A和图1-B)。挑取雪梨果实病斑处的菌丝和子实体进行显微镜观察发现无隔菌丝,未见孢子(图1-C)。
2.2 雪梨轮纹病病原菌的分离纯化
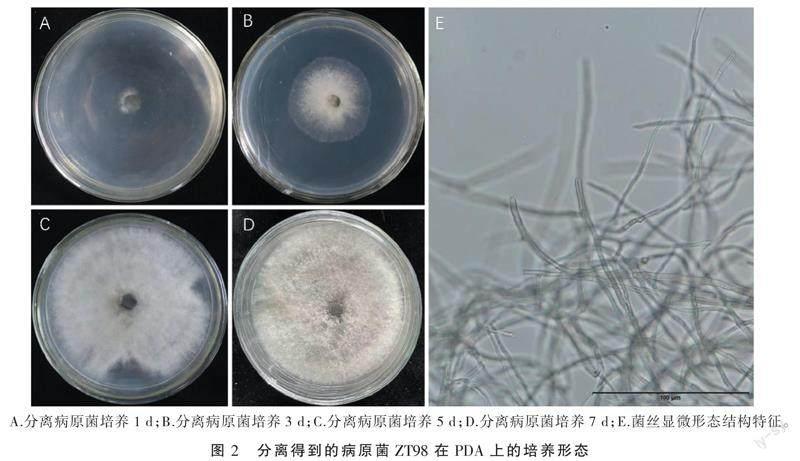
雪梨轮纹病的病健交界处经病原物分离后得到形态一致的菌落2个,进一步纯化和形态学观察确认是同一种菌。菌株ZT98在PDA培养基上生长初期呈蓬松灰白色绒毛状,菌落边缘光滑且透明,菌丝无色,具有隔膜和较细的分枝,菌丝宽度约2.3~5.6 μm 生长至5~7 d即长满直径为9 cm的培养皿,且无色素沉积(图2),继续培养至14 d菌落呈灰白色,且菌板背面中心处变为黑色,但未观察到孢子或产孢结构。
2.3 菌株ZT98的致病性检测
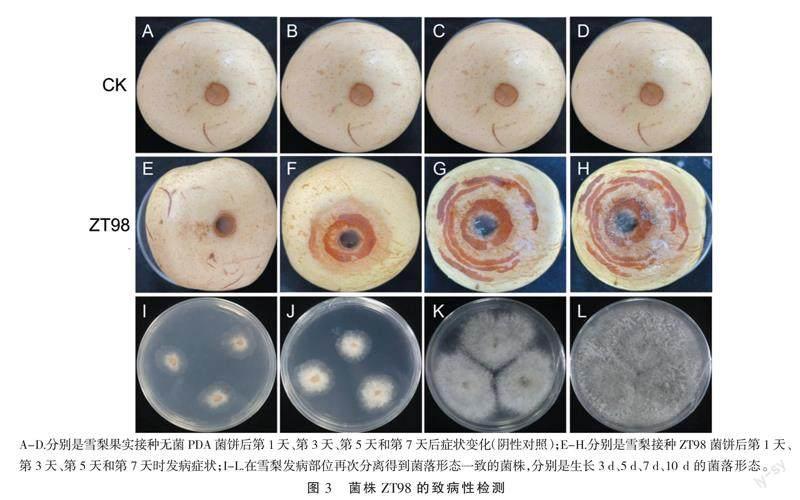
将分离得到的菌株ZT98依据柯赫氏法则进行致病性验证,通过菌饼打孔法直接回接到健康且大小均一的雪梨果实上,同时接种PDA培养基空白菌饼作阴性对照,接种的第1天、第3天、第5天和第7天对照均无症状(图3-A、图3-B、图3-C、图3-D)。接种菌株ZT98的雪梨果实3 d后在接种点形成褐色水渍状斑圈,接种的第5天和第7天,褐色同心轮纹逐渐扩大,且病斑颜色变至深褐色,水渍状面积扩大,具有酸臭味道(图3-E、图3-F),这与梨轮纹病田间发病症状一致。再次通过分离纯化得到与ZT98菌落形态一致的菌株,随着培养时间的延长,菌落逐渐由浅灰色变成深灰色,(图3-I、图3-J、图3-K、图3-L)。因此,本研究明确ZT98是雪梨果实轮纹病的致病菌株。
2.4 菌株ZT98的分子生物学鉴定
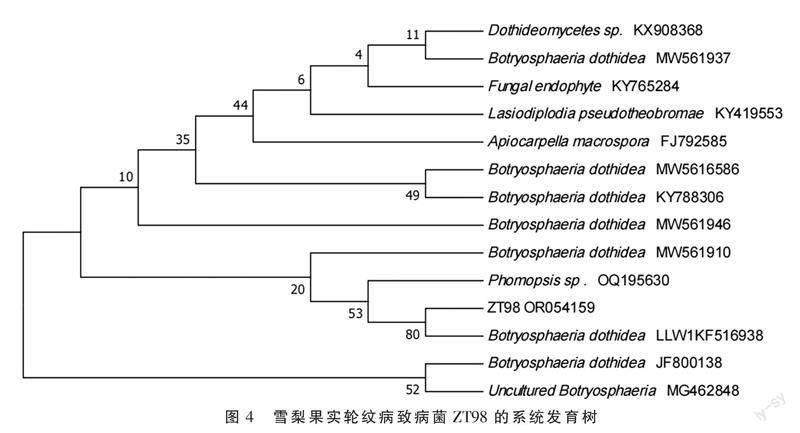
通过对菌株ZT98的rDNA-ITS序列(约550 bp)在NCBI网站的Genebank获得登录号(OR054159),经基因序列比对和系统发育分析发现,ZT98与葡萄座腔菌(B. dothidea)聚于同一分支,同源性高达100%(图4),说明采样梨园轮纹病致病菌种类单一,无多种病原菌复合侵染。因此,天津地区雪梨果实轮纹病病原菌为葡萄座腔菌(B. dothidea)。
3 讨论与结论
我国是世界上梨种植和生产大国,随着种植面积的增大,梨常遭受多种病原菌的威胁,轮纹病是限制梨产业高效发展的重要病害之一,其分布广泛,严重时造成绝产。轮纹病的病原菌扩展到木质部后,影响水分和养分的运输,导致梨树树势削弱,或枯萎死亡。轮纹病病原菌在梨树内可存活6年之久,还可侵染苹果、山楂、杏、桃、枣等多种果树,一旦发病应及时刮除病原残体,并选育抗病品种[13-14]。轮纹病病害以化学防治为主,多菌灵、烯唑醇或苯醚甲环唑等均具有较好的防效[15-17]。生物防治能有效减少化学药剂的使用量并缓解抗药性,但目前梨轮纹病的生物菌剂如枯草芽孢杆菌和木霉菌等,防治效果仍不稳定。
梨轮纹病致病菌的鉴定是有效防治该病害的关键因素之一,天津地区梨轮纹病致病菌尚无明确分类。本研究将采集自天津市蓟州区梨园果实轮纹病样品进行了致病菌的分离纯化,得到一株真菌ZT98,菌丝有隔,分支顶端尖细,但未发现分生孢子,与龙珑等[18]和冷伟锋等[19]的报道一致。本研究對ZT98的产孢条件进行了摸索,将接种病原菌的雪梨果实置于容器中在自然光下培养,或将菌板于25 ℃黑光灯下培养10~20 d,均未观察到孢子。因此,笔者推测菌株ZT98的产孢条件可能较为苛刻,除温度和光照外,还可能受到其他环境因素和生理生化特性的影响,或仅在活体梨树或果实发病后期才能产生分生孢子。
依据柯赫氏法则对分离获得的菌株进行致病性检测是病原菌鉴定的关键。因菌株的致病性受到环境、寄主品种等多种因素的影响,有多种植物病害病原物即使在田间有明显的致病力,但在实验室条件下致病性会减弱或失去致病力[20]。将分离得到的菌株ZT98回接到雪梨果实后出现的症状与采集样品症状一致,因此推测ZT98是雪梨果实轮纹病的致病菌。进一步分析菌株ZT98与其他地区梨或苹果轮纹病致病菌基因组序列的差异基因,筛选与致病性或症状有关的关键基因,能为梨轮纹病抗性基因筛选和抗病品种的培育提供依据。
真菌菌落形态和菌丝结构特征常受到培养条件的影响,导致植物病原真菌鉴别存在一定差异[21],因此依据症状、菌落形态和培养特征进行病原菌的鉴定是不充分的,难以明确到种或亚种[22-23]。而已发展成熟且灵敏的分子生物学技术分析菌株ZT98的ITS序列是本研究中雪梨果实轮纹病致病菌鉴定的关键[24-25]。通过分析看家基因将病原物鉴定到种或亚种,是致病菌鉴定分类的常用技术。但葡萄座腔菌属的看家基因EF1-α、GPD、HSP或H3等作为种类鉴定的依据仍存在一定的争议[26]。梨轮纹病致病菌自然界常见的无性态为轮纹大茎点霉(Macrophoma kuwatsukai Hara.)[27],有性态致病菌B. dothidea主要通过皮孔和伤口侵染梨树树干或果实形成典型的枝干或果实轮纹症状。湿度大的条件下引起梨或苹果的轮纹病症状,干燥条件下引起果树干腐症状[12]。在美国梨轮纹病的致病菌是B. dothidea [28],B. dothidea包括4个基因型,引起苹果轮纹病的病原菌包括2种,即B. kuwatsukai和B. dothidea。我国梨轮纹病致病菌分为2种基因型,分别是B. berengeriana 和 B. dothidea,它们致病性存在一定分子分化,但被证实ITS及看家基因的序列一致,均被命名为B. dothidea [9]。因此,本研究分离纯化了一株天津蓟州地区梨轮纹病病原菌,并结合形态学特征和ITS基因序列分析,明确了该病致病菌是B. dothidea,为梨轮纹病病害的精准诊断、抗病品种筛选和有效防治奠定基础。
参考文献:
[1] 陈策. 苹果果实轮纹病研究进展[J]. 植物病理学报, 1999, 29(3): 193-198.
[2] 董金皋. 农业植物病理学[M]. 北京: 中国农业出版社, 2001.
[3] 王文青, 李扬, 向均, 等. 我国梨产区引起黑斑病的链格孢种类鉴定与致病性研究[J]. 果树学报, 2020, 37(12): 1922-1933.
[4] 邓一文, 刘裕强, 王静, 等. 农作物抗病虫研究的战略思考[J]. 中国科学(生命科学), 2021, 51(10): 1435-1446.
[5] TANG W, DING Z, ZHOU Z Q, et al. Phylogenetic and pathogenic analyses show that the causal agent of apple ring rot in China is Botryosphaeria dothidea[J]. Plant Disease, 2012, 96(4): 486-496.
[6] 张璐, 刘奇志, 张国珍. 6种梨果实对轮纹病的抗性差异及4种杀菌剂对轮纹病菌的抑菌作用[J]. 植物保护, 2019, 45(4): 224-228.
[7] 刘晓琳, 马丽亚, 刘焕禄. 天津地区苹果轮纹病防治的室内药剂筛选试验研究[C]//园艺学进展. 西安: 陕西科学技术出版社, 2004: 339-340.
[8] ZHAI L F, ZHANG M X, LV G, et al. Biological and molecular characterization of four Botryosphaeria species isolated from pear plants showing stem wart and stem canker in China[J]. Plant Disease, 2014, 98(6): 716-726.
[9] MARSBERG A, KEMLER M, JAMI F, et al. Botryosphaeria dothidea: a latent pathogen of global importance to woody plant health[J]. Molecular Plant Pathology, 2017, 18(4): 477-488.
[10] 吕刚. 我国梨树轮纹病和干腐病病原菌的遗传多样性及分子特点研究[D]. 武汉: 华中农业大学, 2012.
[11] 肖峰. 我国梨轮纹病病原鉴定与BkLiP1基因功能研究[D]. 武汉: 华中农业大学, 2022.
[12] 翟立峰. 梨轮纹病与干腐病的病原关系及轮纹病菌携带真菌病毒多样性研究[D]. 武汉: 华中农业大学, 2016.[13] 彭斌, 刘丽锋, 吴会杰, 等. 苹果轮纹病菌种内遗传多样性研究[J]. 中国农业科学, 2011, 44(6): 1125-1135.
[14] 邓辉. 天津蓟州梨树主要病虫害的发生与防治[J]. 果树实用技术与信息, 2023(5): 36.
[15] 丁芳兵. 梨轮纹病生防菌株的筛选及其防治作用的研究[D]. 南京: 南京农业大学, 2009.
[16] 张丽丽. 梨轮纹病菌生物学特性及其果实病害生物防治研究[D]. 南京: 南京农业大学, 2009.
[17] 赵杰, 赵宝明, 陆晓莉, 等. 梨轮纹病菌的生物学特性及药剂的毒力测定[J]. 上海交通大学学报(农业科学版), 2016, 34(3): 79-84.
[18] 龙珑, 周泽科, 蒋军喜. 南昌市郊梨轮纹病病原菌鉴定[J]. 中国南方果树, 2012, 41(4): 36-38.
[19] 冷伟锋, 李保华, 国立耘, 等. 苹果轮纹病菌诱导产孢方法[J]. 植物病理学报, 2009, 39(5): 536-539.
[20] 何开平, 吴楚, 张俊伟. 崇阳县梨轮纹病病原菌鉴定及生物学特性[J]. 中国植保导刊, 2013, 33(11): 17-21.
[21] TAYLOR J W, JACOBSON D J, KROKEN S, et al. Phylogenetic species recognition and species concepts in fungi[J]. Fungal Genetics and Biology, 2000, 31(1): 21-32.
[22] 汪来宝, 付艳苹, 刘信强. 砂梨果实轮纹病病原鉴定及抑菌药剂的筛选[J]. 中国果树, 2018(5): 15-18, 22.
[23] 张丽丽, 常有宏, 陈志谊. 梨轮纹病菌培养特性研究[J]. 果树学报, 2009, 26(4): 520-524.
[24] 吴良庆, 朱立武, 衡伟, 等. 砀山梨炭疽病病原鉴定及其抑菌药剂筛选[J]. 中国农业科学, 2010, 43(18): 3750-3758.
[25] 赵杰. ITS序列分析及其在植物真菌病害分子检测中的应用[J]. 陕西农业科学, 2004, 50(4): 35-37.
[26] CHETHANA K W T, LI X H, ZHANG W, et al. Trail of decryption of molecular research on Botryosphaeriaceae in woody plants[J]. Phytopathologia Mediterranea, 2016, 55(2): 147-171.
[27] 劉邮洲, 常有宏, 魏本强, 等. 梨轮纹病拮抗细菌的筛选与评价[J]. 果树学报, 2009, 26(3): 344-348, 262.
[28] 肖峰, 王国平, 洪霓. 我国梨树轮纹病和干腐病病原菌种内遗传多样性研究[C]//中国植物病理学会2017年学术年会论文集. 北京: 中国农业科学技术出版社, 2017: 154.

