miR-891a-5p对结肠癌细胞肿瘤生物学行为和血管生成潜能的作用
康丽丽, 陈昭伟, 宋 健
(海南省肿瘤医院, 海南 海口 570123)
美国癌症协会公布的癌症统计数据显示,人类结肠癌的发病率为10.2%,死亡率已达到9.2%,从第四位上升到第二位[1],是消化系统中最常见的癌症之一。通常,肿瘤切除适用于结肠癌的早期阶段,化疗药物的组合通常用于不同阶段的结肠癌患者,特别是在晚期[2]。随着癌症治疗的发展,特别是免疫治疗和靶向治疗癌症患者的总生存率有所提高[3]。然而,并非所有癌症患者都能从这些治疗中受益,为了解决这个问题,许多研究还探索了一系列分子特征,如基因组特征[4]和生物标志物[5],用于预测对治疗的反应,从而指导个性化治疗。MicroRNA是一类由19-22个核苷酸组成的小非编码RNA,作为mRNA翻译效率的负介质参与几乎所有细胞过程,转录后的MicroRNA通过结合靶mRNA的3,非翻译区(3,-UTR)中的序列来降低靶基因表达[6]。miRNA的调控功能已在细胞增殖、迁移、分化和侵袭等各种细胞过程中被发现,新兴研究报道,功能性miRNA可直接作为抑癌基因或促癌基因,从而调节肿瘤进展[7]。肿瘤的生长、侵袭和迁移取决于血管生成,血管生成为肿瘤细胞提供足够的氧气和营养。因此,血管生成抑制剂开启了癌症治疗的新时代,近年来,已被广泛接受为一种临床治疗策略。本研究探讨了miR-891a-5p作为潜在血管生成因子在结肠癌转移中的作用。本研究考察了miR-891a-5p在结肠癌患者组织样本以及结肠癌细胞系中的表达水平,并确定了miR-891a-5p的诊断和预后价值。此外,利用体外实验研究了miR-891a-5p对结肠癌细胞增殖、迁移和侵袭及血管生成的影响,并通过分析潜在的靶基因初步确定了miR-891a-5p在结肠癌发展中的潜在机制。
1 资料与方法
1.1临床样本采集:患者从海南省肿瘤医院2021年5月至2022年4月就诊的36例患者中收集了结肠癌组织和邻近正常组织(距离肿瘤边缘至少3cm),所有收集的组织均储存在-80℃以进行后续实验。事先签署患者知情同意书,并取得海南省肿瘤医院研究所研究伦理委员会的批准。
1.2细胞培养和转染:结肠癌细胞系(SW480,HCT8,HCT116和SW620)和正常人结肠上皮细胞(FHC)购自中国科学院细胞库。所有细胞均在Dulbecco的改良Eagles培养基中孵育,并补充有10%胎牛血清(FBS)在37℃的含5% CO2的细胞培养箱中。使用Lipofectamine2000检测试剂盒进行转染细胞,仅用转染试剂转染的细胞用作空白对照组。细胞转染在37℃下进行6h,然后更换培养基,并在转染后48h将细胞用于后续分析。
1.3CCK-8:将细胞接种到96孔板(2×103细胞/孔)并孵育0h、24h、48h和72h。然后,向每个孔中加入10μL lCCK-8试剂,并进一步孵育2h。使用酶标仪在450nm处测量光密度。
1.4管形成测定:将50μL基质胶接种在96孔培养板中,然后在37℃下孵育。人脐静脉内皮细胞(HUVECs)在具有不同外泌体或其他处理的基质胶上培养。在37℃孵育4h后,在显微镜下观察管的形成,并通过测量累积管长度进行分析。
1.5RNA提取和逆转录定量PCR(RT-qPCR):使用PrimeScript逆转录酶试剂盒将RNA逆转录成单链cDNA。使用qPCR和SYBR-GreenI预混液试剂盒在7500实时荧光定量PCR系统。U6用作miR-891a-5p的内源性对照,GAPDH用作NLRP7的内源性对照。热循环条件如下:初始变性在95℃下变性10min,然后在95℃下变性40个循环30s,在60℃退火20s,在72℃下延伸15s,最终表达式值是使用2-ΔΔCt方法。见表1。

表1 引物序列表
1.6伤口愈合试验:细胞(1×105细胞/mL)在处理24h后接种在24孔板中,并孵育至70%-80%汇合。使用无菌移液器吸头,通过刮擦细胞单层产生划痕伤口。加入新鲜培养基,将细胞再孵育24h或不孵育,细胞在倒置显微镜下成像。
1.7Transwell:Transwell室在37℃下预包被基质胶1h用于侵袭测定,而没有基质胶涂层的室用于迁移测定。转染的细胞密度为2×105细胞/腔室用无血清培养基接种到上室中,同时将补充有10%FBS的培养基添加到下室中,作为化学引诱剂。在37℃孵育48h后,将下室中的细胞在室温下用0.1%结晶紫染色20min,并在倒置光学显微镜下计数。
1.8靶基因预测和双荧光素酶报告基因检测:TargetScan在线工具(http://www.targetscan.org/vert_72)预测miR-891a-5p潜在的靶基因。为了确认miR-891a-5p和NLRP7在SW480细胞中的相互作用,将SW480细胞按照4×104细胞/孔接种到六孔板中,并在37℃下培养24h。随后,将SW480细胞的野生型(WT)和突变型(MUT)3'-UTR克隆到荧光素酶报告载体PsiCheck2中。MUT序列是使用定点诱变试剂盒生成的。根据制造商的方案,将WT和MUT SW480细胞荧光素酶质粒(100ng)与miR-891a-5p mimic(50nM)和相应的NC共转染到SW480细胞中。在37℃孵育48h后,使用双荧光素酶报告检测系统测量相对荧光素酶活性,萤火虫荧光素酶活性被标准化为雷尼拉萤光素酶活性。
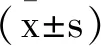
2 结 果
2.1miR-891a-5p在结肠癌中的表达水平:miR-891-5a在结肠癌组织样本中的表达水平显著高于健康对照组或邻近正常对照组,如图1A所示,还发现miR-891a-5p在结肠癌细胞系(SW480,HCT8,HCT116和SW620)中的表达水平显著高于正常人结肠上皮细胞(FHC)(F=25.29,P<0.01),miR-891a-5p在SW480中表达最高,因此挑选SW480为后续研究,如图1B所示,在测定miR-891a-5p在SW480细胞的细胞质和细胞核中的含量时,发现miR-891a-5p在细胞质中的表达高于细胞核中的表达量,如图1C所示。

图1 miR-891a-5p在结肠癌组织与细胞中的表达
2.2miR-891a-5p对SW480细胞增殖、侵袭及迁移作用:miR-891a-5p mimic和miR-891a-5p inhibitor转染后,miR-891a-5p的mRNA表达水平分别在SW480细胞系中成功过表达和沉默(F=26.30,P<0.01),如图2A所示,之后,使用CCK-8测定,转染miR-891a-5p mimic的细胞增殖、侵袭及迁移能力显著增加,但与对照组相比,转染miR-891a-5p inhibitor的细胞增殖(F=28.93,P<0.01)、侵袭(F=21.24,P<0.01)及迁移(F=22.68,P<0.01)能力显著降低。
2.3miR-891a-5p对SW480细胞血管生成的影响:图3A结果表明,与Control比较miR-891a-5p mimic的血管生成数量明显增加,而miR-891a-5p inhibitor的血管生成数量明显降低(F=25.67,P<0.01),为验证HUVEC管形成实验的可靠性,使用Western blot对血管生成因子的相关蛋白VEGF和MMP-9进行检验,结果发现,VEGF和MMP-9在miR-891a-5p mimic组蛋白表达水平显著增加,蛋白表达水平在miR-891a-5p inhibitor明显降低(F=20.36,P<0.01)。

图3 miR-891a-5p对SW480细胞血管生成的影响

图4 NLRP7是miR-891a-5p下游靶点基因
2.4NLRP7是SW480细胞中miR-891a-5p的直接靶标:根据starBase v2.0网站(http://starbase.sysu.edu.cn/starbase2/)在线分析的结果,预测NLRP7是miR-891a-5p的靶标,在其3′-UTR,在NLRP7基因中发现了miR-891a-5p的结合位点,并利用荧光素酶报告基因检测miR-891a-5p与NLRP7之间的相互作用。双荧光素酶报告基因检测结果表明,NLRP7-WT组中的荧光素酶活性因miR-891a-5p的表达水平上调而降低,然而,MUT组的荧光素酶活性没有显著变化(t=1.31,P=0.26)。NLRP7的表达水平在结肠癌患者肿瘤组织中明显低于邻近正常组织(t=10.08,P<0.001),与miR-891a-5p的表达水平呈负相关,上述结果表明,NLRP7可能是结肠癌中miR-891a-5p的直接靶标。
2.5NLRP7过表达对SW480细胞增殖、侵袭及迁移的作用:NLRP7作为miR-891a-5p的靶向目标,与OE-NC组相比,OE-NLRP7组中NLRP7表达水平显著增加(t=18.12,P<0.01),表明细胞转染成功,如图5A所示,而且OE-NLRP7组的细胞增殖(t=20.17,P<0.01)、侵袭(t=23.15,P<0.01)及迁移(t=19.64,P<0.01)能力明显下降。

图5 NLRP7过表达对结肠癌增殖、侵袭及迁移的作用
2.6NLRP7过表达对SW480细胞血管生成的影响:Western blot实验结果表明VEGF(t=13.88,P<0.01)和MMP-9(t=15.67,P<0.01)蛋白表达水平在OE-NLRP7显著降低。图6B结果表明,与OE-NC比较OE-NLRP7的血管生成数量明显降低(t=20.17,P<0.01)。

图6 NLRP7过表达对SW480细胞血管生成的影响
3 讨 论
结肠癌发展的基础机制为各种基因的转录和多种信号转导相关的协同过程。尽管已有许多研究探索了结肠癌发展的分子机制,但还远远不够。研究表明miRNA的异常表达已被确定与多种恶性肿瘤的发生密切相关,据报道,它们通过改变转录后基因表达参与细胞凋亡,增殖,细胞周期和转移[8]。miRNA已被鉴定为肿瘤发生中的癌基因或抑癌基因,侵袭和迁移是肿瘤细胞的重要生物学行为,与预后不良密切相关,严重威胁患者的健康和生命。因此,深入分析迁移机制对提高结肠癌患者的生存率和预后具有重要意义。据报道,miR-891a-5p在许多癌症中具有促进癌症的功能[9],本研究使用36份结肠癌组织和邻近正常组织检测miR-891a-5p表达水平,我们的结果表明,结肠癌患者标本中的miR-891a-5p显著增加。基质金属蛋白酶-9(MMP-9)是侵袭和破坏细胞外基质所必需的,可促进癌细胞向附近健康组织的侵入性进展[10],在恶性肿瘤的侵袭性,迁移性和血管生成进展中具有不可或缺的地位。血管内皮生长因子(VEGF)是重要的促血管生成的生长因子,对内皮细胞具有有丝分裂和抗凋亡作用,增加血管通透性,促进细胞迁移等[11],迁移的开始不仅仅是细胞自主事件,而是受到复杂组织微环境的影响,肿瘤相关巨噬细胞可以被癌细胞分泌的乳酸刺激以促进血管生成,微环境对癌细胞侵袭和迁移的影响既是细胞自主的,也是组织环境依赖性的,这进一步增加了这一过程的复杂性。总而言之,miR-891a-5p的下调导致肿瘤细胞迁移、增殖和侵袭受到抑制,但miR-891a-5p的上调导致肿瘤细胞生物学行为增强。
本研究中,在NLRP7的3'UTR中发现了miR-891a-5p的互补序列,我们使用荧光素酶活性测定证明了miR-891a-5p与NLRP7的相互作用。此外,结肠癌患者miR-891a-5p与NLRP7 mRNA表达呈负相关。先前报道的关于NLRP7在结肠癌中的功能作用的研究,结合我们的数据启发我们推断miR-891a-5p可能通过靶向NLRP7参与结肠癌进展的调节。miR-891a-5p在结肠癌进展中的确切分子机制尚未深入探索,这是本研究的局限性,值得进一步研究。
NLR家族成员的重要作用是直接或间接促成癌症发展,包括炎症、细胞死亡、肿瘤生长、血管生成、侵袭和转移[12]。在功能方面,一些成员可能是炎症小体途径的启动者,其规范激活半胱天冬酶-1,此后激活IL-1β和IL-18[13],在NLR家族的所有成员中,NLRP7及其功能知之甚少。最近报道了NLRP7基因与溃疡性结肠炎(UC)之间的相关性,并且发现NLRP7表达在炎症性肠病患者的肠黏膜中上调[14]。考虑到炎症性肠病患者发生结直肠癌的风险过高,且NLRP7在癌症中的功能尚不清楚,我们结果证实,NLRP7可能在结肠癌进展中起到抑制作用,这与其他人的研究结果并不一致,因此其具体机制有待进一步探索。
但是本研究有几个局限性,例如样本量有限,缺乏动物实验。此外,未研究甲基化等其他因素对NLRP7表达水平的影响,这可能干扰miR-891a-5p对NLRP7的调节。因此,在未来的研究中,可利用动物癌症模型进一步研究miR-891a-5p在结肠癌发生中的功能作用和机制,以及miRNA 891a-5p/NLRP7轴的具体调控机制。
综上所述,本研究结果表明,miR-891a-5p在结肠癌组织的表达增加,可作为结肠癌诊断和预后生物标志物。miR-891a-5p过表达可促进结肠癌细胞增殖、迁移、侵袭及血管生成能力,表明miR-891a-5p可能是结肠癌进展中的癌基因,对结肠癌的治疗具有靶向潜力。NLRP7也被确定为miR-891a-5p的靶基因,可能介导miR-891a-5p在结肠癌进展中的生物学功能。

