基于RT-RAA的禽流感H5亚型核酸CRISPR-Cas13a检测方法的建立
杨芷翊,王新凯,2,史玉婷,付思源,张钰炘,曹琛福,贾伟新*
(1.华南农业大学兽医学院 国家禽流感专业实验室(广州)/广东省人兽共患病防控制剂工程实验室/人兽共患病防控制剂国家地方联合工程实验室/农业农村部人畜共患病重点实验室/广东省动物源性人兽共患病防控重点实验室,广州 510642;2.深圳海关动植物检验检疫技术中心,深圳 518045)
禽流感病毒(avian influenza virus, AIV)是禽流行性感冒(禽流感)的病原,含有8个单链负链RNA片段,包含在独立的病毒核糖核蛋白复合物(vRNPs)中[1]。根据禽流感病毒对鸡的致病性,可将其分为高致病性禽流感病毒(HPAIV)和低致病性禽流感病毒(LPAIV)。HPAIV主要包括H5和H7两种亚型,我国H5亚型HPAIV主要有H5N1、H5N6和H5N8三种亚型[2]。近年来,高致病性H5亚型禽流感疫情规模之大和地理分布之广前所未有,不仅在亚洲、欧洲和非洲的家禽中流行,也引起了人的偶发感染[3],严重威胁家禽业和人类健康[4]。对H5亚型HPAIV的早期精准监测是控制H5亚型禽流感的关键措施。
目前,对于H5亚型HPAIV的检测主要包括病毒分离培养、抗原抗体检测和分子生物学检测。病毒分离培养法是诊断禽流感病毒感染的“金标准”[5],其检测准确率高、检测结果完整,但耗时长且工作量大,不适合H5亚型禽流感爆发时的大规模检测。基于抗原抗体的AIV H5亚型检测方法种类繁多,研究范围广泛,但是不可避免地都会出现抗原抗体检测法本身存在的缺陷,如检测过程中会经常出现假阳性反应从而降低检测结果的可信度,商品化的抗原或抗体可能存在价效差异,制备抗体血清的时间较长等。相比于抗原抗体检测,分子生物学检测(核酸检测)将对病原体检测的研究提高到了基因分子水平,有着耗时短、灵敏度高、特异性强等优势,能够有效地应用于致病菌的快速检测。
有规律成簇间隔短回文重复序列(clustered regularly interspaced short palindromic repeats, CRISPR)及其相关蛋白在RNA干扰和基因编辑等领域有着巨大的潜力[6]。其中CRISPR相关蛋白Cas13a和Cas12a能在crRNA的引导下特异性切割靶标RNA,并在切割完成后仍保持活性,继续切割其他非靶标 RNA,即具有“附带切割”能力[7]。基于Cas12和Cas13的旁切活性,研究团队开发出各种核酸检测工具。张锋实验室的 Gootenberg 等[8]开发了基于CRISPR-Cas13的特异性高灵敏度酶解报告基因解锁(specific high-sensitivity enzymatic reporter unlocking,SHERLOCK)检测系统。在反应体系中加入大量信号报告RNA,该RNA一端连有荧光基团,另一端连有猝灭基团,正常情况下报告RNA不发出荧光。当Cas13蛋白-crRNA二元复合体识别底物RNA后,Cas13蛋白被激活,除了特异性地切割底物RNA,还会非特异性地切割环境内的报告分子,释放信号。Jennifer Doudna团队的Chen等[9]则基于Cas12a开发了DETECTR(DNA endonuclease targeted CRISPR trans reporter)技术。与SHERLOCK类似,Cas12a/crRNA识别检测序列后,激活Cas12a的旁切活性,接着切割单链DNA报告探针并发出荧光。有研究比较了Cas13a和Cas12a酶的核酸检测特性和报告酶切割活性,结果显示靶向RNA的Cas13a在低活化剂浓度下的检测速度明显快于靶向DNA的Cas12a[10]。
但仅依靠 Cas 蛋白的切割活性检测实际样本存在敏感度不足、耗时长等问题[11]。目前主要的解决方法是与核酸扩增技术联合,而等温扩增技术(ITA)的反应过程始终维持在恒定的温度下,通过添加不同活性的酶和各自特异性引物来达到快速扩增核酸的目的。与其他的核酸扩增技术相比,等温扩增有快速、高效、特异的优点且无需专用的设备。逆转录重组酶辅助扩增(reverse transcription-recombinase aided amplification, RT-RAA)是一种核酸恒温扩增技术,具有灵敏度高、特异性强、检测速度快、操作简便等优点。在室温下,重组酶可以与引物DNA紧密结合形成聚合物。当引物识别出与之完美匹配的互补序列模板DNA时,在单链DNA结合蛋白的帮助下,DNA聚合酶可以打开模板DNA的双链结构,形成新的cDNA链,扩增产物呈指数级增长[12]。采用依赖于体温的RAA核酸扩增技术来提高样品中的DNA或RNA水平,从而增加CRISPR工具的灵敏度,且这种工具能够在几乎任何环境下使用[8]。目前,基于RT-RAA的AIV H5亚型核酸CRISPR-Cas13a检测方法未见报道。
本研究拟运用CRISPR-Cas13a基因编辑术结合逆转录重组酶辅助扩增技术(RT-RAA)建立检测 AIV H5亚型的新平台,该类检测平台具有新颖、快速、方便等特点,既可以在实验室完成大批量临床样本的检测,也可以在养殖场等室外环境进行小规模的快速检测。这将为H5亚型禽流感病毒的临床检测提供新的技术手段,也为其他RNA病毒的快速准确检测提供新思路,具有较广阔的应用前景。
1 材料与方法
1.1 质粒与病毒
含有目的基因的pUC57-H5质粒标准品购自生工生物工程(上海)股份有限公司。H3、H5、H6、H7、H9、H10亚型禽流感病毒(avian influenza virus, AIV),鸡新城疫病毒(Newcastle disease virus, NDV)、鸡传染性支气管炎病毒(infectious bronchitis virus, IBV)、鸡传染性法氏囊病病毒(infectious bursal disease virus, IBDV)和鸭坦布苏病毒(duck tembusu virus, DTMUV)由华南农业大学国家禽流感专业实验室(广州)保存。
1.2 试剂与仪器
RNA提取试剂盒购自上海飞捷生物技术有限公司,RT-RAA核酸扩增试剂(基础型)购自杭州众测生物科技有限公司,EZ-10柱式DNA纯化试剂盒购自生工生物工程(上海)股份有限公司,DL1000 DNA Marker购自宝日医生物技术(北京)有限公司,T7 RNA Polymerase和NTP Buffer Mix购自New England Biolabs,LwaCas13a蛋白购自广州美格生物科技有限公司,Murine RNase inhibitor(MRI)购自南京诺唯赞生物科技股份有限公司。实时荧光PCR仪和Bio-rad恒温水浴锅购自Biod-rad公司。
1.3 方法
1.3.1 RT-RAA引物与crRNA序列的设计与合成 从 GISAID数据库中下载并使用342条AIV H5亚型的HA基因序列,使用DNAStar软件对比分析序列的保守性,在保守区域内选择28 bp作为crRNA的目的基因靶向序列。根据RAA引物设计的原则,通过Oligo 7.0软件设计了RT-RAA引物,设计的引物扩增区域内包含crRNA 的目的基因靶向序列。在RT-RAA上游引物的5′端添加25 bp的T7启动子序列,序列如表1所示。crRNA由广州博徕斯生物科技股份有限公司合成,引物由生工生物工程(上海)股份有限公司合成。
表1 基因序列信息Table 1 Gene sequence information
1.3.2 RNA提取与RT-RAA扩增 用RNA提取试剂盒对H5病毒株样本核酸进行提取后,按照众测®RT-RAA核酸扩增试剂(基础型)使用说明书对模板进行RT-RAA扩增。向单个干粉管中加入29.4 μL A Buffer,T7-RAA-F(10 μmol·L-1) 和RAA-R(10 μmol·L-1) 各2 μL,再加入模板和DNase/RNase-Free Water共14.1 μL,向每个反应管盖内加入 2.5 μL B Buffer,同时用DNase/RNase-Free Water设置阴性对照(NC),盖上管盖后上下颠倒混匀7~8次,瞬间离心后,在水浴锅中42 ℃孵育30 min。将获得的RT-RAA扩增产物经过DNA纯化试剂盒纯化,并经2%琼脂糖凝胶电泳后送生工生物工程(上海)股份有限公司进行测序验证。
1.3.3 CRISPR-Cas13a检测体系的建立与优化 首先配制CRISPR-Cas13a反应体系:包括crRNA(100 μmol·L-1)1.6 μL、TaqMan探针(50 μmol·L-1)0.64 μL、T7 RNA Polymerase 0.25 μL、NTP Buffer Mix 1.6 μL、MRI(40 U·μL-1) 1 μL、10×T7 RNA Polymerase Buffer 2.0 μL,向反应混合物内分别加入 0.5、1、2、4 μL LwaCas13a蛋白(60 μg·mL-1),加入0.6 μL cDNA(100 ng),用DNase/RNase-Free Water补至20 μL,37 ℃反应20 min,以CRISPR-Cas13a检测最短时间出现最强荧光信号为准则,确定最佳 LwaCas13a基因编辑蛋白用量。以最佳LwaCas13a蛋白用量配制反应体系,在反应体系中分别加入 0.2、0.4、0.6、0.8、1.6、3.2 μL crRNA(100 μmol·L-1),确定最佳crRNA浓度。运用顺序控制变量的方法对CRISPR-Cas13a检测体系进行优化,其他物质浓度设置如下:TaqMan探针(50 μmol·L-1)0.16、0.32、0.64、1.28 μL;T7 RNA Polymerase 0.25、0.5、1、2 μL;NTP Buffer Mix 0.8、1.2、1.6、2、2.4 μL,最终确定CRISPR-Cas13a的最佳反应体系。
1.3.4 RT-RAA-CRISPR特异性试验 对AIV H3、H5、H6、H7、H9、H10亚型以及感染家禽的其他常见病毒NDV、IBV、IBDV、DTMUV进行核酸抽提,将抽提的核酸进行RT-RAA扩增并进行纯化。使用优化后的CRISPR-Cas13a反应体系进行反应,将DNase/RNase-Free Water作为阴性对照,于37 ℃反应20 min,实时检测荧光信号,验证其特异性。
1.3.5 RT-RAA-CRISPR灵敏度试验 使用pUC57-H5质粒作为标准品,用DNase/RNase-Free Water进行10倍梯度稀释,设置不同拷贝数(105~1 copies·μL-1)的质粒作为模板进行RT-RAA扩增和CRISPR-Cas13a反应,并用DNase/RNase-Free Water设置阴性对照,检测该反应的检出限。
1.3.6 RT-RAA-CRISPR符合性试验 选取已知的20份阳性和36份阴性临床样本,对其进行核酸提取后,运用国标GB/T 18936—2020公布的引物(RT-qPCR-H5F和RT-qPCR-H5R)和探针(RT-qPCR-H5Taq)以及依据标准中提供的反应体系和反应程序进行荧光定量RT-PCR检测,引物和探针的序列具体见表1。反应体系为:2×RT缓冲液10 μL,酶混合液0.5 μL,上游引物(10 μmol·L-1)0.8 μL,下游引物(10 μmol·L-1)0.8 μL,探针(10 μmol·L-1)0.4 μL,无核酶灭菌水2.5 μL。反应程序为:45 ℃ 反转录15 min;95 ℃ 预变性2 min;退火延伸95 ℃ 15 s,60 ℃ 60 s,40个循环,在每次循环退火延伸时收集荧光信号,按照标准中提供的依据进行结果判定。同时将56份样品用本研究建立的方法进行 RT-RAA-CRISPR 检测,比较两者之间的符合性。
2 结 果
2.1 CRISPR 核酸检测靶点的筛选与RT-RAA引物序列
为了获得适用于检测AIV H5亚型的高效特异性crRNA目的基因的靶向序列,经过对GISAID数据库中342条AIV H5亚型的HA基因序列进行筛选,根据crRNA设计原则找到合适的保守区域为第1 409位碱基到第1 440位碱基(图1),该区域保守性一致率为98.1%:第1 416位碱基G占比97.6%,A占比2.4%;第1 429位碱基G占比96.7%,A占比3.3%;其他碱基一致率均>98.8%。因此,在该保守区域内选择了28 bp作为crRNA目的基因的靶向序列(5′-GCTTAGGGATAATGCAAAGGAGCTGGGT-3′),用于 AIV H5 亚型 CRISPR-Cas13a 核酸检测靶点。该靶向序列的反向互补序列与36 bp的LwaCas13a 蛋白结合的锚定序列(5′-GAUUUAGACUACCCCAAAAACGAAGGGGACUAAAAC-3′)共同构成crRNA,详见表1。

图1 crRNA保守性分析Fig.1 crRNA conserved analysis
按照RAA引物设计的原则通过Oligo 7.0软件设计了RT-RAA引物,引物扩增产物长度为198 bp,扩增序列包含crRNA的靶向序列且与之不重合,应用Primer-BLAST进一步检验引物的特异性。经过筛选后,在RAA上游引物的5′端添加了25 bp的T7启动子序列(5′-TAATACGACTCACTATAGGG-3′),以便后续对 RT-RAA 扩增产物进行DNA转录,序列如表1所示。
2.2 基于RT-RAA的 CRISPR-Cas13a 检测方法的建立与最佳体系的优化
根据RT-RAA试剂盒说明书将抽提好的核酸扩增为cDNA并纯化,凝胶电泳结果如图2所示,所设计的针对H5病毒株的RT-RAA引物在198 bp的位置扩增出单一特异性条带,与预期片段大小相符,经测序验证为正确序列。结果表明,本研究成功设计了可以扩增H5病毒株的RT-RAA引物,可利用扩增产物继续进行后续试验。

M. DL1000 DNA Marker;1. H5;2. 阴性对照M. DL1000 DNA Marker; 1. H5; 2. Negative control图2 RT-RAA扩增结果Fig.2 RT-RAA amplification results
按照顺序控制变量逐一优化CRISPR-Cas13a检测体系,以 CRISPR-Cas13a 检测最短时间出现最强荧光信号为准则,确定最优反应体系。荧光检测结果如图3所示,表明CRISPR-Cas13a的最佳检测体系为:LwaCas13a蛋白(60 μg·mL-1)2.0 μL、crRNA(100 μmol·L-1)3.2 μL、TaqMan探针(50 μmol·L-1)1.28 μL、T7 RNA Polymerase 0.25 μL、NTP Buffer Mix 2.0 μL、Murine RNase Inhibitor(40 U·μL-1)1 μL、10×Cas13a Reaction Buffer 2.0 μL、10×T7 RNA Polymerase Buffer 2.0 μL,加入0.6 μL cDNA(100 ng)后用DNase/RNase-Free Water补至20 μL,于 37 ℃ 反应20 min,实时检测 CRISPR-Cas13a 附带切割释放的荧光信号。
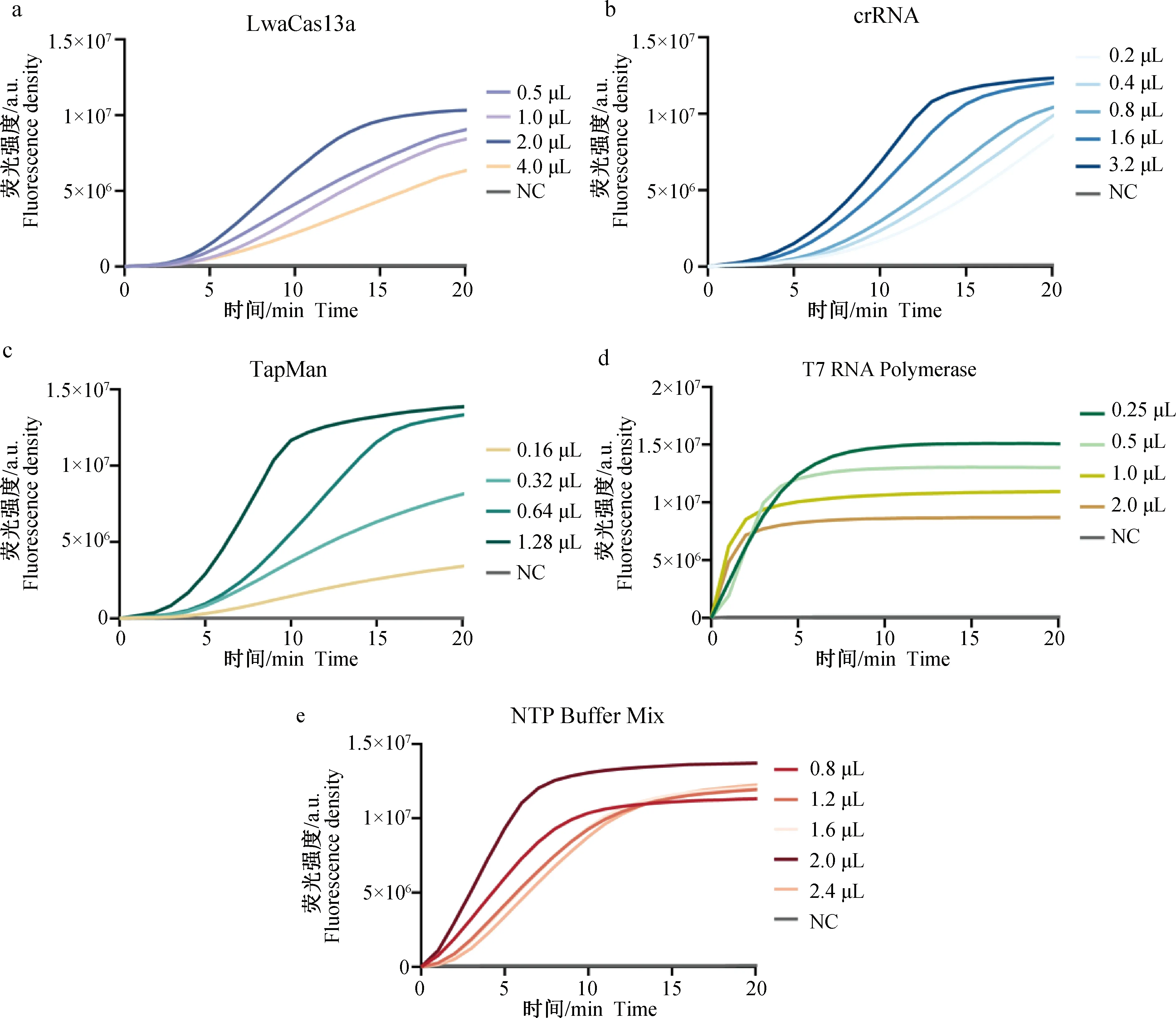
a. LwaCas13a蛋白用量的优化;b. crRNA 浓度的优化;c. TaqMan探针用量的优化;d. T7 RNA Polymerase用量的优化;e. NTP Buffer Mix用量的优化a. Optimization of LwaCas13a protein dosage; b. Optimization of crRNA concentration; c. Optimization of TaqMan probe concentration; d. Optimization of the amount of T7 RNA Polymerase; e. Optimization of NTP Buffer Mix consumption图3 CRISPR最佳检测体系的优化结果Fig.3 Optimized results of CRISPR optimal detection system
2.3 RT-RAA-CRISPR的灵敏度检测结果
为了评价RT-RAA-CRISPR检测方法的灵敏度,将pUC57-H5标准质粒用DNase/RNase-Free Water进行10倍梯度稀释,设置105、104、103、102、10、1 copies·μL-16个检测浓度梯度,同时设置阴性对照(NC)。荧光检测结果如图4所示,反应20 min后,从105copise·μL-1到1 copy·μL-1这6个检测梯度的荧光值分别为14 553 189、11 586 768、11 375 226、12 802 810、6 765 644.5、841 933.25 a.u.,结果均与阴性对照的荧光值差异具有统计学意义(P<0.05)。结果表明,本研究建立的 RT-RAA-CRISPR 方法检测AIV H5亚型的灵敏度为 1 copy·μL-1。

图4 RT-RAA-Cas13a 灵敏度试验荧光检测结果Fig.4 Fluorescence detection results of RT-RAA-Cas13a sensitivity test
2.4 RT-RAA-CRISPR的特异性检测结果
为评价 RT-RAA-CRISPR 检测方法的特异性,分别用该方法检测了AIV H3、H5、H6、H7、H9、H10亚型以及NDV、IBV、IBDV、DTMUV的RAA扩增产物。经过CRISPR-Cas13a体系反应后,各样品荧光强度信号结果如图5所示。结果表明,H5 病毒株的检测荧光强度显著高于 H3、H6、H7、H9、H10、NDV、IBV、IBDV、DTMUV和阴性对照,且与阴性对照有显著性差异(P<0.01)。说明本研究建立的检测AIV H5亚型方法特异性良好,与禽流感其他亚型及其他禽病均无交叉反应,可用于特异性检测AIV H5亚型的病毒。
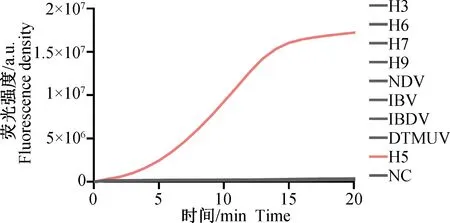
图5 RT-RAA-Cas13a 特异性试验荧光检测结果Fig.5 Fluorescence results of RT-RAA-Cas13a specific assay
2.5 RT-RAA-CRISPR的临床样品检测结果
为进一步评估RT-RAA-CRISPR核酸检测方法与国家标准规定荧光定量 RT-PCR方法的一致性,选取了20份AIV H5亚型的阳性临床样本和其他36份阴性临床样本,进行CRISPR核酸检测和GB/T 18936—2020荧光定量RT-PCR检测。结果如表2所示,其中19份荧光RT-PCR方法检测阳性的样本全部检出,特异性为100%,敏感性为95%,符合率为98.2%。

表2 基于RT-RAA的CRISPR临床样品检测结果Table 2 Results of CRISPR clinical samples based on RT-RAA
3 讨 论
H5亚型HPAIV传播快、致死率高,可引起家禽急性死亡,且具有重要的公共卫生意义。从2003年1月至2022年10月,全球21个国家共报告了868例人感染H5N1禽流感病毒的病例,其中456例死亡,致死率高达53%[13]。因此,H5亚型HPAIV的快速、准确分型鉴别诊断对于养禽业和人类健康尤为重要。目前临床对于AIV H5亚型的检测方法主要包括病毒分离培养、抗原抗体检测和分子生物学检测。病毒分离培养和抗原抗体检测虽然较为可靠,但同时也受到假阳性率高、检测周期长、成本高、检测过程较为复杂等缺点的影响。分子生物学研究可以同时检测大量样本,检测效率高,适合于流感大面积暴发时使用。常用的分子检测法有普通PCR、多重PCR(Multiplex PCR)、实时荧光定量PCR(Real-time PCR,RT-qPCR)、数字 PCR(digital PCR,dPCR)等。普通PCR和多重PCR虽然引物设计简单、操作方便,但只能根据凝胶电泳进行定性试验。实时荧光定量PCR和数字PCR虽然可以进行定量试验,由于仪器成本高,使用复杂,且需要相关专业人员进行操作,在资源有限的地区无法大范围推广。因此,需要找到更合适的方法用于H5亚型禽流感病毒的即时检验(point-of-care testing, POCT),即在采样现场即刻进行分析,省去样本在实验室检验时的复杂处理程序,快速得到检验结果。
核酸的快速检测是临床诊断和生物技术应用中不可或缺的一部分。近几年来,利用CRISPR-Cas酶的附带切割活性,CRISPR-Cas13实现了对核酸靶标片段的检测且被迅速开发、应用于核酸诊断。但其单独使用时灵敏度较低[8],因此,CRISPR-Cas13一般与其他核酸扩增技术一同使用。有研究利用PCR技术稳定性好、实用性强及高效扩增靶序列的特点,建立了基于PCR和CRISPR-Cas13a系统的结核分枝杆菌脱氧核糖核酸(MTB DNA)检测方法——PCR-CRISPR,其最高灵敏度为10 copies·μL-1[14],但PCR扩增过程所需时间较长,在检测时间上几乎没有优势。也有研究利用CRISPR/Cas系统结合环介导等温扩增技术(LAMP)实现了对非洲猪瘟病毒CD2v基因的快速现场化检测,其检测灵敏度达到8.88 copies·μL-1[15],但LAMP对引物的要求极高,需要设计4~6对引物,不利于该方法的推广。基于重组酶介导等温核酸扩增技术(RAA)与CRISPR-Cas13a技术相结合建立的RT-RAA-CRISPR具有引物设计简单、反应温度低、操作简易、检测时间短等特点。本研究中对样本RNA进行提取后,通过RT-RAA进行30 min的核酸反转录以及扩增过程,对获得的cDNA进行纯化,再通过CRISPR-Cas13a进行荧光检测,在37~42 ℃条件下于1 h 20 min内即可完成对RNA病毒样本的检测,可通过荧光值直观判断出病毒含量,短时间内实现将待测靶标信号放大的同时对样品进行定量检测,大幅度提高了核酸检测的效率。除具有检测的快速性以外,该方法还具有良好的特异性和灵敏度,其最低检测限度为1 copy·μL-1,比PCR-CRISPR和LAMP-CRISPR的检测灵敏度高[14-15]。与其他检测平台(如荧光定量PCR)相比,RT-RAA-CRISPR方法的另一个优势是其使用成本低,该方法中荧光信号也可以通过荧光恒温扩增仪、酶标仪进行检测,相较于荧光定量PCR仪价格更加低廉,若采用便携式荧光检测仪替代,对检测环境的要求更低、适应性更好。
4 结 论
本研究成功建立了一种针对AIV H5亚型的基于RT-RAA的CRISPR快速检测方法,可满足生产实践和临床检测的需要,为新型H5亚型禽流感病毒检测方法的开发提供了技术支撑,在H5亚型禽流感病毒的防控、毒株的鉴别诊断以及流行病学调查方面均具有较好的应用价值。

