七种猪常见病毒核酸磁-纳米微粒可视化快速检测技术的建立与应用
赵永攀,郑芳芳,尹俊卿,杜 谦,童德文*,黄 勇*
(1.陕西省畜牧产业试验示范中心,泾阳 713702;2.西北农林科技大学动物医学院,杨陵 712100)
随着现代养猪业规模化、集约化发展,多种病原体混合感染在猪场越来越普遍[1]。在猪场发生的病毒性疾病中,猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)[2]、猪瘟病毒(classical swine fever virus,CSFV)[3]、猪圆环病毒2型(porcine circovirus type 2,PCV2)[4-5]、猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)[6]、猪伪狂犬病病毒(porcine pseudorabies virus,PRV)[7]、猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)[8]和猪细小病病毒(porcine parvovirus,PPV)[9]等7种病毒是导致猪呼吸道疾病、生殖系统疾病和肠道疾病的主要病原[6,10],此外PRV、PPV、PCV2、PRRSV和CSFV这5种病毒会不同程度地破坏猪的免疫系统[11],降低免疫力[12],使猪容易被其它病原体感染[13-14],给养殖业带来了严重的损失。因此,建立猪常见病毒病病原的便捷诊断技术对于有效控制和预防猪多种病原的单独或混合感染具有重要支撑作用。
目前临床对于猪病原的检测主要是通过PCR等分子诊断分析技术,但是需要专业的检测实验室和技术人员,对设备的依赖度较高。因此建立快速、灵敏、适于大规模现场检测,鉴定多种病原的检测方法已成为当今猪病检测与鉴定研究领域的热点和重要方向。纳米检测技术与传统的检测方法相比,纳米材料由于独特的结构和优异的性能,有望进一步提高灵敏度和检出限,满足检测手段早期、快速和准确诊断的需求[15]。金属纳米粒子,特别是金纳米粒子(gold nanoparticles, AuNPs),由于其大小、形状和光电子特性的可操作性、良好的生物相容性和高的稳定性已成为研究人员的首选[16-18]。核酸分离作为分子生物学研究的重要步骤,在使用现代技术之前,是一个耗时的过程,通常受到分离产品的收率小和纯度低的限制,不适合自动化和放大[19]。氧化铁Fe3O4能修饰不同表面官能团(包括羧基、胺基、醛基、羟基、硫醇和甲苯),以及生物分子修饰,例如抗体、寡核苷酸、DNA/RNA探针、蛋白质A或G、链霉亲和素(streptavidin)等,使得它们表面功能化,进而高特异性识别不同种类的靶目标[20-22]。这些功能化的磁性粒子不仅可用于核酸分离,同时可以免去离心步骤,有助于缩短检测时间和降低检测成本。
本研究通过特异性 DNA 探针偶联的磁性微粒(magnetic microspheres, MMP)从检测样本中快速高效地富集病毒 DNA,从而扩大病原体模板量,在此基础上,以纳米金颗粒(AuNPs)作为二级识别元件(包含数以百计的特异性地识别待检病原体的 DNA 识别标签),使其可以结合在有靶基因序列的磁性微粒周围并形成一个“三明治”的结构。利用磁纳米微粒的结构特征,从疑似感染的粪便或血清中对核酸进行高效富集和信号放大,实现双探针同时富集筛选病原核酸提高检测特异性和准确性,最后结合工具酶的酶促可视化反应,从而将富集杂交病原核酸信号进一步放大,旨在开发建立一种磁-纳米微粒可视化快速检测的新方法(ultrasensitive nanoparticle visualization detection,UNVs)。该技术无须进行病原核酸提取,以期实现对发病猪群感染病原的现场可视化的快速诊断,满足基层机构和疫源地无任何实验室条件下的快速检测的需要,从而为猪传染病的研究提供技术支撑。
1 材料与方法
1.1 主要材料
1.1.1 病毒和细胞 本研究中所用到的PCV2毒株(GenBank No. MH492006.1),PRV毒株(GenBank No. MH582511.1),PPV毒株(GenBank No. MK993540),PEDV毒株(GenBank No. AF353511),TGEV毒株(GenBank No. HQ462571),CSFV毒株(GenBank No. AY775178)和PRRSV毒株(GenBank No. HQ401282)均由本实验室分离鉴定,保存于-80 ℃。本研究中所用到的PK-15细胞、Marc-145细胞、Vero细胞、ST细胞均为本实验室保存。
1.1.2 主要试剂 羧基化免疫磁珠(MNPs)、 DNA/RNA共提试剂盒、DMEM培养基、 RPMI 1640培养基和胎牛血清(FBS)购自Invitrogen;胶体金AuNPs溶液购自Aurion公司;1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、二甲基亚砜(DMSO)、碱性磷酸酶(AP)标记的兔抗生物素抗lgG(Rabbit Anti-Biotin/AP)购自Sigma公司;BCIP/NBT碱性磷酸酶显色试剂盒购自武汉默沙克生物科技有限公司。
1.2 UNVs的设计思路
本研究设计的针对猪7种病毒(PCV2、PRV、PPV、PEDV、TGEV、PRRSV和CSFV)建立的磁纳米微粒可视化检测方法,具体操作流程图如图1所示,向待检样本中加入等体积裂解液并煮沸,使病毒核酸释放,以MNPs为载体,AuNPs为桥梁,在富集捕捉病毒核酸介导下,通过AuNPs上携带的生物素修饰的通用信号放大探针,耦合碱性磷酸酶标记的抗生物素抗体,以碱性磷酸酶使底物显色的酶促可视化反应为检测依据,完成对病原核酸的特异性富集捕捉和信号放大,实现在较为简单的仪器和场所下对病原的现场早期、灵敏、可视化(蓝紫色为阳性)检测。

图1 磁纳米微粒可视化方法UNVS检测流程图Fig.1 UNVs detection flow chart of magnetic Nanoparticles visualization method
1.3 基因组序列分析
从美国国家生物技术信息中心(NCBI)的GenBank库中下载7种国内外猪常见病原的典型毒株的全基因组序列,并进行全基因组序列比对,根据所比对的同源性结果分别找出复制酶区域高度特异保守片段,用于设计一对特异性识别探针(富集探针、杂交探针)和通用信号放大探针标签。
1.4 特异性识别探针和通用放大探针标签及引物的设计和优化
根据各个病毒的全基因组同源比对结果结合前期研究经验,筛选各个病毒的复制酶区域的高度保守序列作为修饰磁珠和纳米金的一对特异性识别探针(富集探针和杂交探针)的设计位点。利用引物设计软件Primer 5设计特异性磁珠富集探针和纳米金杂交探针以及通用信号放大标签,选出评估最高的探针序列共29条(表1)。将设计的富集探针、杂交探针、通用信号放大探针标签送于生物合成与修饰,其中-NH2修饰富集探针通过酰胺键与MNPs偶联;-SH修饰的杂交探针和放大标签通过-Au-S-键与AuNPs颗粒偶联。以广谱型磁-纳米微粒可视快速检测技术(UNVs)检测目标病毒,进行探针的优选。本研究所用到的探针引物均由安徽通用有限公司合成。

表1 UNVs方法所用到的特异性识别探针和通用标签序列Table 1 Specific recognition probes and generic tag sequences used by UNVs method
1.5 功能化磁珠(MMPs)和纳米金微粒(AUNPs)的制备
将MNPs(100 mg·mL-1,1 μm)用TE缓冲液清洗和MES缓冲液冲洗以稳定pH,随后MES缓冲液重悬。加入与MES等体积的EDC和NHS混合溶液,再加入表1中针对猪7种不同病原分别设计的氨基修饰的特异性富集探针,室温孵育3 h以上,制备成对应病毒不同修饰探针的功能化磁珠,将其重悬于TE缓冲液中,终浓度为10 mg·mL-1,2~8 ℃保存备用。
取1 mL AuNPs(10 nmol·L-1,15 nm)溶液于EP管中以9 000 r·min-1离心50 min,弃去上清后重悬于DEPC水中,随后按杂交探针:Common Tag信号放大探针1∶2,使其终浓度为3 μmol·L-1,分别加入表1中筛选出的针对猪7种不同病毒分别设计的2种不同功能特异性巯基修饰的杂交探针和通用信号放大探针标签,室温孵育48 h以上,孵育期间分3次加入低浓度盐溶液。最后用PBS缓冲液低速离心清洗,并重悬,2~8 ℃保存备用。
1.6 标准检测样品的制备
分别制备已知拷贝数的系列稀释的病毒标准品。首先将病毒标准品在无菌情况下进行外源病毒检验,对检验合格的PCV2、PRV、PPV、PEDV、TGEV、PRRSV和CSFV等病毒进行取样分装,于-80 ℃保存备用。扩增病毒,计算拷贝数,然后置于-80 ℃冰箱中冻存,作为标准检测样本备用。
1.7 阳性对照的制备
将猪7种常见病毒使用Primer 5软件设计目的基因扩增引物,将扩增好的PCR产物目的序列cDNA回收后,连接pMD18-T克隆载体构建成的重组阳性质粒,重组质粒经测序验证后转化至DH5α感受态细胞,随后挑取单克隆菌落,经菌液PCR再次验证后保存于-80 ℃超低温冰箱中,作为阳性对照检测模板。阳性质粒引物序列如表2所示。

表2 UNVs的阳性质粒引物序列Table 2 Positive plasmid primers sequence of UNVs
1.8 定量标准曲线的制备
为了测定所制备的猪7种病毒标准检测样本的拷贝数,在Primer 5中设计扩增引物(表3)。分别测定制备的阳性质粒浓度,根据拷贝数计算公式[拷贝数(copies·mL-1)=6.02×1023(copies·mol-1)×质粒浓度(g·μL-1)/MW(g·mol-1)]分别计算拷贝数。将不同模板按照标准Real time-PCR体系设置3组重复试验并进行扩增,扩增结果使用QuantStudioTMReal-Time PCR Software软件处理qPCR数据,使用Excel软件对Ct值和病毒量,做线性回归模型并绘制标准曲线。

表3 Real-time PCR引物序列Table 3 Real-time PCR primer sequences
1.9 UNVs可视化方法的建立
以特异性标记的MNPs为载体,AuNPs为桥梁,结合工具酶的酶促可视化反应为检测依据,建立7种猪常见病毒的广谱磁纳米微粒可视化的检测方法,主要包括样本中病毒核酸的裂解和释放、核酸的杂交、工具酶的特异性偶联、非特异性吸附的清洗及工具酶的洗脱显色反应这5个环节。
取含有PCV2、PRV、PPV、PEDV、TGEV、PRRSV和CSFV的标准检测样本与等体积的病毒裂解液混合,使病毒核酸充分释放。分别取含有7种病原的产物上清,针对性地加入含有不同病原的富集探针修饰的功能化磁珠和5×杂交缓冲液,混匀后40 ℃杂交50 min;然后向反应体系中分别加入不同病原对应的含有杂交探针和通用信号放大探针修饰的功能化纳米金,50 ℃孵育60 min,形成MMPs-DNA-AuNPs-biotin杂交复合物。清洗残留的杂交液、探针和标签,纯化得到含有生物素(biotin)修饰的DNA标签“三明治”样复合物。在置入100 μL Anti-Biotin/AP酶促反应标签,室温孵育,随后再次磁分离纯化,得到MMPs-DNA-AuNPs-biotion-Anti-Biotin/AP杂交复合物。洗脱下纳米金颗粒表面特异性的酶促反应标签,通过磁分离收集上清,加入BCIPNBT底物,根据显色颜色(蓝紫色为阳性)的深浅或分光光度计检测OD562 nm值来判断样品中病原的含量。碱性磷酸酶酶促反应的OD562 nm值 ≥ 2.1倍健康猪血清时,检测结果成立。
1.10 磁性微粒的核酸快速高效富集技术方法的优化
1.10.1 磁性微粒用量的选择 分别使用功能化磁珠100、200、300、400、500、600 μg,利用PCR检测技术检测功能化磁珠富集到的靶核酸,确定最佳的功能化的磁性微球用量。
1.10.2 裂解体系的优化 主要从裂解体系以及裂解条件两个方面来对裂解液进行筛选优化。
裂解体系的优化:选取含有SDS、硫氰酸胍和盐酸胍3种不同的成分的裂解配比体系,以及有无溶菌酶(1 mg·L-1)和Triton X-100(0.05%)的配比体系,作为裂解液的裂解效果的筛选。
裂解条件的优化:首先采用单因素试验,找到每个因素的最佳用量范围,再选用三水平正交表,设置三因素(pH、温度和时间)三水平正交试验,设置3次重复,即L9(34)。最终裂解评价指标:测定提取DNA的OD260 nm/OD280 nm和浓度。根据裂解评价指标考察裂解液对DNA提取效果的影响,确定裂解条件的最佳组合。
1.10.3 杂交结合体系的优化 使用杂交结合缓冲液(5×SSC、2% SDS、0.5% Tween-20、0.5% Tween-80)的基础上分别加入以PEG-8000(聚乙二醇)、10%硫酸葡聚糖、40%甲酰胺作为杂交结合缓冲液的改良条件,对结合缓冲液的种类进行优化,根据凝胶电泳试验评价不同种类杂交结合缓冲液的结合率。
1.10.4 清洗体系的优化 使用2种清洗液:清洗液Ⅰ(1 mol·L-1PBS)和清洗液Ⅱ(5 mol·L-1PBS)分别以2种清洗次数:清洗2和3次(每组做平行样),清洗磁珠,对清洗体系进行优化。选取等量功能化磁珠在相同条件下和裂解后的核酸杂交结合,以上述两种清洗液和两种不同的清洗次数清洗功能化磁珠。随后检测清洗后的功能化磁珠上富集的核酸的纯度和效率,同时与未清洗之前的功能化磁珠上富集的核酸纯度和效率相对比。根据凝胶电泳试验评价清洗液的清洗效果。
1.10.5 显色体系的优化 首先采用单因素试验设计,找到每个因素的最佳用量范围,再选用三水平正交表,设置三因素(显色温度、显色体积、显色时间)三水平正交试验,设置3次重复,即L9(34)。同样的正交试验定量显色效率的评价方法:在碱性磷酸酶催化底物进行显色(蓝紫色沉淀物的形成)后,仪器测定BCIP/NBT碱性磷酸酶显色底物在562 nm光下的吸收值(OD562nm),并进行统计。
2 结 果
2.1 UNVs可视化探针的优选
首先根据各病毒的复制酶高度保守区域设计特异性识别探针(包括富集探针P1、P2和杂交探针O1、O2),合成后分别标记于MNPs和AuNPs,形成功能化MNPs和AuNPs。分别将各个病毒的2组探针标记的功能化MNPs和AuNPs随机组合试验,标准检测样本作为待检模板,制备好的阳性模板和阴性模板(健康猪血清/粪便)作为对照。根据UNVs可视化检测体系的显色结果和OD562 nm值,分别筛选出针对各病毒的1对具有良好的富集病毒核酸和放大病原信号能力的特异性识别探针。不同特异性识别探针随机组合的酶促可视化反应显色结果,结合OD562 nm值表明UNVs可视化检测中所设计的探针(PPV-P1-O1、PCV2-P1-O2、PRV-P1-O1、CSFV-P1-O1、PRRSV-P2-O1、PEDV-P1-O1、TGEV-P2-O1)检测到相应标准检测样本和阳性模板会有明显颜色(蓝紫色)变化,优于其它的探针和标签,被筛选用于建立7种病毒的UNVs检测技术(图2、表4)。

表4 猪7种病原探针的优选结果OD562 nm值Table 4 Optimization results of 7 swine pathogen probes OD562 nm value
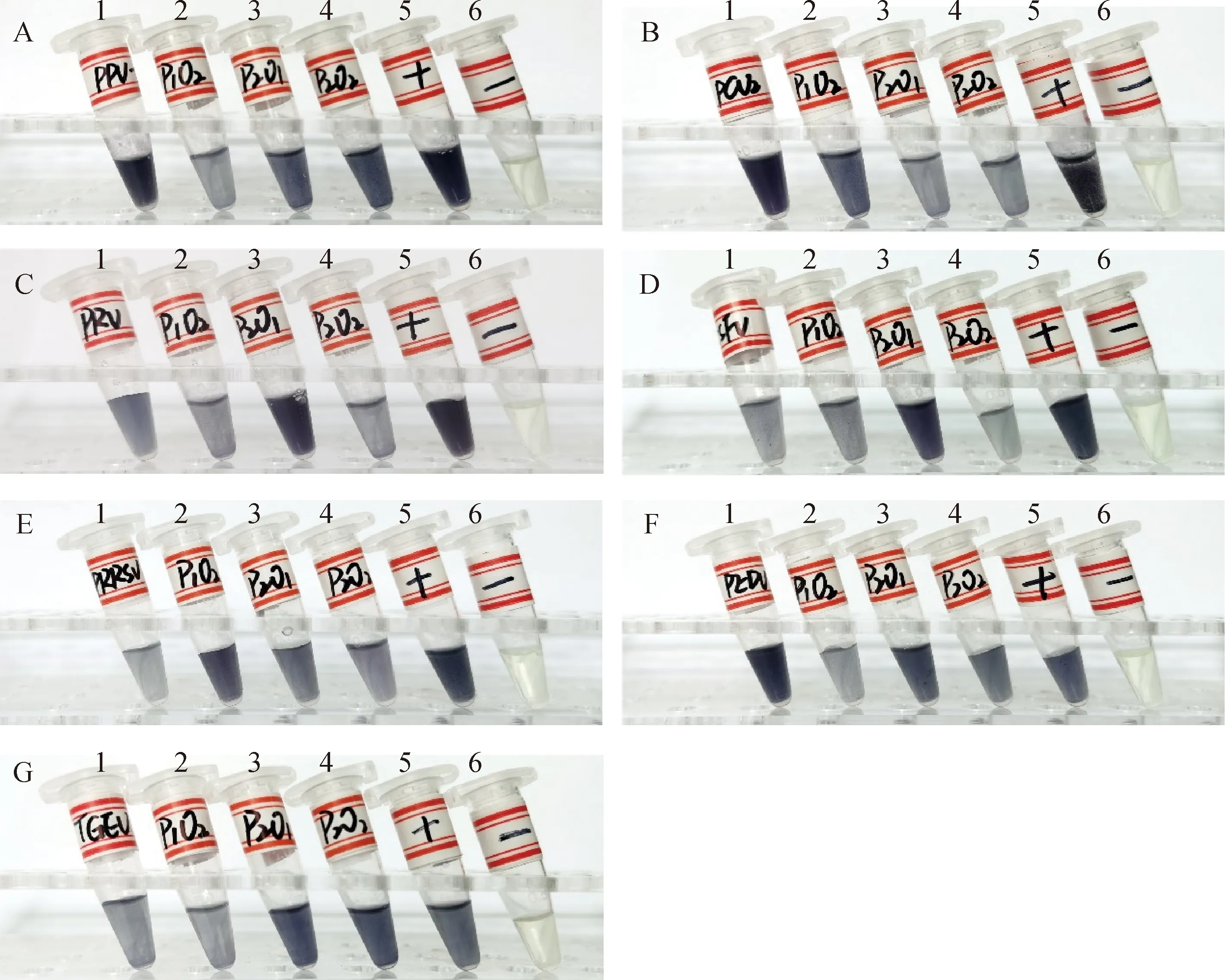
A. PPV;B. PCV2;C. PRV;D. CSFV;E. PRRSV;F. PEDV;G. TGEV;1~6. 从左至右依次为P1+O1、P1+O2、P2+O1、P2+O2、阳性对照PC、阴性对照NCA. PPV; B. PCV2; C. PRV; D. CSFV; E. PRRSV; F. PEDV; G. TGEV; 1-6. From left to right, the samples were P1+O1, P1+O2, P2+O1, P2+O2, Positive control, Negative control, respectively 图2 猪7种病原UNVs可视化试验探针的优选试验结果Fig.2 Optimization results of visual test probes for UNVs of 7 porcine pathogens
2.2 UNVs可视化方法的磁性微粒的核酸快速高效富集技术方法的优化
2.2.1 磁珠用量的选择 以PRV阳性检测样本为例,用上述筛选出的最优的PRV-P1富集探针与磁珠进行耦合,制备特异性功能化磁性微粒。分别选择100、200、300、400、500、600 μg制备好的磁珠(每组做平行样)进行试验,用普通PCR对PRV进行鉴定。结果显示,磁珠使用量在400 μg时即可以达到较好的富集效果(图3)。
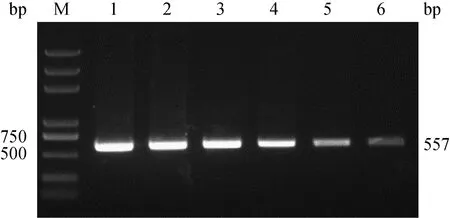
M. DL2000 plus DNA相对分子质量标准;1. 600 μg磁珠;2. 500 μg磁珠;3. 400 μg磁珠;4. 300 μg磁珠;5. 200 μg磁珠;6. 100 μg磁珠M. DL2000 plus DNA marker; 1. 600 μg magnetic beads; 2. 500 μg magnetic beads; 3. 400 μg magnetic beads; 4.300 μg magnetic beads; 5.200 μg magnetic beads; 6.100 μg magnetic beads图3 UNVs磁性微粒的用量图Fig.3 Dosage of UNVs magnetic particles
2.2.2 裂解体系的优化 将不同裂解体系的裂解液和等量PRV标准检测样品在相同条件下裂解,随后使用100 μL 1 mol·L-1PBS重悬,高温解链后异丙醇沉淀纯化。PCR检测所裂解的PRV的核酸量,根据凝胶电泳图来评价不同裂解体系的效果。核酸电泳结果显示,含有盐酸胍、溶菌酶(1 mg·L-1)和Triton X-100(0.05%)的裂解液体系优于SDS和硫氰酸胍的裂解体系(图4)。
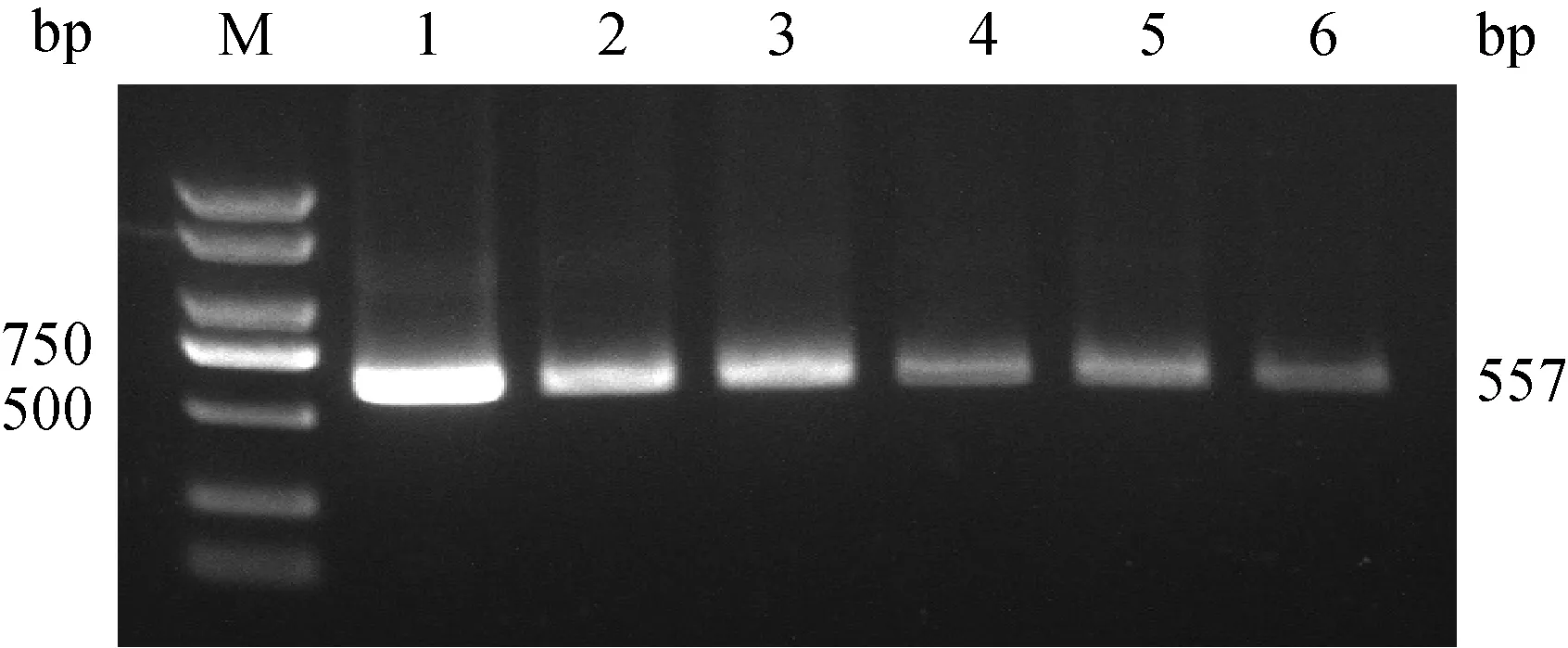
M. DL2000 plus DNA 相对分子质量标准;1. 含有盐酸胍(0.2 mol·L-1)、溶菌酶(1 mg·L-1)和TritonX-100(0.05%)的裂解液体系;2. 含有盐酸胍的裂解液体系;3. 含有硫氰酸胍、溶菌酶(1 mg·L-1)和TritonX-100(0.05%)的裂解液体系;4. 含有硫氰酸胍的裂解液体系;5. 含有SDS、溶菌酶(1 mg·L-1)和TritonX-100(0.05%)的裂解液体系;6. 含有SDS的裂解液体系M. DL2000 plus DNA marker; 1. Cracking liquid system containing guanidine hydrochloride、lysozyme (1 mg·L-1) and TritonX-100 (0.05%); 2. Cracking liquid system containing guanidine hydrochloride; 3. Cracking liquid system containing guanidine thiocyanate, lysozyme (1 mg·L-1) and TritonX-100 (0.05%); 4. Cracking liquid system containing guanidine thiocyanate; 5. Cracking liquid system containing SDS、lysozyme (1 mg·L-1) and TritonX-100 (0.05%); 6. Cracking liquid system containing SDS图4 UNVs裂解液体系的优化Fig.4 Optimization of UNVs cracking fluid system
首先采用单因素试验设计,找到每个因素的最佳用量范围,再选用三水平正交表,设置三因素(pH、温度和时间)三水平正交试验,设置3次重复,即L9(34),正交试验的裂解效果评定采用DNA含量评价方法,即测定DNA在260 nm光下的吸收值(OD260 nm),并计算DNA浓度。采用分光光度法的OD260 nm/OD280 nm比值评价DNA纯度,越接近1.80,DNA纯度越高。单因素正交试验结果显示,pH=7.0~9.0为合适的pH范围,45~100 ℃为合适的温度时间范围,10~30 min为合适的裂解时间范围。三因素三水平正交试验结果显示,在pH=8.0时,100 ℃条件下裂解10 min,为理论最佳裂解条件,与实测裂解效果也无差异。
2.2.3 杂交结合体系的优化 在使用杂交结合缓冲液(5×SSC,2% SDS,0.5% Tween-20,0.5% Tween-80)的基础上,分别加入以PEG-8000(聚乙二醇)、10%硫酸葡聚糖、40%甲酰胺作为杂交结合缓冲液的改良条件,对结合缓冲液的种类进行优化。结果显示,在相同的磁珠用量、裂解条件和杂交结合条件下,含有40%甲酰胺的结合体系优于PEG-8000(聚乙二醇)和10%硫酸葡聚糖的结合体系(图5)。
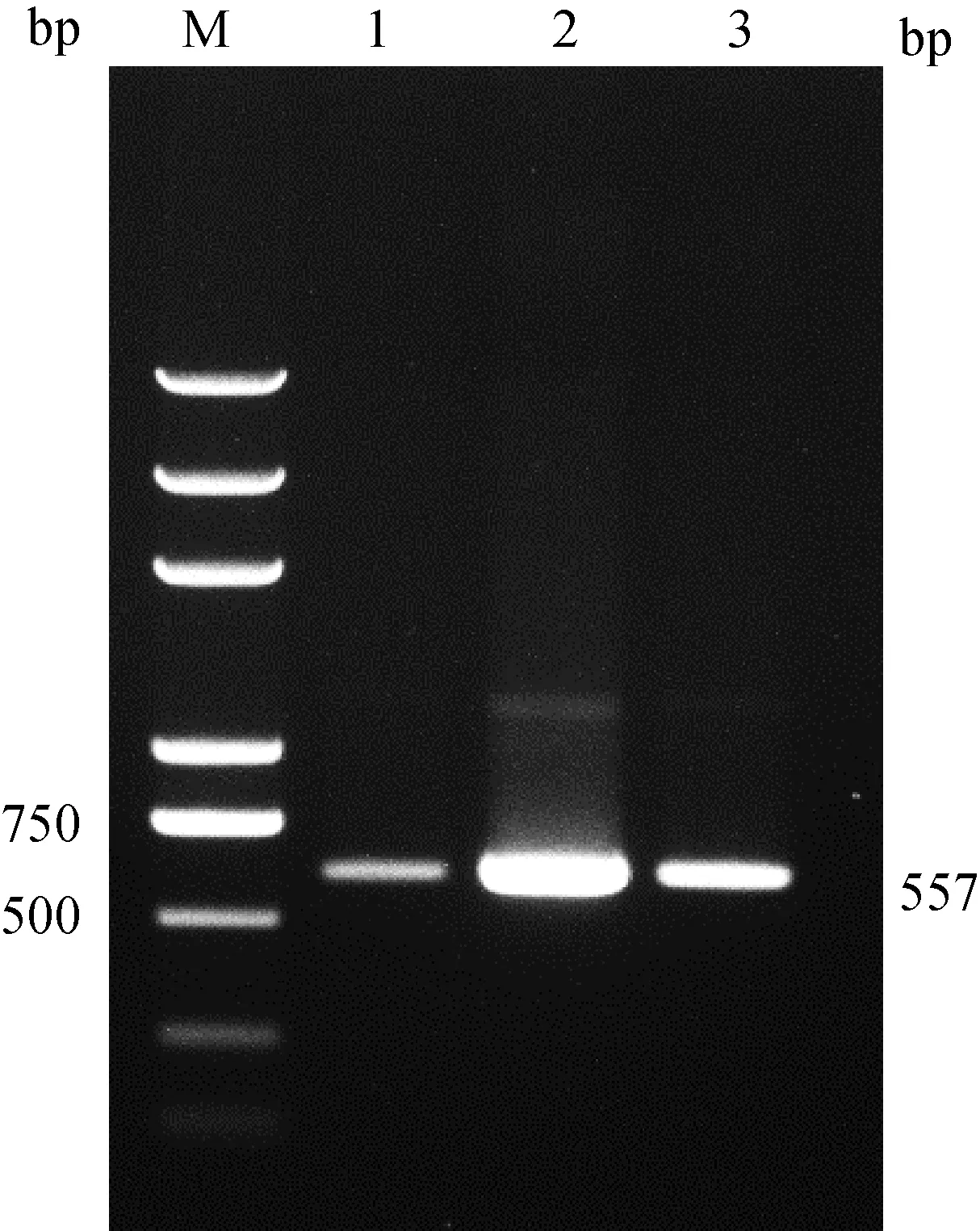
M. DL2000 plus DNA相对分子质量标准;1. 含有PEG-8000(聚乙二醇)的结合体系;2. 含有40%甲酰胺的结合体系3. 含有10%硫酸葡聚糖的结合体系M. DL2000 plus DNA marker; 1. The binding system containing PEG-8000 (polyethylene glycol); 2. The binding system containing 40% formamide; 3. The binding system containing 10% dextran sulfate图5 UNVs结合体系的优化图Fig.5 Optimization diagram of UNVs combined system
2.2.4 清洗体系的优化 用2种清洗液:清洗液Ⅰ(1 mol·L-1PBS)、和清洗液Ⅱ(5 mol·L-1PBS)分别以两种清洗次数:清洗2和3次(每组做平行样)。结果显示,与清洗之前的功能化磁珠(PRV-P1)所富集的核酸量相比,清洗液Ⅰ(1 mol·L-1PBS)优于清洗液Ⅱ,清洗次数2次优于3次(图6)。
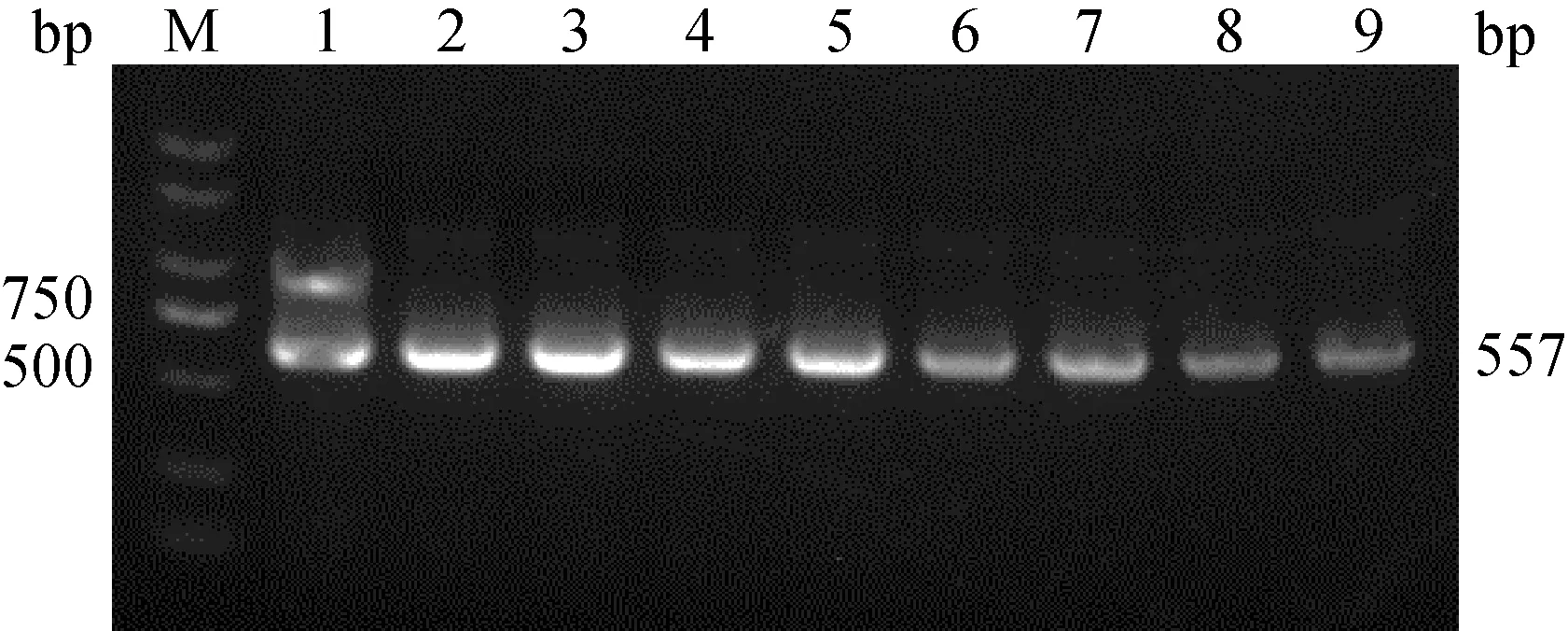
M. DL2000 plus DNA相对分子质量标准;1. 未清洗;2、3. 清洗液Ⅰ(1 mol·L-1 PBS)清洗2次;4、5.清洗液Ⅰ(1 mol·L-1 PBS)清洗3次;6、7. 清洗液Ⅱ(5 mol·L-1 PBS)清洗2次;8、9. 清洗液Ⅱ(5 mol·L-1 PBS)清洗3次M. DL2000 plus DNA marker; 1. Uncleaned; 2, 3. Cleaning liquid Ⅰ (1 mol·L-1 PBS) clean twice; 4、5. Cleaning liquid Ⅰ (1 mol·L-1 PBS) clean three times; 6, 7. Cleaning liquid Ⅱ (5 mol·L-1 PBS) clean twice; 8, 9. Cleaning liquid Ⅱ (5 mol·L-1 PBS) clean three times图6 UNVs清洗体系的优化图Fig.6 Optimization diagram of UNVs cleaning system
2.2.5 显色体系的优化 针对显色温度、显色体积、显色时间三个因素,通过正交试验对显色体系进行优化,并对每个因素选择三个水平。单因素正交试验结果表明,合适的显色体积为100~300 μL,合适的显色温度为25~45 ℃,合适的显色时间范围为10~60 min(表5)。三因素三水平正交试验结果显示,显色时间和温度有较大的影响,在显色缓冲液体积200 μL、37 ℃、60 min时为理论最佳试验组合显色体系(表6),与实测结果无差异。

表5 显色体系的单因素试验Table 5 Single factor test design of color system
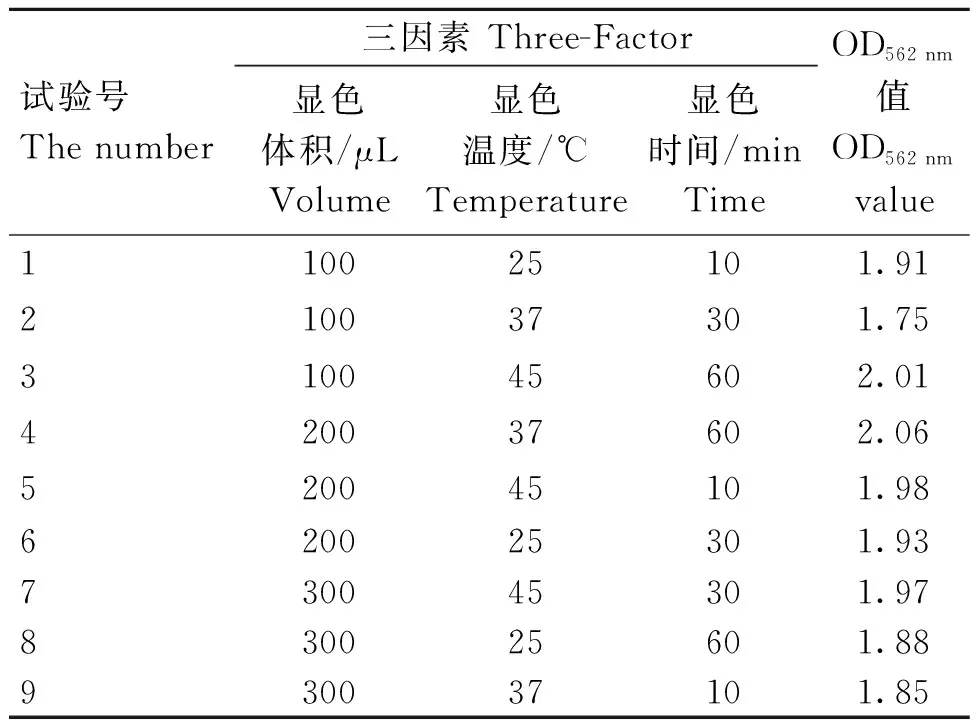
表6 显色体系的正交试验结果Table 6 Orthogonal experimental result of color system
2.3 UNVs的特异性
选取上述筛选好的15条特异性识别探针,按所建立的UNVs方法进行检测,分别以仅包含PCV2、PRV、PPV、PEDV、TGEV、PRRSV和CSFV的标准检测样品,作为待检样品。其中qPCR检测的PPV标准检测样品的病毒量为7.49×107copies·mL-1,TGEV标准检测样品的病毒量为4.63×107copies·mL-1,PRV标准检测样品的病毒量为6.398×108copies·mL-1,PEDV标准检测样品的病毒量为6.0×106copies·mL-1,PCV2标准检测样品的病毒量为4.24×106copies·mL-1,PRRSV标准检测样品的病毒量为7.59×106copies·mL-1,CSFV标准检测样品的病毒量为7.62×105copies·mL-1。阳性模板以CSFV、PRRSV、PCV2、PPV、PRV、PEDV和TGEV的重组阳性质粒107copies·mL-1作为阳性对照和阴性对照(混合入健康猪血清/粪便)。结果显示,所设计的针对不同病毒的UNVs特异性探针均只对针对的病毒具有阳性反应,而其它检测样本和阴性对照无明显阳性反应,特异性结果成立(表7)。
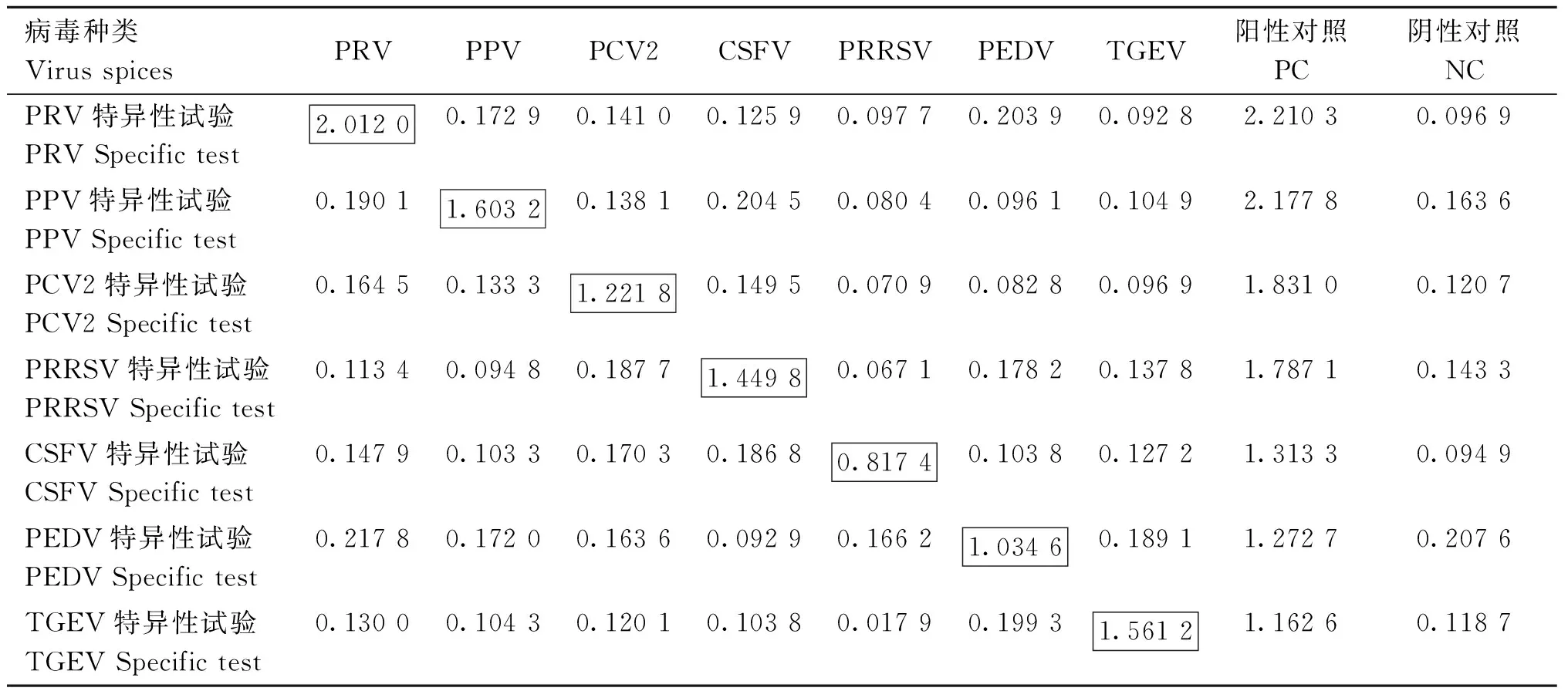
表7 UNVs可视化方法特异性OD562 nm值Table 7 The UNVs visualization method is specific to OD562 nm values
2.4 UNVs的灵敏度
为了确定本发明的磁纳米微粒可视化诊断方法的最小检出量,分别对含有不同病毒的标准检测样品进行定量检测并计算病毒拷贝数,然后根据每种病毒标准检测样品的既定浓度,将病毒用无污染的健康猪血清梯度稀释为4×105、4×104、4×103、3×103、2×103、1×103、6×102及4×102copies·mL-1共8个浓度梯度,作为各个病毒的灵敏度的标准检测样品,选取优选的15条特异性识别探针,按照所建立的UNVs方法进行检测。结果显示,在样品最低检测浓度103copies·mL-1时颜色变化较为显著,同时OD562 nm值 ≥ 2.1倍阴性对照,检测结果成立(表8)。表明本发明的磁纳米微粒可视化诊断方法具有较广的检测范围,最低检测限至少为103copies·mL-1。
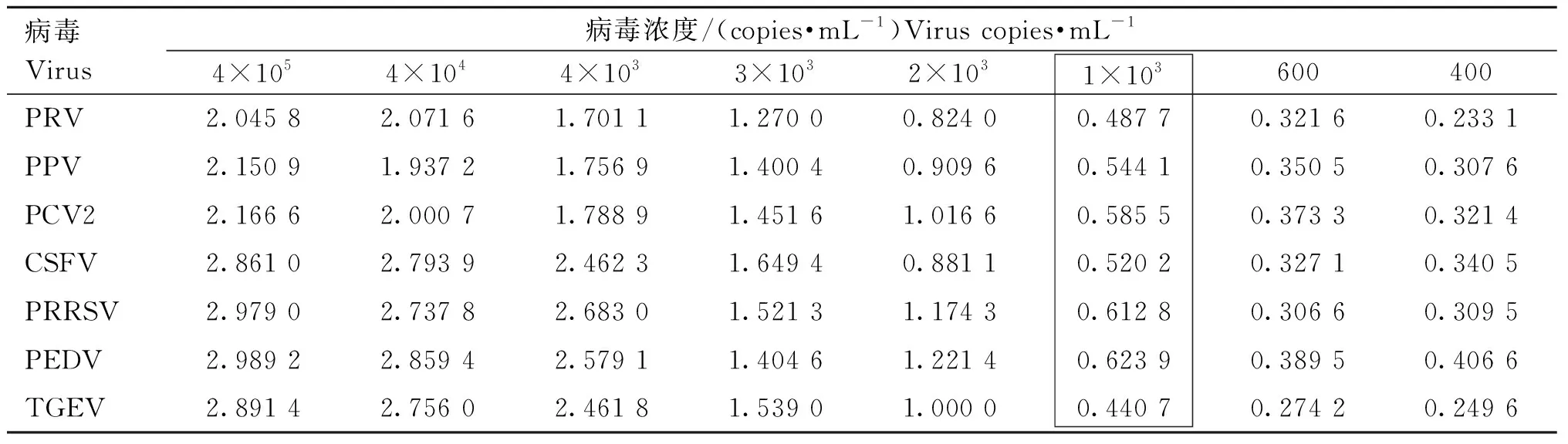
表8 UNVs可视化方法灵敏度的OD562 nm值Table 8 OD562 nm value of UNVs visualization technology sensitivity
2.5 UNVs的重复性
分别选取7种病毒的3个不同稀释浓度标准检测样品(分别为4×104、2×103、1×103copies·mL-1),按照所建立的UNVs方法分别进行检测。通过同一试验内和不同试验间的同一样品的OD562 nm值变异系数(标准偏差/重复值的平均数)来初步评估该方法的重复性。三次重复试验,并进行组内重复,统计所测得的OD562 nm值;另外每30 d做一次试验,每次3个,重复3次,统计所测得的OD562 nm值,计算平均值,进行组间重复试验,得到磁纳米微粒可视化重复性检测结果。利用DPS统计软件对不同病毒拷贝数在同一次试验和不同试验间得到的OD562 nm值进行统计学分析。结果显示,选取标准检测样本所进行的组内与组间重复性试验显色结果均稳定,无较大差异,有良好的重复性。统计数据显示,针对CSFV、PRRSV、PRV、PPV、PCV2、PEDV、TGEV的检测方法组内与组间的最大变异系数均小于5%,说明其组内与组间重复性良好(表9)。
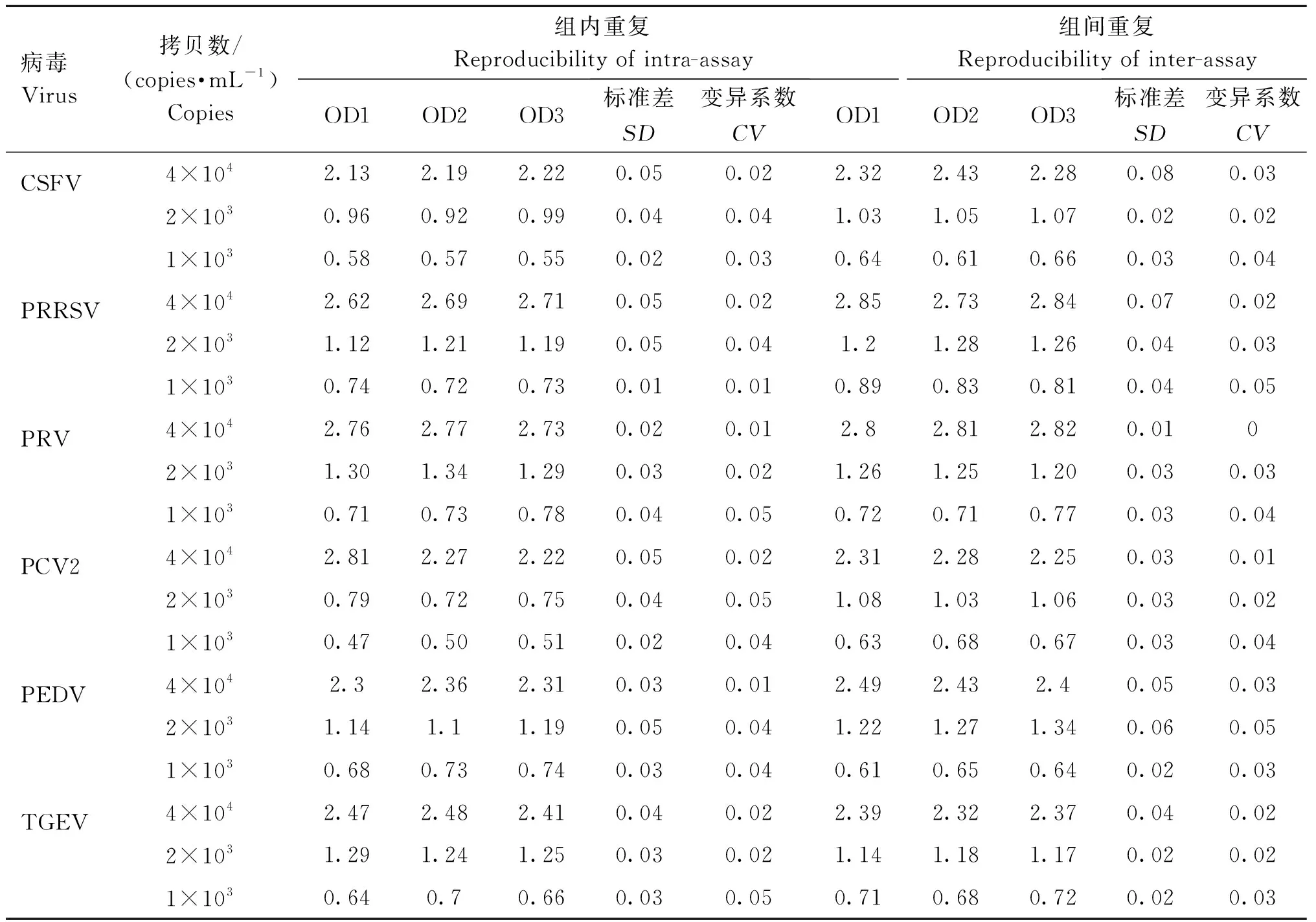
表9 UNVs可视化方法的重复性结果(OD562 nm)Table 9 Repeatability results of unvs visualization methods (OD562 nm)
2.6 猪7种常见病原UNVs和普通PCR的临床样本检测
以本研究建立的广谱磁纳米微粒UNVs可视化技术与普通PCR检测方法对来自陕西省的499份临床样品(疑患有PCV2、PRV、PPV、PEDV、TGEV、PRRSV和CSFV的猪的血清、粪便样品)进行同步检测,结果见表10,广谱磁纳米微粒可视化UNVs试验中PCV2阳性检出率为31.67%(19/60)、PPV阳性检出率为33.30%(17/51)、PRV阳性检出率为26.30%(20/76)、CSFV阳性检出率为36.14%(30/83)、PRRSV阳性检出率为35.40%(28/79)、PEDV阳性检出率为39.70%(27/68)和TGEV阳性检出率为35.40%(29/82)。普通PCR的阳性检出率均低于光谱纳米微粒可视化UNVs的阳性检出率。

表10 磁纳米微粒可视化UNVs检测和普通PCR检测临床样品统计Table 10 Magnetic nanoparticles visualized UNVs detection and common PCR detection of clinical samples statistics
为进一步验证磁纳米微粒可视化诊断方法检测的准确性,对上述UNVs方法和普通PCR的检测检测结果平行比对后,找出不一致的临床样本,即UNVs方法检测为阳性结果,而普通PCR检测为阴性结果的样品,分别进行UNVs和PCR重复检测。结果分别与第一次试验结果一致。对这些样品进行Real time-PCR重复检测,结果均为阳性(Ct值均在15~30可信范围内),与UNVs方法检测结果一致。
3 讨 论
随着生猪生产养殖规模的扩大,生猪疾病已经对我国养猪业产生了巨大的影响。本研究中包含的7种病毒(PCV2、PRV、PPV、PEDV、TGEV、PRRSV和CSFV)常表现为多种病原的单独、混合感染,造成更大的经济损失。临床亟需一种能对这些病原进行早期、快速、准确检测的技术,以便制定有针对性的防控方案,进而更好地防控这些病原导致的疾病。目前猪常见病原检测技术有病原的分离技术[23]、血清学和免疫学技术[24]以及分子诊断技术[25]。其中病原分离是一种相对费时费力的方法,必须在高安全度的生物实验室中进行[26]。血清学和免疫学技术中酶联免疫吸附技术主要用于检测感染或免疫后的抗体水平,检测所需抗体一般在1周后产生,检测所需时间更长,无法在感染早期进行检测[27]。分子诊断分析目前被认为是最可靠的检测方法,如常规PCR和荧光定量PCR技术。许多逆转录聚合酶链反应(RT-PCR和Real-time RT-PCR)方法已被广泛报道用于猪常见病原的检测[28],但是这些方法因为其操作的复杂性,只能在实验室进行,太过于依靠设备和良好训练的技术人员,而不适用于设备不足的现场检测[29]。
纳米技术作为一个多学科交叉前沿领域,涵盖工程、生物、化学和物理等。自1959年初提出后,各种新型材料被应用于纳米技术,由于具有多种独特的光学、电子、磁性和力学特性,新材料迅速成为生物和化学分析的有前途的工具[30]。其中纳米医学是涉及纳米技术应用的一个新的医学领域,与传统的药物、检测方法相比,纳米材料由于独特的结构和优异的性能具有显著的临床疗效、非靶点毒性更小、治疗效果更好,有望进一步提高灵敏度和检出限,满足检测手段早期、快速和准确诊断的需求[15]。迄今为止,已成功合成并探索了各种不同形态的AuNPs,如纳米球、纳米棒、纳米星、纳米金字塔和纳米花[17]。
AuNPs具有独特的化学、物理和光学性质,在医学成像、药物递送和疾病检测等领域有着广泛的应用前景[18]。此外,磁性纳米粒子(MNPs)生物传感器由于其生产成本低、理化稳定性好、较好的生物相容性和低毒性等特点,受到了人们的广泛关注[31]。MNPs与小分子有机荧光染料、量子点、荧光蛋白等传统荧光材料相比,具有光稳定性高、荧光波长可调、生物相容性好、制备简单等优点,因此被广泛应用于小分子和蛋白质的检测以及细胞标记和成像[32]。2018年,Ning等[33]设计了一个可以直接检测 CSFV 的纳米金粒子的探针,AuNPs 与一对特异性识别和捕获 CSFV 的 RNA 的互补 DNA 序列结合产生荧光信号,通过纳米信号的荧光增强检测 CSFV 特定的 RNA 序列,在感染猪瘟的病例中成功检测出了 CFSV。Hamdy 等[34]设计了一种新型的 AuNPs生物传感器,该传感器使用硫醇连接的寡核苷酸来识别猪口蹄疫病毒(FMDV)保守的 3D 基因,且表现出良好的分析能力和临床应用价值。本研究以新型材料四氧化三铁磁性微粒为载体,纳米金为桥梁,结合碱性磷酸酶的酶促可视化反应为检测依据,建立了可用于现场诊断的猪7种常见病原的磁纳米微粒可视化检测方法。本研究设计采用两个特异性识别探针同时检测病原核酸,大大提高了准确性,具有特异性强、富集效率和杂交效率高的特点。此外,该方法通过通用信号放大探针上的碱性磷酸酶催化底物进行显色,酶促反应显色结果可直接进行观察,进而判断样品是否存在待检测病原。检测流程操作简单,具有快速、准确、简单、特异、直观等优点。
4 结 论
本研究建立了一种对PCV2、PRV、PPV、PEDV、TGEV、PRRSV和CSFV具有检测灵敏度较高、检测范围较广以及特异性和可靠性良好的广谱磁纳米微粒可视化检测方法,检测限为103copies·mL-1(血清样本)或103copies·g-1(粪便样本),基本上达到了PCR或RT-PCR的检测敏感度,灵敏度组内与组间最大变异系数均小于5%,显色结果稳定,无较大差异,有良好的重复性,单个样本的检测可在4 h以内完成,为猪重要病毒性疫病的早期诊断和防控提供了良好的技术支撑。

