广东惠州地区体检人群乙醛脱氢酶2 基因多态性分析
邓韵婷,车玉传,黄海勇,陈嘉明,吴显劲(惠州市中心人民医院检验中心,广东惠州 516001)
人线粒体乙醛脱氢酶2(acetaldehyde dehydrogenase 2,ALDH2)由ALDH2基因编码,该基因位于12 号染色体(12q24.2)上,由13 个外显子组成。ALDH2基因存在单核苷酸多态性(single nucleotide polymorphism,SNP)位点,其中以rs671 位点最为重要,出现在第12 外显子中,即1510 G>A 突变(ALDH2*2),使酶的第504 位氨基酸由谷氨酸(Glu)变为赖氨酸(Lys),导致蛋白质空间结构改变,从而影响酶的活性[1]。ALDH2基因型包括野生型GG(ALDH2*1/*1),其具有正常的酶催化活性;杂合突变型GA(ALDH2*1/*2),其只有约10%~45%的酶催化活性;纯合突变型AA(ALDH2*2/*2),其催化活性仅为1%~5%[2]。ALDH2 是酒精代谢过程中的关键酶,在体内酒精主要在肝脏代谢,先经过乙醇脱氢酶途径产生有毒产物乙醛,乙醛则由乙醛脱氢酶转化为无毒乙酸,最终代谢为水和二氧化碳,从而达到解毒作用[3]。ALDH2 对于体内氧化应激诱导的脂质衍生醛产物(如4-羟基壬烯酸等)的去除也发挥了重要作用,保护组织和细胞免受氧化损伤[4]。ALDH2基因rs671 位点突变导致的酶活性的减弱或丧失,使体内乙醛不能有效快速的转化,尤其在摄入酒精状态下,乙醛在体内蓄积,引发酒精性相关的肝脏疾病[3]。此外,ALDH2rs671 基因多态性与心血管疾病[4]、糖尿病[5]、癌症[6]、神经变性病[7]等的发生或发展具有一定联系。ALDH2同时还具有酯酶的活性,是催化硝酸甘油类药物在体内转化为一氧化氮,从而发挥药效的重要酶[8]。ALDH2rs671 基因多态性也影响个体使用硝酸甘油的药效。本研究通过检测惠州地区体检人群ALDH2rs671 基因型,分析惠州地区ALDH2基因多态性分布情况,以期为酒精危害防治、硝酸甘油的使用药效判断以及对疾病的发病风险评估提供数据参考。
1 资料与方法
1.1 研究对象 回顾性分析2021 年7 月至2022年10 月在惠州市中心人民医院进行ALDH2基因多态性检测且无血缘关系的体检健康人群样本2 057例,年龄16~83 岁,中位年龄47 岁。
1.2 试剂与仪器ALDH2基因突变检测试剂盒(PCR-荧光探针法,北京乐普诊断科技股份有限公司),7500 荧光定量PCR 仪(美国ABI 公司)。
1.3 方法 采集各受检者就诊时的EDTA-K2抗凝血1 mL,按照试剂盒说明书配制并分装ALDH2-G和ALDH2-A 反应液,加入1 μL 全血DNA 模板,按以下条件进行PCR 扩增:95 ℃5 min;98 ℃10 s,60 ℃40 s(检测荧光信号),45 个循环。根据样本在ALDH2-G 管和ALDH2-A 管扩增曲线的Ct 差值,定义ALDH2分型。试剂的分型设计基于SNP 位点设计的特异性引物,即3'端最后1 个碱基为野生型碱基或突变型碱基。野生型引物在野生型样本中与靶标完全匹配,其扩增效率高(Ct 值小),而突变型引物与野生型样本在3'端存在1 个碱基的差异,导致其在野生型样本中的扩增失败或扩增效率低(Ct 值大);反之,在纯合突变型样本中,则突变型引物的扩增效率高于野生型引物,即突变型引物扩增的Ct 值小于野生型引物的Ct 值;若样本的靶标是杂合型,则野生型引物和突变型引物的扩增效率相当,即两者的Ct 值接近。通过扩增效率差值判断纯合或杂合,其中野生型GG:CtA-CtG>5;杂合突变型GA:|CtG-CtA|<3;纯合突变型AA:CtGCtA>5。
1.4 统计学分析 使用SPSS 25.0 软件进行统计学分析,计数资料以率(%)表示。基因型频率Hardy-Weinberg遗传平衡分析采用χ2检验,不同年龄组ALDH2基因型分布采用Kruskal-WallisH检验,并将惠州地区ALDH2基因型分布频率分别与文献报道的其他国家及地区的ALDH2基因型分布频率进行比较,两地区间基因多态性频率分布的差异比较采用2×2 列表的χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1ALDH2G1510A 基因分型结果 本研究样本检出的ALDH2基因型共有3 种,分别为野生型GG:ALDH2*1/*1;杂合突变型GA:ALDH2*1/*2;纯合突变型AA:ALDH2*2/*2。
2.2 体检人群ALDH2G1510A 基因分型结果和Hardy-Weinberg 遗传平衡分析 2 057 例体检人群样本ALDH2rs671 基因型结果见表1,基因型GG频率为58.48%,GA 频率为35.88%,AA 频率为5.64%;ALDH2G 等位基因和A 等位基因的频率分别为76.42%和23.58%。对基因型检测数据进行Hardy-Weinberg 遗传平衡分析,差异无统计学意义(χ2=0.025,P=0.988),本次检测结果符合Hardy-Weinberg 遗传平衡,样本具有区域群体代表性。
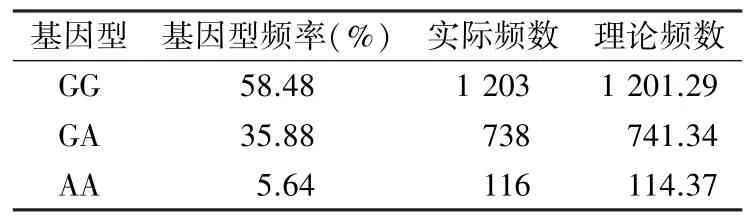
表1 Hardy-Weinberg 遗传平衡检验
2.3 本地区不同年龄组体检人群ALDH2rs671 基因型分布情况 本次研究以每10 岁分为1 个年龄组,30 岁及以下和60 岁及以上各单独分为1 个年龄组,将研究人群分为5 个年龄组,不同年龄组基因型分布进行Kruskal-WallisH检验,其差异无统计学意义(P=0.488),结果见表2。
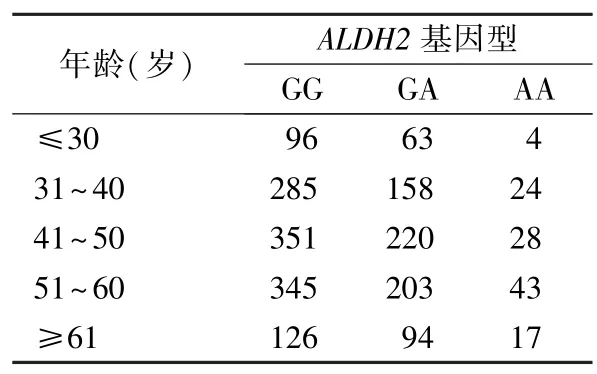
表2 惠州地区不同年龄组人群ALDH2 rs671 基因型分布情况(n)
2.4 本地区与我国其他地区及邻国ALDH2rs671基因型分布情况的比较 本地区与江苏、湖南省比较,ALDH2基因型分布差异无统计学意义(P>0.05),但与北京、四川、山东和山西等省市比较差异有统计学意义(P<0.05),此外,与日本、韩国、泰国等国家比较差异亦有统计学意义(P<0.05),结果见表3。
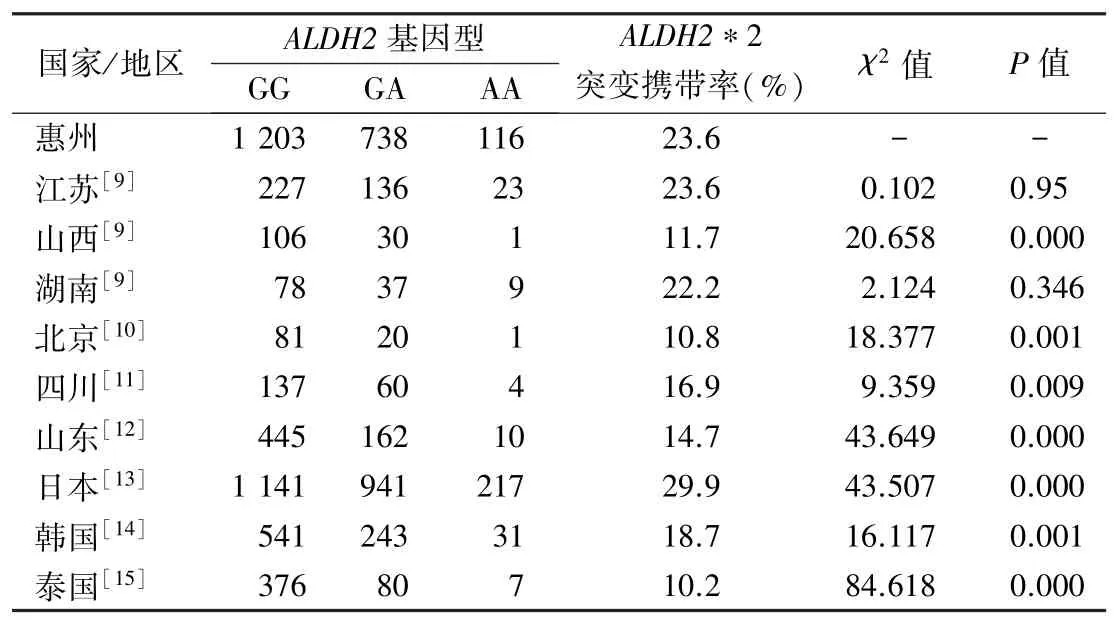
表3 惠州与我国其他地区及邻国ALDH2 rs671 基因型分布情况比较(n)
3 讨论
ALDH2 主要存在于肝脏、肾、心、肺、脑和其他组织细胞的线粒体中。肝脏是酒精代谢的主要器官,而ALDH2 是酒精代谢过程中的关键酶,负责酒精代谢过程中产生的有毒产物乙醛的转化。就酒精摄入而言,纯合型基因ALDH2*2/*2 患者ALDH2 活性缺失,不能代谢乙醛,而杂合型基因ALDH2*1/*2代谢乙醛能力急剧降低(损失>90%活性)[16]。携带*2 等位基因人群饮酒后血乙醛浓度达峰时间较携带*1 等位基因的人群提前,且饮酒后1~6 h血乙醛浓度高于携带*1 等位基因的人群[17]。醛分子非常活泼且不稳定,能与细胞组分迅速反应,产生无生理功能的醛加合物[16],形成的醛加合物不断累积,引起细胞功能障碍,从而引起各种疾病发生。对于携带*2 等位基因人群,由于乙醛在细胞中过度积累,会产生脸红反应、潮红伴有头痛、出汗、心动过速、心悸、恶心,之后出现嗜睡等各种不适[16],尤其是纯合携带者,所以纯合携带者反而不容易酗酒,成为1 个保护因素。但对于携带突变基因的个体若长期保持喝酒行为,乙醛在肝细胞大量蓄积,乙醛及其衍生加合物引发肝细胞损伤,引起肝脏炎症、纤维化、脂肪变性、肝硬化等酒精性相关的肝脏疾病甚至肝癌[3,16]。携带突变基因加上饮酒因素还可使上呼吸道/消化道(包括口腔、口咽、下咽、喉和食管)、胃部、结直肠等部位患癌风险增加[6]。因此,对于携带*2 突变的个体应限制饮酒,尤其纯合突变个体更应远离酒精。
ALDH2基因多态性的检测对于心血管疾病的治疗也有重要意义。硝酸甘油(甘油三硝酸酯,GTN)是治疗急性心绞痛和慢性心力衰竭时最常用的药物。舌下含服硝酸甘油是大众医学科普中为人熟知的“心痛救命药”。ALDH2 同时具有硝酸酯酶活性,是负责体内GTN 生物转化为一氧化氮(NO)的酶,从而引发cGMP 介导的血管舒张而起效。当ALDH2 酶活性下降或者受抑制时,不能产生足够浓度的NO 达到保护心脏的作用[8]。对于携带*2 突变个体,由于酯酶活性的急剧下降,舌下含服硝酸甘油很可能失效,从而延误治疗的时间。因此,对于有心绞痛病史的患者应进行ALDH2基因多态性的筛查,突变携带者避免使用硝酸酯类药物。ALDH2 对于机体应激状态下产生的内生醛(如4-羟基壬烯醛和丙二醛等)的清除也发挥重要作用,可避免后续的氧化损伤。有研究发现在急性心肌梗死(acute myocardial infarction,AMI)发生时缺血再灌注(I/R)过程中形成大量的醛可导致有害的级联反应,损害心功能并引起心律失常。及时使用ALDH2 激活剂(如Alda-1)可以极大地提高ALDH2的活性,激活的ALDH2 可以去除更多有毒的醛,并通过不同的信号通路产生心脏保护作用,这对ALDH2*2 携带者特别重要[4,18]。有心血管疾病的人群进行ALDH2基因多态性检测,可指导硝酸甘油的个体化用药,避免药物使用无效,并且在发生心梗等心血管事件时可指导临床的治疗。Jiang 等[19]通过多中心病例对照分析,发现即使在不饮酒的中国人群中,ALDH2变异也与AMI 的风险相关,提示ALDH2变异可能是AMI 的独立危险因素。Nannelli 等[20]概述了ALDH2 在维持内皮细胞功能上的重要作用,证实其活性改变与氧化应激和衰老相关,并参与衰老相关的动脉粥样硬化和神经退行性疾病的发展,ALDH2rs671 可能成为这些疾病预防或治疗的靶点。
ALDH2基因多态性存在种族差异和地域差异。白种人和非洲人群突变携带率很低,主要为亚洲黄种人群携带,在世界范围内ALDH2基因多态性突变主要集中在东亚(如中国、日本、韩国等),大约40%的东亚人口携带,约占世界人口的8%。研究表明ALDH2*2 突变体可追溯到我国中原地区的汉族祖先,在随后的几千年里随着人群南迁并在东亚地区继续传播[21]。在我国不同民族间携带率也存在差异,汉族是携带突变的主要人群,蒙古族或维吾尔族发生率较低[21]。不同地区间的汉族人群ALDH2基因突变携带率也有差异[7-10],东南部的闽南和粤东地区的汉族(客家人和闽南人)携带率最高[21]。携带率整体呈现南高北低的趋势,南方地区*2 等位基因携带率高于北方[22],东南部的频率最高,并从东南部开始频率呈放射状逐渐下降[21]。本研究中惠州地区携带率高于北京、山东、山西等北方地区,差异有统计学意义,而与江苏、湖南等南方地区的差异无统计学意义,但与四川比较存在差异,符合南方地区*2 等位基因携带率高于北方地区的趋势,但南方地区不同省份间还是存在差异,东南部携带率比西南部高。其机制可能与气候、环境、社会文化等因素相关[23]。惠州地区携带率与邻国日本、韩国、泰国等也存在差异,日本携带率更高,韩国的携带率较低,泰国的携带率更低,这种差异可能与种族起源、遗传漂移和地理环境分布有关[23]。惠州地区处在客家文化、广府文化和潮汕文化的交汇地带,各种文化的交流促使人口的流动,也可能形成本地区特有的基因遗传多态性分布。本研究提供了惠州地区体检人群ALDH2*2等位基因流行率的报告,为研究本地区的ALDH2基因遗传多态性分布提供必要的数据。惠州地区杂合突变型(GA)和纯合突变型(AA)个体占总研究群体的41.52%,有着较高的突变携带率,在本地区进行个体ALDH2基因多态性的筛查,找出突变携带者以便进行必要的健康指导,具有非常重要的意义。
本文为回顾性研究,选取的是进行ALDH2基因多态性检测的体检人群,研究对象年龄段集中在30 至60 岁间,将该人群分为5 个年龄组,结果显示每一年龄组间ALDH2基因型多态性分布没有明显差异。本研究收集的2 057 例基因型检测数据符合Hardy-Weinberg 遗传平衡,说明本样本具有区域群体代表性。但本研究只进行了人群中ALDH2基因多态性的分布特点分析,后续将深入研究不同基因型别人群具体的体检检测指标的差异,探讨ALDH2基因多态性对于人群基础健康水平是否有影响。

