过瘤胃烟酰胺对育肥羊肠道形态、屏障和转运功能以及挥发性脂肪酸含量的影响
张艺伟 马智聪* 韩 强 褚玲娜 李浙烽 冯长东 吴 昊 王 翀** 魏筱诗**
(1.浙江农林大学动物科技学院·动物医学院,杭州 311300;2.浙江省长兴县农业农村局,长兴 313100;3.长兴县畜牧兽医站,长兴 313199;4. 杭州康德权饲料有限公司,杭州 311107)
湖羊是我国一级保护地方畜禽品种[1],今广泛存在太湖流域及临近地区[2-3],具有发育快、性早熟、四季发情、多胎且耐高温高湿等优良性状[4-5]。湖羊产业链对我国羊肉、羊毛、羔皮等贡献巨大[6]。内蒙古、新疆、甘肃、贵州等省区实施退耕还草工程时需引进优良品种,湖羊成为首选品种之一,浙江湖州的供种量约10万头以上,可占到整省供给的65%[7-8]。湖羊是浙江优势地方品种,省内以湖州居多,在2015年农业部批准对“湖州湖羊”实施国家农产品地理标志登记保护。
肠道是反刍动物重要的消化器官,大量的过瘤胃营养物质在后肠道消化吸收[9],小肠营养素转运载体的表达可影响过瘤胃营养物质在肠道的转运,从而影响机体的生长发育和新陈代谢[10-12]。此外,肠道上皮是机体抵御外源性病原体的重要屏障[13-14]。因此,肠道的健康及其组织结构的完整性,对于反刍动物的生产性能、营养物质消化吸收与屏障抵御功能有重要作用[15]。
烟酰胺(nicotinamide, NAM)是维生素B3的衍生物[16-17],作为辅酶Ⅰ与辅酶Ⅱ的前体物质参与脂代谢、糖代谢以及蛋白质代谢[18-21]。研究表明,NAM能改善肉鸡空肠黏膜形态结构,促进消化吸收,并改善小肠的黏膜形态结构[22]。此外,补饲NAM可促进羔羊小肠形态发育,提高空肠葡萄糖转运载体葡萄糖转运蛋白2(GLUT2)、钠-葡萄糖共同转运体1(SGLT1)和回肠GLUT2的基因相对表达量[23]。前期研究中发现,补饲过瘤胃烟酰胺(rumen protected NAM,RPN)能够显著增加育肥湖羊平均日增重及心脏、肝脏和脾脏重量,显著提高肝脏指数以及胴体重,并且显著降低育肥湖羊背最长肌的黄度值,改善其屠宰性能[24]。本试验在前期研究的基础上,探究RPN对育肥湖羊肠道结构形态、屏障功能、转运载体表达以及后肠道内容物挥发性脂肪酸(volatile fatty acid, VFA)含量的影响,旨在为NAM在湖羊生产中的应用提供新的思路。
1 材料与方法
1.1 试验设计及饲养管理
选取16只体况良好、体重[(20.45±1.18) kg]相近的健康育肥公湖羊,随机分为2组,分别为对照组(饲喂基础饲粮)和试验组(额外添加1 g/d RPN),每组8只。RPN由杭州某饲料有限公司提供(NAM含量为60%,过瘤胃率为83.6%)。RPN于每日08:00晨饲前撒在一小部分基础饲粮上,用手诱导湖羊采食,保证湖羊采食完全后再饲喂基础饲粮。基础饲粮每日饲喂2次(08:00和14:00),湖羊自由进食和饮水。预试期7 d,正试期90 d。基础饲粮为商品化育肥期饲粮(营养成分等详见朱锦鹏等[24]发表的文章)。
1.2 样品采集及指标测定
试验结束后,屠宰所有湖羊采集样品。屠宰前湖羊禁食12 h,自由饮水。分离湖羊的十二指肠、空肠、回肠和盲肠,用于后续测定。剪取回肠和盲肠的中段肠管,取其内容物放于冻存管,迅速置于液氮中,后转入-80 ℃冰箱保存,用于空肠和盲肠内容物的VFA含量分析。
1.2.1 肠道组织形态的观察
石蜡切片的制作及苏木精-伊红(HE)染色参考Zhang等[25]的方法,经过组织梯度酒精脱水、透明、浸蜡、包埋等一系列步骤制作空肠与回肠组织石蜡切片,最后进行HE染色。使用正倒置一体荧光显微镜观察肠道形态结构,对绒毛高度、隐窝深度与肌层厚度进行测定,计算绒毛高度与隐窝深度的比值(绒隐比)。
1.2.2 紧密连接蛋白表达测定
取空肠和回肠组织样,使用细胞组织快速裂解液(RIPA)提取总蛋白,并测定蛋白浓度(BCA法,Protein Assay Kit, Thermo)。按照雅酶凝胶快速制备试剂盒进行制胶,分离蛋白样品,转膜(聚偏二氟乙烯膜),封闭,孵育一抗二抗,曝光显色,并采用Image J计算各组灰度值,用于数据分析。
1.2.3 肠道葡萄糖、氨基酸转运载体表达测定
使用TaKaRa RNAios Plus(Total RNA提取试剂)试剂盒提取各肠段组织的总RNA,测定RNA浓度和质量后反转录合成cDNA(PrimeScriptTMRT reagent Kit with gDNA Eraser,TaKaRa)。葡萄糖、氨基酸转运载体相关基因的特异性引物序列见表1。使用TB Green Premix Ex Taq(TaKaRa)试剂盒检测相关基因相对表达量,反应体系为10 μL。
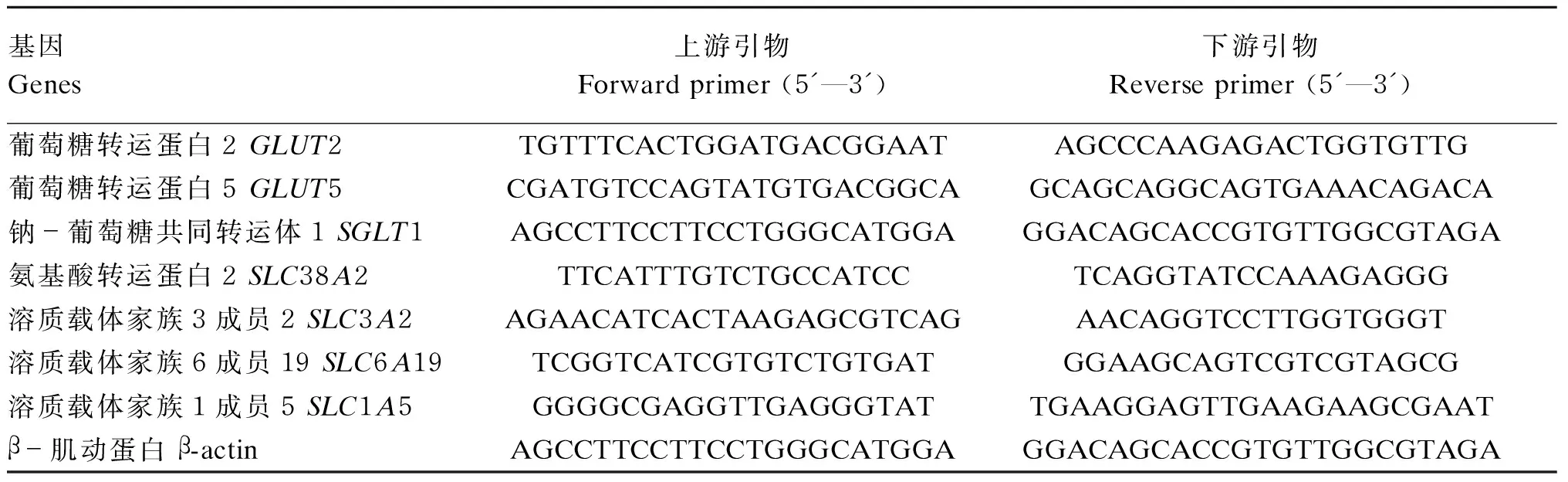
表1 葡萄糖、氨基酸转运载体相关基因的引物序列
1.2.4 肠道VFA含量的测定
肠道内容物VFA含量的测定参考Kristensen等[26]的方法,正磷酸酸化后的空肠、盲肠内容物样品于冰上解冻,在4 ℃、13 000×g条件下离心10 min,吸取上清液经0.22 μm水系滤膜过滤后注入气相色谱进样瓶,于气相色谱仪(Agilent7890BGC)上机分析。
1.3 数据处理及统计分析
使用Excel 2019软件进行数据初步整理,应用SPSS 25.0统计软件进行独立样本t检验,Graphpad prism进行图片绘制。结果用平均值和均值标准误(SEM)表示,P<0.05为差异显著,0.05≤P<0.10为差异有显著的趋势。
2 结果与分析
2.1 RPN对湖羊肠道组织形态的影响
湖羊空肠及回肠的HE染色切片如图1所示,所有试验组湖羊肠道结构与形态完整。由表2可知,与CON组相比,RPN组湖羊空肠绒毛高度和肌层厚度显著提高(P<0.05),隐窝深度与绒隐比均无显著差异(P>0.05)。由表3可知,与CON组相比,RPN组湖羊回肠绒毛高度、隐窝深度、绒隐比及肌层厚度均无显著差异(P>0.05)。
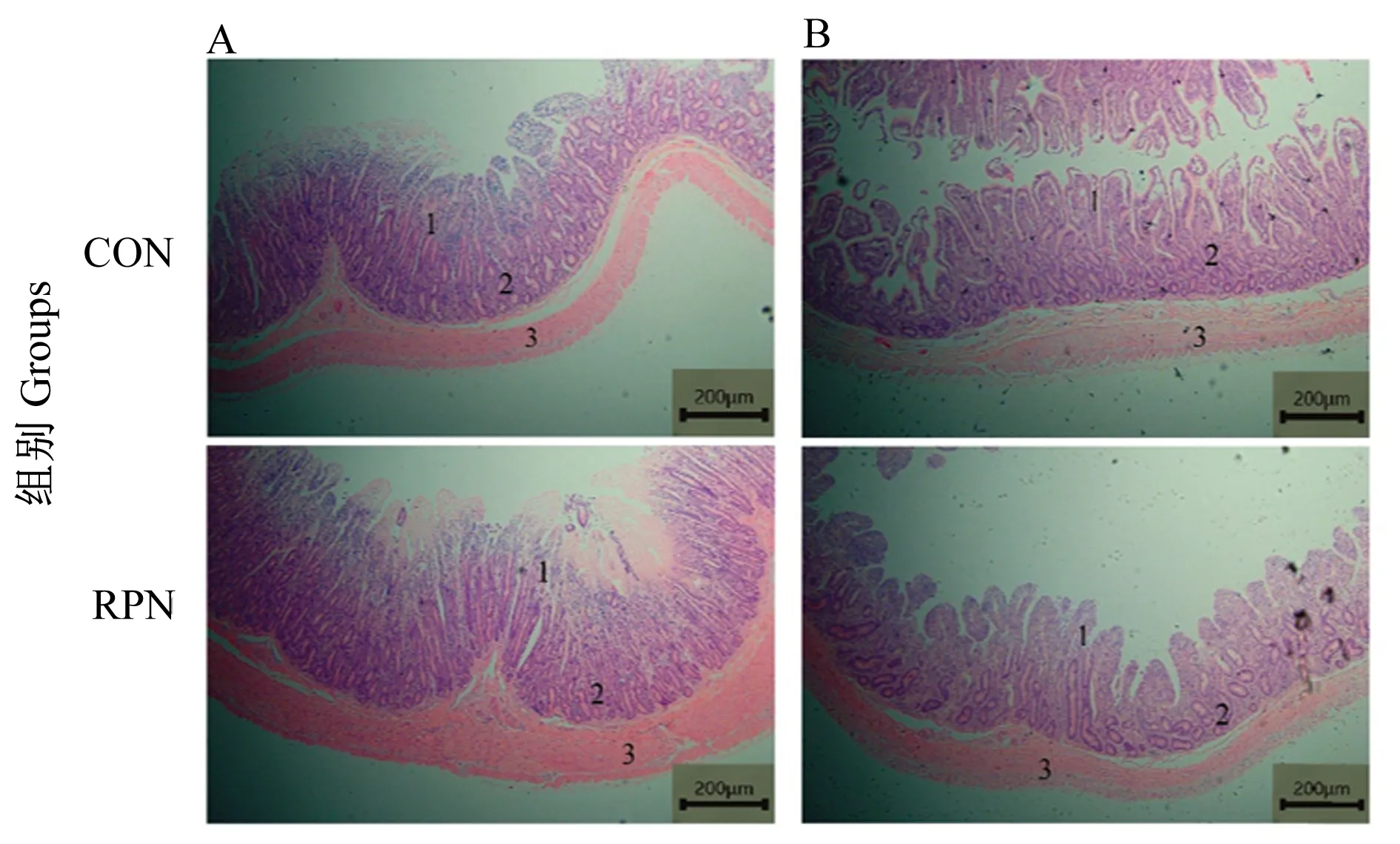
图中A和B分别为空肠和回肠,1、2、3分别为肠绒毛、隐窝和肌层。
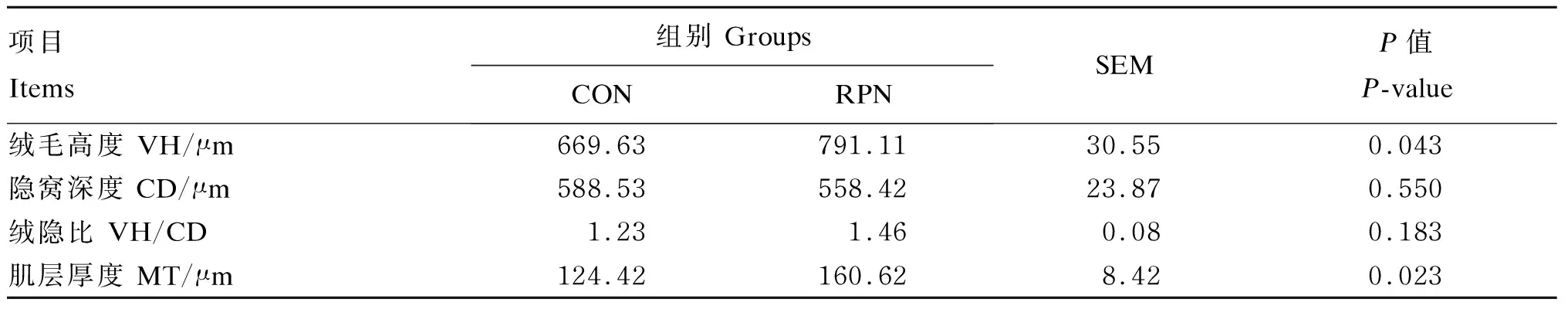
表2 RPN对湖羊空肠形态的影响
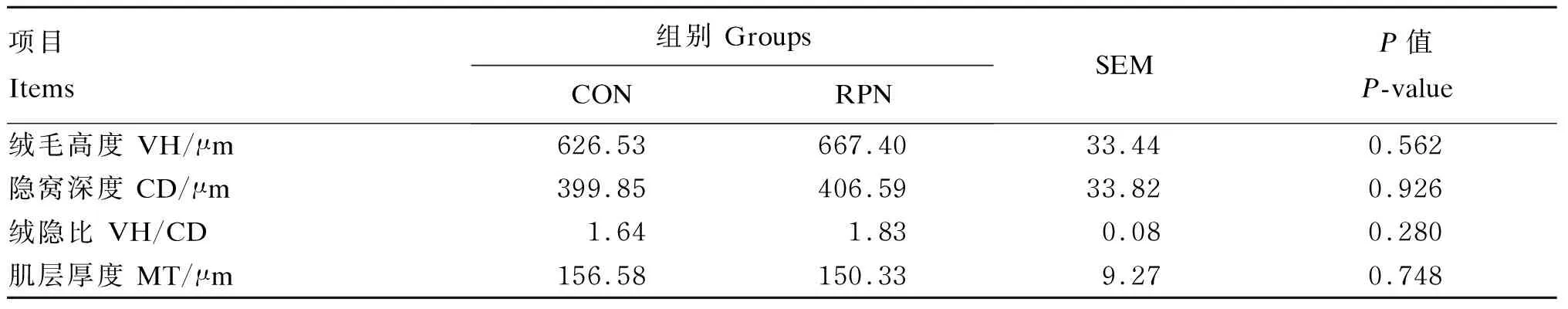
表3 RPN对湖羊回肠形态的影响
2.2 RPN对湖羊空肠、回肠黏膜紧密连接蛋白表达的影响
如图2-A所示,与CON组相比,RPN组空肠黏膜中封闭蛋白-2(Claudin-2)与闭合蛋白(Occludin)的蛋白表达水平显著增加(P<0.05);如图2-B所示,RPN组回肠黏膜中Claudin-2与Occludin的蛋白表达水平与CON组相比无显著差异(P>0.05)。
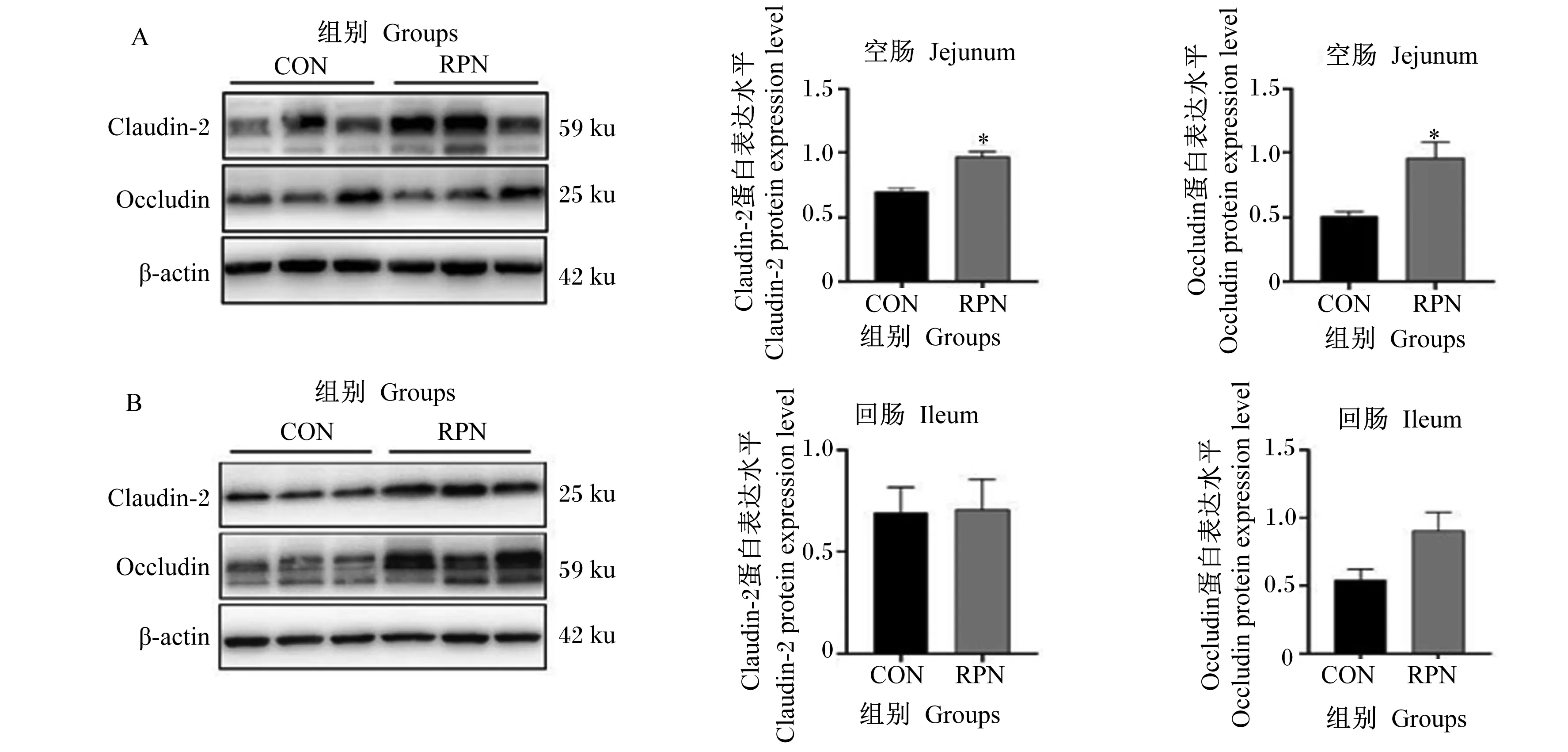
Claudin-2:闭合蛋白-2;Occludin:闭锁蛋白;β-actin:β-肌动蛋白。
2.3 RPN对湖羊十二指肠、空肠和回肠葡萄糖、氨基酸转运载体基因表达的影响
由表4可知,与CON组相比,RPN组十二指肠的氨基酸转运蛋白2(SLC38A2)基因相对表达量具有增加趋势(P=0.094),溶质载体家族6成员19(SLC6A19)(P=0.053)、溶质载体家族3成员2(SLC3A2)(P=0.066)的基因相对表达量均具有降低趋势。
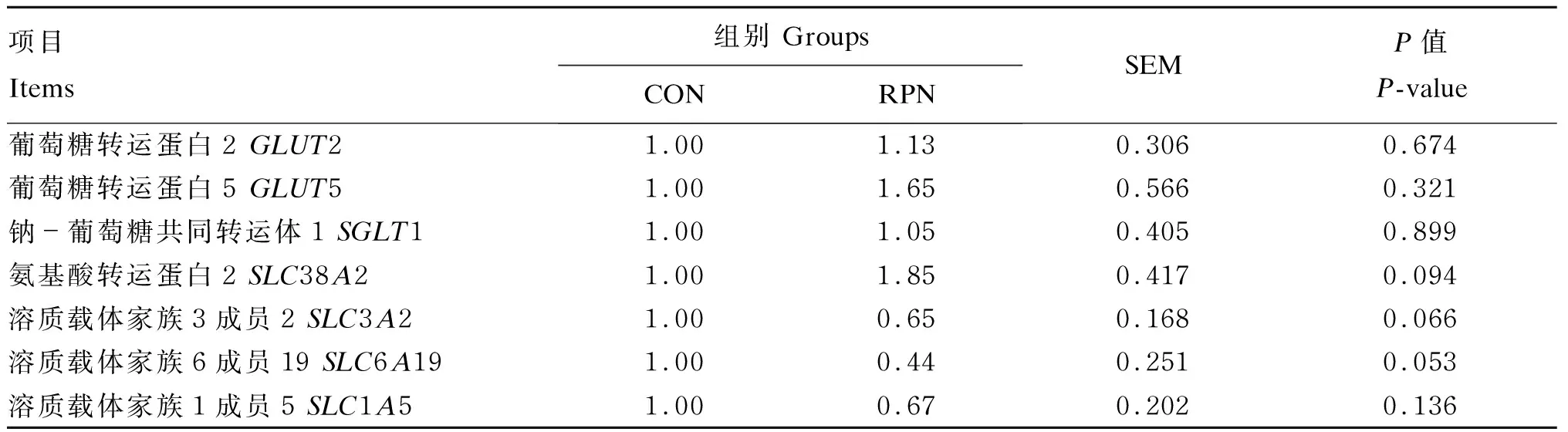
表4 RPN对湖羊十二指肠葡萄糖、氨基酸转运载体基因表达的影响
由表5可知,与CON组相比,RPN组空肠GLUT2和钠-葡萄糖共同转运体1(SGLT1)基因相对表达量显著升高(P<0.05)。
由表6可知,与CON组相比,RPN组回肠GLUT2、SLC38A2、溶质载体家族1成员5(SLC1A5)的基因相对表达量显著升高(P<0.05),SGLT1的基因相对表达量显著升高(P<0.05)。

表5 RPN对湖羊空肠葡萄糖、氨基酸转运载体基因表达的影响
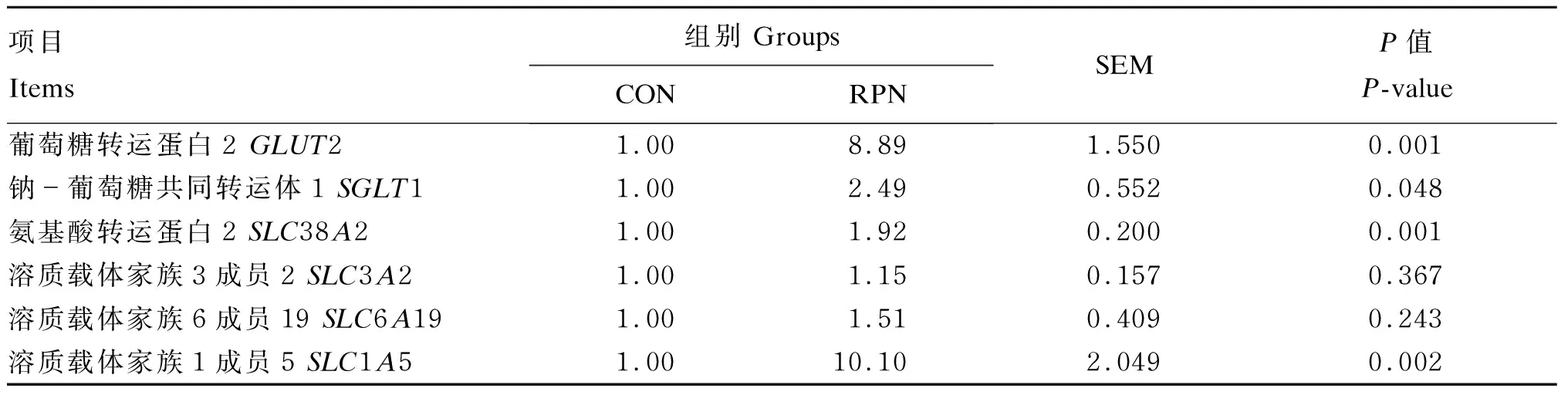
表6 RPN对湖羊回肠葡萄糖、氨基酸转运载体基因表达的影响
2.4 RPN对湖羊空肠和盲肠VFA含量的影响
由表7可知,RPN组空肠的异戊酸和异位酸含量显著高于对照组(P<0.05),乙酸(P=0.058)和总挥发性脂肪酸含量(P=0.077)均具有增加的趋势。
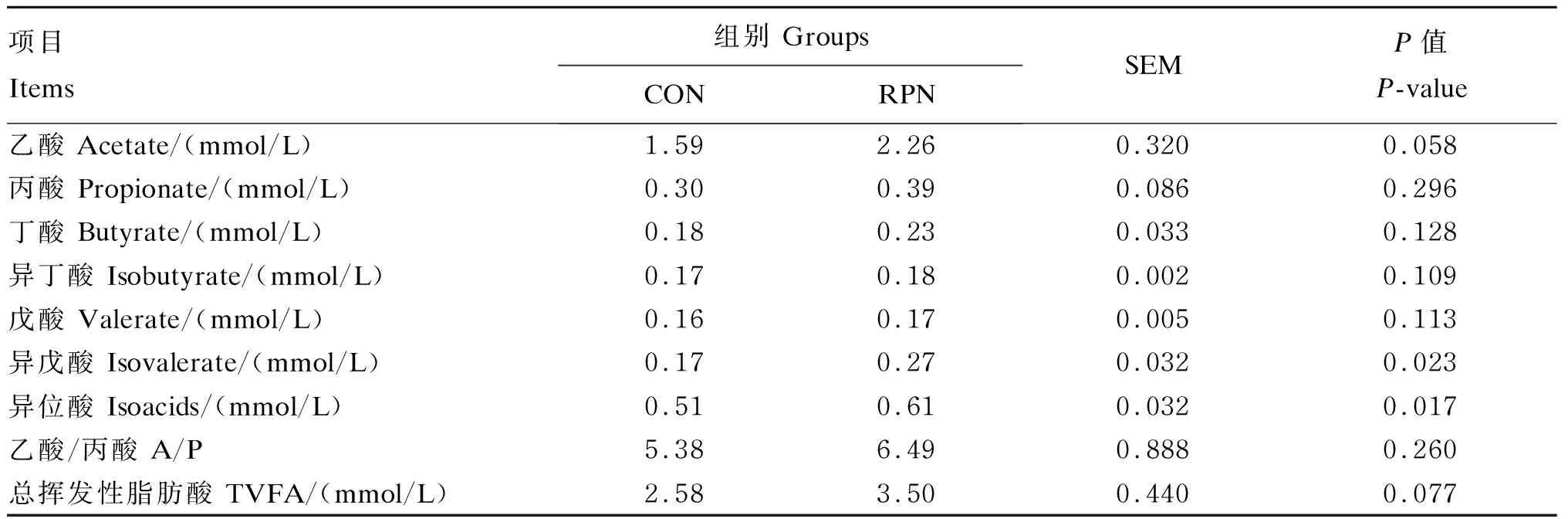
表7 RPN对湖羊空肠挥发性脂肪酸含量的影响
由表8可知,与CON组相比,RPN组盲肠的各VFA含量、乙酸/丙酸和总挥发性脂肪酸含量均无显著差异(P>0.05)。
3 讨 论
3.1 RPN对湖羊肠道组织形态的影响
肠道良好的结构形态是动物机体对营养物质消化和吸收的重要保证[27],尤其是小肠的绒毛和隐窝结构,它们是判别反刍动物机体对营养物质消化和吸收的重要标准[28];除此之外,小肠的吸收功能会被小肠的收缩运动所影响,并且其肌层厚度一发生变化就会直接影响到小肠的收缩运动[29]。本试验在育肥湖羊饲粮中添加RPN能显著提高空肠的绒毛高度与肌层厚度。研究显示,NAM能提高仔鼠十二指肠和空肠的绒隐比[30]。在肉鸡饲粮中补饲60、90 mg/kg NAM增加了肉鸡空肠绒毛高度[22]。赵会会[23]的研究表明,在围产后期奶山羊饲粮中添加5 g/d NAM提高了羔羊十二指肠和空肠的绒毛高度。这些结果表明,饲粮中添加RPN可改善湖羊肠道形态和促进肠道发育。
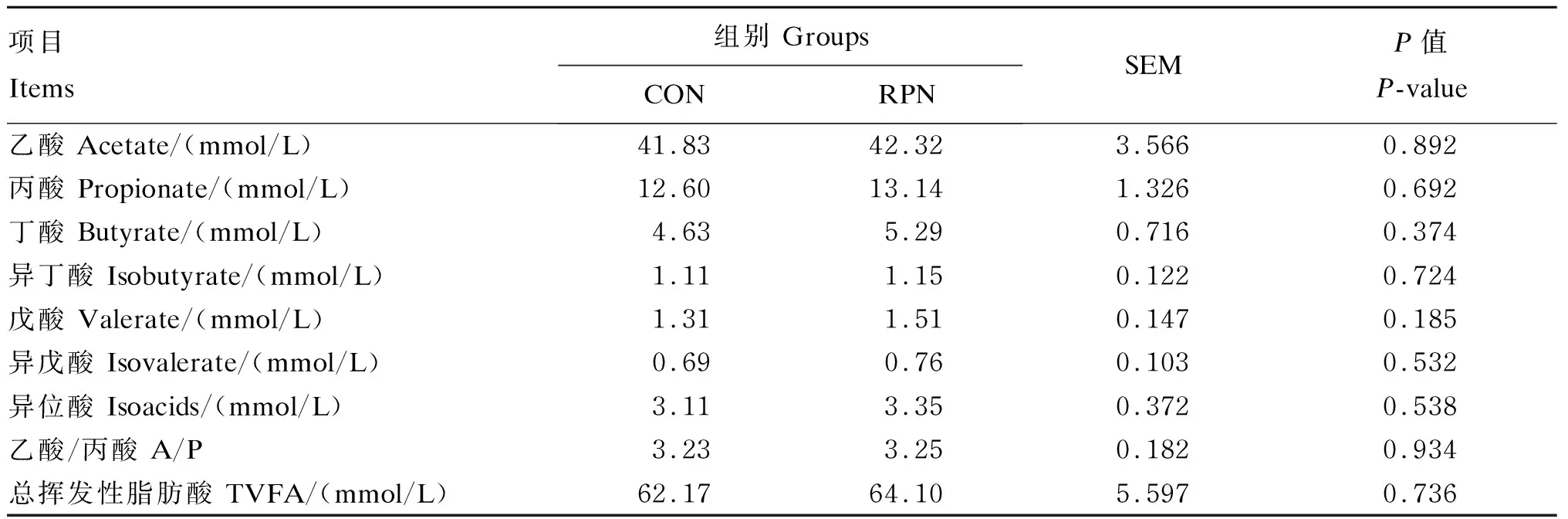
表8 RPN对湖羊盲肠挥发性脂肪酸含量的影响
肠道黏膜屏障的完整性能够抵抗肠道有害病菌的入侵[31],而紧密连接蛋白是构成肠屏障的重要蛋白分子,与肠道通透性息息相关[32]。其中,最主要的紧密连接蛋白是Occludin家族和Claudin家族等[33]。NAM是烟酸(nicotinic acid,NA)的酰胺形式。断奶仔猪补饲NA可以增加小肠Occludin与Claudin-1的基因相对表达量[34]。动物补饲NA可通过介导沉默调节蛋白1(SIRT1)、腺苷酸活化蛋白激酶(AMPK)等能量代谢信号通路提高肠道上皮细胞紧密连接蛋白的表达,从而促进肠道黏膜屏障功能损伤修复[35]。SIRT1是NAD+依赖性蛋白脱乙酰酶,其活性可影响APMK的激活[36],也可抑制促炎症因子的表达[37],随着NAD+的浓度提高,肠道干细胞SIRT1的活性增加,使肠道上皮细胞促炎症因子的表达下降,SIRT1迅速活化激活细胞核内的AMPK,促进肠道干细胞的增殖,提高肠道上皮细胞紧密连接蛋白的表达[38-39]。本试验中,添加RPN后能使空肠黏膜中Claudin-2与Occludin的蛋白表达水平显著增加,表明RPN在维持肠道屏障紧密连接功能方面起着重要作用,我们推测添加RPN可能通过增加体内NAD+浓度改善肠道屏障,有待进一步明确。
3.2 RPN对湖羊肠道转运载体表达的影响
RPN可以改善肠道形态,提高肠道紧密连接蛋白的表达量,推测可能会影响肠道对营养物质的吸收。因此,本试验中检测了十二指肠、空肠、回肠的葡萄糖转运载体与氨基酸转运载体的表达。转运载体的相对表达量是衡量小肠吸收能力的重要指标[40],进入小肠的蛋白质、脂肪以及碳水化合物会被消化酶降解为游离的氨基酸、果糖和葡萄糖等[41],然后通过相应的肠道转运载体的转运被小肠上皮细胞吸收,继而进入血液循环以供机体生长发育及代谢使用[12]。前期研究显示,添加NAM能提高羔羊空肠葡萄糖转运载体GLUT5、SGLT1与回肠GLUT2的基因相对表达量,与本试验结果相似,但对氨基酸转运载体表达无显著影响[23]。课题组前期研究发现,NAM可能影响氨基酸代谢[42],本试验中提高的氨基酸转运载体表达一定程度支持了氨基酸代谢改变的结果。在机体内,NAD+和NADP+可作为辅酶参与糖酵解、三羧酸循环、磷酸戊糖途径,外源补充NAM可提高体内NAD+的浓度,进而参与机体糖代谢[43-44]。本试验结果显示,RPN提高肠道葡萄糖、氨基酸转运载体的表达,表明RPN可能促进育肥湖羊对葡萄糖、氨基酸等的吸收。
3.3 RPN对湖羊肠道VFA含量的影响
肠道内容物中的VFA是肠道微生物对碳水化合物的降解产物[45],能够调节肠道pH,抑制有害病菌的增殖[46],保护肠道黏膜屏障[47],还能够为动物机体和肠道细胞提供能源[48]。目前RPN对肠道VFA影响的研究较少,大多是NA对瘤胃VFA含量影响的研究。在水牛的精料混合物中添加NAM和NA,能提高胃肠道的总VFA浓度和VFA中丙酸比例[49]。杨艳等[50]研究发现,适量添加NA能够使瘤胃中总VFA、丙酸含量增加,降低乙酸/丙酸。本试验中,添加RPN能够提高VFA含量以及乙酸/丙酸,推测丙酸可能在瘤胃被吸收,导致肠道中乙酸/丙酸升高。空肠和盲肠的VFA含量变化不同可能与肠道内微生物种类、NAM水平以及肠道pH有关。上述结果表明,RPN能够提高湖羊肠道VFA的含量。添加NA发现乙酸含量与瘤胃原生动物数量呈负相关[51]。有研究表明,添加NA能够影响肠内菌的数量,可能改善肠道发酵[52-53]。所以,本试验推测RPN可能促进肠道微生物的生长与增殖,提高微生物蛋白产量[54],以维持肠道内VFA之间的比例;此外,RPN也有可能通过影响NAD+和NADP+浓度影响肠道发酵环境[55]。
4 结 论
综上所述,育肥湖羊补饲1 g/d RPN可改善其肠道形态,促进肠道屏障紧密连接和后肠道发酵;此外,还能够提高湖羊肠道葡萄糖、氨基酸转运载体的表达,可能促进肠道对葡萄糖等的吸收。

