黏细菌Myxococcus sp. BS对烟稻轮作土壤真菌多样性和群落组装过程的调控
于潇玮,王创,王可,李欣艳,董雷,崔中利,曹慧*
(1.南京农业大学生命科学学院/农业农村部农业环境微生物工程重点实验室,江苏 南京 210095;2.宣城市宣州区烟草产业发展中心,安徽 宣城 242000;3.安徽中烟工业有限责任公司蚌埠卷烟厂,安徽 蚌埠 233010)
烟草是全球广泛种植的非食用经济作物。中国烟草的种植面积和总产量均居世界第一位[1-2]。安徽是我国重要的烟草产区,烟草的种植对安徽省的农业和经济发展有着极为重要的推动作用[3],但烟草黑胫病、烟草炭疽病、烟草白粉病等病害发生严重[4],轻则减产,重则绝收,严重影响烟草品质和产量。因此,在防治烟草病害方面的问题亟待解决,以促进烟草产业的可持续发展。虽然化学农药是病害防治高效快速的手段,但其会通过渗透、挥发和迁移等方式渗入土壤水源和大气等自然环境中,对整体生态环境造成威胁,同时也会严重影响农产品生长质量和土壤养分情况[5]。因此,植物致病菌的生物防治被认为是保持农业可持续发展的一项重要措施。
真菌是引起植物病害的常见病原微生物,真菌性病害占植物病害的70%~80%[6]。真菌病害对作物生长危害严重,降低作物产量,进而造成巨大的经济损失。土壤微生物群落结构和土壤的功能有密切联系[7],土壤微生物群落结构反映土壤的生物功能[8]。植物病原微生物在植株根际定植的数量是其能否侵染植株的关键因素,土传真菌病害的发生与土壤中病原菌数量有直接的相关性[9-10]。
黏细菌(Myxobacteria)属于δ变形菌纲(Deltaproteobacteria)黏球菌目(Myxococcales),为革兰氏阴性棒状杆菌[11]。黏细菌Myxococcussp. BS是本实验室分离出的一株生防菌,室内和田间试验表现出明显的生防效果[12]。王婷[12]研究发现当猎物胡萝卜软腐果胶杆菌胡萝卜亚种(Pectobacteriumcarotovorumsubsp.Carotovorum,Pcc)与黏细菌BS共培养时,猎物能诱导黏细菌分泌大量的外膜囊泡。黏细菌分泌的外膜囊泡聚集在Pcc周围,使Pcc被裂解,由此囊泡在黏细菌捕食Pcc过程中具有一定的作用。乔燕等[13]通过田间试验发现黏细菌EGB在土传植物真菌病害控制方面具有良好的防控效果,表明其作为一类新型生防微生物,在农业生产过程中的病害控制方面具有重要的应用潜力。叶现丰[14]发现黏细菌来源的β-1,6-葡聚糖酶(GluM)通过对尖孢镰刀菌细胞壁的水解作用,激活高渗甘油信号(HOG)途径及细胞内活性氧的积累,诱导真菌细胞凋亡的产生,造成尖孢镰刀菌孢子和菌丝的死亡。Dai等[15]的研究表明影响不同堆肥粪便中黏细菌分布的关键非生物因素(pH和Mg2+)与黏细菌群落多样性呈显著正相关,堆肥可增加黏细菌群落多样性并且改良农田土壤。Wang等[16]研究发现,施用氮肥引起的土壤酸化是土壤黏细菌丰度和细胞密度下降的最重要驱动因素,黏细菌丰度和细胞密度是土壤细菌α和β多样性的潜在驱动因素。Ye等[17]研究发现,黏细菌EGB通过捕食改变了土壤微生物群落结构,降低土壤中尖孢镰刀菌(Fusariumoxysporumf. sp.cucumerinum,FOC)的数量,抑制由FOC引起的黄瓜枯萎病。Wu等[18]研究发现,施肥和秸秆覆盖使小于2 mm土壤组分的细菌Chao1指数下降,并且黏细菌群落结构是土壤微生物多样性最重要的潜在驱动因素。还有研究表明,微生物菌剂通常会改变土壤微生物群落结构[19]。因此,在种植烟草时可以添加黏细菌,利用其生防功能,可以将病原菌数量控制在发病阈值内,从而减小经济损失[20]。
本文以安徽省宣城市宣州区的烟稻轮作土壤为研究对象,运用高通量测序技术对黏细菌菌剂和菌肥处理的土壤真菌微生物多样性、群落组成和组装过程进行研究,以期分析黏细菌添加对土壤中真菌群落产生的影响,为黏细菌的生物防治功能和土壤微生物区系调控提供理论指导。
1 材料与方法
1.1 试验材料
1.1.1 菌株黏细菌Myxococcussp. BS是南京农业大学生命科学学院分离出的一株生防菌。分类上属于黏球菌目(Myxococcales)黏球菌科(Myxococcacceae)黏球菌属(Myxococcus),由无菌兔粪诱导子实体从土壤中分离获得。
1.1.2 供试烟草供试烟草为‘云烟97’由宣城市宣州区烟草产业发展中心提供。
1.1.3 菌剂和菌肥的制备BS菌剂制备:在10 L发酵罐中添加LBS培养基,按照1%(体积分数)的接种量,将种子液与LBS培养基混合发酵,发酵罐转轴转速100 r·min-1,通气量9 L·min-1,30 ℃、发酵48 h,得到发酵液,BS菌剂制备完成。
BF菌肥制备:将灭菌后的兔粪研磨成粉末,与打碎的稻秸秆以2∶1(质量比)混合,湿热灭菌2~3次。将BS菌剂以1%的接种量接入上述有机肥中,调节温度为30~45 ℃,含水量为75%,发酵4 d,期间不断翻抛,即得到BF菌肥。
1.2 试验设计
试验田位于安徽省宣城市宣州区文昌镇(118°28′E—119°04′E,30°34′N—31°19′N),试验田土壤的利用方式为多年烟草-水稻轮作。
试验田分为3个试验小区,每个小区面积为86.4 m2(6 m×14.4 m),设置3个处理:CK(不添加任何菌剂或菌肥)、BS(添加菌剂)和BF(添加菌肥)。每个试验小区有5垄烟草,垄间距为1.2 m,每个小区种植烟草32株,株间距0.45 m。垄垂直方向上,不同处理小区间用1垄烟草苗作为隔离行。垄平行方向上,不同处理小区间由5株烟草苗隔开。隔离区的烟草苗株距和移栽的烟草苗与处理小区相同。烟草田间试验开始时间是2019年5月25日,CK试验区不施用菌剂或菌肥,作对照处理;在BS试验区的每株烟草根际施加5 mL BS菌剂;在BF菌肥试验区的每株烟草根穴施加10 g发酵后的BS固态菌肥。
1.3 土壤样品的采集
在每个试验小区设置3个采样点,每个采样点使用五点取样法采集土壤样品。土壤采样器事先经消毒处理,将表层土刮去后用土壤取样器取烟草植株根际处0~20 cm的土壤,去除土壤中石砾和植物残根,完成单次采样。按上述操作完成余下采样,共采集9个样品。将采集的土壤装入自封袋,冷藏运输至实验室,放入-80 ℃冰箱保存,用于后续土壤总DNA的提取。
1.4 土壤微生物DNA的提取和Illumina高通量测序
土壤样品微生物DNA的提取参见试剂盒FastDNATMSpin Kit For Soil(MP Biomedicals,USA)的说明书,每个处理3个DNA重复样品。将各个处理对应的DNA送至天津诺禾致源生物科技公司进行高通量测序分析。使用Ion S5TMXL测序平台,利用单端测序(Single-End)的方法,构建小片段文库进行单端测序,对各个样品的土壤总DNA中ITS序列进行测序。引物为ITS1-1F-F(5′-CTTGGTCATTTAGAGGAA-GTAA-3′)和ITS1-1F-R(5′-GCTGCGTTCTTCATCGATGC-3′),对真菌ITS1可变区进行PCR扩增。PCR扩增体系(30 μL):Phusion Master Mix(2×)15 μL,Primer F(1 mol·L-1)1 μL,Primer R(1 mol·L-1)1 μL,gDNA(1 ng·μL-1)10 μL,ddH2O补足30 μL;PCR扩增程序:98 ℃ 1 min;98 ℃ 10 s,50 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。2 g·L-1琼脂糖凝胶电泳检测PCR产物,使用GeneJET胶回收试剂盒(Thermo Fisher Scientific,USA)回收纯化产物,之后使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒(Thermo Fisher Scientific,USA)构建文库,文库经Qubit定量和检测合格后采用Ion S5TMXL平台进行上机测序。
使用Cutadapt减去测序结果中的低质量序列,以97%相似度聚类为操作分类单元(Operational Taxonomic Unit,OTU),然后利用UNITE数据库对OTU序列进行物种注释。
1.5 测序分析与数据处理
为评估真菌群落的α多样性指数,使用R包“vegan”计算Chao1指数和Shannon指数,并通过单因素方差分析进行差异显著性检验。
丰度差异散点图用于显示不同OTU丰度变化的差异性。本研究选择错误发现率(FDR)来调整P值[21]。使用R包“DESeq2”计算log2倍数变化(log2FC)和调整后的P值。OTU的差异丰度图是使用R包“ggplot2”构建的。使用OriginPro2021(ver.9.80)中的“主坐标分析”应用程序构建PCoA图。
在HutlabGalaxy网站(https://huttenhower.sph.harvard.edu/galaxy/)应用程序1上进行线性判别分析(LDA),同时结合效应大小(LEfSe)测量,以找到各处理之间的统计生物标志物[22]。
真菌亚群落的组装过程是使用“MicEco”包中的“ses.comdistnt”函数构建的[23],使用β平均最近分类单元距离(βMNTD)来确定群落的系统发育结构。同时,通过空模型分析评估真菌亚群落的随机和确定性生态过程[24]。使用R包“iCAMP”[24]定量分析真菌的群落组装过程,确定随机过程的扩散限制和非主导过程的比例,以及确定过程的变量选择和同质选择的比例。结合β最近分类单元指数(βNTI)和通过模拟得到的Bray-Curtis距离小于实际观察到的Bray-Curtis距离的比例(RCbray)来确定不同生态过程对真菌群落组装过程的贡献度。其中:βNTI>2为变量选择的影响;βNTI<-2为同质选择的影响;|βNTI|<2且RCbray>0.95为扩散限制的影响;|βNTI|<2和RCbray<0.95则用于估计非主导过程的影响[23-24]。
2 结果与分析
2.1 添加黏细菌对土壤真菌多样性的影响
2.1.1 α多样性从9个样品测序结果中共得到575 867条有效序列,将序列按照97%相似水平聚类,共得到1 395个真菌OTU。通过Chao1指数分析(图1-A)可以发现,添加菌剂和菌肥后,土壤中的真菌丰富度呈现显著下降的趋势,并且添加菌肥的土壤中真菌丰富度比添加菌剂的土壤中真菌丰富度下降更多。Shannon指数(图1-B)结果表明,添加菌剂和菌肥后BS和BF处理组中的Shannon指数增加,说明群落多样性增加。

图1 土壤真菌群落Chao1指数(A)和Shannon指数(B)Fig.1 Soil fungal community Chao1 index(A)and Shannon index(B)CK:未处理土壤Untreated soil;BS:添加菌剂土壤Soil with added Myxococcus sp. BS;BF:添加菌肥土壤Soil with added organic fertilizer. 不同小写字母表示组间差异显著(P<0.05)。Different lowercase letters indicate significant differences between groups(P<0.05).
2.1.2 β多样性基于OTU的绝对丰度,对土壤中真菌群落进行PCoA分析(图2)。PCoA1的解释量为42.57%,PCoA2的解释量为22.2%,2个坐标轴共解释了64.77%的信息。PCoA2可以很好地将CK与BS、BF分开,CK全部在PCoA2=0的上方,BS和BF都在PCoA2=0的下方。
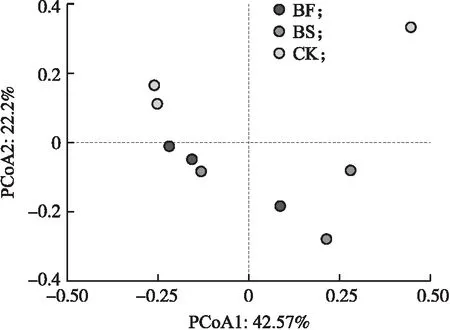
图2 不同处理真菌群落主坐标分析(PCoA)图Fig.2 Principal coordinate analysis(PCoA)plots offungal communities in different treatments
使用CK的OTU丰度作为对照,统计BF与CK和BS与CK中丰度显著变化的OTU(图3)。在BF处理组中,有25个(1.93%)OTU丰度显著上调,4个(0.31%)显著下调;BS处理中,有49个(3.67%)OTU丰度显著上调,25个(1.87%)显著下调。BS较BF处理的OTU变化更显著,表明单独添加BS菌剂较添加菌肥处理对OTU影响更大。
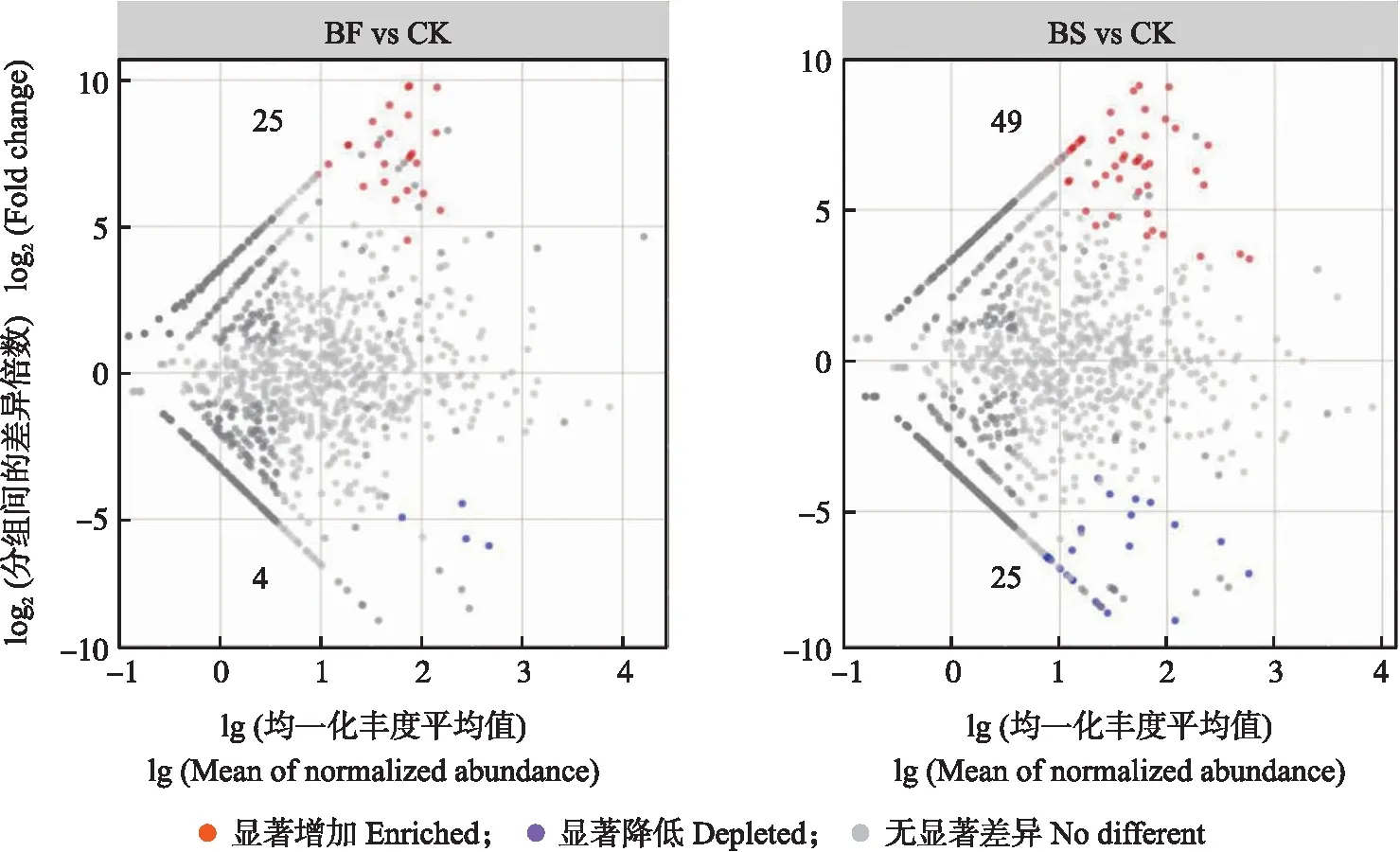
图3 不同处理OTU上调和下调丰度差异散点图Fig.3 Scatter plot of the difference in abundance between up- and down-regulated OTU by treatments每个点代表一个单独的OTU,沿y轴的位置代表与CK相比丰度倍数的变化。红色点表示OTU丰度显著增加,蓝色点表示OTU丰度显著降低,数字代表上调或下调的OTU总数。Each dot represents an individual OTU and the position along the y-axis represents the change in abundance multiple compared to CK. Red dots indicate significant increase in OTU abundance,blue dots indicate significant decrease in OTU abundance,and the numbers represent the total number of OTU that were adjusted up or down.
2.2 添加黏细菌对土壤真菌群落组成的影响
以相对丰度从高到低对样品中的真菌门进行排序,相对丰度排前10的真菌门的统计结果见图 4-A。在3个处理中,相对丰度排前10的真菌门的真菌丰度占总真菌数的58.20%~75.54%。子囊菌门(Ascomycota)在各个处理组中的相对丰度均最高,其在CK中的相对丰度最高(53.22%),在BS处理中的相对丰度为43.37%,BF处理最低(40.94%)。被孢霉门(Mortierellomycota)的相对丰度仅次于子囊菌门(Ascomycota),在所有处理组中,其平均相对丰度为18.10%。与CK相比,BS和BF处理中的球囊菌门(Glomeromycota)的相对丰度降低。
以相对丰度排名前10的真菌属为优势属,真菌优势属统计结果见图4-B。真菌优势属结构在不同处理间存在差异。CK处理中的优势属相对丰度之和为41.53%,高于其他2个处理组(BS 29.43%,BF 27.16%)。链格孢属(Alternaria)、腐质霉属(Humicola)和被孢霉属(Mortierella)在CK中的相对丰度分别为23.67%、10.19%和4.64%,高于BS(10.07%、5.04%和1.27%)和BF(2.96%、5.95%和4.20%)处理组。其中,茎点霉属(Phoma)和绿核菌属(Ustilaginoidea)的相对丰度在BF处理组中最高(0.74%、1.05%),BS次之(0.16%、0.53%),CK最低(0.04%、0.15%)。

图4 不同处理真菌优势门(A)和属(B)相对丰度Fig.4 The relative abundance of the dominant fungal phylum(A)and genus(B)in the different treatmentsOthers表示相对丰度排前10真菌门之外的所有真菌门的丰度总和。“Others”represents the sum of the abundances of all fungal phylums except the top 10 phylums in relative abundance.
2.3 不同处理下真菌群落结构差异性分析
通过线性判别分析(linear discriminant analysis,LDA)方法分析多级物种的差异,以发现CK、BS和BF中差异显著物种,结合LDA效应值(linear discriminant analysis effect sizes,LEfSe)与P值比较各组中真菌物种丰度对差异效果的影响,筛选出差异物种(LDA≥ 2.0,P<0.05)。如图5所示:在CK中,发生显著变化的真菌差异物种有7个,分别来源于双担菌纲(Geminibasidiomycetes)、Geminibasidiales、陆生壶菌科(Terramycetaceae)、Geminibasidiaceae、丛孢菌属(Arthrobotrys)、Boothiomyces和双子担子菌属(Geminibasidium),差异物种相对丰度为0.42%;在BS处理中发生显著变化的真菌差异物种有5个,分别来源于银耳科(Tremellaceae)、Helotiales_fam_Incertae_sedis、赤霉菌属(Gibberella)、隐球菌属(Cryptococcus)和Apiotrichum,差异物种相对丰度为0.15%;在BF处理中,发生显著变化的真菌差异物种有8个,分别来源于葡萄座腔菌目(Botryosphaeriales)、银耳目(Tremellales)、葡萄座腔菌科(Botryosphaeriaceae)、生赤壳科(Bionectriaceae)、Hypocreales_fam_Incertae_sedis、螺旋聚孢霉属(Clonostachys)、绿核菌属(Ustilaginoidea)以及葡萄座腔菌科中未被鉴定的属,差异物种相对丰度为4.47%。

图5 不同处理中真菌LEfSe进化分支图(A)和LDA值柱状分布图(B)Fig.5 Branch diagram of LEfSe evolution(A)and Histogram of LDA values(B)of fungi in different treatments
2.4 添加黏细菌后土壤真菌群落组装机制
βNTI能够明确微生物群落变化受确定性或随机性因素影响的大小。大部分真菌OTU都存在于|βNTI|<2的范围内(图6-A),说明真菌群落组装过程是以随机性过程为主导。其中,CK的随机性过程占62.96%,BS处理中随机性过程占66.67%,BF处理中随机性过程比70.73%。在加入黏细菌之后,确定性过程的比例逐渐减小,随机性过程的比例逐渐增加。为进一步深入探究群落组装机制,计算RCbray的值(图6-B)。随机性过程的扩散限制对群落组装的贡献最大,其在CK、BS和BF处理中依次增加,分别是51.85%、55.56%和62.96%。确定性过程中的同质选择在CK、BS和BF中依次降低,分别是18.52%、11.11%和7.41%。随机性过程中的未主导过程也依次降低。总体而言,添加菌剂增加真菌群落组装中扩散限制的比例,而添加菌肥则进一步增加了扩散限制的占比。

图6 不同处理中土壤真菌群落的βNTI值(A)和不同生态过程对真菌群落组装的贡献(B)Fig.6 βNTI values of soil fungal communities under different treatments(A)and the contribution ofdifferent ecological processes to fungal community assembly(B)
3 讨论
微生物是土壤养分转化和循环的动力,调控着土壤能量流动和养分循环过程[25],因此在土壤中增加具有特殊功能的微生物制剂能够改变土壤中营养元素的活性状态,改善土壤营养状况,进而调控土壤微生物群落结构。本试验将黏细菌Myxococcussp. BS制备为微生物菌剂(BS)和菌肥(BF)分别添加到土壤中,发现土壤中真菌OTU数量和Chao1指数都呈下降趋势,而Shannon指数升高,表明真菌丰富度降低,但多样性和均匀度升高,这与刘海洋等[26]在棉田土壤中施用微生物菌剂的研究结果相似。黏细菌具有广谱性捕食真菌的能力[27],黏细菌菌剂或菌肥施入烟草-水稻轮作的土壤中,可能对土壤中某些真菌(如本试验中的链格孢菌)产生优先捕食作用,造成真菌种类减少,呈现Chao1指数下降和Shannon指数升高的变化特征。本试验中,BF比BS对微生物群落组成的影响更大,具体表现为Chao1指数从大到小的处理依次为CK、BS、BF,Shannon指数从大到小的处理依次为BF、BS、CK,上述结果表明以黏细菌配施有机肥会增强黏细菌的捕食作用,这可能是因为菌肥为黏细菌的生长提供了更多营养,而黏细菌的“狼群捕食”策略[28]需要捕食性细菌达到足够的细菌密度[29]。
大量研究表明,向土壤中添加微生物菌剂会改变原始的微生物群落组成,从而达到有效控制土传真菌病害的发生、提高作物的产量和品质,以及改善土壤的微生物环境等目的[30-32]。从本研究中发现,添加黏细菌后链格孢属(Alternaria)的相对丰度降低。链格孢属是一种寄主范围广泛的植物病原菌[33],可造成多种作物的严重病害。Li等[34]的研究表明,由于黏细菌分泌的β-1,6-葡聚糖酶可以水解真菌细胞壁,添加黏细菌会使稻瘟病菌(Magnaportheoryzae)的相对丰度降低。同样,链格孢属相对丰度降低极有可能是黏细菌的专性捕食作用引起的。
阐明群落组装的机制是微生物生态学的一个关键主题[35]。外源添加菌剂/菌肥可能会改变微生物群落的组装机制,不同的添加物可能会使微生物群落组装向着不同的方向发展[36-37],而量化确定性和随机性过程对群落组装的影响至关重要。对本研究中的群落组装过程分析表明,CK、BS和BF都是以随机性过程为主导且占比逐渐增大,扩散限制贡献最大,这与Jiao等[38-39]的研究结果类似。Xun等[40]研究了微生物α多样性对微生物群落组装的随机性/确定性过程的影响,发现在高的微生物多样性条件下群落随机性组装过程占据主导地位;Zhang等[41]在研究长期保护性耕作的玉米-小麦轮作土壤中真菌群落的响应时发现,常规耕作处理组的Chao1多样性指数最高、Shannon多样性指数最低,其群落组装过程由随机性过程主导。这表明黏细菌添加会使烟稻轮作土壤中真菌群落的组装过程更加随机,同时以有机肥配施黏细菌菌剂较单一菌剂施用具有更好的生防效果。

