花青素协同酶水解法对翅果油粕蛋白功能性质和结构特性的影响
王江涛,赵晓瑜,郭彩霞
(山西大学生命科学学院,山西太原 030006)
翅果油树(Elaeaguns molisDiels)是我国稀有物种,属胡秃子科胡秃子属,主要分布于山西和陕西等地[1-2]。翅果油种仁富含油脂、蛋白质、维生素等营养物质,其中蛋白质含量高达32%~36%[3],翅果油种仁蛋白含有17 种氨基酸,其中人类必需氨基酸7种,对人体有益的谷氨酸、脯氨酸、天冬氨酸、精氨酸的含量较高,具有很好的保健作用和开发潜能[4]。然而,翅果油粕蛋白在中性条件下的溶解性较差[5],这极大地限制其开发和应用,因此改善翅果油粕蛋白的功能性质十分必要。
目前,蛋白改性常用的方法有物理法、化学法、酶解法等,其中酶解法通过蛋白酶催化肽键断裂,使大分子蛋白变为小分子多肽,从而提高其体内消化吸收率并且改善植物蛋白功能性质[6-7]。此外,多酚结合法改善蛋白质的功能性质逐渐成为近年来的研究热点。多酚与蛋白质结合形成复合物,通过相互作用改变蛋白结构从而提高功能性质和生理活性,拓宽蛋白质的应用范围。多酚与蛋白质之间相互作用会受到温度、pH、多酚类型和蛋白类型等因素的影响,其中pH 决定多酚与蛋白质间相互作用类型[8],多酚与蛋白质之间的相互作用可以分为共价作用和非共价作用。在碱性条件下,多酚易被氧化成醌,醌类物质会和蛋白质的氨基酸残基发生不可逆的共价结合,而多酚与蛋白质之间的非共价作用是通过疏水相互作用和氢键等相对较弱的作用力发生可逆结合[9]。
花青素(Anthocyanin)是一种天然的水溶性植物色素,属于黄酮类化合物[10],作为天然的抗氧化剂,花青素对氧化应激导致的损伤具有一定的保护作用[11],现有研究表明花青素与蛋白质结合可有效地提高蛋白溶液的功能性质[12-13]。然而,目前花青素结合法均是对大分子蛋白进行改性,对于花青素结合法与酶解法协同作用于蛋白,提高其功能性质的研究不足。本文通过花青素与酶水解法协同作用对翅果油粕蛋白进行改性,探究了花青素结合法和酶水解法协同对翅果油粕蛋白功能性质及抗氧化活性的影响,并利用荧光光谱和紫外光谱探究花青素对翅果油粕蛋白及其酶解产物二级结构的影响,为拓宽翅果油粕蛋白在食品行业中的应用范围提供理论依据。
1 材料与方法
1.1 材料与仪器
翅果油粕 山西琪尔康翅果生物制品有限公司;花青素(纯度为95%)天津尖峰天然研究产物研究开发有限公司;考马斯亮蓝G-250、十二烷基苯磺酸钠(SDS)、甘氨酸、谷胱甘肽(GSH)北京索莱宝科技有限公司;四甲基乙二胺(TEMED)、三羟甲基氨基甲烷(TRIS)、丙烯酰胺、N,N-甲叉双丙烯酰胺、β-巯基乙醇、过硫酸铵 上海麦克林生化科技有限公司;1-苯胺基-8-萘基磺酸盐(ANS)上海贤鼎生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)美国Sigma 公司;实验室所用试剂 均为国产分析纯。
STARTER2100 pH 计 奥豪斯仪器有限公司;SC-3614 型低速离心机、KDC-140HR 型高速冷冻离心机 安徽中科中佳科学仪器有限公司;HH-S 型水浴锅 巩义市英峪予华仪器厂;DYCZ-24DN 型双垂直电泳槽 北京六一仪器厂;LS-55 型荧光分光光度计 珀金埃尔默仪器有限公司;UV-2550 型紫外-可见光谱仪 日本日立公司。
1.2 实验方法
1.2.1 翅果油粕蛋白粉的制备 将翅果油粕与蒸馏水以料液比1:75 混合,用0.1 mol/L NaOH 调节pH为11,于55 ℃水浴55 min 提取蛋白。冷却至室温后,于4000 r/min 离心15 min,收集上清液备用。上清液用0.1 mol/L HCl 调节pH 为4.5 进行酸沉蛋白,30 min 后结束酸沉,于4000 r/min 离心15 min,收集蛋白进行真空冷冻干燥得到纯度为84.03%的翅果油粕蛋白。
1.2.2 翅果油粕酶解蛋白的制备 配制底物浓度为4%的翅果油粕蛋白溶液,选用碱性蛋白酶,在酶添加量为10000 U/g、酶解pH11、酶解温度50 ℃的条件下,酶解50 min,将酶解液冷冻干燥,制得水解度为10%的蛋白酶解物。
1.2.3 花青素-翅果油粕蛋白复合物的制备 根据李扬等[8]的方法制备复合物。具体步骤为:将样品粉末用0.01 mol/L 磷酸盐缓冲液(pH7.4)配制成1%的蛋白样液,向样液中加入0.05%花青素,充分混合后调节溶液pH 分别为3、5、7,室温搅拌2 h,得到花青素与蛋白非共价结合复合物。同样地,将溶液pH调整到9、11,室温搅拌24 h,得到花青素与蛋白共价结合复合物。测定复合物溶液清除DPPH 自由基清除能力,选取清除DPPH 自由基能力最强的pH 作为制备具有较强抗氧化能力花青素-蛋白复合物的最适pH。
1%蛋白溶液中分别加入0.025%、0.05%、0.1%花青素,充分混合后调节混合溶液pH 至花青素结合蛋白的最适pH,室温搅拌2 h,即得到不同质量比的花青素-翅果油粕蛋白复合物(A-P)和花青素-酶解蛋白复合物(A-EP)。其中,P 代表翅果油粕蛋白,0.025%、0.05%、0.1%花青素与翅果油粕蛋白形成的复合物用0.025% A-P、0.05% A-P、0.1% A-P 表示;EP 代表酶解蛋白,0.025%、0.05%、0.1%花青素与酶解蛋白形成的复合物用0.025% A-EP、0.05% A-EP、0.1% AEP 表示。
1.2.4 溶解性测定 根据Lowry 等[14]的方法测定翅果油粕蛋白、酶解蛋白及1.2.3 中制备的不同质量比的花青素-蛋白复合物的溶解性。将样品配制成浓度为0.25 mg/mL 的蛋白溶液,分别调整pH 到3、7,室温搅拌30 min,于4000 r/min 离心10 min,收集上清液。取0.2 mL 上清液与1 mL 碱性铜溶液混合,室温放置10 min。加入0.1 mL 酚试剂迅速摇匀,继续放置30 min。以蒸馏水为空白对照,于750 nm 处测定吸光度值。以牛血清蛋白为标准物作标准曲线(y=0.0034x+0.1183,R2=0.999),上清液吸光度代入标准曲线计算蛋白含量,并按照公式计算溶解性。
式中:m:样品中蛋白质含量,mg;m1:上清液中蛋白质含量,mg。
1.2.5 起泡性和泡沫稳定性测定 根据Sze-Tao 等[15]的方法测定翅果油粕蛋白、酶解蛋白及1.2.3 中制备的不同质量比的花青素-蛋白复合物的起泡性能。取100 mL 蛋白浓度为1 g/mL 样品溶液,分别调整溶液pH 到3、7,将溶液于10000 r/min 的高速分散器中分散2 min,记录泡沫的体积。室温静置30 min后再次记录泡沫体积。按照公式计算起泡性和起泡稳定性。
式中:V0:样品溶液的起始体积,mL;V1:分散后0 min 泡沫体积,mL;V2:静置30 min 后泡沫体积,mL。
1.2.6 乳化性及乳化稳定性测定 根据Kevin 等[16]的方法测定翅果油粕蛋白、酶解蛋白及1.2.3 中制备的不同质量比的花青素-蛋白复合物的乳化性能。取100 mL 蛋白浓度为1 g/mL 样品溶液,分别调整溶液pH 到3、7,并按3:1 体积比与大豆油混合,混合后于10000 r/min 的高速匀浆机中均质2 min。从溶液底部吸取100 μL 乳状液,用0.1%的SDS 溶液稀释至5 mL。乳状液静置放置10 min,重复上述步骤。以0.1% SDS 溶液为空白,测定500 nm 处吸光度值。按照公式计算样品的乳化性及乳化稳定性。
式中:A0:乳状液0 min 时的吸光度;∆ A:乳状液在0 和10 min 吸光度之差;∆t:吸取乳状液的间隔时间,10 min。
1.2.7 抗氧化活性测定
1.2.7.1 DPPH 自由基清除能力测定 根据杨虎等[17]的方法测定样品DPPH 自由基清除能力。吸取2 mL 1 mg/mL 样液与2 mL DPPH 标准溶液混合,为样品组;2 mL 样品液和2 mL 无水乙醇混合,为对照组;2 mL 无水乙醇和2 mL DPPH 标准溶液混合,为空白组,3 组反应液室温下避光反应20 min,于517 nm处测定吸光度,按照公式计算DPPH 自由基清除率,结果以每克样品所具有的清除能力相当于多少毫克GSH 计,单位为mg/g。
式中:A1:样品组吸光度;A2:对照组吸光度;A3:空白组吸光度。
1.2.7.2 ABTS+自由基清除能力测定 根据邹容等[18]的方法测定样品的ABTS+自由基清除能力。将配制好的ABTS 储备液在室温下避光反应12~16 h,用无水乙醇稀释,使其在734 nm 处吸光度为0.7±0.02,得ABTS 工作液。取0.1 mL 1 mg/mL 样液与3.9 mL工作液混合,室温避光反应10 min 于734 nm 处测定吸光度。同时,用蒸馏水代替样品做同样处理作为空白对照。按照公式计算样品的ABTS+自由基清除率,结果以每克样品所具有的清除能力相当于多少毫克GSH 计,单位为mg/g。
式中:A0:空白对照组吸光度;A1:样品组吸光度。
1.2.7.3 总还原力测定 根据秦丹丹[19]的方法测定样品总还原力。取1 mL 1 mg/mL 样液与2 mL 0.2 mol/L 磷酸盐缓冲液(pH6.6)、2 mL 1%铁氰化钾溶液混匀,50 ℃水浴20 min,快速冷却后加入2 mL 10%三氯乙酸溶液,混匀后4000 r/min 离心10 min。吸取2 mL 上清液和2 mL 蒸馏水、0.4 mL 0.1%三氯化铁溶液混合,室温反应10 min。以蒸馏水作为空白,在700 nm 处测吸光度值。结果以每克样品所具有的清除能力相当于多少毫克GSH 计,单位为mg/g。
1.2.8 SDS-PAGE 凝胶电泳测定 根据Laemmli[20]的方法测定样品分子量,具体实验步骤如下:根据表1 制备12%分离胶和5%浓缩胶。将分离胶和浓缩胶先后灌入制胶器,待凝固后,将胶体放置于装有电极缓冲液的电泳槽中,浸泡10 min 左右,小心拔出梳子。吸取1 mL 样品溶液分别与1 mL 未含β-巯基乙醇和含有β-巯基乙醇的样品缓冲液混合,沸水浴5 min,于12000 r/min 离心2 min,取20 µL 上样。保持电压80 V 持续电泳,直到样品距离底部0.5~1 cm 处停止电泳。电泳结束后,小心取出分离胶于考马斯亮蓝(G-250)染液中。染色结束后,将分离胶转移至脱色缸,使用提前配制的甲醇-冰乙酸脱色液脱色,直到凝胶上蛋白分子量条带清晰可见。
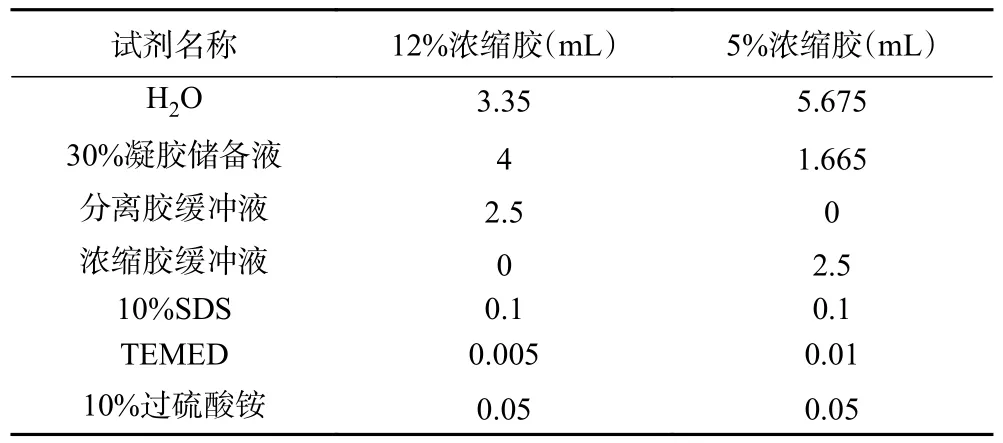
表1 分离胶和浓缩胶的制备Table 1 Preparation of the separating gel and stracking gel
1.2.9 本征荧光光谱和紫外吸收光谱测定 根据Xiong 等[21]的方法测定样品本征荧光光谱。将未加花青素的蛋白溶液和复合物溶液均稀释至蛋白浓度为0.5 mg/mL,固定激发波长为280 nm,狭缝宽度为5 nm,连续扫描记录300~500 nm 范围内的发射光谱,即为复合物的本征荧光光谱。
将未加花青素的蛋白溶液和复合物溶液稀释均至蛋白浓度为1 mg/mL,在200~400 nm 范围内进行紫外吸收光谱扫描,得紫外吸收光谱。
1.3 数据处理
所有试验均重复进行3 次,结果以平均值±标准差表示。所有的数据使用SPSS Statistics 18.0 进行ANOVA 差异显著性分析及相关性分析,当P<0.05时,差异性显著。处理完毕后用Origin 8.0 作图。
2 结果与分析
2.1 复合物制备pH 条件确定
由表2 可知,pH 在3~11 范围内变化时,随着pH 的升高,翅果油粕蛋白对DPPH 自由基的清除能力逐渐增强,酶解蛋白清除DPPH 的能力呈先增强后降低的趋势,且在pH7 时最大,GSH 当量值为30.05 mg/g,远高于相同pH 条件下的翅果油粕蛋白。酶解蛋白的抗氧化能力强,这是由于小分子肽获得氢离子的可用性强[22]。即与天然蛋白相比,小分子量的酶解蛋白终止自由基链式反应能力更强。加入花青素修饰蛋白结构后,形成的花青素-蛋白结合复合物的DPPH 自由基清除能力均有所提高,其中花青素-翅果油粕蛋白复合物在pH7 制备条件下的DPPH自由基清除能力最强,GSH 当量值为43.46 mg/g;花青素-酶解蛋白复合物在pH3 制备条件下的DPPH自由基清除能力最强,GSH 当量值为142.17 mg/g。为进一步考察花青素添加量对花青素-翅果油粕蛋白复合物和花青素-酶解蛋白复合物的抗氧化能力、功能性质和结构特性的影响,分别选取花青素-翅果油粕蛋白复合物和花青素-酶解蛋白复合物的DPPH自由基清除能力最强的pH 制备条件,即pH7 和pH3,作为下一步试验的结合pH 条件。
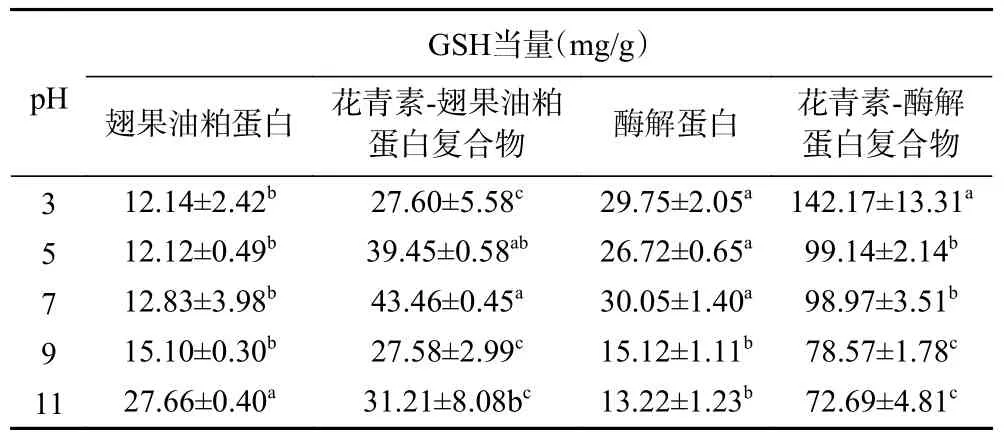
表2 不同pH 条件下花青素与蛋白和酶解产物复合物DPPH 自由基清除能力Table 2 DPPH radicial scavenging ability of complexes with protein and hydrolysate under different pH conditions
2.2 复合物溶液溶解性测定
在pH3 和pH7 条件下复合物的溶解性如图1所示,由于酶解蛋白较翅果油粕蛋白溶解度更强,花青素-酶解蛋白复合物较花青素-翅果油粕蛋白复合物也具有更好的溶解性。随着花青素质量浓度的而增大,两种复合物的溶解性均有一定程度的降低。Prigent 等[23]研究也有相同结果,添加原花青素后,蛋白质溶解度降低,其原因是带电荷的多酚类物质的附着可能会改变蛋白质的电性,从而导致蛋白质溶解性的降低。
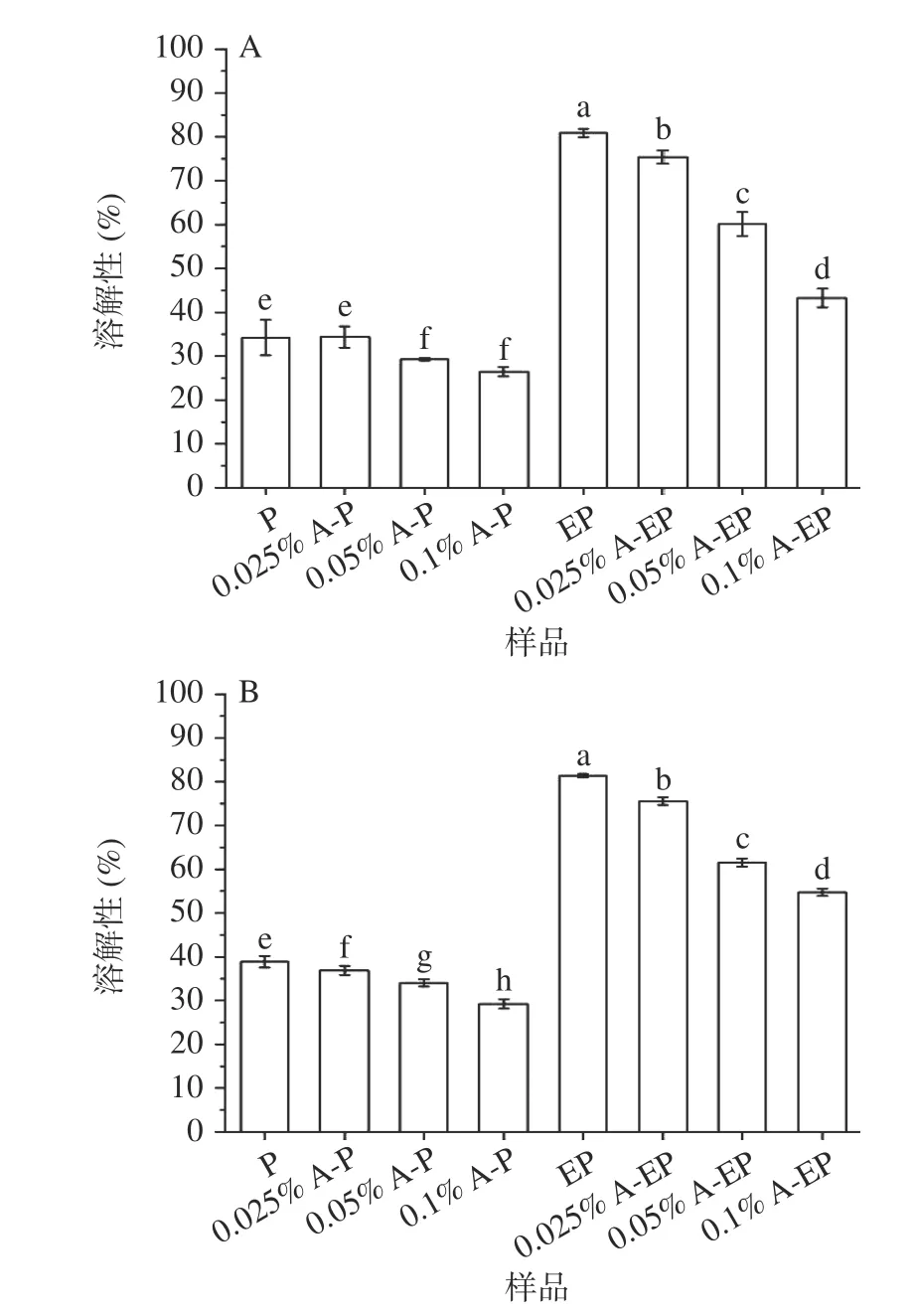
图1 pH3(A)和 pH7(B)条件下的复合物溶解度Fig.1 Solubility of complex at pH3 (A) and pH7 (B)
2.3 复合物的起泡性及起泡稳定性
泡沫是分散在气液界面连续相中的亚稳态体系,受到蛋白质溶解度,表面性质和结构构象的影响[24]。花青素-蛋白复合物的起泡性能如图2 所示,在pH3 和pH7 条件下,复合物比未添加花青素的蛋白具有更好的起泡性。pH7,花青素质量浓度0.1%的条件下,花青素-酶解蛋白复合物的起泡性和起泡稳定性达到最大值,分别为157.54%和93.60%。起泡性和起泡稳定性的改善可能是由于多酚与蛋白质形成复合物后固有黏度提高,导致排水速度降低,起泡稳定性增强[25]。多酚与蛋白相互作用导致界面膜结构改变,进而增强了起泡性能[26]。
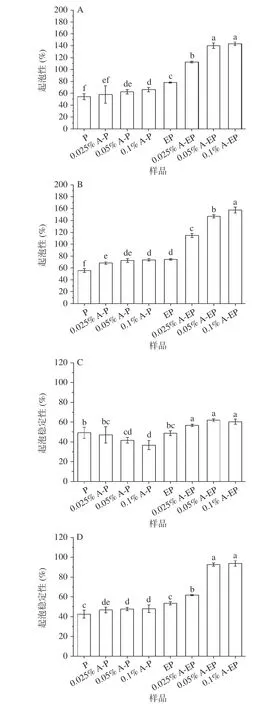
图2 pH3(A,C)和pH7(B,D)条件下的复合物起泡性和起泡稳定性Fig.2 Foaming property and foaming stability of complex at pH3 (A,C) and pH7 (B,D)
2.4 复合物的乳化性及乳化稳定性
如图3 所示,在pH3 制备条件下,复合物的乳化性高于未加花青素的蛋白,而对于酶解蛋白,复合花青素对于乳化性并未有明显的影响。在pH7 制备条件下,复合物的乳化性能高于未加花青素的蛋白。在pH7 制备条件下,花青素质量浓度0.1%的条件下,花青素-酶解蛋白复合物的乳化性和乳化性能稳定性较好,分别提高至156.60%和81.48%。复合物乳化性能的提升,可能是由于多酚羟基与蛋白质残基结合,改变了蛋白质的构象,导致更多的疏水基团暴露,结合油滴的能力增强,从而增强了乳化性能[25]。综上所述,花青素结合法与酶水解法的协同作用能有效地提高复合物的功能性质。
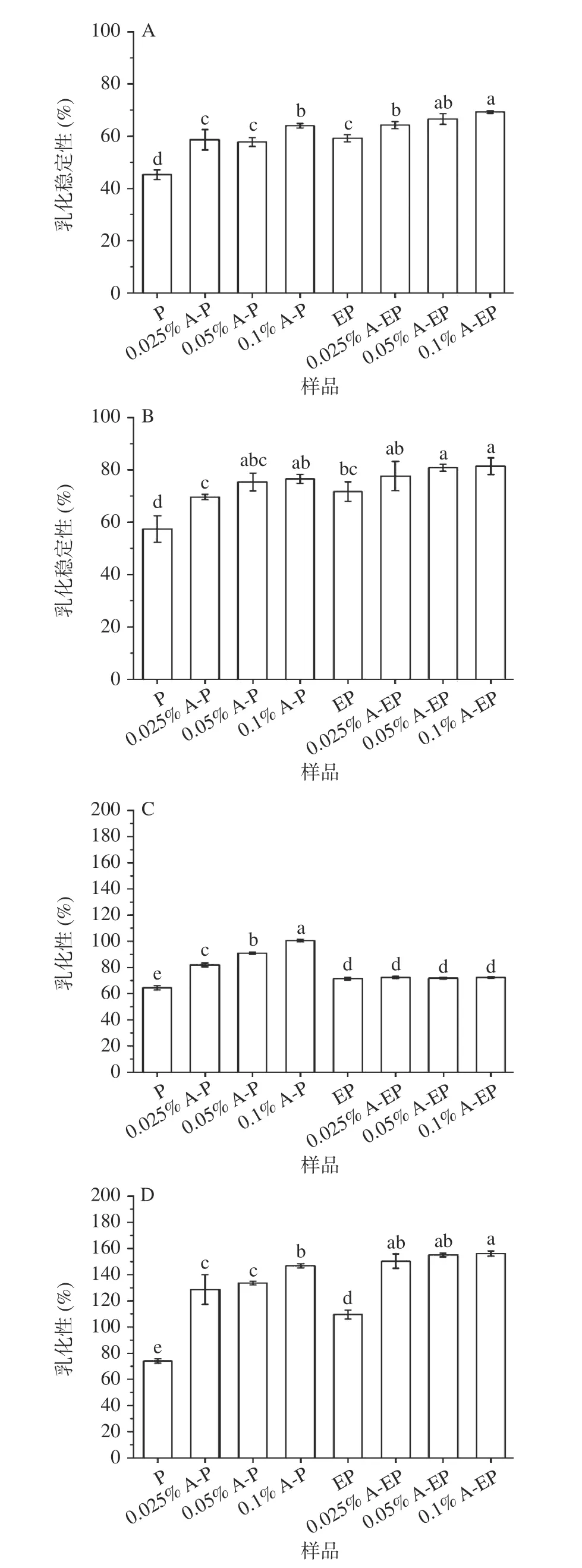
图3 pH3(A,C)和pH7(B,D)条件下的复合物乳化性和乳化稳定性Fig.3 Emulsibility and emulsion stability of complex at pH3(A,C) and pH7 (B,D)
2.5 复合物的体外抗氧化能力
花青素对翅果油粕蛋白及酶解蛋白抗氧化能力的影响如表3 所示,花青素-蛋白复合物的抗氧化能力优于天然翅果油粕蛋白及其酶解蛋白,随着花青素质量浓度增大,复合物抗氧化能力逐渐增强。Almajano等[27]研究报道称当多酚与蛋白质相结合时,与苯环相连的自由羟基可发挥抗氧化能力。同时多酚与蛋白质形成更稳定的反应产物清除自由基。此外,花青素-翅果油粕蛋白复合物在pH7 条件的抗氧化能力较强,结合溶解度推测,这是由于较pH3 的制备条件而言pH7 条件下蛋白及复合物的溶解度更大。而在pH3 条件下制备的花青素-酶解蛋白复合物具有更强的抗氧化能力,这可能由于在酸性条件下,花青素结构稳定,表现出较强的抗氧化能力。Li 等[28]对不同pH 条件下大米蛋白与花青素结合的研究结果相同,在pH3 条件下,大米蛋白与花青素结合后具有最强的抗氧化能力,蛋白质二级结构表明pH3 条件下大米蛋白具有更强的柔韧性和未折叠的结构,更容易与DPPH 和ABTS+自由基反应。综上所述,通过酶解和花青素结合协同作用,在pH3 条件下,向酶解翅果油粕蛋白中添加0.1%质量浓度的花青素制备花青素-酶解蛋白复合物可显著的提高翅果油粕蛋白的抗氧化性能。
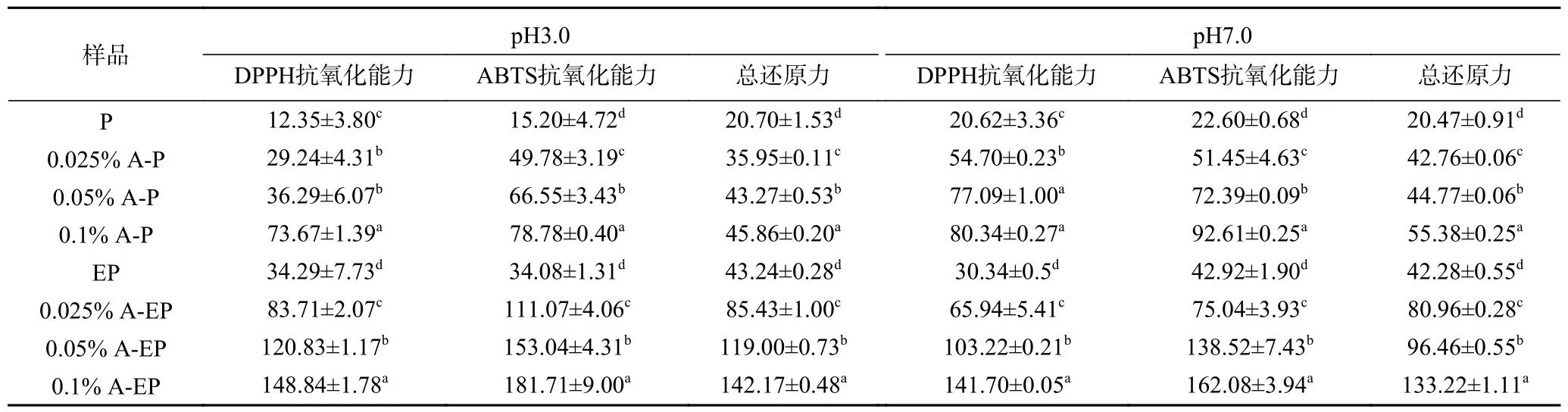
表3 pH3 和pH7 复合物的抗氧化能力(mg GSH·g-1)Table 3 Antioxidant capacity of complex at pH3 and pH7 (mg GSH·g-1)
2.6 复合物的SDS-PAGE 凝胶电泳测定结果
图4 所示为利用SDS-PAGE 研究与花青素结合后蛋白亚基的变化,复合物电泳结果图。在非还原和还原条件下,花青素-翅果油粕蛋白复合物在31.0~66.2 kDa 的条带强度较翅果油粕蛋白均有所增强,而22.0~14.0 kDa 之间的条带强度有所下降,且复合物均为出现新的蛋白条带;花青素-酶解蛋白复合物的条带强度较酶解蛋白也有所增强。这与Sui 等[24]研究结果相同,蛋白与多酚通过非共价作用结合,未发生共价交联反应,没有形成股具体配合物,未改变蛋白质四级结构。因此,推测花青素通过疏水相互作用、氢键等非共价作用力,附着在蛋白质的多酚结合位点上,进一步证明了复合物的形成是由非共价作用驱动的。
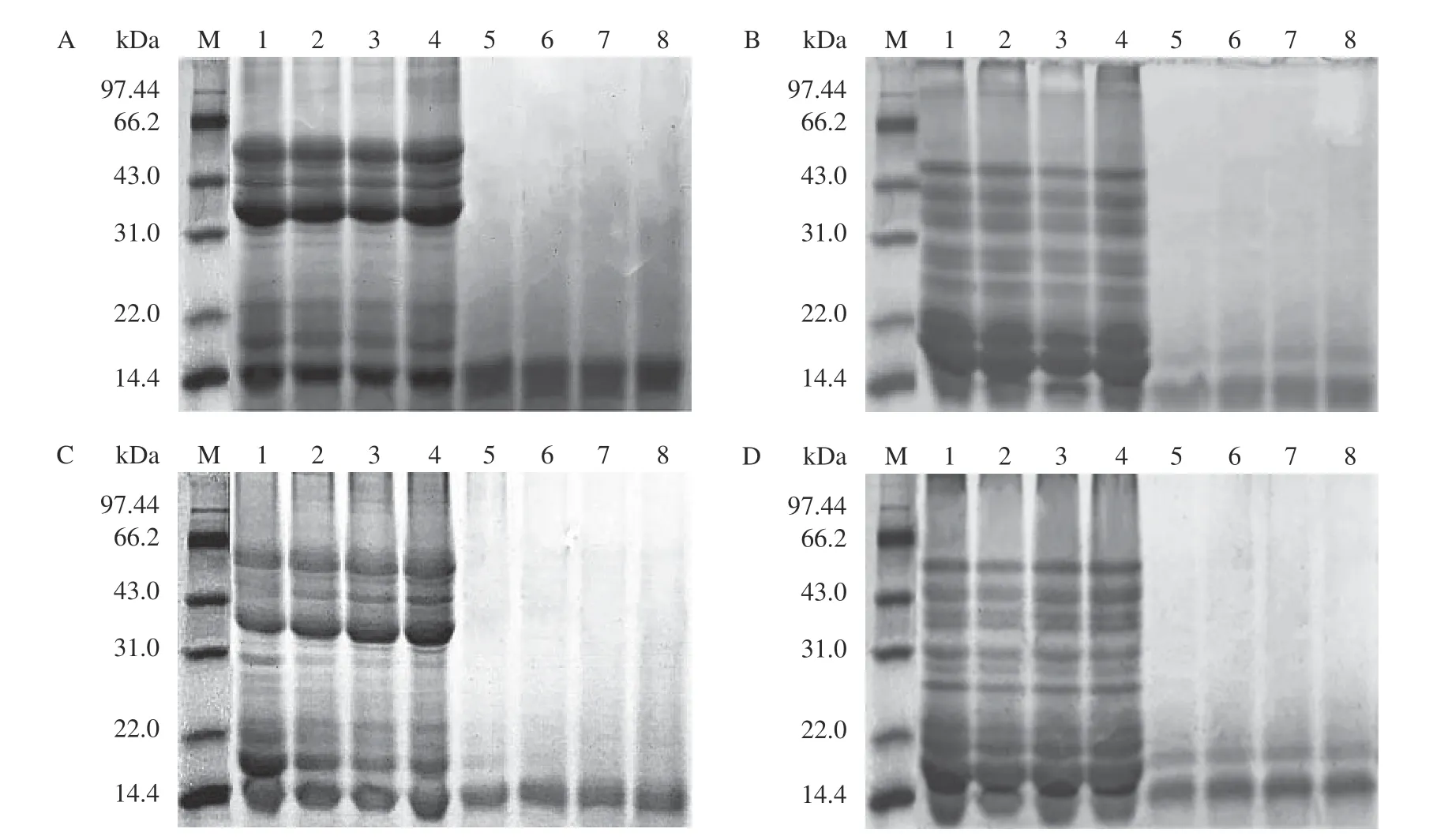
图4 pH3(A,B)和pH7(C,D)条件下的复合物的电泳谱图Fig.4 SDS-PAGE profiles of complex at pH3 (A,B) and pH7 (C,D)
2.7 复合物的本征荧光光谱测定结果
蛋白质的固有荧光是由于色氨酸和酪氨酸残基在280 nm 的激发波长下发射荧光产生的,蛋白质构象的改变、亚基的结合和变性会引起发射光谱的变化[29],因此荧光光谱可用于研究花青素-蛋白复合物结构的变化[10]。在不同pH 条件下,添加不同质量浓度花青素的翅果油粕蛋白及其酶解蛋白的内源荧光光谱如图5 所示,随着花青素质量浓度的增加,荧光强度逐渐减弱,表明青素与蛋白质之间存在相互作用,促使蛋白质分子构象的改变,荧光强度减弱[30]。Li 等[28]的研究呈现相同的结果,通过猝灭机理研究表明,花青素与蛋白之间通过疏水相互作用和氢键结合,导致荧光静态猝灭。此外,随着花青素质量浓度的增大,两种花青素-复合物的最大发射波长均发生了蓝移,表明色氨酸与酪氨酸周围的微环境极性减小,疏水性增强,从而引起蛋白结构的变化[31]。结合紫外光谱分析,花青素与蛋白质结合导致蛋白质结构发生改变,改善了蛋白的功能性质。
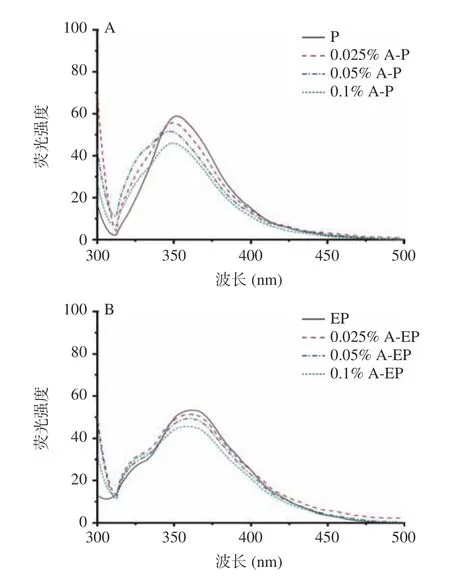
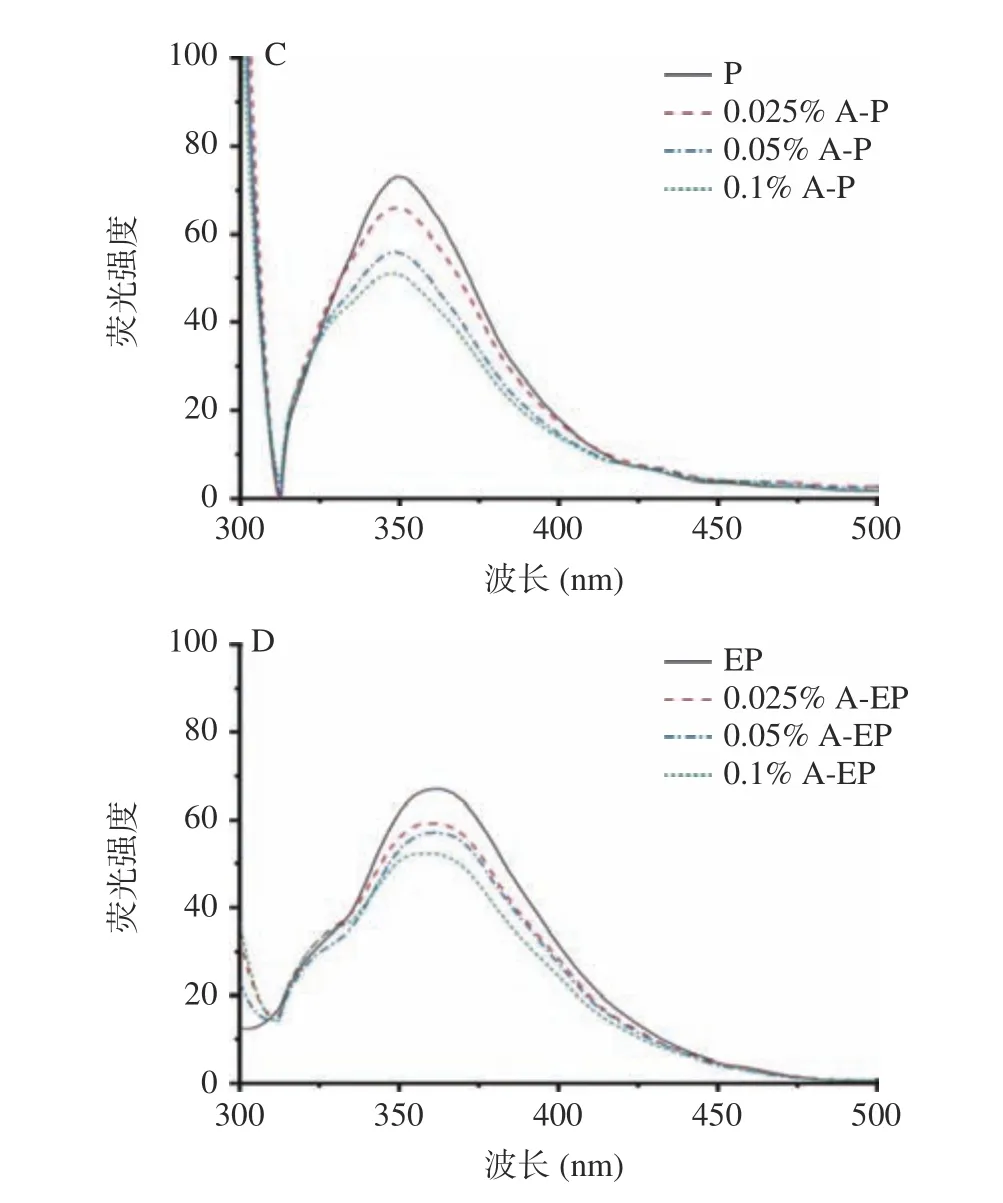
图5 pH3(A,B)和pH7(C,D)条件下的复合物内源荧光光谱Fig.5 Fluorescence spectra of the complex at pH3 (A,B) and pH7 (C,D)
2.8 复合物紫外吸收光谱测定结果
花青素与翅果油粕蛋白及其酶解蛋白复合物的紫外吸收光谱图如图6 所示,两种花青素-蛋白复合物溶液在275 nm 附近有明显的吸收峰,随着花青素质量浓度增大,复合物溶液紫外吸收带的强度增强,表明疏水氨基酸与花青素的芳香基团之间可能存在疏水相互作用[28]。此外,根据275 nm 处的吸收峰是由于蛋白质分子中的色氨酸和酪氨酸残基的芳杂环π-π*跃迁引起的[29],这可能是由于花青素与蛋白质中的色氨酸残基结合,形成新的共轭体系,增加了ππ*跃迁所需能量,导致复合物的紫外吸收增强。紫外吸收光谱结果表明,花青素与翅果油粕蛋白及酶解蛋白之间通过相互作用形成了复合物,这与荧光光谱分析结果一致。

图6 pH3(A,B)和pH7(C,D)件下的复合物的紫外全波长扫描Fig.6 UV of the complex at pH3 (A,B) and pH7 (C,D)
3 结论
本文研究了花青素结合对翅果油粕蛋白及其酶解蛋白功能性质、结构性质和抗氧化活性的影响。实验结果表明,花青素结合法可有效的改善翅果油粕蛋白及其酶解蛋白的乳化性能,起泡性能和抗氧化能力。这可能是由于花青素与蛋白存在氢键和疏水作用等非共价作用,形成了复合物,导致蛋白质结构发生变化,提高了蛋白质的功能性质。随添加花青素质量浓度的增大,复合物的乳化性,乳化稳定性,起泡性,起泡稳定性和抗氧化能力不断增强。且花青素-酶解蛋白复合物的功能性质和抗氧化能力强于花青素-翅果油粕蛋白复合物,远高于翅果油粕蛋白。以上结论表明,花青素结合法和酶水解协同作用能够进一步改善翅果油粕蛋白的功能性质和抗氧化能力,为翅果油粕蛋白的高效利用提供了一定的科学依据。

