非生物胁迫诱导的棉花酵母双杂交文库构建及GhJAZ1互作蛋白筛选
蔡 肖 李兴河 王海涛 刘存敬 唐丽媛 张素君 张建宏
(河北省农林科学院棉花研究所/农业农村部黄淮海半干旱区生物学与遗传育种重点实验室/国家棉花改良中心河北分中心,河北 石家庄 050051)
JAZ(Jasmonate ZIM-domain)蛋白作为E3泛素连接蛋白降解复合体SCFCOI1的靶蛋白,是茉莉素(jasmonic acid,JA)信号转导途径中重要的转录抑制因子之一[1-2]。JAZ蛋白不仅广泛参与植物生长发育、次生代谢物合成等生物学进程[3-4],而且在抵御生物及非生物胁迫逆境中扮演着重要角色[5]。不同JAZ基因调节逆境响应的方式不同:水稻(Oryzasativa)OsJAZ9过表达能显著提高水稻对盐和干旱的耐受性[6],OsJAZ1的超量表达则使水稻的抗旱能力降低[7];OsJAZ11能够参与调控水稻对低磷胁迫的响应[8];ZmJAZ14可增强拟南芥干旱耐受性[9];ZmJAZ15参与玉米(Zeamays)对赤霉素茎腐病的免疫调节[10];大豆(Glycinesoja)GsTIFY10和GsJAZ2在拟南芥中过量表达可提高转基因拟南芥耐盐碱的能力[11-12],而GsTIFY11b的过量表达会增加拟南芥对盐碱胁迫的敏感性[13]。
棉花(Gossypium)是重要的经济作物之一。近年来,极端天气等自然灾害频发,造成棉花生长环境和条件恶化,严重影响着棉花的产量和品质。棉花JAZ基因的鉴定分析和功能研究相继被报道,为研究其在棉花生长及逆境响应中的作用机制提供了理论依据[14-16]。Hu 等[17]发现GhJAZ2通过与R2R3-MYB 转录因子GhMYB25-like互作来负调控纤维发育。GhJAZ2还通过与GhbHLH171互作,增强植株对大丽轮枝孢菌和取食性昆虫的敏感性[18]。Xia等[19]发现GhJAZ3参与了拟南芥表皮毛的分化和伸长。GhJAZ10转基因拟南芥气孔数量显著减少,对干旱胁迫的耐受性提高[20]。过表达GaJAZ1基因的陆地棉植株耐盐性显著提高[21]。然而,有关棉花JAZ基因在非生物胁迫中的作用机制研究还少有报道。前期研究表明,陆地棉GhJAZ1基因是一个低温相关的抑制因子[22],受脱落酸和茉莉酸甲酯和低温胁迫诱导表达,在不同低温耐性棉花材料中表达量变化程度不同,但GhJAZ1在低温调控中的分子作用机理尚不清楚。
酵母双杂交技术是一种研究蛋白之间相互作用的有力工具[23]。通过构建酵母双杂交cDNA 文库,利用酵母双杂交技术筛选鉴定与目的蛋白(诱饵)相互作用的蛋白质,对于深入研究目的蛋白的作用机理、理解蛋白参与的信号传导途径和调控网络具有重要的理论指导意义。目前,利用酵母双杂交cDNA 文库筛选鉴定蛋白质相互作用关系已经在小麦[24]、棉花[25]、苦瓜[26]等多种农作物得到了广泛应用。
鉴于此,本研究以陆地棉标准系TM-1 为材料,构建棉花非生物胁迫诱导的酵母双杂交文库,以期为棉花非生物胁迫响应信号途径和蛋白互作机制的研究奠定基础,并通过对GhJAZ1 互作蛋白进行筛选,为进一步解析GhJAZ1在低温应答中的调控网络和分子作用机理提供参考依据。
1 材料与方法
1.1 试验材料和处理方法
将陆地棉标准系TM-1种子浸泡24 h,待种子露白后播种于湿润的沙子中,子叶展开后转移到Hoagland营养液中进行水培。培养条件为白天28 ℃ 16 h/夜晚26 ℃ 8 h,湿度70%。待植株第3 片真叶完全展开时,进行胁迫处理[27]。低温处理:将生长一致的棉苗移到4 ℃的培养室中处理6 h;聚乙二醇(polyethylene glycol,PEG)模拟干旱处理:17% PEG6000 处理棉苗6 h;NaCl处理:200 mmol·L-1NaCl处理棉苗6 h。胁迫处理后迅速剪取棉苗的幼嫩叶片和根,液氮速冻,-80 ℃保存。
1.2 非生物胁迫诱导的棉花酵母双杂交cDNA 文库构建
将低温、PEG、NaCl胁迫处理6 h的根和叶片进行取样,采用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法进行植物总RNA 的提取,琼脂糖凝胶电泳对总RNA的质量进行检测。将提取的各处理样品的总RNA等量混合,得到非生物胁迫处理的总RNA。参考Oligotex mRNA Midi Kit(70042,QIAGEN,德国)说明书进行mRNA分离纯化,琼脂糖凝胶电泳鉴定分离结果。
cDNA 文库的构建采用Gateway 位点特异性重组技术完成,具体方法参照CloneMiner™ II cDNA 文库制备试剂盒(A11180,Invitrogen,上海)说明书,初级文库载体为pDONR222 vector,次级文库载体为pGADT7-DEST。重组质粒电转大肠杆菌DH10B,取转化后细菌原液10 μL 稀释1 000 倍后,从中取出50 μL 涂布含相应抗性(初级文库菌液为卡那霉素抗性,次级文库菌液为氨苄青霉素抗性)的LB平板。第二天计数进行库容量鉴定,计算方法如下:
每毫升大肠杆菌文库菌液库容量(CFU·mL-1)=50 μL菌液涂布的平板上的克隆数/50 μL×100倍×1 000 μL
文库总克隆数(CFU)=每毫升大肠杆菌文库菌液库容量(CFU·mL-1)×文库菌液总体积(mL)。
随机挑取克隆,分别以M13-F/R和pGADT7-DESTF/R 为引物对初级文库和次级文库进行菌落PCR 检测,鉴定重组率和插入片段长度。
构建好的次级文库菌液加入含氨苄青霉素的LB培养基过夜扩增培养,利用PureLink™ HQ 小提质粒DNA纯化试剂盒(K210001,Invitrogen,上海)进行文库质粒抽提,将质粒转化酵母菌株Y187(CC306,Coolaber,北京),在SD/-Leu 平板上检测转化效率并筛选收集转化子,获得酵母AD文库菌液,计算酵母文库滴度:
文库滴度(cells·mL-1)=平板生长的克隆数/涂板体积×稀释倍数。
1.3 pGBKT7-GhJAZ1 诱饵载体构建、自激活检测及毒性检测
根据GhJAZ1基因编码序列(coding sequence,CDS)和pGBKT7 载体设计引物pGBKT7-GhJAZ1-F 和pGBKT7-GhJAZ1-R,以pEASY-T3-GhJAZ1质粒为模板扩增并回收目的片段,利用EcoRⅠ(FD0275,Thermo,上海)和BamHⅠ(FD0054,Thermo,上海)双酶切载体pGBKT7 并回收线性化载体,采用T4 DNA 连接酶(EL0011,Thermo,上海)将上述目的片段和线性化载体连接,重组产物转化DH5α 大肠杆菌化学感受态细胞(C502,Vazyme,南京),提取大肠杆菌中pGBKT7-GhJAZ1bait 质粒,酶切后用1%琼脂糖凝胶电泳检测,经测序验证后利用质粒抽提试剂盒(DP116,天根,北京)进行bait质粒抽提。
将诱饵载体质粒pGBKT7-GhJAZ1和pGADT7-T共转化Y2H Gold 酵母菌株感受态,涂布在SD/-Leu/-Trp/X-α-gal(DDO/X)、SD/-Trp/-Leu/-His/X-α-gal(TDO/X)和SD/-Trp/-Leu/-His/-Ade/X-α-gal/AbA(DDO/X/A)培养基上,30 ℃倒置培养,观察生长情况,以确定诱饵蛋白的自激活活性及对酵母细胞的毒性。以pGBKT7-Lam + pGADT7-T为阴性对照,pGBKT7-53 + pGADT7-T为阳性对照。
1.4 酵母双杂交文库筛选及回转验证
将诱饵质粒pGBKT7-GhJAZ1 转化酵母感受态Y2HGold,取4~5 mL含诱饵质粒pGBKT7-GhJAZ1的新鲜酵母菌液,与1 mL酵母AD次级文库菌液混合加入到灭菌锥形瓶中,加入45 mL 含50 μg·mL-1kanamycin 的2×酵母膏胨葡萄糖琼脂培养基(yeast extract peptone dextrose medium with agar,YPDA)(PM2011,Coolaber,北京)液体培养基中,30 ℃、50 r·min-1条件下低速培养24 h,显微镜下观察酵母杂交液中出现三叶草状结合子,停止培养。1 000 ×g离心10 min 收集菌体重悬于含50 μg·mL-1kanamycin 的0.9% NaCl 液体培养基中,将菌液涂布SD/-Trp/-Leu/-His/X-α-Gal/AbA(TDO/X/A)初筛平板,30 ℃恒温培养3~5 d,将初筛平板上的蓝色克隆转移到高强度筛选QDO/X/A 培养基上,进一步观察酵母克隆生长情况。
参照酵母质粒提取试剂盒(DP112,天根,北京)对QDO/X/A 上生长的蓝色阳性克隆抽提酵母质粒,转化大肠杆菌DH5α,挑取含氨苄青霉素的溶菌肉汤(lysogeny broth,LB)平板上生长的单菌落进行质粒扩增,抽提的质粒用于测序和一对一回转验证。测序得到确定阳性克隆的序列信息,即为GhJAZ1 的候选互作蛋白。将构建好的pGBKT7-GhJAZ1bait 质粒分别与抽提的阳性克隆质粒共转化Y2H Gold酵母菌株,在QDO/X/A 平板上培养筛选再次生长蓝色克隆的质粒。
1.5 酵母双杂交一对一互作验证
克隆候选互作蛋白对应基因的CDS,参考1.3中的载体构建方法,构建pGADT7-GhJAZ12_A、pGADT7-GhJAZ12_D、pGADT7-GhPP2-A13和pGADT7-GhKINB1重组质粒。分别将重组质粒与pGBKT7-GhJAZ1质粒共转酵母菌株Y2HGold,涂布DDO固体培养基,待菌斑生长至2~3 mm,挑取菌斑于100 μL 0.9% NaCl溶液中震散混匀并按梯度稀释后,点板到QDO/X/A 固体培养基。30 ℃条件下倒置培养3~5 d,直至菌落长出。以质粒pGBKT7-53×pGADT7-T 和pGBKT7-Lam×pGADT7-T作为阳性对照和阴性对照。引物列表见表1。
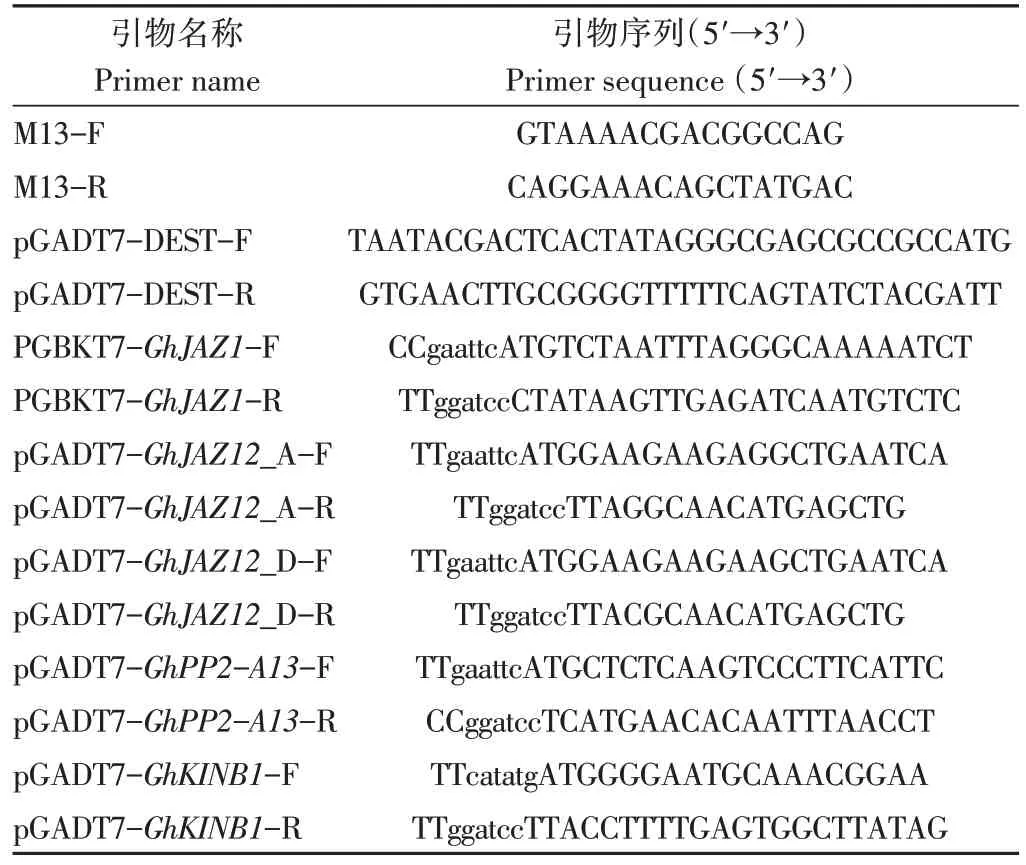
表1 本研究所用引物列表Table 1 Primers used in this study
2 结果与分析
2.1 非生物诱导的棉花酵母双杂交文库的构建
将提取的低温、PEG、NaCl 胁迫处理6 h 的棉花根和叶片总RNA 等量混合,琼脂糖电泳检测结果显示总RNA 质量良好(图1-A),可用于酵母双杂交文库的构建。对总RNA 进一步分离纯化mRNA,结果显示mRNA带型分布正确(图1-B)。反转录合成双链cDNA(double strand cDNA,ds cDNA),电泳结果表明,mRNA有效反转录且得到的cDNA分布正常(图1-C),可以用于后续试验。将dscDNA 与三框attB1 重组接头连接,BP重组反应后转化大肠杆菌,经鉴定,初级文库总克隆数为1.2×107CFU,重组率100%,平均插入片段长度>1 000 bp(图1-D、F)。将初级文库质粒与线性化质粒pGADT7-DEST进行LR重组反应,转化大肠杆菌后,获得的次级文库总克隆数为1.6×107CFU,重组率100%,平均插入片段长度>1 000 bp(图1-E、G)。以上结果表明,构建的初级文库和次级文库库容量均大于107CFU。转化酵母菌株Y187 后,获得的酵母文库滴度为5.0×107cells·mL-1,酵母克隆PCR鉴定结果显示平均插入片段长度>1 000 bp(图1-H)。以上结果表明,所构建的酵母文库符合双杂交筛选的要求,可以用于后续试验筛选。
2.2 pGBKT7-GhJAZ1自激活活性检测与毒性检测
根据GhJAZ1基因CDS序列设计引物,通过酶切连接将目标序列连接到载体pGBKT7,构建诱饵载体pGBKT7-GhJAZ1。将诱饵载体质粒pGBKT7-GhJAZ1和pGADT7-T共转化Y2HGold酵母菌株,从图2可以看出,阳性对照pGBKT7-53+pGADT7-T在SD/-Leu/-Trp/X-α-gal(DDO/X)上生长且变蓝,阴性对照pGBKT7-Lam+pGADT7-T在DDO/X上正常生长但不变蓝,pGBKT7-GhJAZ1+pGADT7在DDO/X上正常生长且变蓝,表明3组质粒均转化正常,且pGBKT7-GhJAZ1对酵母生长无毒性。pGBKT7-GhJAZ1能够在DDO/X上生长且变蓝,但在SD/-Leu/-Trp/-His/X-α-gal(TDO/X)和SD/-Leu/-Trp/-His/-Ade/X-α-gal/AbA(QDO/X/A)上均不能生长,表明GhJAZ1 在Y2H Gold 酵母菌株中无自激活活性,可以用于进行后续酵母文库筛选试验。
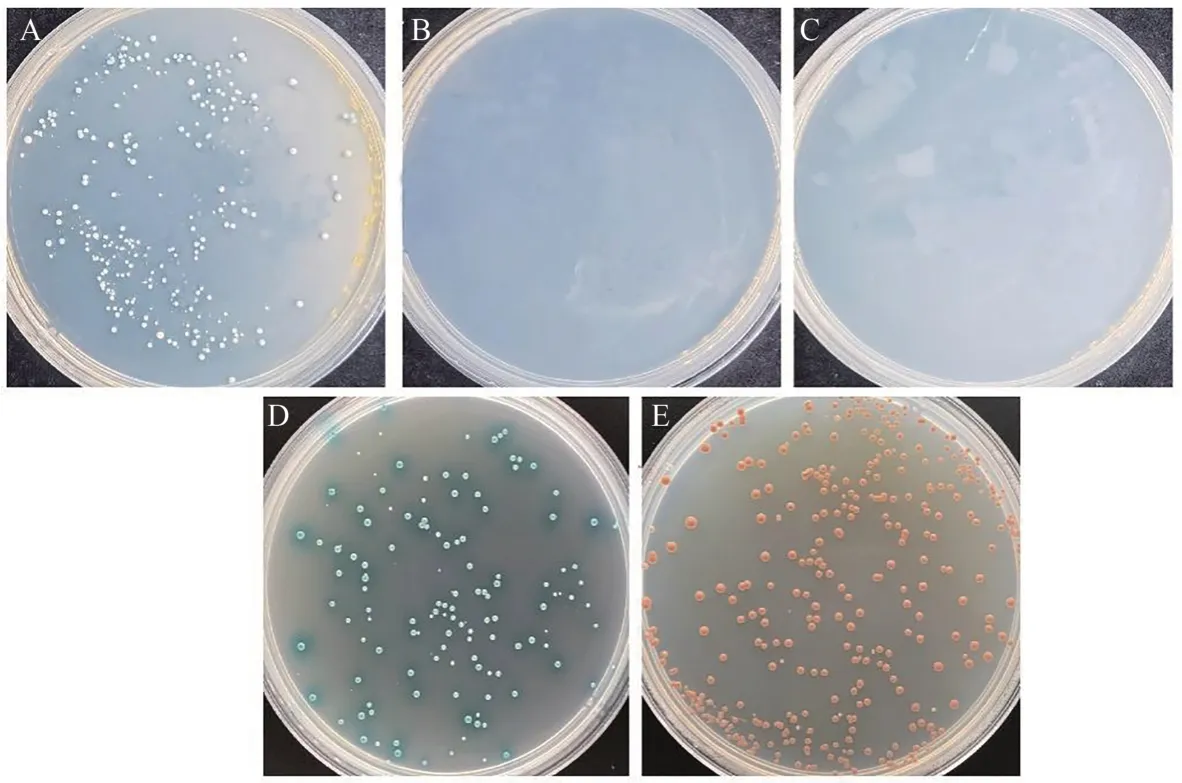
图2 GhJAZ1诱饵蛋白毒性和自激活活性检测Fig.2 Assessment of toxicity and self-activation activity of GhJAZ1 bait plasmid
2.3 酵母双杂交文库筛选GhJAZ1互作蛋白
以pGBKT7-GhJAZ1为诱饵,采用Mating法筛选构建的非生物胁迫诱导的棉花酵母双杂交cDNA 文库。在SD/-Leu/-Trp/-His/-Ade/X-α-gal/AbA(QDO/X/A)平板上筛选培养,有72个克隆生长变蓝(图3)。对QDO/X/A 上生长的蓝色阳性克隆抽提酵母质粒,转化大肠杆菌进行阳性克隆prey 质粒扩增,测序确定阳性克隆的序列信息。除去比对到未知蛋白以及重复比对到同一个蛋白的阳性克隆后,将构建好的pGBKT7-GhJAZ1质粒分别与阳性克隆prey质粒共转化Y2HGold酵母菌株,在QDO/X/A平板上筛选再次生长为蓝色克隆的文库质粒,共获得11个回转阳性的互作蛋白(表2)。对筛选到的靶蛋白进行分析发现,互作蛋白功能涉及碳水化合物代谢、脂肪酸生物合成、氧化还原反应、防御反应、蛋白质折叠以及蛋白质泛素化修饰等多种生物学过程。
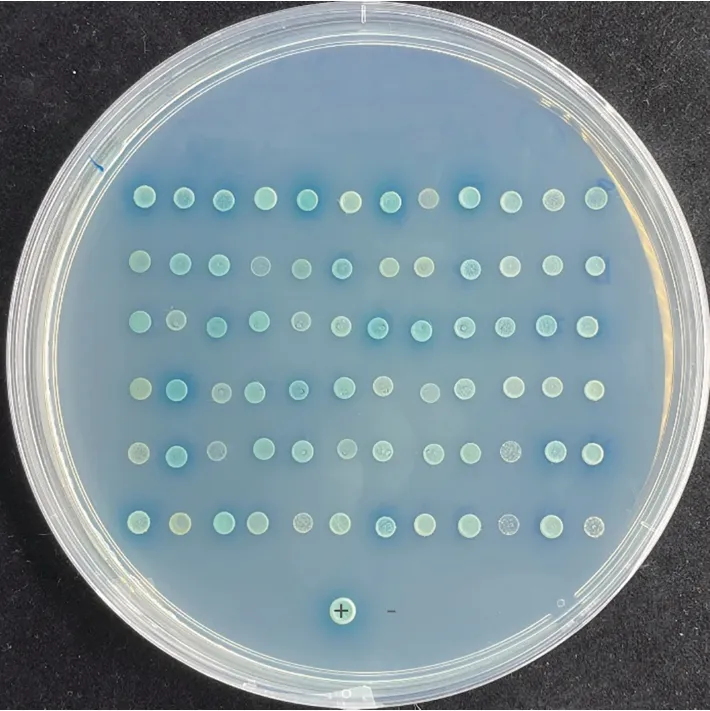
图3 高严谨度平板筛选的阳性克隆(QDO/X/A)Fig.3 Clones on highly stringent screening plate(QDO/X/A)
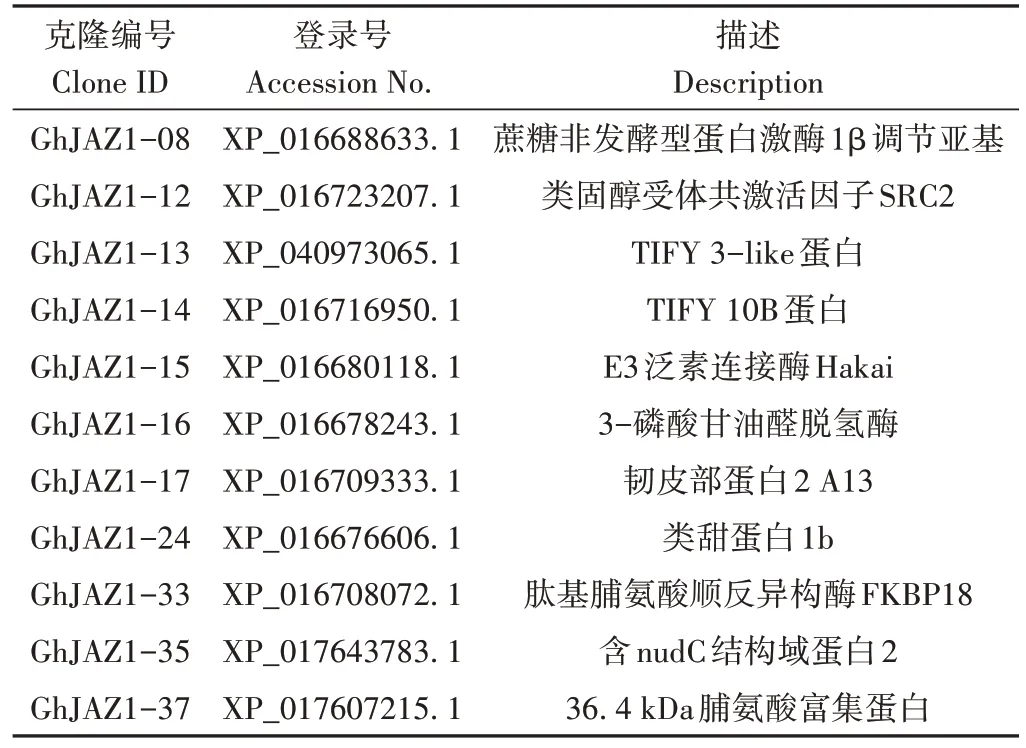
表2 酵母阳性克隆质粒测序结果Table 2 Plasmids sequencing results of positive clones in yeast
2.4 Y2H一对一验证蛋白的相互作用关系
为了验证阳性克隆的准确性,降低酵母双杂交筛选的假阳性率,根据筛选阳性克隆的注释结果、公共数据库中基因非生物胁迫的表达模式,并结合已有文献报道等信息,选取4 个候选互作蛋白克隆其对应基因的全长CDS,构建到pGADT7 载体,分别与pGBKT7-GhJAZ1质粒共转酵母菌株Y2HGold,确认4 个候选互作蛋白与GhJAZ1 的互作关系。4 个蛋白中,包括2 个TIFY/JAZ 家族成员GhJAZ12_A(XP_040973065.1)和GhJAZ12_D(XP_016716950.1)、1 个F-box 蛋白GhPP2-A13(XP_016709333.1)以及1 个蛋白激酶调节亚基GhKINB1(XP_016688633.1)。点板验证结果显示,pGBKT7-GhJAZ1×pGADT7-GhJAZ12_A、pGBKT7-GhJAZ1×pGADT7-GhJAZ12_D、pGBKT7-GhJAZ1×pGADT7-GhPP2-A13、pGBKT7-GhJAZ1×pGADT7-GhKINB1以及阳性对照pGBKT7-53×pGADT7-T 和阴性对照pGBKT7-Lam×pGADT7-T 在二缺板(DDO)上均可以长出菌斑并正常生长(图4),说明质粒转化成功。除阴性对照外,所有共转质粒均能在QDO/X/A 上生长且变蓝(图4),表明在酵母细胞内GhJAZ1 与4 个候选蛋白GhJAZ12_A、GhJAZ12_D、GhPP2-A13和GhKINB1均存在相互作用。

图4 GhJAZ1与部分候选互作蛋白的酵母双杂交验证Fig.4 Verification of interaction relationships between GhJAZ1 and candidate proteins by yeast two-hybrid
3 讨论
JAZ 蛋白在植物抵御非生物胁迫中发挥着重要作用。前人发现,GhJAZ1基因表达受低温胁迫诱导且在不同低温耐性棉花材料中存在表达量的差异,表明GhJAZ1 参与了棉花低温响应[22],但GhJAZ1 参与低温应答的分子机制及其可能发挥的其他生物学功能还不明确。酵母双杂交是一种高效筛选互作蛋白、研究蛋白相互作用的分子生物学方法,是解析蛋白质的分子作用机制和调控网络常用的一项技术手段。本研究利用Gateway 方法构建了棉花非生物胁迫诱导的酵母双杂交cDNA文库,为互作蛋白的筛选奠定了基础。
提高文库质量有利于减少酵母双杂交结果的假阴性[23]。高质量的酵母双杂交cDNA 文库构建依赖于高质量cDNA 文库的制备。本研究对获得的cDNA 初级和次级文库的滴度、重组率及插入片段大小的检测结果表明,构建的cDNA 文库具有较好的完整性,较广泛的覆盖度以及良好的cDNA 片段多态性等特点,满足酵母文库构建的要求。
本研究构建的pGBKT7-GhJAZ1诱饵载体在酵母系统中无毒性和自激活活性。通过筛选酵母双杂交文库获得了11 个可能与GhJAZ1 相互作用的蛋白。由于酵母双杂交文库筛选结果存在假阳性的问题,有必要利用Y2H 技术对候选互作蛋白的互作关系进行一对一验证[23]。本研究利用Y2H 技术证明了GhJAZ1 蛋白与GhJAZ12、GhPP2-A13 和GhKINB1 之间存在相互作用,后续仍需利用其他蛋白互作技术,如双分子荧光互补(bimolecular fluorescence complementation,BiFC)、免疫共沉淀(co-Immunoprecipitation,Co-IP)、Pull down等技术对互作关系深入确认。
研究表明,JAZ 蛋白在棉花纤维发育、生物胁迫和非生物胁迫响应等生物学进程中发挥着重要作用,但在不同生理过程中与JAZ互作的蛋白质及其调控机制不尽相同。Li 等[16]分析GhJAZ 蛋白的互作模式发现,大多数GhJAZ 蛋白不仅可以与GhCOI1、GhMYC2/3 和GhNINJA 等蛋白相互作用参与JA 信号转导,还可以有选择性地通过与其他JAZ蛋白形成同源或异源二聚体的形式来发挥功能。GhJAZ2通过与R2R3-MYB 转录因子GhMYB25-like互作从而负调控棉花纤维发育[17],还可以通过与GhbHLH171互作增强植株对大丽轮枝孢菌和取食性昆虫的敏感性[18]。GhJAZ11_D 可以与棉花GhHOX3、GhEIN3蛋白发生相互作用,进一步转基因试验结果表明GhJAZ11_D 可能是通过与EIN3 之间互作使JA 和乙烯(ethylene,ET)信号途径协同,从而正向调控棉花纤维的伸长发育[28]。在花粉发育过程中,转录抑制因子GhWRKY22可以与多个GhJAZs基因的启动子直接结合从而调控JAZs基因的表达,进一步酵母双杂交发现,GhJAZ8-A、GhJAZ13-A通过与GhMYB24相互作用调控JA 信号转导从而影响棉花花药/花粉的发育[29]。本研究筛选的GhJAZ1 互作蛋白中也包括了2个JAZ 家族蛋白,分别是与拟南芥JAZ12同源的陆地棉A亚组蛋白GhJAZ12_A(XP_040973065.1)和D亚组蛋白GhJAZ12_D(XP_016716950.1),说明GhJAZ1 可以与GhJAZ12互作形成异源二聚体来发挥功能。本研究未筛选鉴定到与GhJAZ1相互作用的COI1、MYC2等JA 信号通路关键因子,GhJAZ1 是否可以通过与这些关键因子互作来参与JA 信号通路转导仍需要后续的深入验证。
F-box家族蛋白韧皮部蛋白2(phloem protein 2,PP2)被认为在植物多种逆境胁迫中发挥重要的调节作用。AtPP2-B11负调控拟南芥干旱胁迫响应,而在盐胁迫响应中则发挥正调控作用[30-31]。AtPP2-B11 能与SCF复合体蛋白SKP1 互作,暗示了其具有F-box 蛋白的功能,可以作为SKP1/Cullin/F-box E3 连接酶复合体SCFAtPP2-B11的底物受体[32]。小麦PP2-A13基因响应逆境胁迫,并与SCF复合体接头蛋白SKP1相互作用[24]。拟南芥PP2-A13基因受光周期诱导表达,仅在短的光周期下表达,对于植物对短光条件的适应至关重要[33]。本研究鉴定到一个与拟南芥PP2-A13同源的GhJAZ1互作蛋白GhPP2-A13(XP_016709333.1),推测其可能参与了棉花对非生物胁迫的响应,二者互作调控胁迫响应的分子机制有待深入研究。
GhKINB1编码一个SnRK1(蔗糖非发酵-1-型相关蛋白激酶1,SNF1-related protein kinase 1)的β1 调节亚基。已有研究表明,JA 可能与SnRK 信号协同作用以响应应激条件。例如,JA 响应元件是大麦SnRK1基因启动子区最常见的元件之一[34];超表达OsSnRK1a启动了JA 介导的防御反应[35]。然而目前为止鲜有关于JAZ 蛋白与SnRK 及其复合体直接相互作用参与防御反应的报道,GhJAZ1 是否通过与GhKINB1 互作调控棉花逆境响应及其可能的互作调控方式仍需后续试验进一步验证。
4 结论
本研究开展了陆地棉低温、PEG、NaCl处理的非生物胁迫酵母双杂交cDNA 文库构建,经鉴定,构建的文库滴度为5.0×107cells·mL-1,平均插入片段长度>1 000 bp,可以用于蛋白互作筛选。以pGBKT7-GhJAZ1为诱饵,筛选上述酵母文库,共获得11个与GhJAZ1相互作用的候选蛋白,功能涉及碳水化合物代谢、脂肪酸生物合成、氧化还原反应、防御反应、蛋白质折叠以及泛素化修饰等多种生物学进程。利用酵母双杂交点对点技术进一步确认了GhJAZ1 与GhJAZ12_A、GhJAZ12_D、GhPP2-A13 和GhKINB1的相互作用关系。进一步阐明了GhJAZ1与候选蛋白的互作机制将是今后的重点研究方向。

