产细菌素粪肠球菌EF-3的分离鉴定及其细菌素理化特性
车笑吟,涂会鑫,杨舒涵,李琪瑶,董文龙
(吉林农业科技学院动物科技学院,吉林 吉林 132109)
奶牛乳房炎是奶牛饲养过程中一种危害极大的疾病,一旦发生会对奶牛胎次和产奶量产生影响,降低鲜奶的适口性和营养成分[1],而且增加治疗成本和额外劳动力[2]。研究表明,奶牛乳房炎可由大肠杆菌(Escherichiacoli,E.coli)、金黄色葡萄球菌(Staphylococcusaureus,S.aureus)和化脓隐秘杆菌(Trueperellapyogenes,T.pyogenes)等多种病原体引起,其中S.aureus引起的奶牛乳房炎约占50%[3]。S.aureus具有多种毒力因子,其产生的肠毒素sea、seb、sec、sed和see等会溶于牛奶中,如不慎饮用易使人患扁桃体炎和咽喉炎等疾病[4]。目前,使用细菌素是治疗奶牛乳房炎较为理想的方法,可避免抗生素治疗后在牛奶中的残留,不破坏人体内正常的益生菌,不会引起部分人对抗生素的过敏反应,不会使人体对抗生素产生耐药性,且不易引发重复感染。
S.aureus极易产生耐药性[5],治疗该菌引起的奶牛乳房炎主要有以下难点:S.aureus可能带有多重耐药基因,对多种抗生素具有耐药性,限制了治疗药物的选择;S.aureus还能侵入宿主细胞内,从而避免了部分抗生素的抗菌作用;S.aureus含有大量可移动遗传元件,可实现耐药基因在不同菌株间的转移[6]。新疆牛源S.aureus临床抗菌素敏感性调查结果显示,牛源S.aureus呈现出多重耐药的特征,大部分菌株同时对5种以上常用类型抗生素耐药[7]。奶牛乳房炎的临床治疗,主要有中医疗法和西医疗法,中医疗法易受药物质量、有效成分等因素影响,易出现治疗效果不佳的情况,且治疗成本偏高;西医疗法中长期使用抗生素易导致耐药菌株增多,治疗后病症易反复[8]。据报道,牛奶中80%的残留药物来源于治疗奶牛乳房炎的药品[9]。细菌素是一种水解蛋白类物质,能有效地渗透生物膜且对人体无害。与抗生素相比,细菌素的抗菌谱较窄,具有一定的专一性和靶向性,且不易产生耐药性[10]。本试验从平菇中分离出1株产细菌素粪肠球菌,该细菌素仅对S.aureus具有抗菌作用,该细菌素有望作为动物生产生活中S.aureus感染的替抗产品。
1 材料与方法
1.1 试验材料
1.1.1 材料 新鲜平菇,购自吉林省吉林市某市场。
1.1.2 菌种 标准株:S.aureusATCC25923、E.coliATCC25922、T.pyogenesATCC19411;奶牛乳房炎临床分离株:S.aureus:S1、S2,E.coli:E1、E2,T.pyogenes:T1、T2,均由吉林农业科技学院动物科技学院动物微生物与免疫研究室保存。
1.1.3 主要试剂 MRS肉汤培养基、MRS琼脂培养基和MH琼脂培养基,均购自青岛海博生物技术有限公司;革兰染色试剂,购自北京索莱宝科技有限公司;DNA提取试剂盒,购自南京诺唯赞生物科技有限公司;过氧化氢酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶和蛋白酶K,均购自生工生物工程(上海)股份有限公司。
1.1.4 主要仪器 超净工作台和PCR仪,均购自赛默飞世尔科技公司;恒温气浴振荡器,购自上海博迅医疗生物仪器股份有限公司;高速离心机,购自盐城市凯特实验仪器有限公司;凝胶成像仪,购自伯乐生命医学产品公司。
1.2 试验方法
1.2.1 细菌的分离和纯化 无菌条件下将平菇接种于乳酸细菌MRS肉汤培养基中,置于37 ℃摇床培养至菌液浑浊,涂布于MRS琼脂培养基上,37 ℃恒温过夜培养后进行纯化,直至出现单菌落。
1.2.2 产抗菌物质菌株的筛选 将纯化后的单菌落接种于MRS肉汤培养基,37 ℃摇床培养至对数生长期,室温6 000 r/min离心10 min,取上清液,使用0.22 μm滤膜抽滤除菌,抽滤后的上清液放入旋转蒸发仪,于50 ℃进行浓缩,将其体积浓缩为原体积的1/10,再次抽滤得到无菌浓缩上清液。在MH琼脂培养基上以S.aureusATCC25923为指示菌采用琼脂扩散法进行抑菌试验,每孔加入200 μL经针式过滤器过滤后的浓缩上清液,室温静置1 h,37 ℃恒温培养16 h,测量抑菌圈直径,以此筛选产抗菌物质的菌株。为减小试验误差,所有抑菌试验均进行3次重复,所得抑菌圈大小取平均值。
1.2.3 抗菌物质的初步确证 为排除过氧化氢的影响,在2 mL浓缩上清液中添加0.02 g过氧化氢酶,37 ℃水浴4 h后煮沸10 min,以未加入过氧化氢酶的原始浓缩上清液作为对照组;为了排除酸性物质的影响,将浓缩上清液用氢氧化钠和乳酸调节至pH=7,以未调节pH的原始浓缩上清液作为对照组,按1.2.2进行抑菌试验。
1.2.4 菌落和菌体形态的观察 将产抗菌物质的细菌接种于MRS琼脂培养基上,37 ℃恒温培养16 h,观察菌落形态,挑取单个菌落在酒精灯火焰上加热固定,按照革兰染色试剂盒说明书操作进行染色,于光学显微镜下观察菌体形态。
1.2.5 菌株的16S rRNA PCR鉴定 将纯化后的单菌落接种于MRS肉汤培养基中,37 ℃摇床培养至对数生长期,取1 mL菌液,12 000 r/min离心1 min,弃去上清液,收集菌体沉淀,按照DNA提取试剂盒说明书操作提取细菌基因组DNA。
以提取的基因组DNA为模板进行16S rRNA PCR扩增,使用细菌16S rRNA通用引物[11]:上游引物:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引物:5′-GGTTACCTTGTTACGACTT-3′。PCR反应体系共25 μL:上、下游引物各1 μL,模板DNA 5 μL,PCR Mix 12.5 μL,ddH2O 5.5 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性30 s,54 ℃退火1 min,72 ℃延伸1 min,共30个循环;最后 72 ℃延伸7 min。取3 μL PCR扩增产物通过1%琼脂糖凝胶电泳进行检测,检测合格样品送至生工生物工程(上海)股份有限公司进行测序。将16S rRNA测序结果与NCBI数据库中序列进行BLAST比对分析。
1.2.6 菌株分泌细菌素的蛋白酶敏感性测定 在菌株分泌细菌素中以0.2 g/mL为终浓度加入胃蛋白酶、胰蛋白酶、木瓜蛋白酶和蛋白酶K。其中加入木瓜蛋白酶的细菌素置于55 ℃水浴,加入其余蛋白酶的细菌素置于37 ℃水浴,所有样品水浴4 h后取出,沸水浴处理10 min使酶失活,按1.2.2进行抑菌试验。
1.2.7 菌株分泌细菌素的稳定性 取5等份菌株分泌细菌素,将其pH分别调至3.0、4.0、5.0、6.0和7.0,静置2 h,再将pH调回至4.6,按1.2.2进行抑菌试验。取4等份菌株分泌细菌素,将其分别放入60、70、80、90和100 ℃水浴中加热处理1 h,冷却后按1.2.2进行抑菌试验。
1.2.8 菌株分泌细菌素的抑菌谱检测 选用导致奶牛乳房炎的E.coli、S.aureus、T.pyogenes为检测对象,以10倍浓缩的MRS琼脂培养基为对照组,再分别以S.aureusATCC25923、S1、S2、E.coliATCC25922、E1、E2、T.pyogenesATCC19411、T1、T2为指示菌,按1.2.2进行抑菌试验。
2 结果
2.1 产抗菌物质菌株的筛选 经过初步筛选发现仅1株菌株的发酵上清液对S.aureusATCC25923具有抗菌作用,抑菌圈直径平均值大小约为(20±1) mm。
2.2 抗菌物质的初步确证 结果显示,过氧化氢酶处理过的浓缩上清液抑菌圈直径大小不变,说明抗菌物质中不含过氧化氢;该细菌浓缩上清液的原始pH=4.6,将其调节至pH=7.0后仍有抑菌圈出现,说明起到抗菌活性的物质并非完全是酸性物质。
正因其抗菌作用并非由过氧化氢和酸性物质产生,故初步推断该抗菌物质为细菌素。
2.3 菌落和菌体形态的观察 MRS琼脂培养基上出现白色、边缘整齐的光滑、圆形菌落(图1A);显微镜下革兰染色呈阳性,成双或短链排列的卵圆形球菌,无芽孢、无荚膜(图1B)。
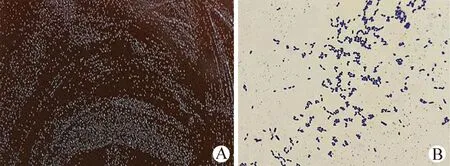
图1 菌落(A)和菌体(B,1 000×)形态观察Fig.1 Morphological observations of colony (A) and bacteria (B,1 000×)
2.4 菌株的16S rRNA PCR鉴定 PCR产物琼脂糖凝胶电泳检测结果显示,在1 500 bp左右出现明显条带,16S rRNA基因 PCR扩增片段大小与预期目的基因片段大小一致。分离菌株16S rRNA测序结果与NCBI数据库中粪肠球菌的同源性高达99.35%,遂将该菌株命名为EF-3。
2.5 EF-3分泌细菌素的蛋白酶敏感性测定 结果显示,胰蛋白酶和蛋白酶K处理后的细菌素抗菌活性明显下降,而经胃蛋白酶和木瓜蛋白酶处理的细菌素抗菌活性均无明显变化(表1)。

表1 蛋白酶对EF-3分泌细菌素活性的影响Table 1 Effect of proteases on the activity of EF-3 secreted bacteriocins
2.6 EF-3分泌细菌素的稳定性 结果显示,EF-3分泌细菌素抗菌活性几乎不受温度的影响,在100 ℃水浴4 h条件下依旧具有良好抗菌活性;但抗菌活性受环境pH变化影响较大,该细菌素在pH=4.0~6.0时能保持较强抗菌活性,在pH=3.0时失去抗菌活性(表2)。

表2 温度和pH对EF-3分泌细菌素抗菌能力的影响Table 2 Effect of temperature and pH on the antibacterial ability of EF-3 secreted bacteriocins

表3 细菌素的抑菌谱Table 3 Antibacterial spectrum of the bacteriocins
2.7 EF-3分泌细菌素的抑菌谱检测 结果显示,该细菌素仅对S.aureusATCC25923、S1、S2有抗菌作用;对E.coli、T.pyogenes的标准株和临床分离株均无抗菌活性。
3 讨论
S.aureus是引发奶牛乳房炎的重要病原菌,主要通过奶牛的乳头导管或乳房皮肤外伤进入乳房引发炎症,病牛主要症状是泌乳减少,如果没有得到合理治疗会对发情和泌乳产生影响,形成瞎乳头,给奶牛产业健康发展带来巨大挑战。目前,临床主要依赖抗生素对奶牛乳房炎进行防治,但长期滥用抗生素会使致病菌产生严重的耐药性并且危害动物体内正常的有益菌群,严重时可导致动物死亡[12],同时奶制品中残留的抗生素严重危害人体健康。
粪肠球菌作为人和动物肠道内主要的菌群之一,可以抑制大肠杆菌和沙门菌等病原菌的生长,能够改善肠道微循环,其代谢可产生有机酸、蛋白质等大分子生物活性物质。研究表明,其部分代谢产物具有良好的抗菌作用[13-16]。而细菌素对动物体很安全,且具有不易产生耐药性、作用快、耐高温、无残留、无毒等优点[17],可用于代替抗生素控制致病菌的滋生和传播,对保障动物健康具有重要意义。宝冠媛等研究表明,粪肠球菌细菌素抑菌谱较广[18],无法对特定的细菌进行针对性消灭。而本试验中粪肠球菌EF-3所分泌的细菌素仅针对S.aureus具有良好的抗菌活性,且具有良好的稳定性,有望作为防控奶牛乳房炎源S.aureus感染的替抗产品,具有重大研究价值和应用前景。

