明太鱼胶原蛋白提取工艺优化及其体外抗氧化活性
辛炫英,李美瑶,张雨嫣,胡竹子,陈子,王妍
(延边大学,吉林 延吉 133000)
明太鱼,学名黄线狭鳕(Theragra chalcogramma),是鳕形目鳕科鳕属。主要分布于朝鲜半岛东岸、日本北部、鞑靼海峡、白令海周缘、鄂霍次克海中部和阿拉斯加等[1]。随着食品产业日益壮大,尤其是海洋产品加工业的发展,人们开始重视海洋资源的综合利用,对海洋鱼类副产物加工提出了更高的要求,因此,鱼类废弃物的开发利用显得越来越重要。明太鱼是我国延边朝鲜族自治州最受欢迎的食物之一,鱼干产量大。但在明太鱼加工过程中副产物资源浪费严重,其中鱼皮占比最高,总计每年约5 万t 的鱼皮被浪费[2]。
相关研究表明,鱼类副产品可被用作获取胶原蛋白或胶原蛋白水解物的来源材料,以提高海洋生产链的价值。由于人们对胶原蛋白的潜在健康益处越来越感兴趣,近年来,全球食品行业对胶原蛋白产品的需求正在增加,胶原蛋白带来的健康益处,包括抗氧化作用、基质金属蛋白酶抑制作用、血管紧张素转换酶抑制作用和抗衰老活性等。这些促进健康的特性与胶原蛋白密切相关[3-5]。目前研究表明,制备胶原蛋白主要有热水浸提法、酸浸提取法、碱浸提取法、酶溶解提取法和盐析溶解提取法等。其中酶溶解提取法目前已经被广泛应用于鱼皮胶原蛋白的提取,常用的酶有胰蛋白酶、木瓜蛋白酶、胃蛋白酶等[6-8]。在选择酶法处理过程中,对温度和pH 值等条件要求较高,因此本研究利用单因素试验及响应面优化试验确定明太鱼胶原蛋白提取最佳工艺,同时鉴定其基本性质,最后初步研究其体外抗氧化作用,以期为解决明太鱼副产物浪费问题以及生产加工胶原蛋白系列产品提供新思路。
1 材料与方法
1.1 材料与试剂
明太鱼干皮:市售;胃蛋白酶(1 500 U/g)、番红花红、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS -PAGE)试剂盒、乙二胺四乙酸铁钠、冰乙酸、氢氧化钠、正丁醇、氯化钠、浓盐酸、异硫氰酸苯酯、三乙胺、乙醇、醋酸钠、正己烷、抗坏血酸、丁基羟基茴香醚:北京索莱宝科技有限公司。18 种氨基酸标准品(纯度均≥97 %):上海安谱实验科技股份有限公司。除特殊标记外,其他化学试剂均为分析纯。
1.2 仪器与设备
CT15RT 台式高速冷冻离心机:中国天美科学仪器有限公司;ZTJZ-200S 均质机:上海众托实业有限公司;YK759CRT900 紫外分光光度计:赛默飞世尔科技公司;IR Prestige-21 傅里叶变换红外光谱仪:日本岛津公司;ZTJZ-200S 均质机:上海众托实业有限公司;LC-20 Agilent1260 液相色谱仪:上海怡赛科学仪器有限公司;ZF-288 凝胶成像仪:上海金鹏分析仪器有限公司。
1.3 试验方法
1.3.1 胶原蛋白制备
参照王艳[9]的方法并加以改进,取一定量的明太鱼鱼皮,去离子水除去皮上杂质。将鱼皮浸泡在含有0.02 mol/L NaOH 的7.5% NaCl 溶液中,同时进行磁力搅拌,持续18 h,再使用10%正丁醇溶液对除去杂质蛋白后的明太鱼鱼皮漂洗5 次,每次1 h。水冲至中性,烘干备用。随后采用胃蛋白酶法提取胶原蛋白,将预处理好的鱼皮剪碎,加入纯水,料液比为1 ∶20(g/mL),加入1 500 U/g 胃蛋白酶,在45 ℃恒温水浴锅中水浴4 h 提取明太鱼皮胶原蛋白。杂质去除干净后加入5%干皮质量的活性炭和氯化钙,以此来达到脱色除味的目的。在60 ℃恒温水浴锅中将混合液静止沉淀20 min,收集上清液后,再用800 目滤布进行过滤,将活性炭及杂质去除。滤液与上清液合并,6 000 r/min 离心20 min,弃去沉淀。将纯化的胶原蛋白溶液放在培养皿中。
1.3.2 胶原蛋白得率测定
胶原蛋白中存在一种特有氨基酸,为羟脯氨酸,通过测定羟脯氨酸含量可以得出胶原蛋白含量,方法参照GB/T 9695.23—2008《肉与肉制品羟脯氨酸含量测定》[10]。按公式(1)计算胶原蛋白得率。
式中:X1为胶原蛋白得率,%;M1为上清液羟脯氨酸含量,%;M2为鱼皮羟脯氨酸含量,%。
1.3.3 单因素试验设计
以胶原蛋白得率为指标,分别考察反应时间、料液比、酶用量、反应温度4 个单因素对明太鱼胶原蛋白得率的影响。各因素水平设置为反应时间选择2、3、4、5、6 h;料液比选择1 ∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g/mL);酶用量选择300、600、900、1 200、1 500、1 800 U/g;反应温度选择25、30、35、40、45 ℃。各因素进行5 次平行试验,取平均值。
1.3.4 胶原蛋白提取工艺优化
根据单因素试验结果,选择对胶原蛋白得率影响较大的反应时间、反应温度、酶用量作为试验因素,以胶原蛋白得率作为考察指标,通过Box-Behnken 中心组合试验,确定胃蛋白酶提取明太鱼皮胶原蛋白的最佳工艺条件,响应面优化因素水平见表1。

表1 响应面因素与水平Table 1 Response surface factors and levels
1.3.5 胶原蛋白SDS-PAGE
将制备好的胶原蛋白溶解,配制成质量浓度为10 mg/mL 的胶原蛋白溶解液,以体积比3 ∶1 与缓冲液混合,沸水浴3 min,在120 V 的恒流下进行电泳,结束后转移电泳胶到快速染色液中处理染色,随后脱色,凝胶成像仪观察成像。
1.3.6 傅里叶红外光谱法分析明太鱼胶原蛋白
称取一定质量制备好的明太鱼胶原蛋白,在傅里叶变换红外光谱仪上扫描,波长范围5 000~4 000 cm-1。
1.3.7 紫外光谱法分析明太鱼胶原蛋白
称取一定质量制备好的胶原蛋白,用0.5 mol/L 乙酸溶液作溶剂,配成浓度为0.5 mg/mL 的胶原蛋白溶液,另一个空白组只加入0.5 mol/L 乙酸溶液。检测波长为190~400 nm,采集速率为0.5 nm/s。
1.3.8 明太鱼胶原蛋白中氨基酸的组分与含量测定
采用柱前衍生反相高效液相色谱法测定氨基酸的组分与含量。
1.3.8.1 色谱条件的确定
色谱柱:UG120 C18(250 mm×4.6 mm,5 μm);流动相A:0.1 mol/L 无水乙酸钠∶乙腈=97 ∶3(体积比),混匀后用冰乙酸调节pH 值至6.5;流动相B:乙腈∶水=80 ∶20(体积比);运行时间:0~45 min;流速:0.8 mL/min;柱温:40 ℃;样品进样量:20 μL;检测波长:254 nm。流动相洗脱程序见表2。

表2 流动相洗脱程序Table 2 Mobile phase elution procedure
1.3.8.2 明太鱼胶原蛋白样品溶液的制备
准确称取明太鱼胶原蛋白样品1.0 g,用25 mL超纯水溶解定容,超声30 min 后在3 000 r/min 下离心10 min,取上清液备用。
1.3.8.3 衍生化试剂的制备
向0.834 mL 三乙胺中加入5.166 mL 乙腈,混匀,制备1.0 mol/L 三乙胺-乙腈溶液,备用。吸取0.072 mL的异硫氰酸苯酯,加入4.328 mL 乙腈,混匀,制备0.1 mol/L 异硫氰酸苯酯-乙腈溶液,备用。
1.3.8.4 溶液的衍生化
吸取明太鱼胶原蛋白溶液及氨基酸标准品混合溶液200 μL。先加入100 μL 的0.1 mol/L 异硫氰酸苯酯-乙腈溶液,再加入100 μL 的1.0 mol/L 三乙胺-乙腈溶液,混合均匀后静置1 h。加入正已烷400 μL,混匀后静置10 min。取下层溶液,用微孔滤膜过滤,待进样。
1.3.8.5 氨基酸含量计算
将处理过的明太鱼胶原蛋白样品溶液进行衍生化,微孔滤膜过滤,过滤后进样20 μL,得到样品中各氨基酸峰面积图谱,将峰面积积分值代入回归方程,求得各氨基酸平均含量。
1.3.9 胶原蛋白抗氧化性测定
以维生素C(vitamin C,VC)、丁基羟基茴香醚(butyl hydroxyanisole,BHA)为对照组,通过测定1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)自由基、超氧阴离子自由基、羟自由基清除能力及总还原能力探究其体外抗氧化作用。
1.3.9.1 胶原蛋白DPPH 自由基清除能力测定
取5 支比色管,加入3 mL 0.05 mmol/L 的DPPH溶液,再分别加入质量浓度为2、4、6、8、10 mg/mL 的胶原蛋白溶液3 mL,摇匀,静置30 min,517 nm 测定吸光度,将3 mL 无水乙醇和3 mL 梯度质量浓度溶液混合均匀,于517 nm 测定吸光度,再将3 mL 无水乙醇和3 mL DPPH 溶液混合均匀,于517 nm 测定吸光度[11]。按公式(2)计算DPPH 自由基清除率。
式中:X2为DPPH 自由基清除率,%;A1为样品与DPPH 反应后的吸光度;A2为样品吸光度;A0为空白组吸光度。
1.3.9.2 胶原蛋白超氧阴离子自由基清除能力测定
胶原蛋白超氧阴离子自由基清除能力采用邻苯三酚自氧化法进行测定[12]。按公式(3)计算超氧阴离子自由基清除率。
式中:X3为超氧阴离子自由基清除率,%;A1为空白组的吸光度;A2为样品组的吸光度。
1.3.9.3 胶原蛋白羟自由基清除能力测定
取1 mL 磷酸缓冲液(0.025 mol/L、pH7.4),1 mL 40 μg/mL 番红花红,0.5 mL 胶原蛋白溶液,1 mL 3%过氧化氢(新鲜配制),1 mL 0.945 mmol/L 乙二胺四乙酸铁钠(新鲜配制),混合后反应30 min 于37 ℃水浴处理,并测定520 nm 处吸光度。空白组使用0.5 mL 蒸馏水,对照组使用1.5 mL 蒸馏水,按公式(4)计算羟自由基清除率[13]。
式中:X4为羟自由基清除率,%;A1为样品组的吸光度;A0为空白组的吸光度;A2为对照组的吸光度。
1.3.9.4 胶原蛋白还原能力测定
取一定浓度的样品,加入2.5 mL pH6.6 的磷酸盐缓冲液(0.2 mol/L)和2.5 mL 体积分数1%的铁氰化钾溶液,混匀,在50 ℃保温20 min 后加入2.5 mL10%的三氯乙酸,混合后以3 000 r/min 离心10 min。取上清液2.5 mL,加蒸馏水2.5 mL 和0.5 mL 质量分数为0.1%的FeCl3,在700 nm 波长处测定的吸光度表示样品还原能力[14-15]。
1.4 数据处理
试验数据以平均值±标准差表示,采用Prism 9 和Design-Expert 软件对试验数据进行处理和分析。
2 结果与分析
2.1 单因素试验结果
酶用量、反应温度、料液比、反应时间对胶原蛋白得率的影响见图1。
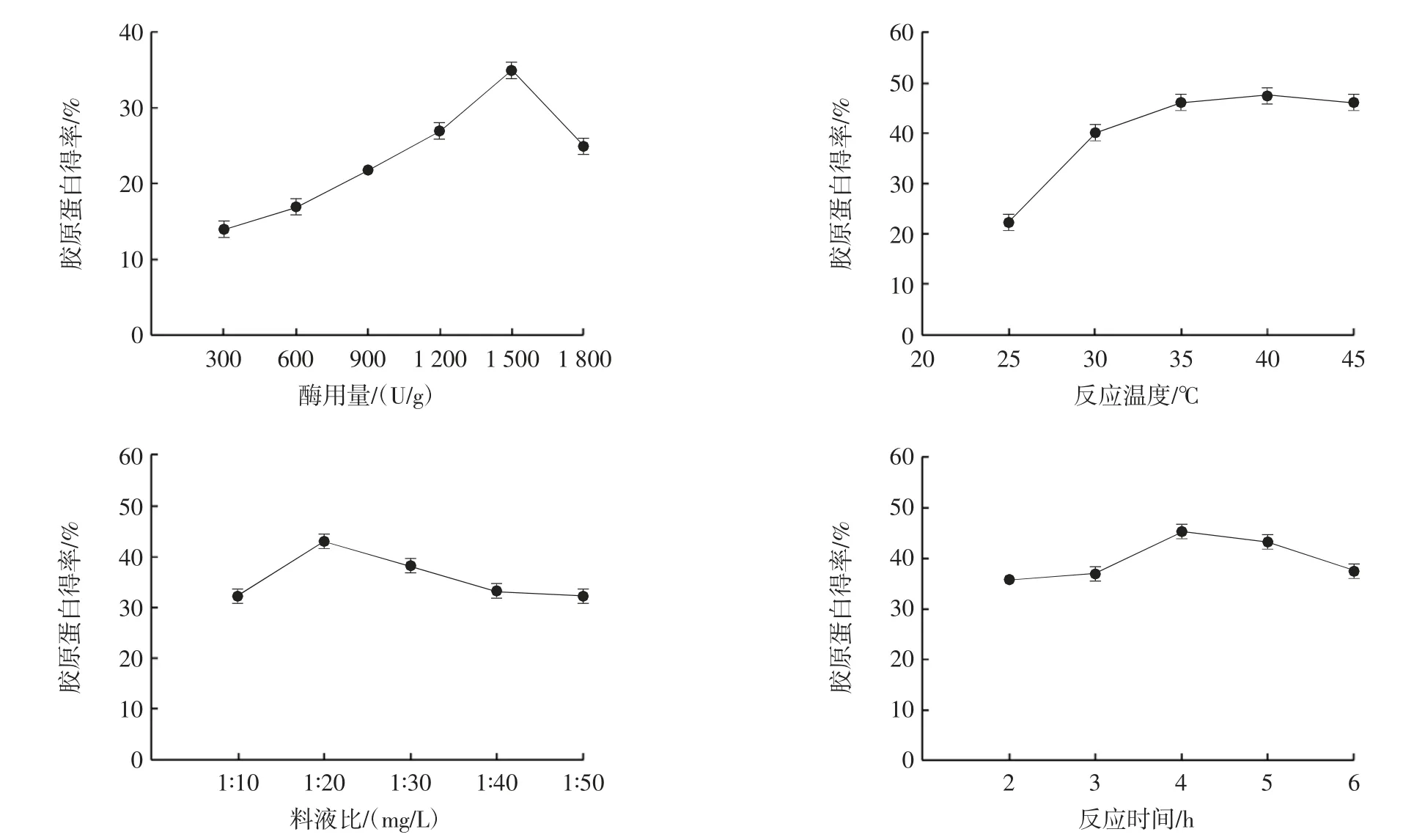
图1 各因素对胶原蛋白得率的影响Fig.1 Effect of each factor on collagen extraction rate
由图1 可知,明太鱼胶原蛋白得率随酶用量增加呈先升高后降低的趋势,在酶用量为1 500 U/g 时,胶原蛋白得率最佳,但随着酶用量进一步增加,胶原蛋白得率下降,结果与甘文梅等[16]的研究结果一致,原因可能是过量的酶会抑制酶解作用,从而导致酶用量过高,得率下降。明太鱼胶原蛋白得率随反应温度升高出现了先升高后下降的趋势,在反应温度为40 ℃时,胶原蛋白得率最佳。王锡念等[17]的研究表明酶法提取胶原蛋白最适温度为35~45 ℃,与该试验结果相同,原因可能是温度过高,酶处于非最适温度,酶活性受到抑制,导致得率下降。明太鱼胶原蛋白得率随溶剂体积增加出现了先增长后下降的趋势,在料液比为1 ∶20(mg/L)时,胶原蛋白得率最佳,但随着溶剂体积进一步增加,胶原蛋白得率逐渐下降,原因可能是溶剂体积过大会导致胶原蛋白分离困难。孙培利等[18]在提取牦牛蹄筋胶原蛋白中同样发现溶剂体积过高会导致得率下降。明太鱼胶原蛋白得率随反应时间延长呈现先增长后下降的趋势,反应时间为4 h 时,胶原蛋白得率最佳,但随着反应时间延长胶原蛋白得率逐渐下降,可能原因是反应时间过长胃蛋白酶会部分水解,从而影响胶原蛋白提取,该结果与郑平安等[19]的研究结果一致。因此,反应时间、酶用量、反应温度分别选择3~5 h、1 200~1 800 U/g、35~45 ℃进行后续响应面试验。
2.2 响应面优化工艺
2.2.1 响应面试验设计结果
根据单因素试验结果,选取酶用量(A)、反应时间(B)、反应温度(C)3 个影响较显著的因素为自变量,以胶原蛋白得率(Y)为响应因子,进行响应面试验设计,试验设计及结果见表3,回归模型的方差分析结果见表4。

表3 Box-Behnken 试验设计及结果Table 3 Design and values of Box-Behnken experiments

表4 回归模型方差分析Table 4 Analysis of variance for regression model
对表3 中17 组试验数据进行多元拟合回归分析,得到酶用量(A)、反应时间(B)、反应温度(C)对胶原蛋白得率(Y)影响的多元二次回归方程:Y=0.43+0.015A+5.754×10-3B-0.012C-0.032AB+0.040AC-4.71×10-3BC-0.066A2-0.012B2-0.052C2。回归模型P<0.01,差异极显著,失拟项P>0.05,不显著,表示模型对试验的拟合度较高。分析得到决定系数R2=0.952 1,说明响应值的变化有95.21%(>90%) 来源于所选的3 个变量。说明该模型可很好地解释95.21%的胶原蛋白得率的变化,各因素间线性相关好,试验误差小,可以采用该模型对不同条件下明太鱼皮胶原蛋白的提取进行预测和分析。由表4 可知,各因素对胶原蛋白得率影响程度顺序为A(酶用量)>C(反应温度)>B(反应时间)。
2.2.2 响应面分析
各因素交互作用对响应值的影响见图2。

图2 各因素对胶原蛋白得率的响应面和等高线Fig.2 Response surface and contour plot of each factor on collagen extraction rate
由图2 可知,AC 的响应面坡面较陡,说明酶用量和反应温度的交互作用对胶原蛋白得率影响较大。经过软件分析得到明太鱼皮胶原蛋白的最优提取工艺条件为酶用量1 508.65 U/g、反应温度41.11 ℃、反应时间3.89 h 时,理论胶原蛋白得率为49.98%。同时结合实际工艺操作,将参数优化为酶用量1 500 U/g、反应温度为41 ℃、反应时间3.9 h,上述工艺参数做3 次平行试验,此时实际胶原蛋白得率为48.90%,与理论值接近,验证了该模型具有可行性与准确性,可以通过响应面优化试验数据得出工艺参数。
2.3 SDS-PAGE 凝胶电泳
胶原蛋白SDS-PAGE 凝胶电泳结果见图3。

图3 明太鱼胶原蛋白SDS-PAGE 图谱Fig.3 SDS-PAGE profile of Theragra chalcogramma collagen
由图3 可知,本试验提取的胶原蛋白分子量在110~130 kDa 之间,经对比为α 链,与Ⅰ型胶原蛋白标准品表现一致。大多数的真骨鱼类真皮的胶原蛋白含有其他脊椎动物所没有的第3 条α 链,它是由3 条不同α链形成的单个α1(I)、α2(I)、α3(I)杂链。在同一条件下,α3 链和α1 链的化学性质相似,电泳迁移位置相同,因此从图谱上不能推断出是否含α3 链。亚基α1、α2 的分子量均在100 kDa 以上。
2.4 明太鱼胶原蛋白傅里叶红外光谱
明太鱼胶原蛋白傅里叶红外光谱图见图4。

图4 明太鱼胶原蛋白傅里叶变换红外光谱Fig.4 Fourier transform infrared spectroscopy of Theragra chalcogramma collagen
由图4 可知,本试验提取得到的胶原蛋白含有酰胺的5 个主要胶原蛋白特征吸收峰A、B、Ⅰ、Ⅱ和Ⅲ。本试验提取的胶原蛋白特征吸收峰波数与标准品对比差异甚小。在3 300 cm-1附近有吸收峰,说明两种胶原蛋白中均存在氢键;分子中CH2基团的不对称伸缩振动产生了酰胺B,说明本试验提取的胶原蛋白的三级结构保留完整。C═O 伸缩振动造成酰胺I 谱带的存在,其特征吸收频率波数一般在1 690~1 625 cm-1,酰胺Ⅱ是由具有双键性质的异相N—H 面内弯曲振动和C—N 伸缩振动共同产生的。酰胺Ⅲ是由C—N 伸缩和N—H 弯曲引起的,其频率波数范围为1 400~1 200 cm-1,与其他蛋白质的胶原红外光谱不同,是Ⅰ型胶原蛋白特有的吸收。综上,本试验提取的胶原蛋白三螺旋结构保留完整。
2.5 明太鱼胶原蛋白紫外吸收光谱分析
提取的明太鱼胶原蛋白紫外吸收光谱图见图5。

图5 胶原蛋白紫外吸收光谱图Fig.5 Ultraviolet absorption spectra of collagen
紫外吸收光谱是蛋白质分子各种紫外生色基团加入的结果,是判断胶原蛋白类型的一个重要标志。其中I 型胶原蛋白在235 nm 附近会出现最大吸收峰,是胶原蛋白三螺旋结构的特征吸收峰。另外值得注意的是色氨酸含有苯环共辄双键,在280 nm 的紫外吸收最强。由图5 所示,本试验制得的胶原蛋白在280 nm处没有强吸收峰出现说明制备的胶原蛋白几乎不含色氨酸或含量很低,同时本试验制得的胶原蛋白在235 nm 附近有明显的吸收峰,符合I 型胶原蛋白的紫外吸收。
2.6 明太鱼胶原蛋白中氨基酸的组分与含量
明太鱼胶原蛋白氨基酸的组分与含量见表5。
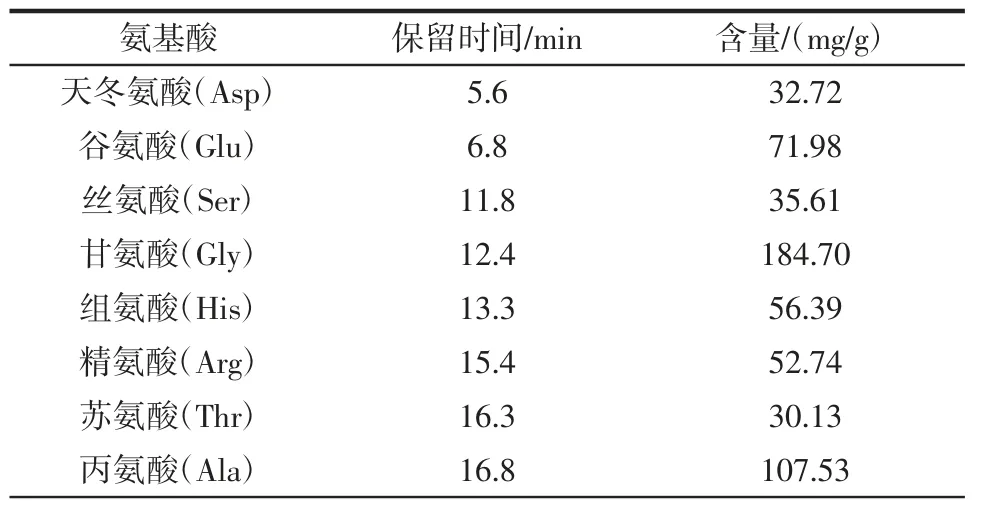
表5 明太鱼胶原蛋白中各氨基酸的含量Table 5 Contents of amino acids in Theragra chalcogramma collagen
从表5 中可以看出,明太鱼胶原蛋白中含有人体必需氨基酸在内的17 种氨基酸,但未检测出色氨酸,其中含量较高的有甘氨酸、脯氨酸、丙氨酸、谷氨酸和组氨酸。综上,经本试验优化工艺提取的胶原蛋白氨基酸组分与含量丰富,可满足人体健康需要。
2.7 体外抗氧化作用
2.7.1 DPPH 自由基清除能力
不同抗氧化剂对DPPH 自由基的清除能力见图6。

图6 胶原蛋白对DPPH 自由基的清除能力Fig.6 Scavenging ability of collagen to DPPH free radicals
由图6 可知,DPPH 自由基清除率均随抗氧化剂浓度的增加而增大。胶原蛋白与BHA 的IC50值分别为2.69 mg/mL 和6.82 mg/mL。因此可知胶原蛋白具有一定的DPPH 自由基清除能力。
2.7.2 超氧阴离子自由基清除能力
不同抗氧化剂对超氧阴离子自由基的清除能力见图7。

图7 胶原蛋白对超氧阴离子自由基的清除能力Fig.7 Scavenging ability of collagen to superoxide anion free radicals
在生物有机体代谢过程中,超氧阴离子是一种具有很强氧化能力的自由基,所以通过测定它们的清除效能来表示抗氧化剂的作用[20-21]。由图7 可知,对超氧阴离子自由基的清除率随抗氧化剂浓度的增加而增大。胶原蛋白和BHA 对于清除超氧阴离子自由基的IC50值分别为4.42 mg/mL 和8.13 mg/mL。浓度相同时,对超氧阴离子自由基清除能力顺序为VC>胶原蛋白>BHA。因此可知胶原蛋白具有较好的超氧阴离子自由基清除能力。
2.7.3 羟自由基清除能力
图8 为不同浓度VC、胶原蛋白和BHA 对羟自由基的清除能力。

图8 胶原蛋白对羟自由基清除能力测定Fig.8 Scavenging ability of collagen to hydroxyl free radicals
羟自由基是在生物需氧代谢过程中产生的较强的氧自由基,所以通过测定羟自由基的清除能力,对抗氧化性的强弱进行分析[22-23]。由图8 可知,随抗氧化剂浓度的增加,羟自由基清除能力增大,浓度相同时,羟自由基清除能力顺序为VC>胶原蛋白>BHA。其中胶原蛋白和BHA 对于清除羟自由基的IC50值分别为3.89 mg/mL 和5.32 mg/mL。而且当浓度相同时,明太鱼胶原蛋白羟自由基的清除效果好于BHA,所以明太鱼胶原蛋白是一种良好的羟自由基清除剂。
2.7.4 总还原能力
不同抗氧化剂对铁离子的还原能力见图9。
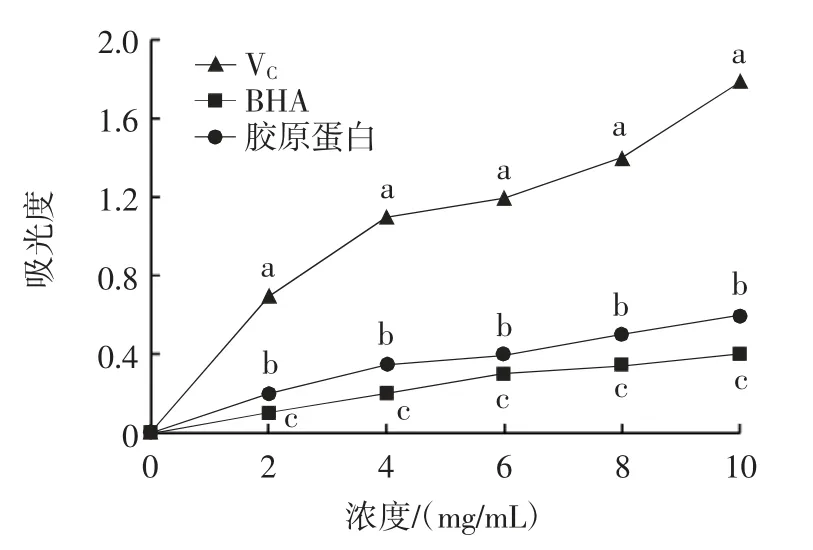
图9 胶原蛋白的还原能力测定Fig.9 Reducing ability of collagen
在酸性条件下,抗氧化剂将Fe3+还原成Fe2+,以Fe2+的量或者相对于标准抗氧化剂的能力来表示抗氧化活性[24]。由图9 可知,浓度相同时,样品还原能力顺序为VC>胶原蛋白>BHA。
3 结论
本研究在单因素试验的基础上采用Box-Behnken中心组合设计方法设计响应面优化试验,结合实际工艺最终得出明太鱼皮胶原蛋白的最优提取工艺为酶用量1 500 U/g、反应温度为41 ℃、反应时间3.9 h,优化后的工艺实际胶原蛋白得率为48.90%,接近理论值,验证了该模型具有可行性与准确性。经SDS-PAGE鉴定本试验提取的胶原蛋白分子量为110~130 kDa,傅里叶红外光谱扫描结果可知本试验制备出的胶原蛋白三螺旋结构保留完整,同时在红外光谱中还含有酰胺的5 个主要胶原蛋白特征吸收峰A、B、Ⅰ、Ⅱ和Ⅲ;利用紫外光谱技术分析可知本试验所制备的胶原蛋白具有明显符合Ⅰ型胶原蛋白的紫外吸收峰(235 nm附近),同时采用了RP-HPLC 法测定明太鱼胶原蛋白中氨基酸的组成与含量,结果表明明太鱼胶原蛋白中含有除色氨酸在外的17 种氨基酸,其中甘氨酸、脯氨酸、丙氨酸、谷氨酸和组氨酸含量丰富,表明经工艺优化后提取的胶原蛋白营养丰富,满足人体健康需要。最后通过体外抗氧化试验得出,明太鱼胶原蛋白对DPPH 自由基、羟自由基和超氧阴离子自由基的半数抑制浓度(IC50)分别为2.69、3.89、4.42 mg/mL,相比于BHA 具有较强抗氧化作用。综上,本研究高效提取了明太鱼胶原蛋白,确定了最佳提取工艺,明确了其体外抗氧化作用,提高了明太鱼副产品的附加价值,为副产物的综合利用提供了思路。

