基于高通量测序技术的广西咸梅细菌多样性分析
熊英梅,向秀连,张苗苗,张彦,郭壮,王玉荣*
(1.湖北文理学院 湖北省食品配料工程技术研究中心,湖北 襄阳 441053;2.湖北文理学院 乳酸菌生物技术与工程襄阳市重点实验室,湖北 襄阳 441053;3.安琪纽特股份有限公司 酵母功能湖北省重点实验室,湖北 宜昌 443003)
青梅又被称为梅子、果梅,主要产区是在我国长江流域以南,在浙江、广东、广西、云南和福建等地加工和食用较为广泛[1]。青梅富含有机酸、无机盐、维生素、矿物质等营养成分,能够生津止渴、缓解疲劳,是开胃助消化的佳品[2];有研究表明青梅既可以食用也可以入药,在缓解发烧症状、调理肠道紊乱、治疗腹泻及皮肤疾病等方面亦有功效[3-4]。由于鲜青梅中含有大量酸性物质,食用起来酸涩,且保质期较短,故大部分青梅要在加工后进行储藏、食用[5]。腌制作为一种常见的食品保藏方法,在我国有着悠久的历史,广西、广东等地将其应用到了青梅加工过程中[6]。腌制好的青梅,当地称为咸水梅、咸梅、酸梅、腌梅子等,其制作过程是将肉质较坚硬的新鲜青梅洗净并晾干表面水分,入坛时分层放入适量的食盐,置于阴凉通风的地方密封发酵60 d 即可食用[7]。王志江等[8]使用咸梅汁腌制新型乳酸菌饮料,发现咸梅汁能赋予产品天然的酸度和良好的咸梅风味;俞福惠[9]发现通过电渗析法可以将咸梅汁制成可食用的酸梅料;王辉等[10]从青梅自然发酵液中分离出一株拜氏酵母Y1,发现其具有良好生长特性且能赋予发酵液良好的香气。然而,目前关于咸梅中微生物群落结构的研究较少。
本研究从广西壮族自治区南宁地区采集9 份农户自制咸梅样品,采用第二代高通量测序技术对细菌群落结构进行解析,以期为分离咸梅中优势发酵细菌并将其应用到饮料新产品研制中奠定基础。
1 材料与方法
1.1 材料与试剂
咸梅样品:市售,共9 份,编号分别为SM1~SM9,所有样品均由南宁市农户自制并于集市上销售,采集时其腌制时间大约在50~60 d。
E.Z.N.ATMMag-Bind Soil DNA 提取试剂盒:德国QIAGE 公司;16S rRNA V3~V4 区引物:上海桑尼生物科技有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs):翌圣生物科技(上海)股份有限公司;DNA Marker、10 倍缓冲液:青岛蔚来生物科技有限公司。
1.2 仪器与设备
Illumina MiSeq 高通量测序平台:美国Illumina 公司;FluorChem HD2 化学发光凝胶成像系统:普诺森生物科技(上海)有限公司;ND-2000C 微量紫外分光光度计:美国Nano Drop 公司;TG16MW 微量高速冷冻离心机:湖南赫西仪器装备有限公司;R930 机架式服务器:美国DELL 公司;S1000 梯度聚合酶链反应(polymerase chain reaction,PCR)核酸扩增仪:美国Bio-Rad 公司。
1.3 方法
1.3.1 咸梅样品总DNA 提取与检验
称取2.0 g 研磨碎的咸梅样品,使用E.Z.N.ATMMag-Bind Soil DNA 提取试剂盒提取9 份咸梅样品的总DNA,通过0.8%的琼脂糖凝胶回收后,使用微量紫外分光光度计检验并测定DNA 及其浓度,检验合格后的DNA 保存于-20 ℃中备用。
1.3.2 咸梅样品中细菌16S rRNA PCR 扩增及高通量测序
以提取到的咸梅样品总DNA 为模板,参照鲍伟等[11]的方法对咸梅样品进行细菌16S rRNA V3~V4区PCR 扩增,引物为338F(5'-ACT CCT ACG GGA GGC AGC AG-3')和806R(5'-GGA CTA CHV GGG TWT CTA AT-3')。PCR 扩增产物通过1.0%的琼脂糖凝胶回收后,将其浓度稀释至100 nmol/L,使用MiSeq PE300高通量测序平台进行测序。
1.3.3 生物学信息分析
参照谢芳等[12]和石黎琳等[13]的方法对下机序列进行拼接和质控,将质控合格后的序列上传至QIIME(V1.7.1)平台进行细菌多样性评价。将校准对齐的序列采用UCLUST 算法工具[14]分别以100%和97%的相似度划分,进而创建分类操作单元(operational taxonomic units,OTU)[15],剔除含有嵌合体的代表性OTU 序列,在SILVA 数据库[16]、核糖体数据库[17]和Greengenes数据库[18]中进行同源性比对,进而整理数据确定咸梅样品中细菌分类学地位,然后对咸梅样品中的Chao1指数和Shannon 指数等指标进行计算,最后对优势细菌属和核心OTU 进行相关性分析。本研究将咸梅样品中相对含量大于1.0%的细菌门或属定义为优势细菌门或属;将均存在于9 份咸梅样品中且相对含量大于1.0%的OTU 定义为核心优势OTU。
1.3.4 核苷酸序列上传
本研究中9 份咸梅样品原始序列数据均已上传至MG-RAST 数据库中,登录号为mgp103141。
1.4 数据处理
使用R 软件(V4.1.1)中的ggplot2 包对咸梅样品中微生物的Chao1 指数和Shannon 指数进行可视化分析,使用Origin 2017 绘制咸梅样品中优势细菌门或属的柱形堆积图,使用R 软件(V4.1.1)中的corrplot 和pheatmap 包绘制样品中优势细菌属的相关性热图和核心OTU 热图。
2 结果与分析
2.1 细菌多样性分析
9 份咸梅样品根据100%相似度划分序列共得到384 880 条高质量16S rRNA 序列,平均每份样品42 764 条,根据97%相似度划分OTU 共得到4 822 个OTU,平均每份样品536 个。咸梅样品Chao1 指数和Shannon 指数可视化分析结果见图1。Chao1 指数在生态学中常用来估计物种总数,是评价物种丰富度的重要指标之一。Shannon 指数则是生态学中常用来定量描述一个区域的生物多样性的重要指标之一,Shannon指数越大说明样品中群落多样性越高[19]。

图1 咸梅样品Chao1 指数和Shannon 指数的可视化分析Fig.1 Visual analysis of Chao1 index and Shannon index of salty plum samples
由图1(a)可知,在测序深度为34 010 条序列时,比较Chao1 指数可得,样品SM7 中细菌丰富度最大,其Chao1 指数为2 205;由图1(b)比较Shannon 指数可得,细菌多样性SM7>SM2>SM9>SM1=SM3>SM6>SM8>SM5>SM4,由此可知,咸梅样品中SM7 的细菌丰富度和多样性均最高。由图1 可知,不同咸梅样品中细菌丰富度和多样性存在一定的差异。因此,进一步在OTU 水平上对咸梅样品中细菌多样性进行分析。
2.2 基于OTU 水平细菌多样性分析
基于9 份样品中所含的OTU 总数绘制花瓣图,对9 份样品的细菌多样性进行分析,可以直观表达各样品中含有的OTU 和共有的OTU,结果见图2。
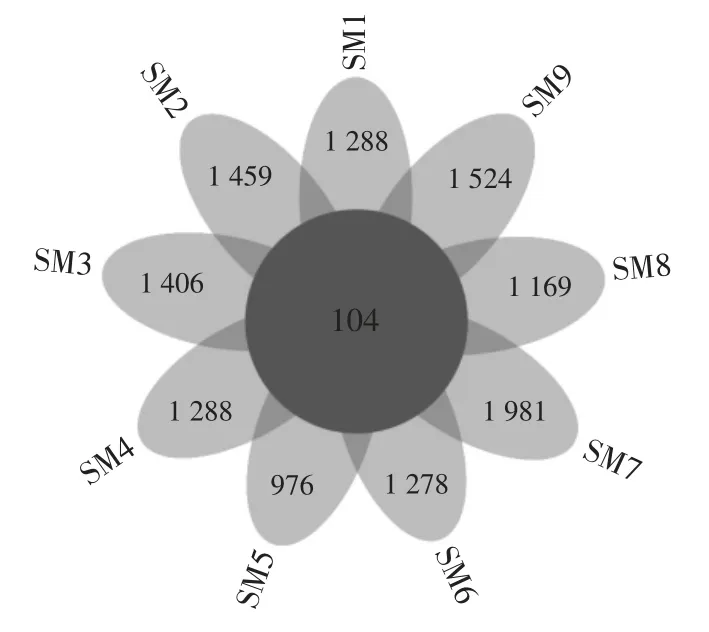
图2 样品中OTU 数量Fig.2 Number of OTU in the sample
由图2 可知,样品SM1~SM9 中分别含有1 288、1 459、1 406、1 288、976、1 278、1 981、1 169、1 524 个OTU,各包含了5 083、4 667、5 682、4 532、3 044、4 372、7 895、3 548、43 445 条序列,其中核心OTU 有104 个,仅占OTU 总数的0.84%,但核心OTU 包含的序列数占总序列数的97.55%,说明咸梅样品中含有较丰富的细菌种类,且各样品中特有细菌种类较多但含量少,而样品中菌群组成是共有细菌菌群居多。此外,在咸梅样品中均存在且相对含量大于1.0%的核心优势OTU共有6 个,其累计平均相对含量为63.87%,对核心优势OTU 进行聚类并进行相关性分析,结果见图3。

图3 咸梅样品中相对含量大于1%的核心优势OTU 热图Fig.3 Heat map of core dominant OTUs with relative content greater than 1% in salty plum samples
由图3 可知,OTU6519 和OTU9265 被鉴定为伯克氏菌属(Burkholderia),OTU10049 被鉴定为乳杆菌属(Lactobacillus),OTU12397 被鉴定为毛螺旋菌属(Lachnospiraceae),OTU736 被鉴定为假单胞菌属(Pelomonas),OTU10998 被鉴定为雷尔氏菌属(Ralstonia),其平均相对含量分别为4.50%、1.37%、5.20%、2.55%、1.32%和48.93%。各核心优势OTU 在咸梅样品中的含量有较大差异,如OTU10049 在SM1 样品中的相对含量为46.57%,而在其它样品中的相对含量小于1.0%;而OTU10998 在SM1 样品中的相对含量远低于其它样品,相对含量为3.57%,由此可见,咸梅样品中核心优势OTU 在样品中的分布不均匀。由图3 可知,被鉴定为雷尔氏菌属的核心优势OTU10998 在样品SM2~SM9 中均存在且相对含量较其它核心优势OTU 较高,可能是咸梅样品中的主要菌属。雷尔氏菌属在温带、亚热带和热带地区分布广泛,其可从植物受伤的根部、茎部或者未受伤的次生冠的根冠寄生于其体内,进而引发植物枯萎乃至死亡[20]。而广西壮族自治区南宁地区地处亚热带地区,适宜雷尔氏菌属的部分菌属存活。雷尔氏菌属中的大部分菌种可以将硝酸盐还原为亚硝酸盐,能影响人体中血红蛋白运输氧气的能力,从而引起人体中毒甚至死亡,还有一些菌种属于植物病原菌,可以引起青枯病[21-22]。由此可知,农户制作的咸梅样品存在一定的食用隐患,究其根本,可能与当地的气候以及制作时操作环境和方法有关。
2.3 基于门和属水平细菌群落结构分析
基于咸梅样品细菌多样性分析,进一步在数据库中对质控合格的序列进行同源性比对,共鉴定出34 个门、110 个纲、170 个目、250 个科和501 个属,其中仅有0.08%和6.90%的序列鉴定不到门和属水平。本研究中相对含量大于1.0%的优势细菌门共有4 个,其在各咸梅样品中的平均相对含量见图4。

图4 咸梅样品中优势细菌门的平均相对含量Fig.4 Average relative content of dominant bacteria phylum in salty plum samples
由图4 可知,咸梅样品中4 个优势细菌门分别为变形菌门(Proteobacteria)、硬壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes),其平均相对含量分别为66.97%、21.50%、5.30%和4.20%,前三者的累计平均相对含量高达93.77%,且为咸梅样品共有的优势细菌门。陈晓东等[23]以Illumina MiSeq 宏基因组测序技术对与咸梅样品制作工艺相似的酸笋中的发酵液进行细菌群落结构分析,发现广西地区的桂林、柳州、来宾、百色、南宁、贵港6 个传统产地的酸笋发酵液中细菌主要来自4 个门类,分别为厚壁菌门(Firmicute)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),与本研究结果类似,此现象可能与采集的地区有关。由图4 可知,样品SM1 中变形菌门(Proteobacteria)的相对含量明显低于其它样品,而样品SM4 中变形菌门(Proteobacteria)的相对含量亦明显高于其它样品,说明各样品中优势细菌门的种类和含量存在差异。
在属水平上发现9 份咸梅样品中相对含量大于1.0%的优势细菌属共有7 个,其在咸梅样品中的平均相对含量见图5。

图5 咸梅样品中优势细菌属的平均相对含量Fig.5 Average relative content of dominant bacteria genus in salty plum samples
由图5 可知,广西地区咸梅样品中主要的菌属是雷尔氏菌属(Ralstonia),其在样品SM2、SM3、SM4、SM5、SM6、SM8 和SM9 中占比较高,相对含量分别为59.30%、61.64%、73.48%、68.55%、65.32%、64.86% 和62.80%,而在样品SM1 中占比较少,为4.08%;此外还有伯克氏菌属(Burkholderia)、假单胞菌属(Pelomonas)乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、诺卡氏菌属(Nocardia)和另枝菌属(Alistipes),在样品中的平均相对含量分别为6.16%、1.35%、10.36%、1.75%、2.74%和1.00%。有研究人员发现雷尔氏菌属的部分菌种对含钾酸盐矿物有较强的分解能力,在矿物生物风化上有一定的作用[24];伯克氏菌属在生物防治上有一定的作用,也有研究发现其可引起腹泻。何梦雪等[25]对广西南宁地区农户自制的酸柠檬进行高通量测序,结果表明,雷尔氏菌属(Ralstonia)、伯克氏菌属(Burkholderia)、诺卡氏菌属(Nocardia)、假单胞菌属(Pelomonas)和另枝菌属(Alistipes)是优势细菌属,与本研究结果一致,这可能与当地原材料的生长环境有很大关联。因此,在后续的咸梅研究中,应该进一步改善当地原料生长环境和加工环境,提高咸梅的食用安全性。对咸梅的研究亦可进一步筛选出优良的菌株,如伯克氏菌属中的部分菌种具有固氮能力[26],有利于植物生长;刘佳莉等[27]发现使用假单胞菌A-4 处理燕麦,有助于提高燕麦的盐碱抗性。由此可知,咸梅中可能潜含有一些可应用于生物防治方面的菌种。
2.4 优势细菌属相关性分析
由细菌多样性和菌群结构分析发现,咸梅样品中含有丰富的细菌菌群,其中特有细菌种类较多但相对含量少,而共有细菌菌群居多,且样品中主要以隶属于变形菌门的雷尔氏菌属为主。为进一步探究咸梅样品中细菌菌属间的关系,本研究对咸梅样品中相对含量大于1.0%的优势细菌属进行了相关性分析,结果如图6 所示。

图6 相对含量大于1.0%的细菌属相关性分析热图Fig.6 Heat map of bacterial genus correlation analysis with relative content greater than 1.0%
由图6 可知,雷尔氏菌属(Ralstonia)与伯克氏菌属(Burkholderia)和假单胞菌属(Pelomonas)均呈显著正相关(P<0.05),芽孢杆菌属(Bacillus)与另枝菌属(Alistipes)存在显著性正相关(P<0.05),伯克氏菌属(Burkholderia)和假单胞菌属(Pelomonas)也呈显著正相关(P<0.05)。其中假单胞菌属(Pelomonas)的细菌多数具有耐盐性、分解脂肪和蛋白质的能力,所以在盐腌食品中有生存优势[28];而芽孢杆菌属(Bacillus)耐高温、耐氧化并且稳定性好,其部分菌种是食品加工中重点预防的菌株[29]。由此可知,不同细菌类群之间可能存在一定的共生关系。此外,广西咸梅样品中部分优势菌属间亦存在拮抗或竞争关系,如乳杆菌属(Lactobacillus)与雷尔氏菌属(Ralstonia)和伯克氏菌属(Burkholderia)均呈显著负相关(P<0.05)。乳杆菌属(Lactobacillus)可以产生乳酸和多种抗菌物质[30],其在咸梅样品中的平均相对含量为10.36%,可能是咸梅滋味形成的基础;而雷尔氏菌属(Ralstonia)和伯克氏菌属(Burkholderia)的部分菌种是潜在的人类病原菌[31],它们在咸梅样品中的平均相对含量为59.44%,如果这些菌属含量过高,会影响咸梅的食用安全性。因此,在后续对咸梅的研究中,可以采用传统可培养技术收集优良的菌株,改善咸梅样品的滋味品质,亦可发掘固氮能力强或盐碱抗性强的潜在菌株。
3 结论
本研究以9 份广西地区咸梅样品作为研究对象,采用第二代高通量测序技术对其细菌多样性和群落结构进行解析。通过细菌多样性分析发现咸梅样品中细菌种类丰富,特有细菌种类较多但含量少,菌群组成以共有细菌菌群居多。通过细菌群落结构解析发现变形菌门、硬壁菌门和放线菌门是广西地区咸梅中共有的优势细菌门,雷尔氏菌属、伯克氏菌属、假单胞菌属、乳杆菌属、芽孢杆菌属、诺卡氏菌属和另枝菌属是广西地区咸梅中的优势细菌属,其中雷尔氏菌属(Ralstonia)与伯克氏菌属(Burkholderia)和假单胞菌属(Pelomonas) 均呈显著正相关(P<0.05),芽孢杆菌属(Bacillus)与另枝菌属(Alistipes)存在显著性正相关(P<0.05),伯克氏菌属(Burkholderia)和假单胞菌属(Pelomonas)也呈显著正相关(P<0.05),还有部分优势菌属间存在拮抗或竞争关系。

