沙枣花多糖提取工艺优化及其对益生菌的增殖作用
赵燕燕,房世杰,张 政,祁华梅,薄学敏,魏 佳,,吴 斌,
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐 830049;2.新疆农业科学院农产品贮藏加工研究所,新疆农产品加工与保鲜重点实验室,新疆乌鲁木齐 830091)
沙枣(Elaeagnus angustifolia)属胡颓子科,主要分布在我国的西北地区,如宁夏,甘肃和新疆等地。沙枣花外观呈淡黄色的钟形,长约5~7 mm,香味与江南桂花相似,享有“飘香沙漠的桂花”的美称[1]。沙枣花含有黄酮、多酚和三萜皂苷等多种活性成分[2-4],不仅具有抗氧化活性、抗炎和抑菌作用,还能治疗气促、哮喘和关节炎等疾病[5-8]。目前,关于沙枣花的研究聚焦于精油提取,但较低的精油提取率限制了相关产品的开发[9-10]。此外,沙枣花中活性物质种类及其功效研究仍处于起步阶段。因此,进一步挖掘沙枣花可能存在的功能活性对于打造生态、经济与社会效益兼具的“三效”沙枣产业,加快新疆沙枣产业化发展和推进乡村振兴战略具有重要意义。
作为天然来源的重要生物大分子,多糖具有免疫、抗肿瘤、保肝、降血脂、抗氧化活性和益生元等作用[11-12]。近年来,随着健康中国建设持续推进,天然多糖的益生元作用引起了消费者广泛关注。在维持人体肠道菌群动态平衡过程中,益生菌是一类必不可少的有益微生物,它们通过抑制病原体生长、增强免疫力、防止腹泻、增加钙吸收和降低结肠癌风险,为人体健康提供“生物屏障”[13]。尤其是两个重要的益生菌菌属——双歧杆菌和乳杆菌,已经被广泛应用于乳制品、饮料和食品中。一些植物多糖已被证明在促进益生菌增殖方面发挥着重要作用,比如红枣多糖对于植物乳杆菌和鼠李糖乳杆菌的增殖有促进作用[14];油菜籽多糖在刺激益生菌增殖和产酸方面表现出较强的活性[15];从籽瓜中分离的多糖能够促进双歧杆菌和嗜酸乳杆菌的生长[16]。然而,目前关于沙枣花多糖的提取工艺及对其功能性作用的研究相对较少,且沙枣花多糖是否也能够对益生菌增殖产生积极作用,成为一种潜在的益生元仍需进一步探究。
目前,提取植物多糖的方法主要有热水浸提法[17]、酸碱提取法[18]、酶解辅助提取法[19]和超声波辅助提取法[20]等。超声波辅助提取法作为近年来被广泛应用的一种提取技术,具有提取时间短、操作温度低、能耗低、安全环保等优点。此外,响应面方法(RSM)已被广泛用于评估单个因素及其交互作用对多糖得率的影响。为了提高多糖得率,根据响应面法设计试验,已有研究系统分析了提取参数对植物多糖得率的影响,如银杏叶多糖[21]、山药多糖[22]、蛇足石杉多糖[23]等。因此,响应面法是优化多糖提取技术的有效方法。
本研究以沙枣花作为实验材料,采用热水浸提-超声波辅助法提取多糖,并结合响应面法(Response Surface Methodoloy,RSM)优化提取工艺。以低聚果糖(FOS)作为对照,明确沙枣花多糖对青春双歧杆菌(Bifidobacterium adolescentis)、两歧双歧杆菌(Bifidobacterium bifidum)和嗜酸乳杆菌(Lactobacillus acidophilus)的增殖及生长的影响,为沙枣花资源的高效利用提供新的思路和方法。
1 材料与方法
1.1 材料与仪器
沙枣花 2022 年5 月采集自中国新疆昌吉回族自治州阜康市,50 ℃烘干12 h 后用高速粉碎机研磨成粉末,通过60 目网筛后,置于自封袋中,室温(20±5 ℃)下干燥储存,用于后续实验;两歧双歧杆菌(Bifidobacterium bifidum)CICC 6071、青春双歧杆菌(Bifidobacterium adolescentis)CICC 6070 和嗜酸乳杆菌(Lactobacillus acidophilus)CICC 6074 中国工业微生物菌种保藏管理中心;低聚果糖(Fructooligosaccharides,FOS)、圆底立式厌氧培养袋 青岛海博生物技术有限公司;硫酸镁、吐温80、乙酸钠、氯化钠、磷酸二氢钠、磷酸氢二钠、葡萄糖 天津福晨化学试剂有限公司;酵母浸粉、蛋白胨、牛肉浸粉、胰蛋白胨 北京奥博星生物技术有限责任公司;本实验使用的化学品均为分析纯。
SK-7200H 超声波清洗器 上海科导超声仪器有限公司;BTP-8ZLE0X 真空冷冻干燥机 美国Spectronics 公司;RE100-Pro 数控旋转蒸发仪 美国SCILOGEX 公司;MIKRO 220R 台式高速离心机 德国Hettich 科学仪器公司;UV-2600 紫外分光光度计 日本岛津公司;HH-2 恒温水浴锅 常州金坛精达仪器制造有限公司;DHG-9145A 电热鼓风干燥箱 上海一恒科学仪器有限公司;GI54TW 高压灭菌器 美国致微仪器;SW-CJ-1D 超净工作台 苏州安泰空气技术有限公司;ZWY-1102C 恒温摇床 上海智城分析仪器制造有限公司。
1.2 实验方法
1.2.1 沙枣花多糖提取工艺 参考刘宇等[24]的方法并稍作修改。通过超声辅助-热水浸提的方法提取沙枣花多糖。首先称取一定重量干燥的沙枣花粉末加入5 倍无水乙醇浸泡12 h,过滤后加入同等体积的石油醚浸泡12 h 来脱脂脱色,然后将残留物干燥。接着称取5 g 残留物粉末置于250 mL 三角烧瓶中,按照一定的料液比加入超纯水,经超声(350 W)处理,设定提取温度和提取时间,并将以上步骤重复2 次。萃取液经过离心(5000 r/min,10 min)后,将上清液合并然后浓缩,添加3 倍无水乙醇后置于4 ℃12 h,将沉淀重新溶解于5 倍蒸馏水中并浓缩去除乙醇,最后冷冻干燥48 h,获得沙枣花多糖,根据以下公式计算得率:
1.2.2 单因素实验 按照1.2.1 中的方法,固定超声时间为20 min、提取温度为70 ℃和提取时间60 min,选择不同的料液比(1:10,1:15,1:20,1:25和1:30 g/mL),考察对多糖得率的影响;固定料液比为1:25 g/mL、提取温度70 ℃和提取时间60 min,设置不同的超声时间(10、20、30、40 和50 min),考察对多糖得率的影响;保持相同的料液比1:25 g/mL、超声时间20 min 和提取时间60 min,设定不同的提取温度(50、60、70、80 和90 ℃),考察对多糖得率的影响;保持相同的料液比1:25 g/mL、超声时间20 min和提取温度70 ℃,设定不同的提取时间(40、50、60、70 和80 min),考察对多糖得率的影响。
1.2.3 响应面试验 由单因素实验结果作为基础,采用三水平三因素Box-Behnken 试验设计进行优化研究。响应面试验因素水平设计见表1。

表1 响应面试验因素水平设计Table 1 Response surface experimental factors level
1.2.4 沙枣花多糖对益生菌生长的影响
1.2.4.1 培养基的配制 双歧杆菌培养基(液体):胰蛋白胨10.0 g,牛肉浸粉5.0 g,酵母浸粉10.0 g,葡萄糖5.0 g,L-半胱氨酸盐酸盐0.5 g,CaCl20.2 g,MgSO4·7H2O 0.48 g,K2HPO41.0 g,KH2PO41.0 g,NaHCO310.0 g,NaCl 2.0 g,溶解于1000 mL 水中,pH7.2。
双歧杆菌培养基(固体):将15.0 g 琼脂加入到1000 mL 液体培养基中。
MRS 培养基(液体):蛋白胨10.0 g,牛肉浸粉10.0 g,酵母浸粉5.0 g,葡萄糖5.0 g,乙酸钠5.0 g,柠檬酸二铵2.0 g,吐温80 1.0 mL,K2HPO42.0 g,MgSO4·7H2O 0.2 g,溶解于1000 mL 水中,pH6.7。
MRS 培养基(固体):将15.0 g 琼脂加入到1000 mL 液体培养基中。
1.2.4.2 菌种的活化 用0.4 mL 无菌水将三个益生菌菌种的冻干粉进行溶解并吹打均匀,接种在5 mL经121 ℃灭菌20 min 的液体培养基中,随后快速放进厌氧培养袋中,在37 ℃下恒温培养48 h。随后,取5%的培养液接种在经121 ℃灭菌20 min 的固体培养基上,用涂布棒涂抹均匀,37 ℃下于厌氧环境培养48 h,接着挑取培养后的单菌接种在液体培养基中,再以相同的培养条件培养48 h,最终得到活化的菌种。
1.2.4.3 沙枣花多糖对益生菌增殖及产酸的影响参考包晓玮等[25]的方法,稍作修改。在试管中分别加入10 mL 的液体培养基(成分与1.2.4.1 中一致,仅不加葡萄糖,下同),接着分别加入0、0.5%、1.0%、1.5%、2.0%和3.0%的多糖溶液,在3500 r/min 离心10 min 后,取上清液配制成由沙枣花多糖作为唯一碳源的增殖培养基,并置于121 ℃下灭菌20 min。按照5 %的比例接种已活化的三个菌种,在厌氧条件下恒温培养48 h。用紫外分光光度计测定每个液体培养基在600 nm 处的吸光度和各培养基的pH值,用FOS 做阳性对照。
1.2.4.4 沙枣花多糖对益生菌生长速率的影响 参考Wang 等[15]的方法稍作修改。在试管中分别装入10 mL 液体培养基,接着分别加入2.0%多糖溶液,3500 r/min 离心10 min 后,取上清液配制成液体培养基,灭菌后接种已活化的三个菌种,在37 ℃下厌氧培养48 h,培养过程中在0、4、8、16、24、32、40 和48 h 分别取部分培养液在600 nm 处测定吸光度及pH,用FOS 做阳性对照。以培养时间为横坐标,以OD 值(600 nm)和pH 为纵坐标,绘制不同菌种的生长速率曲线。
1.3 数据处理
设置三组平行实验,所有数据以平均值±标准差表示;运用Origin 2019 软件进行图形绘制;通过Design Expert 10 软件进行响应面试验设计及分析;使用SPSS 20.0 软件进行方差分析及显著性检验,P<0.05 为差异显著。
2 结果与分析
2.1 单因素实验
2.1.1 不同料液比对沙枣花多糖得率的影响 料液比的变化对沙枣花多糖得率的影响如图1 所示。随着料液比的增加,多糖的得率不断增长,且当料液比为1:25 g/mL 时,多糖得率达到最大(12.10%±0.11%),与料液比为1:10~1:20 g/mL 时的多糖得率存在显著差异(P<0.05),当料液比继续增加到1:30 g/mL时多糖的得率则出现下降趋势,但无明显差异(P>0.05)。增加溶剂会有助于多糖的扩散、溶出,但是当固体和液体有效接触面积达到一定值之后,多糖的扩散就会趋于平衡,在处于平衡时增加溶剂并不会增加多糖的溶出,反而会造成部分多糖的损失[26]。因此,选择料液比为1:25 g/mL。

图1 料液比对多糖得率的影响Fig.1 Effect of solid-liquid ratio on polysaccharide yield
2.1.2 不同超声时间对沙枣花多糖得率的影响 利用超声可以使多糖更充分地释放出来,不同超声时间对多糖得率的影响如图2 所示。在10~20 min,多糖得率随着超声时间延长逐渐增大,且在20 min 时,多糖得率达到最大(12.14%±0.24%),显著高于在10、40 和50 min 时的多糖得率(P<0.05)。随后,多糖得率逐渐降低,这可能是因为超声时间的延长会使多糖大分子链出现断裂,从而使小分子的糖在醇沉过程中损失,导致多糖的得率下降[27]。因此,选择超声时间为20 min 较为合适。

图2 超声时间对多糖得率的影响Fig.2 Effect of ultrasonic time on polysaccharide yield
2.1.3 不同提取温度对沙枣花多糖得率的影响 在较高温度下,多糖扩散系数增加并且多糖在提取溶剂中的溶解度增强会使更多的多糖进入溶液中。由图3可以看出,随着提取温度从50 ℃提高到70 ℃,多糖得率显著升高(P<0.05),从10.30%±0.15%增加到12.16%±0.21%。然而,当提取温度继续增加时,多糖的得率呈现下降的趋势。虽然温度升高会加速分子的热运动,利于多糖分子的溶出,但温度过高则可能会使一些糖苷键断裂,引起多糖的裂解[28],从而导致多糖得率的降低。因此,选择70 ℃为适宜的提取温度。
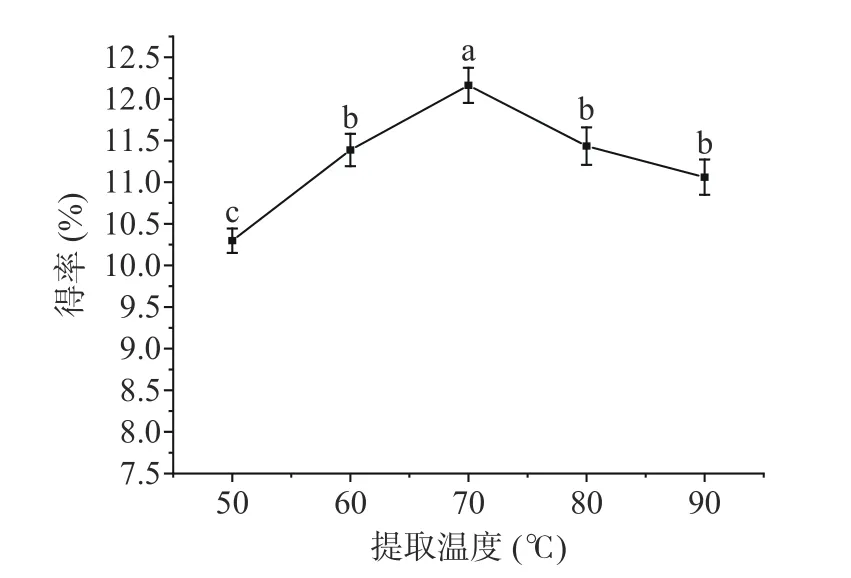
图3 提取温度对多糖得率的影响Fig.3 Effect of extraction temperature on polysaccharide yield
2.1.4 不同提取时间对沙枣花多糖得率的影响 提取时间是影响多糖得率的主要因素之一,长时间提取有利于提高多糖的产量。由图4 所示,多糖的得率随着提取时间的延长呈先上升后下降的趋势。提取时间在40~60 min 之间,多糖得率显著提高(P<0.05),且在60 min 时,多糖得率达到最大(12.23%±0.11%)。当提取时间超过60 min,多糖的得率不断降低,这是由于多糖具有热不稳定性,长时间的高温提取会使多糖降解,降低其得率[29]。因此选择提取时间为60 min。

图4 提取时间对多糖得率的影响Fig.4 Effect of extraction time on polysaccharide yield
2.2 响应面法优化沙枣花多糖的提取工艺
2.2.1 响应面试验设计及实验结果 由单因素实验结果作为基础,将对多糖得率影响较大的三个因素,超声时间(A)、提取温度(B)和提取时间(C)作为自变量,以得率(Y)作为响应值,进行响应面试验设计,共得到17 组试验,结果见表2 所示。

表2 响应面试验设计及结果Table 2 Response surface experimental design and results
2.2.2 模型的建立及统计分析 运用Design-Expert 10 软件对实验数据进行回归拟合,得到二次多项式方程为:Y=12.41+0.40×A+0.79×B+0.45×C-0.77×AB+0.17×AC+0.47×BC-0.95×A2-1.67×B2-1.22×C2。
回归模型的方差分析结果如表3 所示,可以观察到P<0.0001,表明该模型高度显著,因此实验设计合理可行;失拟项P=0.1214>0.05,不显著,说明该拟合模型可以继续后续的优化设计;模型的决定系数R2=0.9801,此值越接近1,表明理论回归方程模型对实际条件拟合越好,因此该模型适合用来优化沙枣花多糖的提取工艺。另外,从表中F值可以看出,本实验中3 个因素对多糖得率的影响程度次序为:B(提取温度)>C(提取时间)>A(超声时间)。

表3 回归模型的方差分析结果Table 3 Variance analysis results of regression model
2.2.3 响应面分析 图5 表示了受超声时间、提取温度和提取时间各因素交互作用的影响沙枣花多糖得率的响应面图与等高线图,可以观察到,3D 响应面图均为开口向下,等高线图均为椭圆形,表示在本次实验范围内存在最高点和中心点。结合3D 响应面图和等高线图可以得出,本实验所设计的因素水平范围之内可以得到沙枣花多糖提取的最优条件。根据响应曲面的陡峭程度,也可以判断各因素对响应值的影响程度,表面越陡,影响越大,反之亦然。因此,本实验中影响因素的大小顺序为提取温度>提取时间>超声时间。

通过软件分析再结合实际操作验证,最终得出沙枣花多糖最佳提取工艺为:料液比1:25 g/mL、超声时间21 min、提取温度72 ℃和提取时间62 min,根据此条件,进行了3 组平行实验,计算出多糖得率为12.45%±0.15%,与理论预测值12.587%相近。因此,该理论模型能够准确地反映各因素对沙枣花多糖得率的影响,证明了用响应面法优化沙枣花多糖得率的回归模型是准确可靠的。
2.3 沙枣花多糖对益生菌增殖的影响
OD 值测定由于具有简便和易操作的特点,通常用来检测菌体的数量变化。OD 值越大,表示培养液中含有的菌体数量越多。沙枣花多糖对青春双歧杆菌、两歧双歧杆菌和嗜酸乳杆菌的增殖情况如图6所示。结果显示,沙枣花多糖对三种益生菌的增殖均具有一定的促进作用,均呈现先上升后趋于稳定的趋势。多糖质量浓度为0.5%~3.0%时,沙枣花多糖和FOS 对三种益生菌的增殖活性均具有显著性差异(P<0.05),当沙枣花多糖质量浓度为2.0%时,测定含有嗜酸乳杆菌、两歧双歧杆菌和青春双歧杆菌培养基的OD 值最大,分别为1.23±0.01、1.06±0.02 和1.22±0.02,表明此时培养基中所含菌体数量最多,益生菌的增殖活性最好。

图6 不同质量浓度多糖溶液对嗜酸乳杆菌(A)、两歧双歧杆菌(B)和青春双歧杆菌(C)增殖的影响Fig.6 Effects of polysaccharide solutions with different mass concentrations on the proliferation of Lactobacillus acidophilus(A),Bifidobacterium bifidum (B) and Bifidobacterium adolescentis (C)
2.4 沙枣花多糖对益生菌产酸的影响
图7 为添加沙枣花多糖和FOS 对三种益生菌培养基pH 的影响。结果显示,当多糖质量浓度在0~3.0%范围内时,三种培养基的pH 随着多糖质量浓度的增加而降低,且对三种益生菌pH 的变化与FOS 存在显著性差异(P<0.05)。当质量浓度为2%时,嗜酸乳杆菌、两歧双歧杆菌和青春双歧杆菌培养基的pH 最低,分别为5.17±0.04、5.95±0.04 和5.52±0.02。由此表明,三种益生菌能够以沙枣花多糖作为碳源进行增殖并产酸。

图7 不同质量浓度的多糖溶液对嗜酸乳杆菌(A)、两歧双歧杆菌(B)和青春双歧杆菌(C)产酸的影响Fig.7 Effects of polysaccharide solutions with different mass concentrations on acid production of Lactobacillus acidophilus(A),Bifidobacterium bifidum (B) and Bifidobacterium adolescentis (C)
2.5 沙枣花多糖对益生菌生长速率的影响
沙枣花多糖对三种益生菌生长速率的影响如图8所示。当培养时间为0、4、8 和16 h 时,沙枣花多糖对两歧双歧杆菌和青春双歧杆菌的促增殖效果和FOS 没有显著差异(P>0.05),并在16 h 之后,OD 值快速增加,于40 h 时达到最大,分别为1.05±0.01 和1.22±0.02(图8B 和图8C)。而添加沙枣花多糖后,嗜酸乳杆菌的OD 值在16 h 时显著高于FOS(P<0.05),说明此时对于嗜酸乳杆菌而言,沙枣花多糖要优于FOS 对其的促进作用,并在32 h 后趋于稳定,在40 h 时达到最大值(1.23±0.02)(图8A)。由以上分析表明,沙枣花多糖对青春双歧杆菌和嗜酸乳杆菌的促增殖活性相当,优于两歧双歧杆菌。

图8 最适质量浓度下多糖溶液对嗜酸乳杆菌(A)、两歧双歧杆菌(B)和青春双歧杆菌(C)生长速率的影响Fig.8 Effects of polysaccharide solution on growth rate of Lactobacillus acidophilus (A),Bifidobacterium bifidum (B) and Bifidobacterium adolescentis (C) at optimum mass concentration
在培养时间为0~8 h 之间,沙枣花多糖对两歧双歧杆菌和青春双歧杆菌的pH 均呈快速下降趋势,两歧双歧杆菌培养基在32 h 之后pH 趋于稳定,而青春双歧杆菌培养基在40 h 之后pH 趋于稳定,两者最低pH 均出现在48 h 时为5.96±0.02 和5.49±0.03(图8B 和图8C);在培养时间为16 h 时,添加沙枣花多糖的嗜酸乳杆菌培养基pH 显著低于FOS(P<0.05),说明此时的沙枣花多糖对嗜酸乳杆菌的促产酸能力高于FOS,并且在48 h 时,pH 达到最低为5.16±0.03(图8A)。由以上分析可以看出,沙枣花多糖对嗜酸乳杆菌的促产酸能力要优于另两种益生菌。
3 讨论与结论
近年来,低聚糖和多糖等益生元作为功能性食品受到了广泛关注,它们可以促进肠道中有益菌的生长,同时对沙门氏菌、大肠杆菌等有害细菌具有拮抗作用,从而抑制其增殖以改善宿主健康。目前可获得的益生元,如菊粉及其衍生物和低聚半乳糖、低聚果糖等,已被广泛用作食品中的功能性成分[30]。再后来,人们对益生元来源的开发日益拓展,通过研究发现,一些植物多糖可以在促进益生菌生长和活性方面发挥重要作用。与低聚糖类似,多糖进入肠道后会转化为碳源,通过调节肠道微生物群并且选择性地刺激有益菌群的生长,积累有机酸等代谢产物来抑制病原体,对人体提供健康益处[31-33]。本研究中的结果表示,沙枣花中提取的多糖对青春双歧杆菌、两歧双歧杆菌和嗜酸乳杆菌的增殖均有一定的促进作用,当沙枣花多糖质量浓度为2.0%时对所测益生菌的增殖最为显著,质量浓度为3.0%时,OD 值则开始降低,这是由于多糖浓度升高会导致培养基中渗透压失去平衡,使菌体破裂,从而抑制了益生菌的生长[34]。这与Wang 等[15]对菜籽多糖的研究相似。此外,在此质量浓度下三种益生菌培养基的pH 分别都有一定的降低,促进了益生菌产酸的活性,这是由于沙枣花多糖可以作为碳源被益生菌所代谢,产生一些有机酸,从而降低培养液的pH。这与常雪花等[16]对籽瓜多糖的研究的结果相似。从多糖对三种益生菌培养基的生长速率曲线图中可以看出,随着培养时间的延长,各培养基中的OD 值均升高,pH 均下降,且当培养40 h 之后,生长速率趋于稳定,这是由于培养基中可以被益生菌利用的碳源被消耗殆尽,所以导致各菌种的生长变得缓慢。根据以上结果可以得出,沙枣花多糖可以成为一种碳源被嗜酸乳杆菌、两歧双歧杆菌和青春双歧杆菌所利用,从而促进菌体的增殖与生长。
在单因素实验的基础上,通过设计响应面优化试验,得到沙枣花多糖最佳提取工艺参数:料液比1:25 g/mL,超声时间21 min、提取温度72 ℃、提取时间62 min。在此条件下沙枣花多糖得率为12.45%±0.15%。沙枣花多糖能够刺激青春双歧杆菌、两歧双歧杆菌和嗜酸乳杆菌的增殖与产酸,并且促进菌种增殖的最佳多糖质量浓度为2%。另外,本研究只是确定了沙枣花多糖的最优提取条件和初步评价了沙枣花多糖对益生菌有一定的促增殖活性,但关于其活性与结构之间可能存在的联系仍有待后续研究。

