有机酸种类对罗非鱼皮酸溶性胶原提取和性质的影响
韩耀辉,田浩浩,石林凡,任中阳,翁武银
(集美大学海洋食品与生物工程学院,厦门市海洋功能食品重点实验室,福建省海洋功能食品工程技术研究中心,福建厦门 361021)
胶原是由三条α肽链通过-COOH 和-NH2基团之间的共价键、氢键和范德华力结合而成的天然蛋白,约占动物体总蛋白的30%,具有亲水性、生物相容性、低免疫原性等优点,是生物医学应用的理想材料[1-3]。海洋动物源胶原蛋白具有高得率、低免疫原性和低炎症性[4]。罗非鱼(Oreochromis niloticus)是世界上第二大养殖鱼类[5]。2021 年罗非鱼全国年产量约达166 万吨[6]。在罗非鱼片等产品生产加工过程中会产生鱼鳞、鱼皮等大量富含胶原蛋白的副产物,它们却没有全部得到高值化利用[7-9]。因此,利用罗非鱼鱼皮、鱼鳞提取胶原,不仅可以提高罗非鱼的利用率和附加值,还可以减少环境污染。
酸的种类、浓度、液/固比、温度和时间等因素对胶原提取率有很大影响[1,4,10]。Bhuimbar 等[7]研究了酸的种类对水母胶原提取率的影响,结果表明乳酸对胶原的提取率最高,其次是甲酸、酒石酸(tartaric acid,TA)、乙酸(acetic acid,AA)和柠檬酸(citric acid,CA)等。Skierka 等[11]研究了AA、TA、乳酸和盐酸等酸种类对鳕鱼皮胶原提取率的影响,结果显示AA 和乳酸对鱼皮胶原的提取率高于其他酸。这些结果表明,酸的种类对鱼皮胶原的提取具有一定的影响,但关于有机酸种类对罗非鱼皮胶原提取和性质的影响却未见报道。AA、TA、CA 分别为一元、二元、三元羧酸,通过研究它们对罗非鱼胶原的提取和理化性质的影响,将为有机酸种类对鱼类胶原的提取机制提供一定的理论依据。
因此,本研究利用AA、TA 和CA 提取罗非鱼皮酸溶性胶原(acid-soluble collagen,ASC),通过ASC 的提取率测定、紫外光谱分析、圆二色光谱(CD)分析、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析、傅里叶变换红外光谱(FTIR)分析、热稳定性测定和成纤维能力分析,探究有机酸种类对提取胶原理化性质的影响。
1 材料与方法
1.1 材料与仪器
冷冻罗非鱼皮 宁德市夏威食品有限公司提供;TA、AA、CA 分析纯,国药集团化学试剂有限公司。
UV-8000A 紫外-可见分光光度计 上海元析仪器有限公司;CD 光谱仪 英国Applied Photophysics公司;Aglient 1200 高效液相色谱仪 美国Aglient公司;Tensor 27 ATR-FTIR 光谱仪 德国Bruker 光谱仪器公司;Q2000 差示扫描量热(DSC)仪 美国TA 仪器有限公司;TA-XT Plus 质构仪 英国Stable Micro System 公司。
1.2 实验方法
1.2.1 罗非鱼皮ASC 的提取 罗非鱼皮ASC 的提取根据Shi 等[12]报道的方法,提取过程在4 ℃下完成。将解冻的鱼皮放在0.1 mol/L NaOH 溶液(w/v,1:10)中浸泡36 h,然后用蒸馏水冲洗至中性。将漂洗好的鱼皮以1:10 比例依次浸入10%(v/v)正丁醇和25%(v/v)乙醇,浸泡24 h 后用蒸馏水冲洗。漂洗好的鱼皮以1:30(w/v)的比例分别放在0.5 mol/L AA、TA 和CA 中浸泡萃取48 h,萃取液用NaCl 盐析后再通过透析、冻干得到纯化的AA-ASC、TAASC 和CA-ASC。胶原的提取率通过如下公式进行计算[13]:
式中:m 表示冻干胶原的质量,g;M 表示干鱼皮的质量,g。
1.2.2 ASC 理化性质测定
1.2.2.1 紫外吸收光谱 胶原紫外吸收光谱参考Meng 等[14]报道的方法进行测定。称取适量冻干的胶原溶于10 mmol/L HCl(pH3.0)溶液中得到终浓度为0.2 mg/mL 的胶原溶液。以10 mmol/L HCl 溶液作为空白对照,利用紫外-可见分光光度计在190~400 nm 波长范围内进行扫描。
1.2.2.2 CD 分析 胶原CD 光谱参考寇慧芝等[15]报道的方法进行测定。称取适量冻干的胶原溶于10 mmol/L HCl 溶液中得到0.1 mg/mL 的胶原溶液,在25 ℃下利用CD 光谱仪在260~190 nm 波长范围内进行扫描,扫描速度为1 nm/min。
1.2.2.3 氨基酸组成分析 胶原溶解在含有0.1%苯酚的6 mol/L HCl 溶液后,放在110 ℃下消化水解22 h。利用旋转蒸发器在60 ℃反复旋蒸去除盐酸,再用0.02 mol/L HCl 溶解,过0.22 μm 水系膜后,用OPA/FMOC 进行衍生,利用高效液相色谱仪进行测定氨基酸组成。
1.2.2.4 SDS-PAGE 分析 将冻干的胶原溶解在8 mol/L 尿素-2% SDS-20 mmol/L Tris-HCl(pH8.8)溶液后,采用4%浓缩凝胶和6%分离凝胶在8 mA电流下进行SDS-PAGE 分析。然后按照冯玲玲等[16]的方法对凝胶进行染色和脱色,利用凝胶成像仪拍照保存。
1.2.2.5 FTIR 分析 参照郑清瑶等[17]报道的方法,利用衰减全反射-FTIR 光谱仪在室温下对胶原进行测定。取适量冻干的胶原样品放置在单反射锗晶体池上,在4000~1000 cm-1范围内进行扫描,并在32 次扫描中以4 cm-1的分辨率采集信号。
1.2.2.6 胶原热稳定性测定 参考Liu 等[18]报道的方法,利用DSC 测定胶原蛋白的热稳定性,并通过设备配套软件计算玻璃化转变温度(Tm)和热变性焓值(ΔH)。将冻干的胶原以1:40(w:v)比例溶于10 mmol/L HCl 溶液后,准确称取5 mg 左右样品于铝坩埚中,以空的坩埚作对照。扫描温度范围为10~50 ℃,升温速率为5 ℃/min。
1.2.2.7 成纤维能力测定 胶原成纤维度的测定根据Meng 等[14]等报道的方法并稍作修改。参考Tang等[19]报道的方法,将胶原溶于10 mmol/L HCl 溶液中得到0.5 mg/mL 的胶原溶液。利用缓冲液在4 ℃对胶原溶液透析12 h,期间每3 h 更换一次透析液[19]。将透析好的胶原溶液置于25 ℃下孵育30 min 后,通过15000×g、20 ℃下离心20 min 后,利用Lowry 法测定上清液的蛋白含量。胶原成纤维度定义为离心后上清液中胶原质量减少的百分比,按如下公式进行计算:
式中:Y 是胶原的成纤维度,%;C0是胶原的初始浓度,mg/mL;C 是离心后上清的蛋白浓度,mg/mL。
1.3 数据处理
实验数据结果用平均值±标准差表示。数据处理软件为Excel 16,图形绘制软件为Origin 2019,采用SPSS 18.0 软件对数据进行单因素方差分析(ANOVA),并通过Duncan 多重比较进行显著性检验,显著水平为P<0.05。
2 结果与分析
2.1 不同有机酸对罗非鱼皮酸溶性胶原提取效果
图1 显示了罗非鱼皮AA-ASC、TA-ASC 和CAASC 的提取率。由图可知,AA-ASC 和TA-ASC 的提取率分别为15.87%和17.69%,显著低于CA-ASC的提取率28.63%(P<0.05),均高于报道的罗非鱼皮AA-ASC 提取率(11.70%)[20]。三种有机酸下的胶原提取率不同可能是因为AA、TA、CA 分别为一元、二元、三元羧酸,在相同摩尔浓度下CA 中的多个羧基不断解离[21],与胶原的肽链竞争性结合[22],促进胶原溶胀溶解。另一方面,浸提溶液的pH 通过调节电荷密度影响胶原的静电相互作用和结构[1],pH 太低会引起胶原在提取过程中发生变性[23],进而影响胶原在鱼皮中的溶解度和提取率。在相同摩尔浓度下TA 的pH 最低,可能由于鱼皮胶原在提取过程中发生部分变性,结果导致TA-ASC 的提取率接近AAASC。
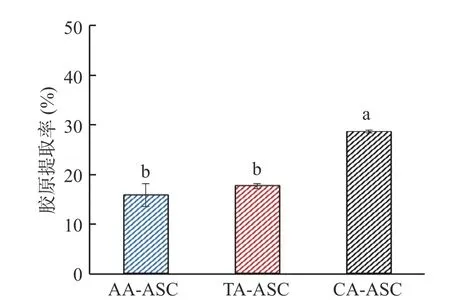
图1 罗非鱼皮酸溶性胶原提取率Fig.1 Yields of ASCs extracted from tilapia skin
2.2 不同有机酸对罗非鱼皮酸溶性胶原紫外吸收的影响
AA-ASC、TA-ASC、CA-ASC 分别在223、221、219 nm 出现最大吸收峰(图2),这归因于胶原三螺旋肽链的-C=O、-COOH 和-CONH2等生色基团的n→π*跃迁[24]。通常,胶原蛋白中酪氨酸和苯丙氨酸等芳香族生色氨基酸含量很少,在280 nm 处无明显吸收峰[25]。因此,AA-ASC、TA-ASC、CA-ASC 在280 nm 处的吸收峰均不明显,表明提取的胶原中杂蛋白含量少,纯度高。这类似于报道的暗纹东方鲀鱼皮胶原蛋白的研究结果[25]。
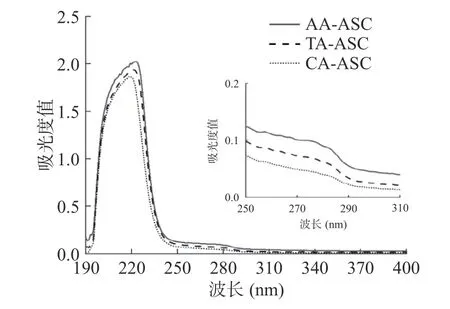
图2 罗非鱼皮酸溶性胶原紫外吸收光谱Fig.2 UV spectra of ASCs extracted from tilapia skin
2.3 不同有机酸对罗非鱼皮酸溶性胶原三螺旋结构的影响
通常,天然胶原蛋白的CD 光谱有一个正吸收峰(220 nm)和一个负吸收峰(195~198 nm),分别来自蛋白多肽链的n→π*电跃迁和π→π*磁跃迁[26-27]。罗非鱼皮AA-ASC、TA-ASC、CA-ASC 的最大正吸收峰和最大负吸收峰分别在220 和197 nm 左右(图3),图谱与横坐标轴的交叉点分别在213、216和213 nm,具有典型的三螺旋结构[28]。在相同浓度(0.1 mg/L)下,AA-ASC、TA-ASC、CA-ASC 的CD光谱强度依次减弱,表明不同有机酸提取的胶原二级结构存在差异[29]。CD 光谱中正负峰强度绝对值的比值(Rpn)用来反映胶原分子的三螺旋程度。非变性胶原的Rpn 值一般为0.12,当胶原发生部分变性时,Rpn 值降低,图谱与横坐标轴的交叉点红移,胶原的三螺旋构象含量降低[23,30]。AA-ASC、TA-ASC、CA-ASC 的Rpn 值分别为0.12、0.05、0.11,而且TAASC 的图谱与横坐标轴的交叉点相对AA-ASC 和CA-ASC 发生了红移(图3)。这些结果表明AAASC 和CA-ASC 的完整性较好、三螺旋构象含量较高,而TA-ASC 发生了部分变性。酸的解离常数(Ka)越高、pH 越低,胶原的溶胀性能就越强,但是有机酸会破坏胶原三螺旋结构的酰胺键、端肽的不稳定交联以及分子内/间的非共价键[31]。极低pH 的破坏作用可能会增强,从而导致胶原在提取过程中发生变性[22,31]。本实验中AA(Ka=1.7×10-5)、TA(Ka1=1.0×10-3,Ka2=4.6×10-5)和CA(Ka1=7.4×10-4,Ka2=1.7×10-5,Ka3=4.0×10-7)分别为一元、二元和三元羧酸,一级解离常数(Ka1)大小为:TA>CA>AA。TA-ASC 变性可能是因为TA 的Ka1值最大、酸性最强。
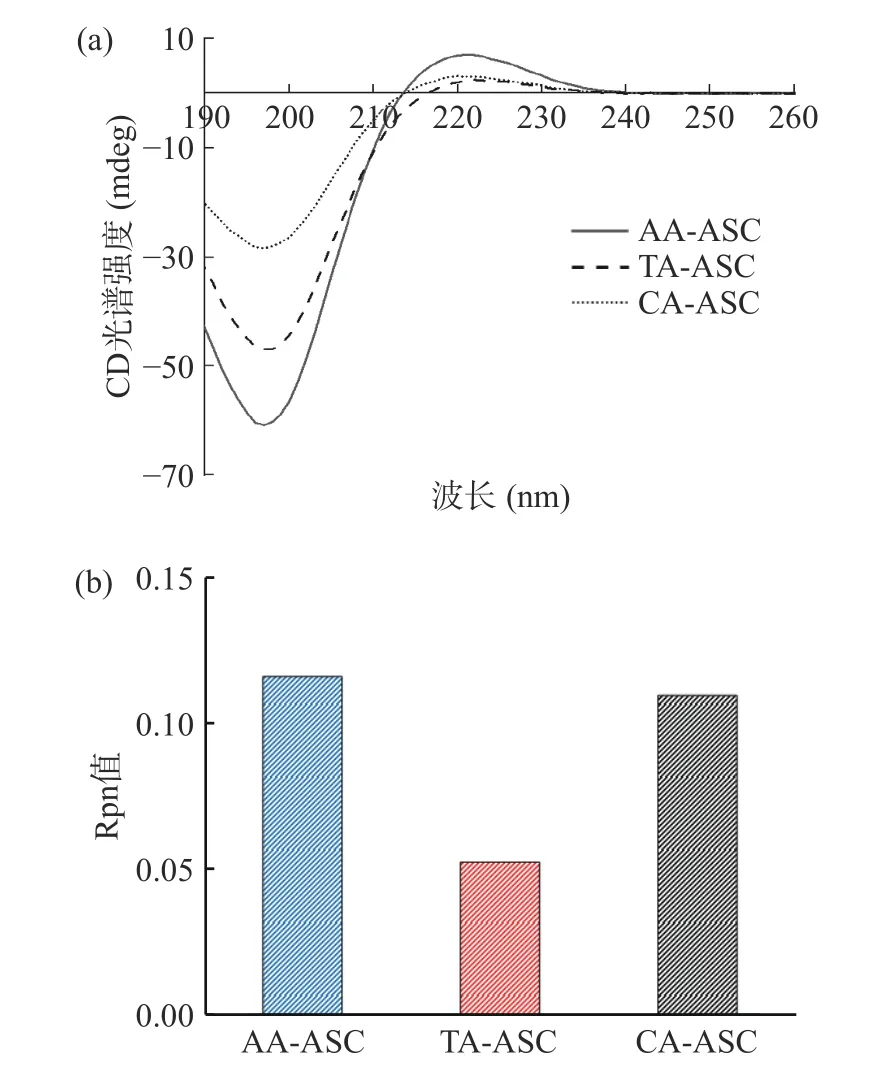
图3 罗非鱼皮酸溶性胶原CD 光谱(a)和Rpn 值(b)Fig.3 CD spectrum (a) and Rpn ratio (b) of ASCs extracted from tilapia skin
2.4 不同有机酸对罗非鱼皮酸溶性胶原氨基酸组成的影响
罗非鱼皮AA-ASC、TA-ASC、CA-ASC 的氨基酸组成测定结果如表1 所示。由表可知,AA-ASC、TA-ASC、CA-ASC 均富含甘氨酸(Gly)、丙氨酸(Ala)、脯氨酸(Pro)和羟脯氨酸(Hyp)等胶原蛋白的特征氨基酸,同时组氨酸(His)、酪氨酸(Tyr)和赖氨酸(Lys)3 种非胶原特征氨基酸均未检出,表明AAASC、TA-ASC、CA-ASC 均为高纯度胶原。Gly 的含量最高,约占总氨基酸残基的三分之一,这是因为除了C-端的前10 个氨基酸残基和N-端的后14 个氨基酸残基,胶原三螺旋区域的肽段均以Gly-XY 的重复序列进行分布[32]。AA-ASC、TA-ASC、CAASC 的Hyp 含量逐渐减少,表明胶原含量依次降低,可能也会影响胶原的热稳定性。
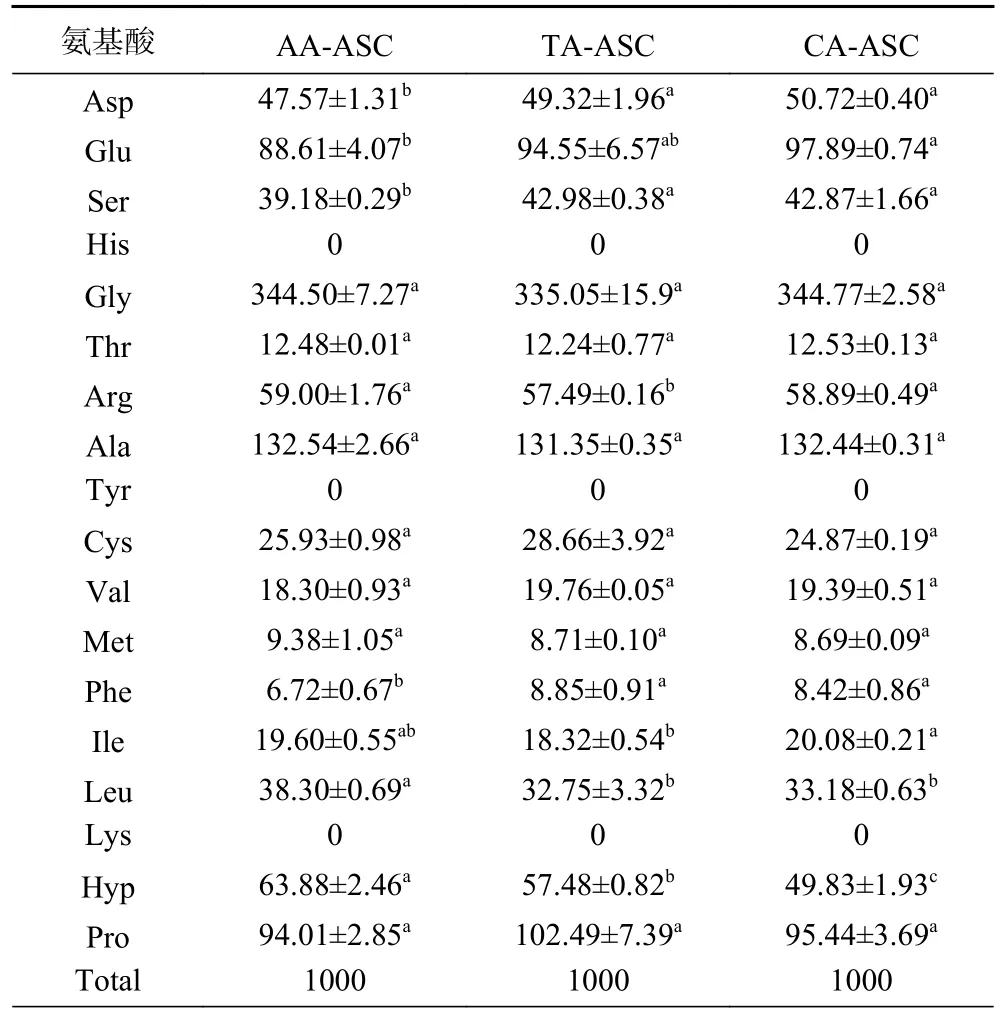
表1 罗非鱼皮酸溶性胶原氨基酸组成(残基数量/1000 个氨基酸残基)Table 1 Amino acid compositions of ASCs extracted from tilapia skin (residues per 1000 total amino acid residues)
2.5 不同有机酸对罗非鱼皮酸溶性胶原分子量的影响
罗非鱼皮胶原的电泳图谱如图4 所示。由图可知,AA-ASC、TA-ASC、CA-ASC 均由α(α1和α2)亚基、二聚体β亚基、三聚体γ亚基和少量高分子组分(HMWF)组成,三种胶原的α1和α2谱带的强度比约为2:1。这些结果表明AA-ASC、TA-ASC、CA-ASC 均为典型的Ⅰ型胶原[33]。且胶原的亚基组成不受有机酸种类的影响。
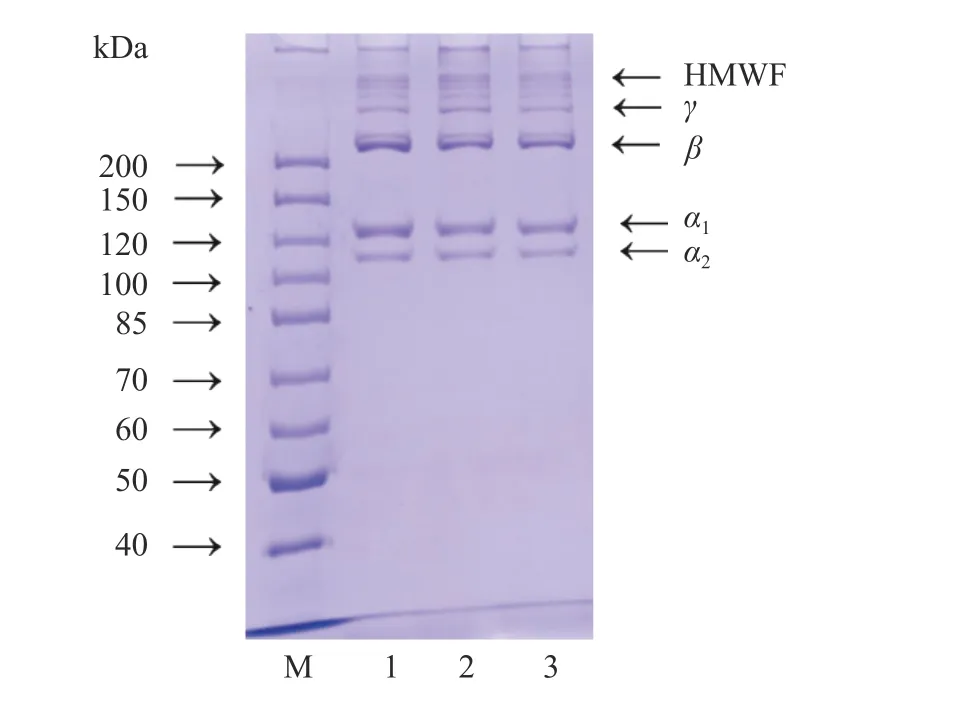
图4 罗非鱼皮酸溶性胶原SDS-PAGE 图Fig.4 SDS-PAGE patterns of ASCs extracted from tilapia skin
2.6 不同有机酸对罗非鱼皮酸溶性胶原红外光谱的影响
胶原的FTIR 光谱通过一组酰胺吸收区域进行表征,这些由基团振动产生的酰胺带提供了多肽链的二级结构信息[17]。罗非鱼皮AA-ASC、TA-ASC、CA-ASC 的FTIR 光谱如图5 所示。由图可知,AAASC、TA-ASC、CA-ASC 的酰胺A 吸收峰分别在3293、3305、3300 cm-1。酰胺A 主要与N-H 基团的伸缩振动有关,当N-H 基团参与形成氢键时,酰胺A 峰向低波数移动[17]。因此,AA-ASC 的N-H 基团参与形成的氢键最多,其次是CA-ASC 和TA-ASC。AA-ASC、TA-ASC、CA-ASC 的酰胺Ⅰ分别在1629、1640、1633 cm-1,酰胺Ⅱ分别在1540、1546、1544 cm-1(图5),意味着胶原中C=O 和C-N 参与维持胶原的三螺旋结构的氢键含量增加[17,34]。
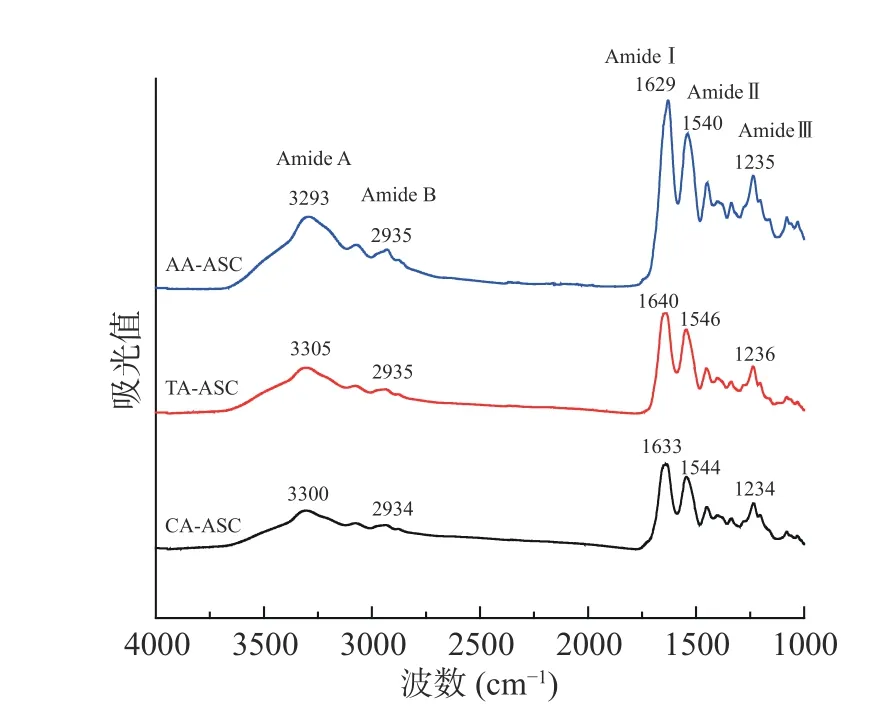
图5 罗非鱼皮酸溶性胶原的红外图谱Fig.5 FTIR spectra of ASCs extracted from tilapia skin
2.7 不同有机酸对罗非鱼皮酸溶性胶原热稳定性的影响
罗非鱼皮AA-ASC、TA-ASC、CA-ASC 的DSC曲线如图6 所示。AA-ASC、TA-ASC、CA-ASC 的热转变温度(Tm)均在32 ℃左右,这与Yan 等[35]报道的AA 提取的罗非鱼皮胶原的Tm(31.85 ℃)一致。图6 的结果表明有机酸提取不会影响罗非鱼皮ASC 的Tm。另一方面,变性焓(ΔH)与胶原分子周围形成的水化网络结构的氢键数量相关[36]。AAASC、TA-ASC、CA-ASC 的ΔH 分别为1.18、0.73、0.35 J/g,表明三者的热稳定性依次降低。这可能是因为AA-ASC 的亚氨基酸和氢键含量最高,TA-ASC的氢键含量低于CA-ASC,但亚氨基酸含量显著高于CA-ASC(表1 和图5)。邓明霞等[37]通过相关性数学模型分析,也表明了氢键和亚氨基酸含量会影响淡水鱼胶原的热稳定性。
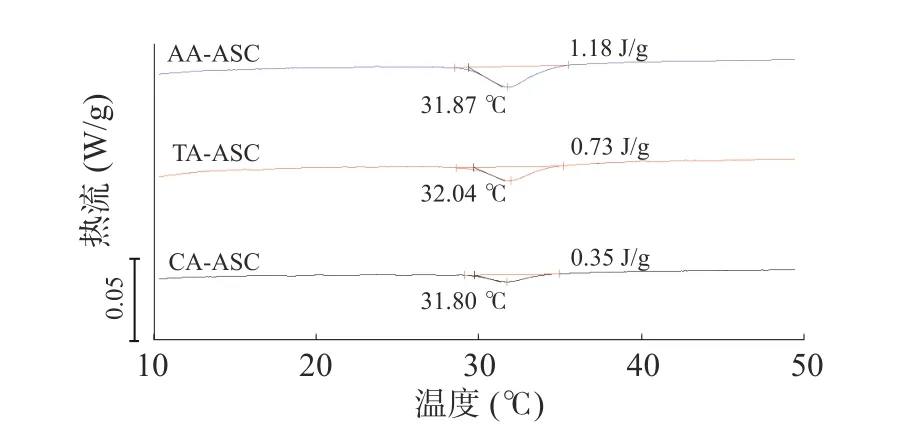
图6 罗非鱼皮酸溶性胶原DSC 曲线Fig.6 DSC thermograms of ASCs extracted from tilapia skin
2.8 不同有机酸对罗非鱼皮酸溶性胶原成纤维能力的影响
罗非鱼皮AA-ASC、TA-ASC、CA-ASC 的浊度-时间曲线和动力学常数如图7 所示。胶原自组装成纤维过程一般分为迟滞期(吸光度值保持不变)、增长期(吸光度值快速增大)和稳定期(吸光度值达到最大并保持稳定状态)。AA-ASC、TA-ASC、CAASC 的迟滞时间分别为6、21、19 min(图7a)。研究表明,胶原三螺旋构象含量降低会导致自组装时间(迟滞期和增长期)延长[38]。在本研究中,AA-ASC的三螺旋构象含量与CA-ASC 接近且均高于TAASC(图3b),这可能导致TA-ASC 的迟滞期和自组装时间最长。由图7 可知,稳定期的吸光度值和动力学常数大小顺序依次为AA-ASC>CA-ASC>TAASC。这与胶原三螺旋构象含量(图3b)和氢键含量(图5)的变化趋势一致。这个结果表明自组装成纤维过程可能受胶原分子的三螺旋结构和氢键等因素的影响。
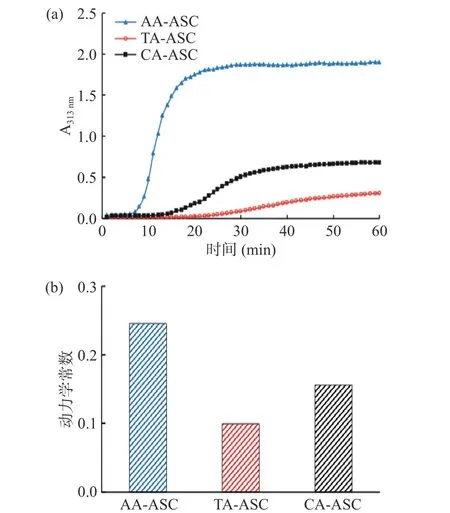
图7 罗非鱼皮酸溶性胶原的浊度-时间曲线(a)和动力学常数(b)Fig.7 Turbidity-time curves (a) and kinetic constants (b) of ASCs extracted from tilapia skin
3 结论
本研究揭示了醋酸、酒石酸和柠檬酸三种有机酸对罗非鱼胶原提取和性质的影响。醋酸对罗非鱼胶原提取率明显低于其他有机酸,但提取的胶原其三螺旋构象含量和热变性焓值均最高。研究结果表明有机酸的种类会影响酸对胶原三螺旋结构和氢键的破坏,进而影响胶原的提取率、氨基酸组成、热稳定性和成纤维能力。胶原的成纤维速率主要受三螺旋构象含量的影响,三螺旋构象含量越高,成纤维速率越大。本研究为有机酸种类对罗非鱼皮酸溶性胶原提取和性质的影响机制提供了一定的理论基础。

