植物乳植杆菌YZH81 胞外多糖基因簇的功能鉴定
赵 芳,黄 璐,宦海琳,黄淑婷,张文君,梁晴晴,杨 瑶,
(1.南京师范大学食品与制药工程学院,江苏南京 210023;2.浙江商业职业技术学院旅游烹饪学院,浙江杭州 310053;3.江苏省农业科学院畜牧研究所,江苏南京 210014;4.徐州湘然农牧发展有限公司,江苏徐州 221622)
胞外多糖(exopolysaccharides,EPS)是乳酸菌的重要代谢产物,一般包括释放到培养基中的粘液多糖(slime polysaccharide,SPS)和附着在细胞壁的荚膜多糖(capsular polysaccharide,CPS)两类[1]。在食品工业中,乳酸菌EPS 是一类安全的功能性添加剂,应用范围广泛,通常用作稳定剂[2-3]、增稠剂[4-5]和乳化剂[6-7],能赋予产品良好的质地、风味和口感。植物乳植杆菌作为一类食源性微生物,因其安全性高,在工业、食品和医药等重要领域占有一席之地,在众多乳酸菌EPS 研究中,植物乳植杆菌来源的EPS 产量高,研究报道较多,其在发酵过程中产生的EPS 被广泛应用于食品生产[8]、制药[9]及化工生产等领域[10]。
细菌EPS 合成相关基因及其功能最先在肺炎链球菌等致病菌中得到了详细的阐述[11]。近年来,随着许多乳酸菌菌株的全基因组序列已经公布[12-15],EPS合成相关基因的研究也在不断推进。乳酸菌EPS 合成基因簇的大小通常为15~20 kb,所含基因数不超过30 个,这些基因往往方向相同并以单个mRNA的形式转录。植物乳植杆菌来源的EPS 合成基因簇研究报道也较多,目前结果显示植物乳植杆菌的EPS合成基因簇类型为荚膜多糖基因簇(cpscluster),不同菌株基因组通常含有1~4 个cps基因簇[16]。一个典型的cps基因簇结构上可以分为四个功能区域,即链长调节、组装、合成和输出区域,多个基因共同完成EPS 重复单元的合成、聚合和输出。植物乳植杆菌WCFS1(以下简称WCFS1)是第一个进行全基因组测序的乳酸菌,也是目前报道含cps基因簇最多的植物乳植杆菌,其基因组包含四个不同的cps基因簇(cps1A-I,cps2A-J,cps3A-J和cps4A-J),每个基因簇片段大小约10 kb,包含10 个左右负责编码调控因子或酶的基因。此外,还有一些植物乳植杆菌的cps被较多报道[17],如ST-III,JDM1,ZJ316 等,各菌株含1~3 个不等的cps基因簇。目前研究显示植物乳植杆菌的cps基因簇的多样性与其菌株特异性存在一定相关性[18],因此针对不同菌株的cps需要开展更多的功能询证实验,为更多潜在益生菌的开发利用奠定基础。
本实验室前期开展高产EPS 乳酸菌筛选,筛选获得一株植物乳植杆菌YZH81(简称YZH81),其EPS 产量为380.00±47.16 mg/L,与现有文献报道的EPS 产量较高的乳酸菌水平相当[19-20]。对YZH81进行全基因组测序,分析其cps基因簇结构,发现其基因组上有一个cps基因簇(cps2)与报道菌株同源性较高[21]。另外,还存在一个区域含多个与EPS 合成相关基因串联一起,推测是YZH81 菌株的另一个cps基因簇(cps1)。进一步比对结果显示,cps1基因簇中的很多基因也在一些植物乳植杆菌菌株中存在,推测cps1基因簇是植物乳植杆菌中普遍存在的一个cps基因簇,其结构和功能亟待鉴定。因此,本文首先利用同源重组的手段对YZH81 菌株cps1基因簇进行敲除,从菌株生长特性、自凝集能力、粘附特性和DPPH 自由基清除能力等不同方面开展研究,旨在揭示cps1基因簇的功能,为进一步研究YZH81菌株高产EPS 的特性奠定基础。
1 材料和方法
1.1 材料与仪器
本实验所用菌株和质粒见表1。本研究中使用的所有植物乳植杆菌均在MRS 培养基中培养,添加的红霉素和氯霉素终浓度均为10 µg/mL,培养温度为37 ℃。大肠杆菌的培养用LB 培养基,添加的红霉素或氯霉素终浓度分别为250 和10 µg/mL;MRS培养基 中国青岛海博有限公司;LB 培养基 英国Oxoid 有限公司;红霉素、氯霉素、透析袋(14 kD)、溶菌酶、PBS(磷酸缓冲盐溶液)、细菌DNA 提取试剂盒、琼脂糖(Agarose H)、4S Red 核酸染料(4S Red Plus Nucleic Acid Stain)生工生物工程(上海)股份有限公司;ExTaq、DNA Marker、Bacteria Genomic DNA Extraction Kit 宝生物工程(大连)有限公司;三氯乙酸、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH·)上海麦克林生化试剂有限公司;无水乙醇 天津市天力化学试剂有限公司;浓硫酸 哈尔滨理工化学试剂有限公司;人结肠腺癌细胞系Caco-2 细胞 生兴生物技术有限公司;

表1 菌株和质粒Table 1 Bacterial strains and plasmids used in this study
本实验所用的引物由生工生物工程(上海)股份有限公司合成(表2)。

表2 引物序列Table 2 Sequence of primers
HE-90 型电泳仪、水平电泳槽 上海天能科技有限公司;SHP-150 型生化培养箱 上海精宏实验设备有限公司;ZQTY-70T 振荡培养箱 上海知楚仪器有限公司;MCO-15AC 型CO2培养箱 日本三洋公司;XD-202 型倒置生物显微镜 江南永新光学有限公司;HH-2 型电热数显恒温水浴锅 常州亚特实验仪器有限公司;SW-CJ-ZF 型双人双面净化工作台 苏州净化设备有限公司;AG 4309 型高压脉冲电击转化仪、Personal PCR 仪、CL-22M 型高速冷冻离心机 德国Eppendorf 公司;Nano-300 微量分光光度计 杭州奥盛仪器有限公司。
1.2 实验方法
1.2.1 基因组DNA 提取 使用细菌全基因组提取试剂盒提取YZH81 全基因组DNA,具体步骤参照使用说明书。取提取后的DNA 样本进行1%琼脂糖凝胶电泳,检测基因组提取质量及完整性。
1.2.2 基因组的测序与分析 YZH81 菌株GenBank编号为JAODTM000000000。基因组的测序在生工生物工程(上海)股份有限公司进行,采用Illumina 测序技术;基因组拼接使用SPAdes 拼接二代测序数据,采用GapFiller 对拼接得到的contig 补GAP;利用PrInSeS-G 进行序列矫正,修正拼接过程中的剪辑错误及小片段的插入缺失。使用Blastn(http://blast.ncbi.nlm.nih.gov/)将YZH81 基因组的cps基因簇与WCFS1(AL935263.2)、LP90(CP_015857)、ST-Ⅲ(NC_014554)和JDM1(CP001617.1)进行对比,由TB Tools(v1.108)进行基因组共线性分析。
1.2.3cps基因簇缺失株的构建 本研究中使用的引物列于表2。YZH81Δcps1的构建基于同源重组原理进行[21],以YZH81 的全基因组DNA 为模板,利用YZH81-Up-F/R、YZH81-Down-F/R 和CAT-F/R引物通过PCR 扩增cps1基因簇的上游和下游侧翼区域,先后克隆至质粒pNZ5319XhoI和BgIII酶切位点,构建敲除质粒pNZ5319Δcps1。按照电击转化法,将质粒电转化YZH81 感受态细胞中,电转产物37 ℃孵育2 h 后涂布于含10 µg/mL 氯霉素的MRS培养基上,37 ℃静置培养24~36 h,阳性克隆采用菌落PCR 验证长度约1.7 kb 同源臂序列,最终获得缺失cps1基因簇的YZH81 突变株,命名为YZH81Δcps1。
为了进一步验证cps1敲除的结果,将YZH81和YZH81Δcps1序列上传到Galaxy 平台进行基因组测序。根据条形码分离来自Illumina 测序的原始Illumina 序列片段,并使用Bowtie 2 将YZH81Δcps1序列的每个读数对应的核苷酸片段映射到YZH81基因组。参考Zhang 等[25]的方法,整合基因组学查看器(IGV)使用核苷酸窗口大小对比对结果进行排序和计数,然后对基因求和。读取映射到基因的最后10%被丢弃,因为这些插入可能不会使基因功能失活。然后,通过以下公式计算归一化读取计数RPKM(每百万输入读取每千碱基读取数),将每个基因的读取计数标准化为映射到每个重复中基因组的读取总数:RPKM=(映射到基因×读取数106)/(样本中映射的总输入读取数×基因长度,单位为kb)。
1.2.4 EPS 产量测定 参考李卫娜等[26]的实验方法并做适量改动。将-80 ℃冰箱保藏的YZH81 和YZH81Δcps1菌种划线相应抗性的MRS 平板,单菌落挑取至液体MRS 培养基活化,活化后的种子液以1%接种量发酵培养,37 ℃静置培养32 h,离心(10000×g,4 ℃,15 min)取上清液。向上清液中加入80%三氯乙酸至终浓度为4%(w/v),4 ℃下静置8 h。通过离心(10000×g,4 ℃,15 min)除去沉淀的蛋白质。随后上清加入3 倍体积的冷乙醇在4 ℃下醇沉过夜,离心(10000×g,4 ℃,20 min)取沉淀。将沉淀用适当体积去离子水溶解,在4 ℃下透析48 h,然后冻干,最终获得粗EPS 样品。采用苯酚-硫酸法测定粗EPS 的碳水化合物含量。绘制标准曲线,以葡萄糖含量(mg/mL)为横坐标,吸光度(A490nm)作为纵坐标,建立回归方程,y=0.014x-0.021,R2=0.99。
1.2.5 生长曲线及pH 测定 参考Yang 等[27]的实验方法并适当改动。将-80 ℃冰箱保藏的YZH81和YZH81Δcps1菌种划线相应抗性的MRS 平板,单菌落挑取至液体MRS 培养基活化,活化后的种子液以1%接种量发酵培养,接种后即刻混匀,取1 mL于比色皿中测定OD600nm值,作为初始零时间点值,随后每2 h 测定一次OD600nm值和MRS 液体培养基的pH,直至24 h 实验结束。以时间为横坐标,OD600nm数值和pH 为纵坐标绘制生长曲线。
1.2.6 自凝集能力检测 参考Gao 等[28]的实验方法并做适量改动。将-80 ℃冰箱保藏的YZH81 和YZH81Δcps1菌种划线相应抗性的MRS 平板,单菌落挑取至液体MRS 培养基活化,活化后的种子液以1%接种量发酵培养,37 ℃静置培养12 h,离心收集菌体(4500×g,15 min),使用PBS(pH7.2)洗涤2 次后于PBS 中重悬,调整菌液浓度至108CFU/mL,将4 mL 等量的细胞菌悬液装入5 mL 的离心管中,混匀后静置于室温。自凝集测定的时间为4 和16 h,每次取0.5 mL 离心管上部菌悬液,加入到1.5 mL的PBS 中,混匀,测定600 nm 下的吸光值。以 PBS作为空白对照,凝集率(%)的计算公式为:
注:A0是凝集前的上清溶液在600 nm 下测定的OD600nm值;AT是凝集后的上清溶液在600 nm下测定的OD600nm值。
1.2.7 Caco-2 细胞粘附性测定 Caco-2 细胞水浴解冻,8000×g 离心5 min 收集细胞,加入5 mL 完全培养液,吸出上清,保留细胞沉淀。加入1 mL 完全培养液轻轻吹吸,混匀并移至培养皿中。放置于37 ℃培养,每隔2 d 更换培养液,显微镜镜检,待细胞培养皿上Caco-2 的覆盖率达到80%后,可进行粘附实验。
细胞粘附实验参照Yang 等[27]的方法。将YZH81 和YZH81Δcps1的菌悬液(已稀释调整至菌浓度为1×108CFU/mL),于12000×g 离心1 min,弃上清,菌体经无菌PBS 缓冲液(pH7.2)清洗3 次,然后重悬于不完全DMEM 培养液。待细胞培养皿中的细胞长至单层时,用无菌PBS 缓冲液(pH7.2)清洗后,添加1 mL 含有1×108CFU/mL 重组乳酸菌的DMEM 培养物,于二氧化碳培养箱中孵育2 h;PBS洗涤去除未粘附细菌,随后加入0.5% Triton X-100处理5 min,使粘附细菌从细胞脱落,收集孔内液体。用细胞粘附数表示粘附性,公式如下:
1.2.8 粘附蛋白的表达量 将活化后的YZH81 和YZH81Δcps1菌株分别转接于相应的MRS 培养基中,37 ℃培养至OD600nm吸光度为0.8~1。根据试剂盒说明书提取YZH81 和YZH81Δcps1的总RNA,使用带有gDNA 的PrimeScript™ RT 试剂盒合成cDNA。以cDNA 为模板,检测粘附蛋白的表达。然后,以rpoBmRNA 为参考基因[24],采用2-ΔΔCT相对定量方法计算各组基因表达,用于RT-qPCR 的引物如表2 所示。
1.2.9 DPPH 自由基清除实验 取2 mL 的DPPH无水乙醇溶液(400 µmol/L),加入2 mL 待测菌液混匀,室温避光静置30 min,8000×g 离心10 min,测定上清液在517 nm 的吸光度值。DPPH 自由基清除率计算公式为:
注:A0为等体积无水乙醇代替样品的吸光度值;A1为实验组吸光度值;A2为等体积无水乙醇代替DPPH 乙醇溶液的吸光度值。
1.3 数据处理
每组实验重复3 次,实验结果为3 次重复的平均值,采用SPSS 22.0 软件进行实验数据的统计与分析。检测水准为0.05,运用最小显著差异(Least significant difference,LSD)法比较,以P<0.05 为差异有统计学意义。实验作图均采用Prism 8.0 软件绘制。
2 结果与分析
2.1 YZH81 菌株cps 基因簇分析
YZH81 菌株经全基因组测序,与cps基因簇研究最为深入的WCFS1 菌株进行比对,结果显示如图1。YZH81 基因组上除基因N7E54_08460 与WCFS1 的cps1B基因有相似性(36.94%)以外,比对获得一个基因簇(自N7E54_12115 至N7E54_12070),含10 个基因,其基因组成、功能、大小及排列与WCFS1 菌株cps4基因簇高度相似,单个基因序列同源性很高,为94.75%~99.62%,故推测该基因簇是YZH81 的一个完整的cps基因簇。

图1 YZH81 菌株cps 基因簇的功能对比图示Fig.1 Comparative illustration of cps gene clusters of L.plantarum YZH81
然而,与其他植物乳植杆菌比对的结果显示YZH81 基因组上还存在一些连续排列的基因(共计14 个,含上述基因N7E54_08460),其功能注释与植物乳植杆菌cps基因簇的功能基因相符,如编码糖基转移酶、多糖生物合成蛋白、翻转酶等,检索比对的基因功能注释和与其他代表性植物乳植杆菌基因相似性分析结果列于表3。因此,推测其为YZH81 另一个cps基因簇。
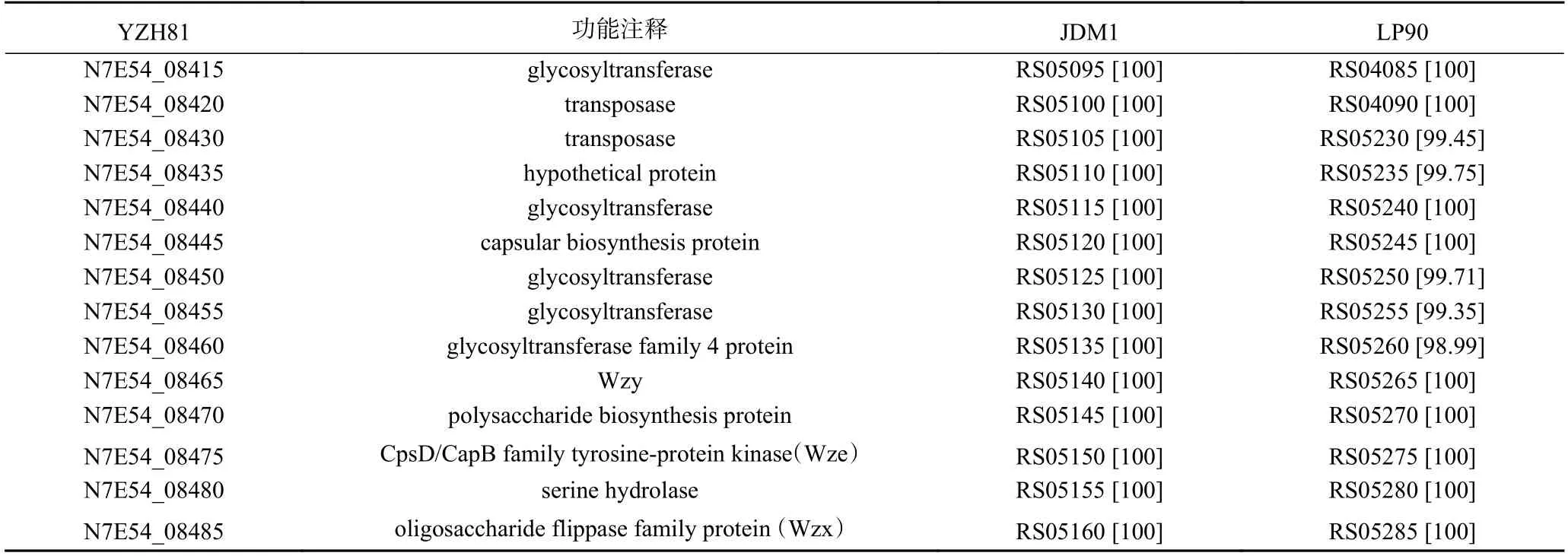
表3 YZH81 菌株cps1 基因簇功能比对Table 3 Functional alignment of cps1 gene clusters of YZH81 strain
综上所述,YZH81 菌株推测含有两个cps基因簇,分别命名为cps1和cps2,其中cps1是尚未报道的植物乳植杆菌cps基因簇,遂开展对YZH81 菌株cps1的功能鉴定研究。
2.2 YZH81Δcps1 的构建
根据方法1.2.3,构建带有YZH81Δcps1基因簇上下游侧翼序列的敲除质粒pNZ5319Δcps1,电击转化YZH81 感受态细胞,利用红霉素和氯霉素双抗性MRS 平板筛选,经PCR 验证,获得阳性菌株YZH81 Δcps1。
由于敲除的cps1基因簇片段较长,为了验证敲除cps1的完整性,对YZH81Δcps1的基因组进行了测序,与野生型YZH81 进行比对,使用IGV 进行定位,如图2 所示,显示整个cps1簇在基因水平上被完全去除。
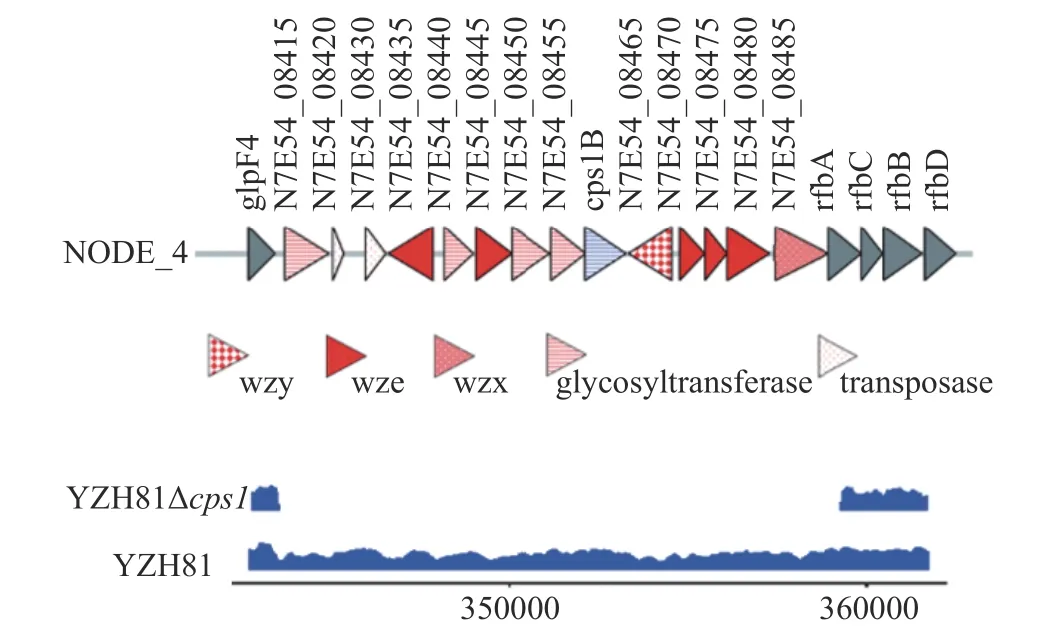
图2 YZH81Δcps1 的cps1 基因簇完整敲除Fig.2 YZH81Δcps1 complete knockout of cps1 gene cluster
2.3 cps1 对YZH81 产EPS 的影响
根据方法1.2.4,对YZH81 和YZH81Δcps1的EPS 产量进行测定,结果如图3。结果显示YZH81 Δcps1的EPS 产量为181.33±22.03 mg/L,相比野生型YZH81 的380.00±47.16 mg/L,EPS 产量显著下降了52.28%(P<0.05)。该结果表明cps1基因簇与菌株EPS 的产量非常相关。
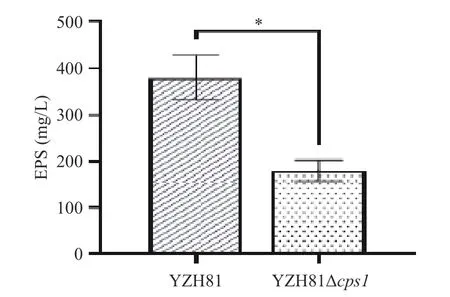
图3 YZH81Δcps1 的EPS 产量Fig.3 EPS production of YZH81Δcps1
2.4 cps1 对YZH81 生长的影响
YZH81 和YZH81Δcps1分别在相应的MRS 培养基中培养24 h,每2 h 测定OD600nm绘制生长曲线,结果如图4 所示。从OD600nm数值来看,YZH81 Δcps1生长不如YZH81,培养24 h 的OD600nm吸光值差异显著(P<0.05)。然而,从培养基pH 数据来看,这两种菌株没有显著差异(P>0.05),随后对两个菌24 h 发酵液进行菌落平板计数,结果为YZH81和YZH81Δcps1的菌落数分别为(9.57±0.40)×109和(9.53±0.25)×109CFU/mL,无明显差异(P>0.05),该结果与pH 结果一致。因此,本研究最终结果表明虽然吸光值OD600nm有显著(P<0.05)下降,但cps1缺失没有影响菌株YZH81 的生长量。
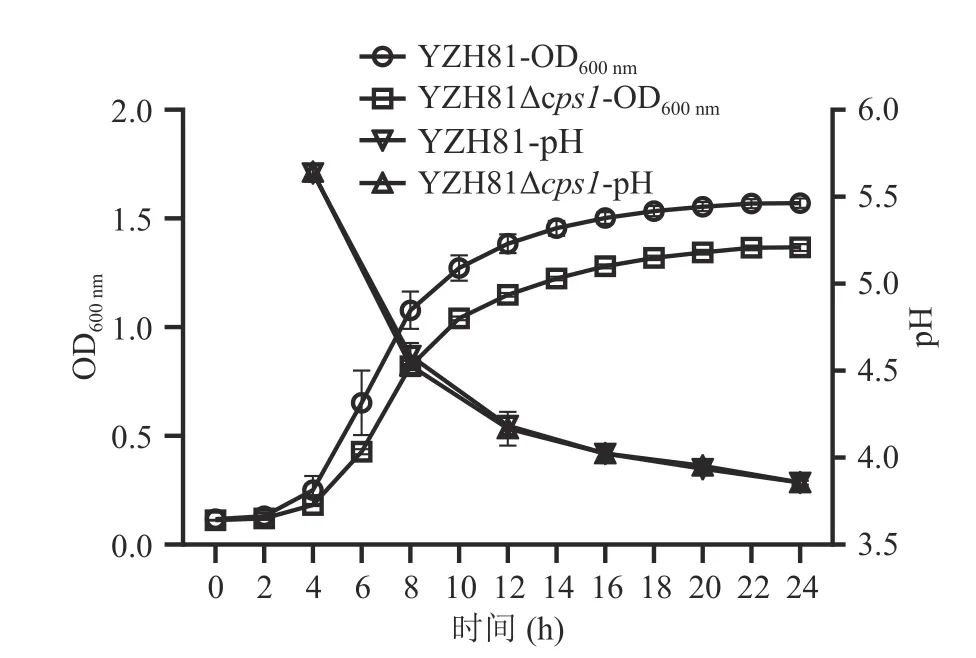
图4 YZH81Δcps1 的生长曲线及pH 测定Fig.4 Growth curve and pH determination of YZH81Δcps1
2.5 cps1 对菌株自凝集的影响
菌株的自凝集是指同一种菌间相互凝集形成多细胞簇的现象,与菌株表面结构相关[28]。YZH81 和YZH81Δcps1的自凝集结果见图5。在4 h 时,YZH81和YZH81Δcps1的自凝集率分别是26.30%±3.22%、38.90%±2.31%;在16 h 时,YZH81 和YZH81Δcps1的凝集速率分别是52.07%±2.03%、68.90%±3.14%。YZH81Δcps1在4 h 和16 h 的自凝集率均显著高于YZH81(P<0.05),分别是YZH81 的1.48 和1.32 倍。该结果说明cps1基因簇的缺失加速了菌株自凝集,分析其原因可能由于EPS 的减少改变了菌株表面分子的相互作用力。自凝集速率的增加可能是导致YZH81Δcps1菌株生长时OD600nm值降低的原因。
2.6 cps1 对菌株粘附性的影响
粘附性是乳酸菌发挥益生作用的前提,与菌体细胞表面结构相关[29]。为了研究cps1基因簇在YZH81 粘附肠上皮细胞的作用,选择肠上皮细胞系(Caco-2 细胞)为研究对象,对YZH81Δcps1的粘附性进行了测定。如图6 所示,YZH81Δcps1的粘附性为8.52±0.20 CFU/cell,显著低于YZH81 的粘附性21.50±1.80 CFU/cell,该结果与Gao 等[28]的实验结果一致,即cpsWC可以促进植物乳植杆菌在Caco-2 细胞上粘附。
此外,实验研究了YZH81 菌株可能的粘附蛋白基因表达情况。首先,根据YZH81 基因组序列与WCFS1 的比对结果,检索获得YZH81 菌株中有12 个与WCFS1 粘附蛋白[14]同源的粘附蛋白基因(表4)。结果显示,除基因N7E54_11140 外,其余11 个粘附蛋白基因序列与WCFS1 菌株同源性较高,相似性高于75%。通过RT-qPCR 研究cps1的缺失对YZH81 粘附蛋白表达的影响,如图7 所示,YZH81Δcps1菌株的12 个粘附蛋白基因中有10 个基因的转录水平显著低于野生型YZH81 表达水平(Fold change 比≥1.5),该结果表明cps1基因簇可能通过影响YZH81 中粘附蛋白的表达,最终导致该菌株与Caco-2 细胞的粘附性显著下降。
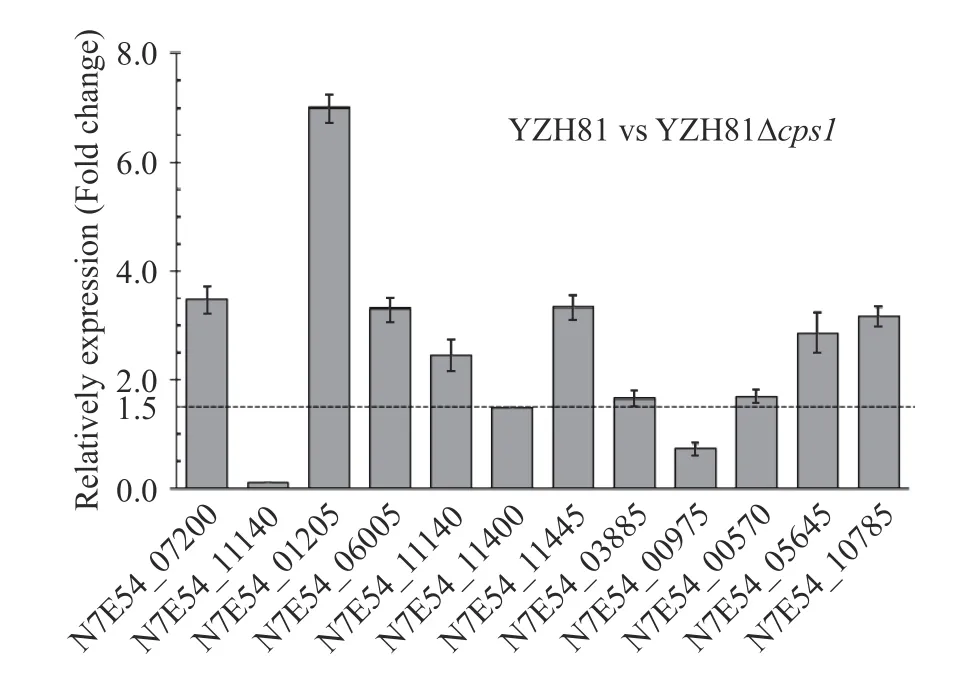
图7 粘附蛋白的基因表达差异Fig.7 Expression of genes coding adhesion proteins
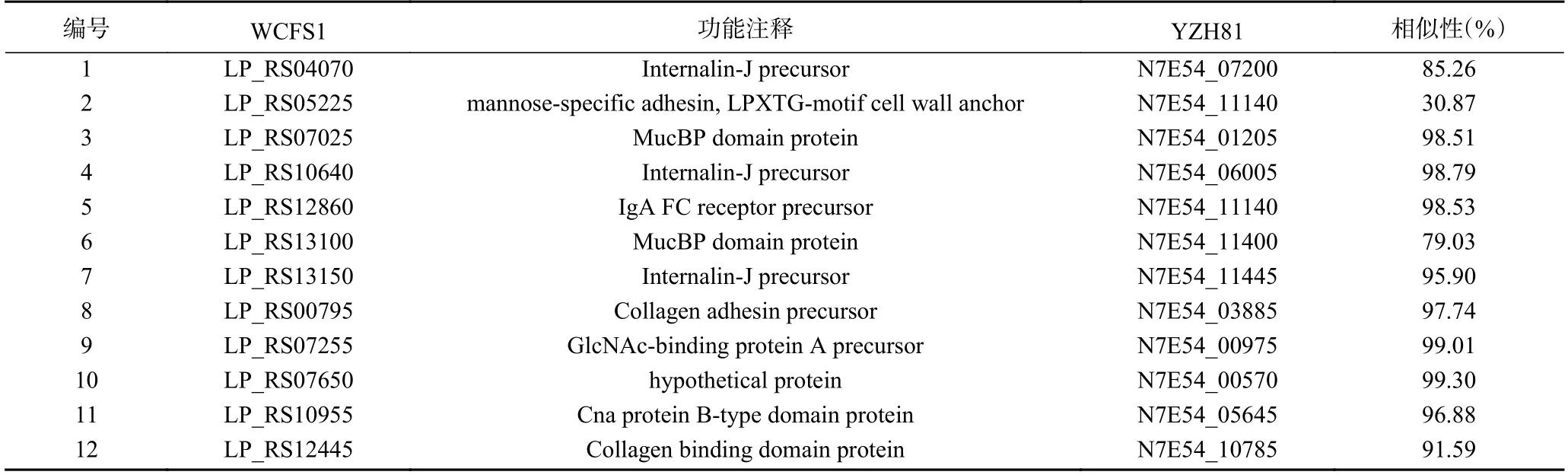
表4 粘附蛋白基因Table 4 Adhesion protein genes
2.7 YZH81Δcps1 对DPPH 自由基清除活性的影响
YZH81 和YZH81Δcps1清除DPPH 自由基能力如图8 所示,两株菌株均有一定的清除DPPH 自由基的能力。但是,YZH81 的DPPH 自由基清除率是46.82%±1.95%,显著高于YZH81Δcps1,清除率为31.64%±1.97(P<0.05)。乳酸菌的DPPH 自由基清除能力与其分泌到菌体表面和代谢产物中的EPS有关,这些多糖类物质通过氢原子和电子转移中和DPPH 自由基[30]。因此,推测YZH81 菌株cps1的缺失引起的EPS 产量的降低,影响了YZH81 对DPPH自由基清除的能力。本实验的结果与Zhang 等[31]对植物乳植杆菌C88 EPS 抗氧化活性分析的结果一致。
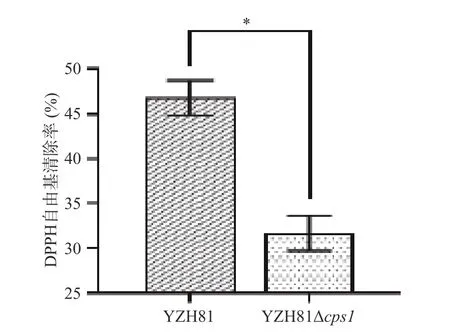
图8 YZH81Δcps1 的DPPH 自由基清除率Fig.8 DPPH· scavenging rate of YZH81Δcps1
3 讨论
乳酸菌广泛应用于生产发酵乳制品,很多菌株被报道可以产生EPS。目前,植物乳植杆菌来源的EPS 研究较为广泛,而且,由于相对简单的基因操作,如成熟的异源表达载体、成功的基因敲除方法[21]和简单的电转化方法,现阶段对植物乳植杆菌的EPS合成基因簇(cps簇)研究报道较多[32-33]。本实验室前期从鸡的直肠中分离获得一株高产EPS 的乳酸菌,经鉴定为植物乳植杆菌,命名为YZH81,其EPS产量为380 mg/L,本研究开展了该菌株cps基因簇的研究,为进一步了解该菌株的EPS 生产特性奠定基础。
植物乳植杆菌基因组通常含有1~4 个EPS 合成基因簇即cps基因簇。典型的cps基因簇通常包含EPS 合成基因(wzd,wze,wzh)、翻转酶(wzx)和聚合酶(wzy)等相关功能基因,单向转录。WCFS1 菌株是植物乳植杆菌中cps簇研究最为透彻的菌株,也是被报道含有最多cps簇的菌株[18]。因此,本文首先将YZH81 菌株与WCFS1 进行比对,结果显示YZH81的基因组仅含1 个cps基因簇,与WCFS1cps4基因簇高度相似(单个基因相似度高达94.75%~99.62%)。但是,与其他植物乳植杆菌(LP90 和JDM1)比对结果显示,YZH81 基因组上还有一个区域聚集一连串与EPS 合成相关基因,功能分别为wze、wzx、wzy和一些编码糖基转移酶家族蛋白的基因,与典型的产EPS 的基因簇结构一致。因此,推测YZH81 具有一个尚未鉴定的cps基因簇,根据基因组上的物理顺序命名为cps1基因簇。
为了鉴定cps1基因簇的功能,本研究构建了cps1敲除菌YZH81Δcps1,并随即开展了该菌株EPS 产量、菌株生长量、菌株自凝集特性和菌株粘附性的体外实验。结果表明,与野生型YZH81 相比,YZH81Δcps1的EPS 产量下降,细胞自聚集加速,且粘附性降低。以上结果不仅说明了cps1基因簇参与了YZH81 菌株的EPS 合成,更为重要的是由于cps1的缺失造成了EPS 的减少,也显著影响了菌株的表面结构,导致了自凝集的加剧和粘附性的降低。考虑到EPS 产量并不是影响菌株粘附性的唯一因素,本文进一步研究了YZH81Δcps1粘附蛋白的表达情况。经检索比对获得的12 个YZH81 菌株粘附蛋白中,与野生型相比,cps1的缺失导致了10 个粘附蛋白基因表达量显著下降,其余2 个无明显变化。该结果说明了YZH81 菌株的cps1基因簇可能通过生产的EPS 产量和调节粘附蛋白表达两个方面的作用来共同影响菌株的粘附性。在此基础上,本研究继续测定了cps1缺失后DPPH 自由基清除效果,结果显示野生型菌株具有一定的抗氧化活性,但cps1基因簇敲除后DPPH 自由基清除率下降了32.42%。该结果显示cps1基因簇的缺失造成EPS 的产量下降影响了菌株的抗氧化功能。
综上所述,YZH81 菌株基因组上发现一个尚未鉴定的EPS 合成基因簇cps1,本研究结果显示该基因簇可影响菌株EPS 的产量,造成菌株粘附性和抗氧化性的改变,为深入研究该菌株EPS 的生物学功能奠定了一定的理论基础。乳酸菌EPS 的合成产生是一个复杂的过程,相关基因簇的调控可能涉及各种调控机制。本研究发现了一个新的cps1基因簇,其功能与EPS 的产生和菌株的功能相关。在此基础上,需要进一步地研究单一cps簇的基因结构与功能以及不同cps簇在EPS 合成中的互作关系,从而深入揭示其合成EPS 的分子机制。
4 结论
本研究针对一株高产EPS 的植物乳植杆菌YZH81 的EPS 合成基因簇(cpscluster)开展研究,对其中一个cps基因簇(cps1)的结构与功能进行初步鉴定。利用同源重组方法,构建pNZ5319Δcps1敲除质粒并成功构建了cps1敲除菌YZH81Δcps1。结果显示,与野生型YZH81 菌株相比,YZH81Δcps1的EPS 产量显著降低,自聚集能力加速,粘附性降低,且清除DPPH 自由基能力明显下降。本研究证明了YZH81 菌株的cps1基因簇在EPS 合成中的重要作用,也为进一步研究该菌株EPS 合成基因簇及其作用机制建立有利条件。

