干旱及复水循环对苗期药用大黄叶片光合碳同化功能和光化学活性的影响
谢丰璞,王 楠,高 静,张 岗,宋忠兴,唐志书,3
(1 陕西中医药大学 陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究与开发国家重点实验室(培育),陕西咸阳 712083; 2 陕西中医药大学 药学院/陕西省中医药管理局“秦药”研发重点实验室,西安 712046; 3 中国中医科学院,北京 100700)
气候变化导致水资源供应异常,干旱事件频发[1]。间歇性和季节性干旱使植物处于土壤水分剧烈波动的环境中,严重影响其正常生长发育[2-3]。植物在受到干旱胁迫时会对生物量进行重新分配[4-5],通常表现为根长和地下部分生物量增加,同时降低地上部分生物量及叶片光合作用,从而来维持自身正常的生长发育和代谢功能[6]。研究发现,在遭受轻度水分亏缺或干旱前期,光合作用的降低主要由气孔因素引起[7]。植物通过限制气孔导度来减少水分损失[8],同时降低CO2在叶肉细胞中的扩散[9],导致光合色素含量减少及光合速率下降[10]。在中、重度或长期干旱胁迫下,植物光合器官电子传递供受体侧受到损害[11],导致光合电子传递受阻,引起叶绿素荧光变化[7]。干旱胁迫使质体醌到光系统I(PSI)末端受体的电子传递量子产额减少,严重影响电子传递链效率[12],而为了降低干旱对光系统Ⅱ(PSⅡ)核心复合体等光合结构的损伤,通常会出现非光化学淬灭等热耗散现象[13]。
植物在遭受干旱后及时获得水分供应,会迅速生长,如光合速率升高,叶绿素含量增加等,以缓解、修复干旱胁迫带来的损伤[14]。有研究发现,玉米叶片叶绿素含量干旱复水后迅速恢复,甚至超过对照水平[15]。新疆大叶苜蓿的光合速率、最大光化学效率、非光化学淬灭等均能在复水后恢复至对照水平并产生补偿效应[3]。然而,当干旱胁迫过于严重时,植物PSⅡ稳定性急剧下降,反应中心失活[16],在复水后叶片光合功能及PSⅡ功能无法恢复[17],光合系统依然遭到严重破坏[7]。植物在遭受干旱胁迫时的抗旱性及其复水恢复功能是否依赖于干旱持续时间、严重程度和复水阶段仍是当前研究的重点。
药用大黄(RheumofficinaleBaill.)为蓼科大黄属植物,其干燥根及根茎为大宗药材大黄的来源之一。虽然药用大黄的固有特性使其可以适应短期干旱,但由于陕南地区连片种植、改变土地利用等原因,导致陆面植被覆盖率降低,土壤蒸发量加大,从而引起缺水现象。
同时,地区降水格局及气候变化带来的季节性干旱会出现干旱-复水-干旱的环境循环,极有可能造成药用大黄关键生育期缺水,严重影响大黄生长和药材品质。然而关于干旱、复水对药用大黄生长发育的影响尚鲜见报道。因此,本试验对不同干旱梯度、干旱时间下的药用大黄幼苗抗旱能力及复水后恢复能力进行研究,观察其干旱及复水后叶片光合作用、叶绿素荧光的变化规律,对药用大黄在不同干旱胁迫程度、干旱时间和复水条件下的光合生理机制进行综合评价,以期为其水分高效利用提供理论依据。
1 材料和方法
1.1 试验材料
参试种子于2020年7月10日采集自陕西省汉中市镇巴县观音镇桃树湾村金竹湾的3年生药用大黄植株,采集地海拔1 470 m,纬度32°29′38″N,经度108°5′19.3″E。选择颗粒饱满、无发霉现象的种子作为试验材料。
试验采用盆栽方式,先将供试种子浸泡于纯净水中24 h,取出后用75%酒精消毒15 s,再用10%的过氧化氢消毒15 min,最后用纯净水冲洗干净,置于有双层湿润滤纸的培养皿中催芽。胚芽长出3~5 mm时取出并播种于直径15 cm、高20.5 cm的花盆中,每个处理种12盆,每盆种7株,土壤质地为泥炭土,在土壤相对含水量为(80±5)%的环境下生长,长至三叶期时选取长势一致的幼苗定苗至每盆3株,各处理共计36株幼苗,生长60 d后开始干旱复水试验。
1.2 试验设计
试验设置4个干旱梯度处理,分别表示为CK[对照组,水分充足,土壤含水量为(80±5)%]、LD[轻度干旱,土壤含水量为(60±5)%]、MD[中度干旱,土壤含水量为(40±5)%]和SD[重度干旱,土壤含水量为(20±5)%],各梯度种3盆作为重复组;各干旱处理又均设置3个持续干旱胁迫复水阶段(干旱10 d→复水3 d→干旱25 d→复水3 d→干旱40 d→复水3 d)。每个处理在每阶段干旱最后一天(复水前,T10-0、T25-0、T40-0)、复水后第1天(T10-1、T25-1、T40-1)、复水后第3天(T10-3、T25-3、T40-3) 取样测定相关各项指标,每处理3个重复。
1.3 测定指标及方法
1.3.1 生长指标
选取长势、大小一致的幼苗,称取各处理地上、地下部分生物量,量取根长,计算根冠比、总生物量、地上部分生长恢复能力、地下部分生长恢复能力、总生长恢复能力,各处理分别选取长势一致的3份样品进行测定,视作3个重复。具体计算公式如下:
根冠比=地下部分生物量/地上部分生物量×100%;总生物量=地下部分生物量+地上部分生物量;生长恢复能力=复水最后一天(T10-3、T25-3、T40-3)生物量-干旱最后一天(T10-0、T25-0、T40-0)生物量。
1.3.2 叶片叶绿素含量
选取长势、大小一致、无病虫害的叶片,避开叶脉剪取0.1 g,采用96%乙醇浸提法提取叶片叶绿素后,使用紫外分光光度计在665 nm和649 nm波长下测定吸光度(A),依据相关公式计算叶绿素a(Chl a)、叶绿素b(Chl b)及总叶绿素(a+b)(Chl a+b)含量,各处理分别选取长势一致的3份样进行测定,视作3个重复。
1.3.3 光合气体交换参数和叶绿素荧光参数
选取长势、大小一致、无病虫害的叶片,使用CIRAS-3便携式光合仪测定,在陕西中药资源产业化省部共建协同创新中心组织培养室测定相关指标,测定时环境参数为:温度25 ℃,二氧化碳浓度380~410 μmol/mol,光合有效辐射(PAR)为1 200 μmol/(m2·s),测定的指标包括:Pn、Ci、Gs、Tr、WUE、Ls、CE、Fv/Fm、ФPSⅡ、ETR、qP、NPQ,各处理分别选取长势一致的3份样进行测定,视作3个重复。各参数释义见表1。

表1 测定和分析中所用的参数指标及其释义
1.3.4 快速叶绿素荧光诱导动力学参数
选取长势、大小一致、无病虫害的叶片,使用Pocket PEA植物效率分析仪测定OJIP曲线及相关参数,测定的指标包括:Fv/Fo、Vj、Vi、Mo、Area、Fo、tFm、Fm、Sm、N、φEo、ψEo、δRo、φRo、ABS/RC、DIo/RC、TRo/RC、ETo/RC、DIo/CSo、TRo/CSo、ETo/CSo、REo/CSo、PIabs、PItotal,各处理分别选取长势一致的3份样进行测定,视作3个重复。各参数释义见表1。
1.4 数据处理
采用Microsoft Excel 2016软件和GraphPad Prism 8.0.2软件进行数据处理和图表绘制,使用IBM SPSS Statistics 22统计分析软件对各指标进行显著性分析(LSD法,P<0.05),使用GraphPad Prism 8.0.2软件制作热图并对荧光参数数据进行单向方差分析和多重比较检验,将本试验各指标处理结果导入R 4.0.2软件,载入vegan、ggplot2程序包分别进行冗余分析(redundancy analysis, RDA)和RDA结果可视化。
2 结果与分析
2.1 干旱和旱后复水对药用大黄幼苗生长的影响
图1显示,在大部分干旱胁迫时间内,药用大黄幼苗复水后地上部、地下部和总的生长恢复能力均随干旱程度的增加呈上升趋势且在干旱胁迫程度之间大多存在显著性差异,这种趋势在总生长恢复能力中表现得尤为突出。随着干旱时间的延长,在轻度干旱胁迫(LD)下,药用大黄幼苗复水后地上部生长恢复能力逐渐显著降低,地下部和总的生长恢复能力则均先降后升且均以胁迫25 d显著最低,其余2个时间段间(10 d和40 d)无显著差异;在中度干旱胁迫(MD)下,地上部和总的生长恢复能力均先降后升并以胁迫25 d显著最低,而胁迫10 d和40 d间无显著差异,地下部生长恢复能力在胁迫时间段间无显著差异;在重度干旱胁迫(SD)下,地下部和总的生长恢复能力均先降后升且均以胁迫25 d显著最低,胁迫40 d明显较高,而地上部生长恢复能力在胁迫时间段间无显著差异。
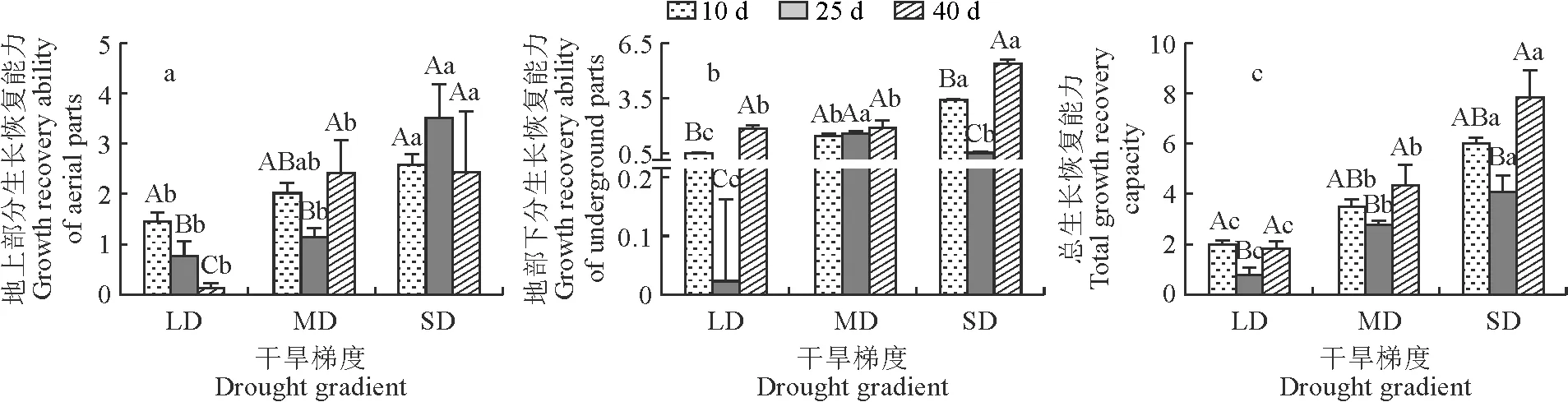
CK、LD、MD、SD分别为对照组(水分充足)、轻度干旱、中度干旱、重度干旱,它们土壤相对含水量分别为(80±5)%、(60±5)%、(40±5)%、(20±5)%,下同;同一干旱梯度下不同大写字母表示干旱时间之间在0.05水平差异显著,同一干旱时间下不同小写字母表示干旱梯度之间在0.05水平差异显著。图1 复水后不同干旱时长、干旱梯度下的药用大黄幼苗生长恢复能力CK, LD, MD and SD were control group (water sufficient), mild drought, moderate drought and severe drought, respectively, and their soil relative water content were (80±5)%, (60±5)%, (40±5)% and (20±5)%, respectively. Capital letters indicate significant difference at 0.05 level among different drought times under a same drought gradient, and lowercase letters indicate significant difference at 0.05 level among different drought gradients under a same drought time.Fig.1 Growth recovery ability of R. officinale Baill. seedlings under different drought durations and drought gradients after rehydration
总体来看,药用大黄幼苗生长恢复能力以重度干旱40 d后复水的地下部分最高,而轻度干旱40 d复水的地上部分近于0。
同时,图2显示,随干旱程度的增加,幼苗地上部分生物量在干旱10 d复水(T10-0、T10-1、T10-3)和干旱40 d复水(T40-0、T40-1、T40-3)处理下均逐渐降低,且干旱胁迫处理均显著低于CK,干旱处理间也多差异显著,而在干旱25 d复水处理(T25-0、T25-1、T25-3)下先升高后下降,LD处理与CK基本无显著差异,而MD和SD处理均比CK显著降低;与复水前(T10-0、T25-0、T40-0)相比,地上生物量在干旱后复水第1天(T10-1、T25-1、T40-1)和复水第3天(T10-3、T25-3、T40-3)多不同程度回升,并以干旱10 d复水和复水3 d表现更突出。幼苗总生物量除T10-3处理随着干旱程度的增加而逐渐显著上升外,其余处理总生物量变化与地上部分生物量相似。另外,幼苗地下部分生物量、根冠比在干旱10 d复水和干旱40 d复水处理下随干旱程度增加均呈逐渐上升趋势,且干旱胁迫处理均显著高于CK,干旱处理间也多差异显著;各指标在干旱25 d及复水处理下均先升高后下降,地下部分生物量在LD和MD处理下显著高于CK,在SD处理下显著低于CK;根冠比、根长均在MD处理下达到最高值,且各干旱处理除SD处理的根冠比外均显著高于CK;与复水前相比,幼苗地下部分生物量、根冠比、根长在复水后大多显著升高。以上结果说明大黄幼苗通过减少地上部分生物量,增加地下部分生物量,来降低水分损耗,保证根系存活,从而抵御干旱胁迫,复水后,幼苗能够正常吸水,生物量均有所回升。

同一阶段干旱梯度下不同大写字母表示复水时间之间在0.05水平差异显著,同一复水时间下不同小写字母表示干旱梯度间在0.05水平差异显著。图2 药用大黄幼苗生长指标对干旱及复水的响应Different capital letters indicate significant difference at 0.05 level among different rehydration times under same drought gradient and stage, and different lowercase letters indicate significant difference at 0.05 level among different drought gradients under same rehydration time and stage. The same as below.Fig.2 Response of seedling growth indexes of R. officinale Baill. to drought and rehydration
2.2 干旱和旱后复水对药用大黄幼苗叶片光合气体交换参数的影响
由图3可知,重度干旱40 d的大黄幼苗Pn、Gs、CE以及WUE值最低。除CK外,随干旱时间增长,各梯度下药用大黄幼苗的Pn、Gs、CE均呈下降趋势;LD、MD处理下幼苗的Ls值随干旱时间增长显著升高,各干旱梯度下幼苗的WUE、SD下幼苗Ls值则均呈先升高再降低的趋势,LD和SD处理下幼苗的Tr值及SD下叶片Ci则呈先降低再升高的趋势。
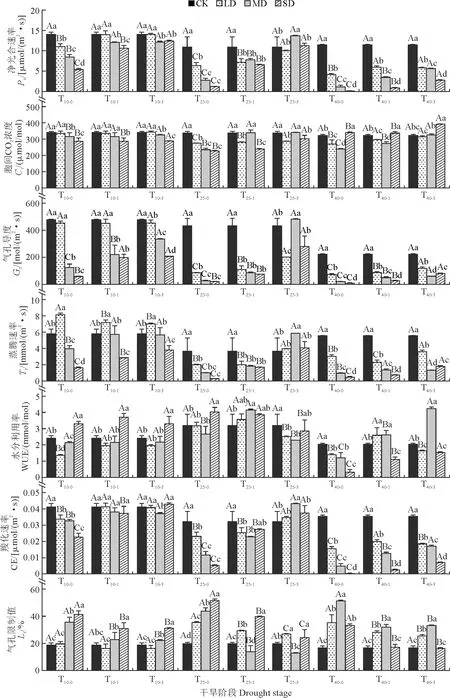
图3 干旱和复水条件下药用大黄幼苗光合参数的变化规律Fig.3 Changes of photosynthetic parameters of R. officinale Baill. seedlings under drought and rewatering conditions
复水后,Pn、Gs、CE均显著回升,LD处理10 d幼苗Pn、Gs、CE均升高且可恢复至CK水平;MD处理25 d的幼苗Pn、CE、Gs在T25-3显著高于CK,出现补偿效应;各梯度下Pn、CE、Gs在T40-3均有所回升,但显著低于CK,SD处理下Pn恢复效率最低,在T40-3仅有2.783 μmol/(m2·s)。Ci在干旱10 d及复水后(T10-0、T10-1、T10-3)LD处理下与CK基本无显著差异,而MD和SD处理均比CK显著降低;在干旱40 d复水处理(T40-0、T40-1、T40-3)下先下降后升高,SD处理下均最高。
另外,随干旱程度的增加,幼苗Tr在干旱10 d及复水后(T10-0、T10-1、T10-3)呈现先升高后降低的趋势,且在LD处理下最高,SD处理下最低;在干旱25 d后复水3 d(T25-3)处理下先升高后下降,且在MD处最高;而干旱25 d复水1 d处理(T25-0、T25-1)和干旱40 d复水(T40-0、T40-1、T40-3)处理下均逐渐降低,且干旱处理均显著低于CK,干旱处理间也多差异显著。幼苗Ls在干旱10 d、25 d时随干旱梯度的升高呈上升趋势,且在复水后均有所降低。其中,Ls值在LD处理下T10-1时及MD处理下T25-1、T25-3时低于CK,出现补偿效应;而在干旱40 d复水处理(T40-0、T40-1、T40-3)下先升高后下降,在T40-0时各干旱梯度均高于CK,不论是干旱还是复水,MD处理下Ls均最高。
此外,随干旱程度的增加,幼苗WUE在干旱10 d复水(T10-0、T10-1、T10-3)和25 d复水处理(T25-0、T25-3)处理下基本呈先降低再升高趋势,且SD处理显著高于LD、MD处理;干旱40 d(T40-0)后,WUE随干旱程度增加呈降低趋势,干旱胁迫处理均显著低于CK,复水后(T40-1、T40-3)WUE显著恢复,且在MD处理下高于CK。以上结果说明遭受干旱胁迫时大黄叶片通过限制气孔导度Gs来降低Tr和Pn,导致Ls升高,WUE因此发生改变,当胁迫过重时,Ci增加,光合器官受损,Pn迅速降低;复水后,叶片光合功能均有所恢复,净光合速率等显著增加,甚至产生补偿效应,来迅速修复干旱带来的伤害。
2.3 干旱和旱后复水对药用大黄幼苗叶片叶绿素含量的影响
由图4可知,除MD处理10 d后的叶绿素b含量显著高于CK外,其余干旱时间及干旱梯度下(T10-0、T25-0、T40-0),幼苗叶绿素a、叶绿素b及总叶绿素含量均显著低于CK,随干旱程度的增加,幼苗叶绿素a、b及总叶绿素含量在干旱25 d复水1 d(T25-0、T25-1)和干旱40 d复水(T40-0、T40-1、T40-3)处理下均逐渐降低。
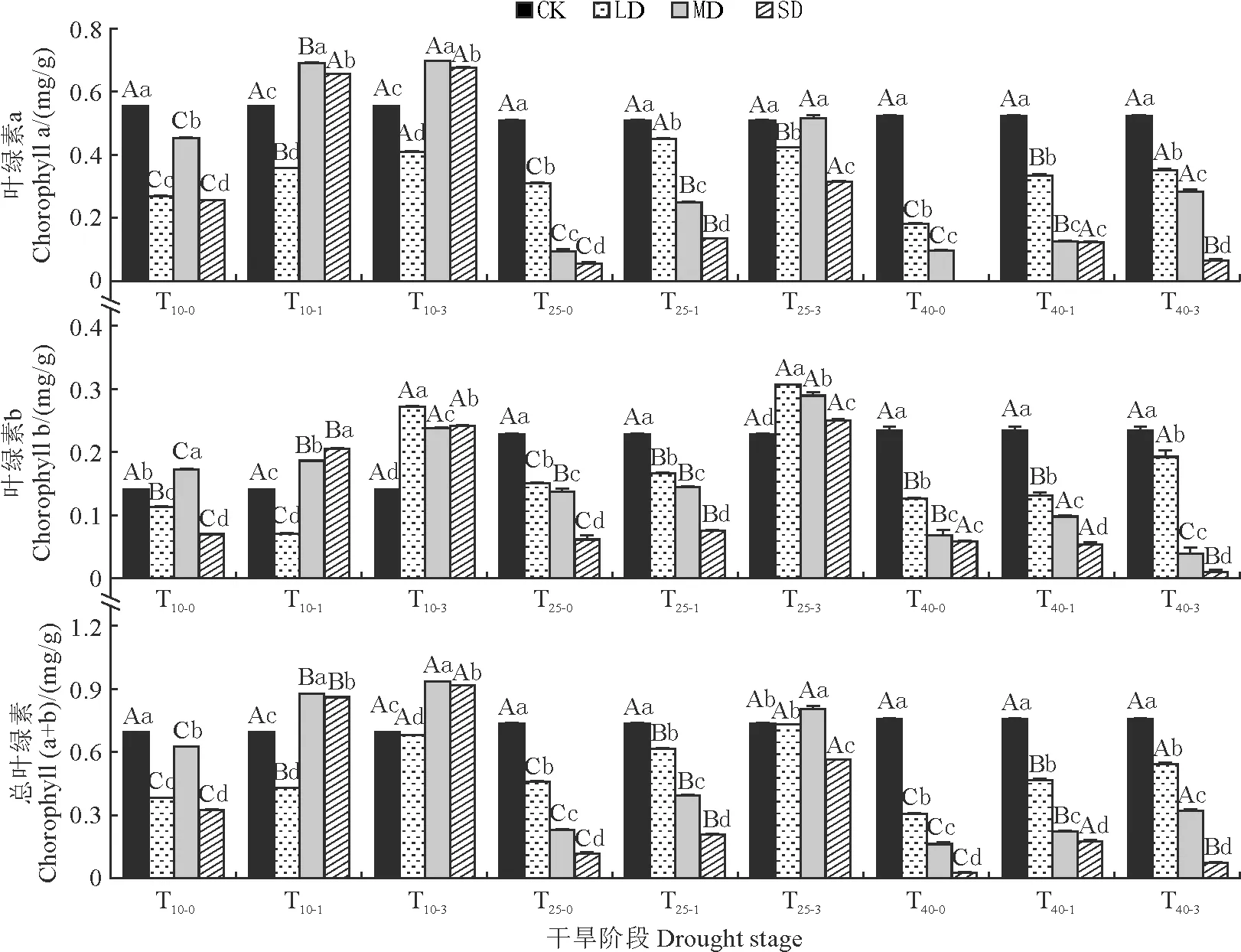
图4 干旱及复水条件下药用大黄叶片叶绿素含量的变化规律Fig.4 Changes of chlorophyll contents in leaves of R. officinale Baill. under drought and rewatering conditions
复水后,叶绿素含量均有所回升。其中,MD、SD处理10 d后复水的叶片叶绿素含量均能在复水3 d内(T10-3)恢复并显著超过CK,产生补偿效应;干旱25 d复水处理,各干旱梯度下叶绿素b含量及MD处理下叶片总叶绿素含量在复水第3天(T25-3)显著高于CK,出现补偿效应;干旱40 d后复水,叶绿素含量仍显著低于CK。
以上结果说明,短期轻度干旱胁迫造成的伤害能在复水后得到补偿,长期干旱会造成不可逆的损伤,复水也无法弥补。
2.4 干旱和旱后复水对药用大黄幼苗叶片OJIP曲线变化的影响
对OJIP曲线进行标准化处理,由图5可知,干旱处理后,随着干旱梯度及干旱时间的增加(T10-0、T25-0、T40-0),OJ段、J相、JI段、I相呈上升趋势,且显著高于CK,各梯度间也差异显著,且均在SD处理下达到最高。
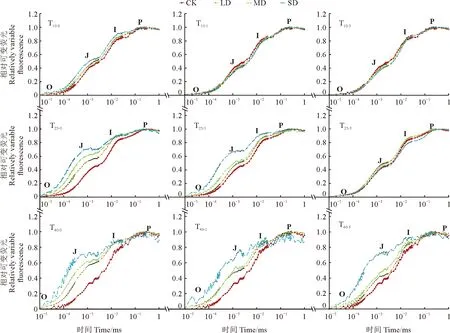
图5 药用大黄叶片OJIP曲线在干旱及复水条件下的变化规律Fig.5 Changes of OJIP curve in R. officinale Baill. leaves under drought and rewatering conditions
复水后,不同干旱时间干旱梯度下的叶片恢复程度不同。其中,各梯度OJ段、J相、JI段、I相在T10-1时显著低于CK,出现补偿效应,而在T25-1、T40-1、T40-3时依然高于CK;SD处理下的I相在T25-3时显著低于CK,产生比干旱10 d后复水更强的补偿效应。
本文在调研M煤矿关闭职工安置工作的基础上,结合国外煤矿关闭的经验,探索M煤矿关闭和职工安置优点和不足。M煤矿关闭过程中,采用四种方式进行职工安置;针对煤矿的特点和工作进程,采取一次性现金奖励的方式,提高安置工作的效率。综观全文,我们可以发现,职工安置工作是煤矿关闭过程中最重要的工作。目前,中国煤矿关闭体系尚不完善,缺乏对煤矿关闭的正确认识,职工安置工作仍存在较大不足,等待改进。煤矿关闭、职工安置工作的顺利进行需要国家从制度法规和财政上给予支持,严格区分煤矿关闭和企业破产之间的关系、制定专项法律、创造有利的再就业环境,从实际出发解决职工的后顾之忧。
2.5 干旱和旱后复水对药用大黄幼苗叶片叶绿素荧光动力学参数的影响
2.5.1 基本荧光参数
由图6可知,随着干旱时间的延长,轻、中、重度干旱下大黄叶片Fv/Fm、ΦPSⅡ、ETR、qP均降低,NPQ呈先升高后下降的趋势。其中,随干旱程度的增加,幼苗Fv/Fm在T10-0、干旱25 d复水处理(T25-0、T25-1、T25-3)和干旱40 d复水(T40-0、T40-1、T40-3)处理下均逐渐降低,且干旱胁迫处理均显著低于CK,干旱处理间也多差异显著,而在干旱10 d复水处理(T10-1、T10-3)下基本无显著差异;与复水前(T10-0、T25-0、T40-0)相比,Fv/Fm在干旱后复水第1天(T10-1、T25-1、T40-1)和复水第3天(T10-3、T25-3、T40-3)多不同程度回升,并以干旱25 d复水和复水3 d表现更突出。
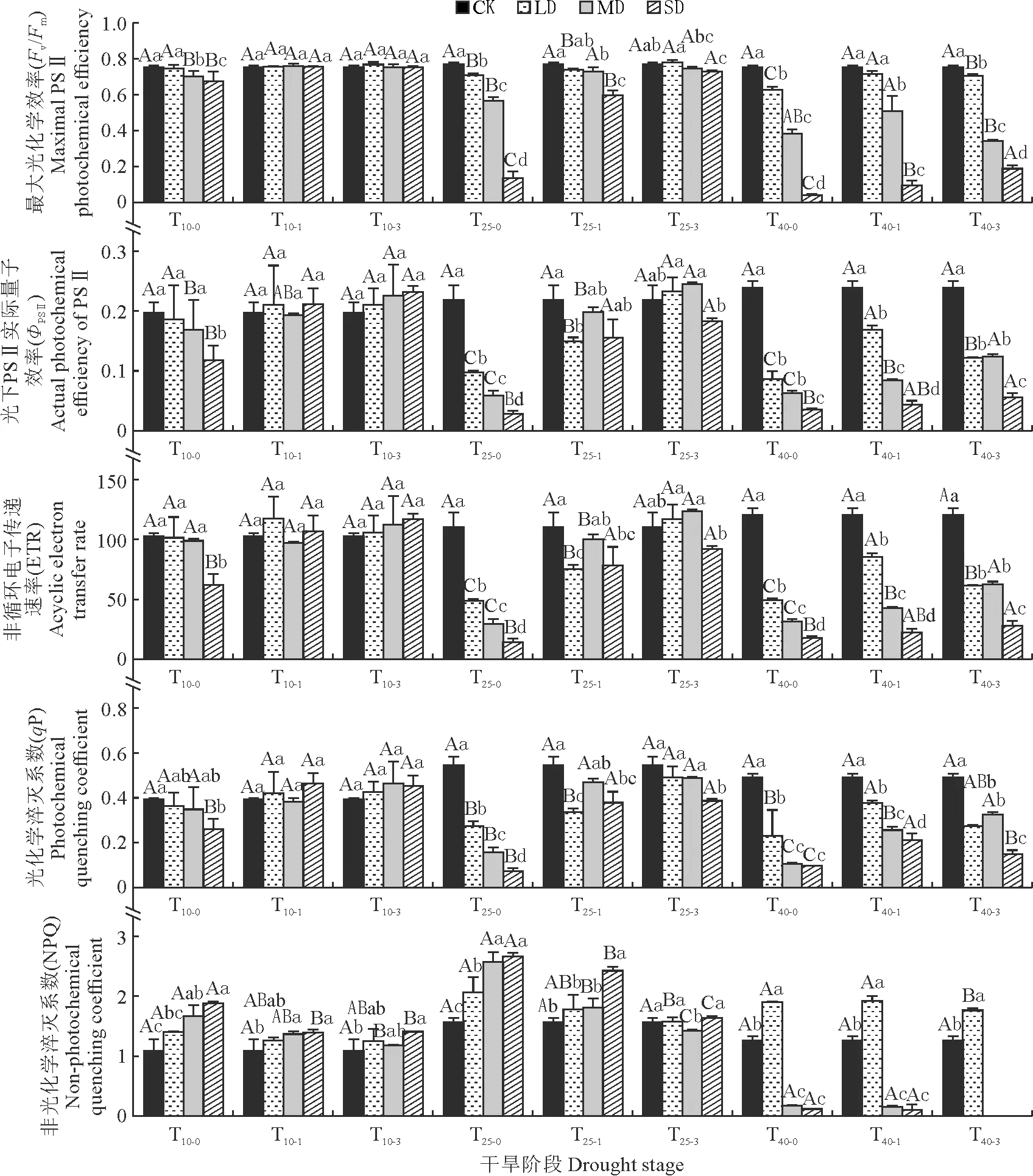
图6 药用大黄叶片荧光参数对干旱及复水的响应Fig.6 Response of fluorescence parameters in R. officinale Baill. leaves to drought and rehydration
除T25-2、T25-3处理下的ΦPSⅡ外,ΦPSⅡ及ETR、qP随着干旱程度的增加的变化趋势与Fv/Fm相似。此外,随干旱程度的增加,幼苗NPQ在T10-0、T10-1、干旱25 d复水处理(T25-0、T25-1)处理下均逐渐升高且显著高于CK;而在干旱40 d复水(T40-0、T40-1、T40-3)处理下先升高后降低,并在LD处最高且高于CK,在MD、SD处显著低于CK。
同时,由图7可知,随干旱程度的增加,幼苗Fv/Fo、Area、tFm、Fm、Sm在干旱处理下(T10-0、T25-0、T40-0)均逐渐降低,且干旱胁迫处理均显著低于CK;干旱10 d后复水,除tFm恢复不明显外,Fv/Fo、Area、Fm、Sm均能在T10-3时恢复至CK水平;干旱25 d后复水,各梯度Fv/Fo、Area、Fm可在T25-3恢复至CK水平;干旱40 d后复水,大部分指标仍与CK差异显著。

*、**、***分别表示相应指标在P<0.05、P<0.01、P<0.001水平与CK差异显著,ns表示该指标与CK无显著性差异;每个色块表示该色块对应的指标值的大小,颜色越接近黑表示相较CK越上调,颜色越接近白色表示相较CK越下调。下同。图7 干旱及复水条件下药用大黄叶片荧光参数方差分析热图*, **, *** indicate that the corresponding indexes were significantly different from those of CK at the levels of P<0.05, P<0.01 and P<0.001, ns indicates that there was no significant difference; Each color block represents the size of the corresponding index value of the color block. the closer the color is to black, the higher it is compared to CK, and the closer the color is to white, the lower it is compared to CK. The same below.Fig.7 Analysis of fluorescence parameters in R. officinale Baill. leaves under drought and rehydration conditions
另外,随干旱程度的增加,幼苗Vj、Vi、Mo在干旱处理下(T10-0、T25-0、T40-0)均显著高于CK。复水后,各指标均有所恢复,其中,LD、MD处理下的Vj、Vi、Mo均能在T10-3、T25-3时恢复至CK水平,除LD、MD处理下的Vj能在T40-3时恢复至CK水平外,各梯度Vi、Mo在干旱40 d后复水(T40-0、T40-1、T40-3)处理下均显著高于CK。
2.5.2 量子产率参数及性能参数
由图8可知,随干旱程度的增加,幼苗δRo、PIabs、PItotal在干旱处理(T10-0、T25-0、T40-0)、干旱25 d后复水1 d(T25-1)以及干旱40 d后复水(T40-1、T40-3)处理下均逐渐降低,且干旱胁迫处理均显著低于CK;复水后,δRo、PIabs、PItotal均有所回升,干旱10 d、25 d复水,恢复能力较好,各梯度PIabs在干旱10 d复水处理(T10-1、T10-3)下显著高于CK(P<0.001),产生补偿效应,干旱40 d后复水,δRo、PIabs、PItotal依然显著低于CK。
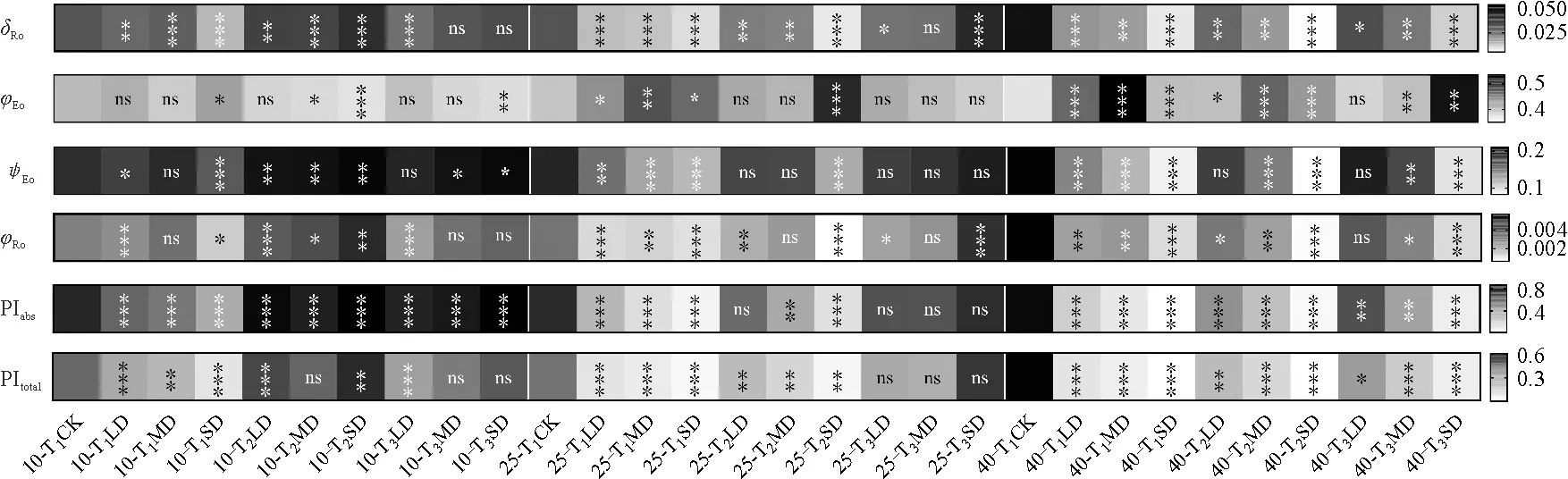
图8 干旱及复水条件下药用大黄叶片量子产率参数及性能参数方差分析热图Fig.8 Analysis of yield or flux ratio and performance index (PI) in R. officinale Baill. leaves under drought and rehydration conditions
此外,干旱10 d对LD下φEo及MD下φEo、ψEo、φRo无显著影响,当胁迫时间增长,φEo、ψEo、φRo均受到显著影响。其中,幼苗φEo在干旱处理(T25-0、T40-0)、干旱40 d后复水1 d(T40-1)处理下均显著高于CK,ψEo变化趋势与之相似;而φRo则在干旱处理(T25-0、T40-0)、干旱40 d后复水1 d(T40-1)处理下均显著低于CK。复水后,φEo、ψEo、φRo均有不同程度的恢复,且以干旱25 d恢复效果最好。
2.6 干旱和旱后复水处理下药用大黄幼苗相关指标的冗余分析
对叶片光合、荧光参数进行PCA分析(图9)可知,叶绿素含量[Chl a、Chl b、Chl (a+b)]、光合参数(Pn、Ci、Gs、Tr、CE)、性能参数(PIabs、PItotal)、基本荧光参数(Fv/Fo、ФPSⅡ、Fv/Fm、tFm、Fm、Sm、N、Area、qP、ETR)、量子产率参数(ψEo、δRo、φRo)及ETo/CSo、REo/CSo均与干旱时长、干旱梯度呈负相关,与复水时间呈正相关;Ls、Vj、Vi、Mo、φEo、ABS/RC、DIo/RC、TRo/RC、ETo/RC、DIo/CSo、TRo/CSo、Fo则与干旱时长、干旱梯度呈正相关,与复水时间呈负相关。
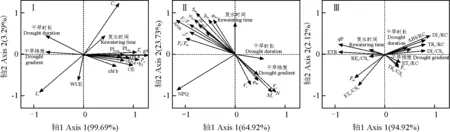
图9 不同干旱时长、梯度、复水时间下药用大黄叶片光合、荧光参数PCA分析Fig.9 PCA analysis of photosynthetic and fluorescence parameters in R. officinale Baill. leaves under different drought durations, gradients and rewatering time
3 讨 论
水分是植物生长发育过程中重要的生态组成部分[2],但是由于降水格局变化,极端气候现象频发,使植物常暴露于反复干旱复水的土壤环境中,导致其光合、蒸腾、呼吸作用以及叶绿素荧光等受到严重影响,从而抑制了植物的生长发育[18]。
3.1 药用大黄幼苗生长指标对干旱复水的响应特征
根冠比是反映植物对土壤水分吸收利用和植物遭受干旱胁迫时生物量分配的重要指标[4]。韩静丽等[5]研究发现,玉米通过增加根系生物量,相应减少叶片生物量,来增加根系活力,降低水分损耗,从而使其在干旱胁迫下也能正常吸水以供生长,复水后,玉米也会适当增加根冠比来保证其生理功能能够快速恢复;赵伟洁等[6]对糜子根进行干旱复水试验,发现根系恢复能力与其遭受的干旱胁迫时长和程度有关,重度干旱后复水,根系的恢复能力强于轻度中度干旱水平。本研究与前人研究结果相似,干旱胁迫后,大部分药用大黄幼苗根冠比及地下部分生物量显著升高,地上部分生物量则呈降低趋势,重度干旱40 d后复水,大黄幼苗生长恢复能力最为显著,可能是重度干旱严重抑制根系生长但未使其失活,复水后依然能得到较好的补偿[5]。然而植物在遭受干旱胁迫时,生物量的变化还会受到诸多因素如光照、温度等的影响,因此生物量变化机制还有待后续进行深入研究。
3.2 药用大黄幼苗叶片光合、气体交换参数和叶绿素含量对干旱复水的响应特征
光合作用是植物生长发育的基础,是植物对干旱胁迫最敏感的生理过程之一[19]。叶绿素在植物光合过程中对光能的吸收、传递和转化起着重要作用[20],其含量与光合作用的碳氧化功能密切相关[21]。干旱胁迫会抑制叶绿素合成,同时提高叶绿素酶的活性和分解速率,从而导致叶绿素含量降低[22]。本试验大部分干旱时长、梯度下的叶绿素a、b及总叶绿素含量显著低于CK(P<0.05),可能是干旱胁迫抑制了叶片光合功能,造成脂质过氧化所致[23]。重度干旱40 d的大黄叶片叶绿素a含量甚至因胁迫过高无法检测,这符合前人研究结果,干旱胁迫对叶绿素a的伤害大于叶绿素b,其原因推测与干旱胁迫对包膜、基粒、类囊体等叶绿体组织的损害程度有关[24]。
光合速率是反映干旱胁迫对植物光合系统危害程度的重要指标[19]。研究发现,植物遭受干旱胁迫时,其净光合速率降低通常由气孔因素和非气孔因素引起,当Ci与Gs变化趋势一致时,净光合速率下降归因于气孔因素[25]。植物通过适当闭合气孔来减少水分流失,从而限制CO2进入叶片,造成净光合速率、蒸腾速率及初级光化学过程降低[26]。Ci与Gs变化趋势相反时,非气孔因素如光合系统受损、叶肉细胞羧化功能降低等成为导致Pn下降的主要原因[27]。本研究中,干旱10,25 d后,中、重度干旱下叶片的Ls显著升高,Pn、Ci、Tr、Gs显著降低,而重度干旱40 d,叶片Pn、Gs、Tr均趋近于0,Ci则显著升高,推测在短期干旱胁迫下,大黄叶片通过限制气孔来降低Tr和Pn,在遭受长期重度干旱胁迫时,Pn下降则是由光能捕获效率、电子传递速率、叶肉细胞活性等非气孔因素引起[25]。此外,气孔还是影响植物水分利用效率(WUE)的重要因素。在水分亏缺条件下,植物叶片为维持自身渗透平衡,会降低气孔导度来减慢水分扩散,从而调控WUE[22]。对枸杞叶片的研究发现,WUE对土壤水分有显著的阈值响应,轻微水分胁迫会增加WUE,土壤水分过低时,光合器官被破坏,WUE受到显著抑制[28]。本研究也同样证实土壤含水量和干旱时间对大黄WUE的影响有明显阈值范围。干旱10,25 d时,WUE在土壤含水量≥40%时无明显变化或显著降低,土壤含水量<40%时,WUE显著升高(P<0.05);干旱40 d后,WUE随土壤含水量减小呈降低趋势。冗余分析结果也表明,WUE与干旱时长呈负相关,其原因推测为初期重度干旱胁迫下,叶片Gs急剧降低,导致Tr降低速率高于Pn,植物通过提高WUE来抵抗干旱[29],随着干旱时间增长,叶片光合系统严重受损,Pn降低速率高于Tr,从而造成WUE显著下降[28]。
植物在遭受干旱胁迫后,复水的刺激效应能使其光合能力快速恢复,类似生长补偿发生在植物的整个生命周期中[22]。Jia等[10]对干旱胁迫下的玉米进行复水处理,其光合速率迅速增加且显著高于对照(P<0.05);水分胁迫后复水,大豆的叶绿素含量快速超过对照水平[23],属于补偿效应。然而,并非所有植物都能在复水后迅速生长。研究发现,干旱胁迫带来的抑制作用在复水后的补偿效果取决于预干旱及干旱胁迫的程度和持续时间[16],较温和的干旱水平或较短的干旱时长会带来更大的补偿效果[23]。本研究中大黄幼苗的大部分光合指标及叶绿素含量在不同干旱时长、不同干旱梯度下复水后均显著恢复(P<0.05),干旱10 d后复水,叶绿素b含量在各干旱梯度下均显著超过CK(P<0.05),发生补偿效应,这说明短期干旱并不影响光合生理机制及叶绿体结构,叶片能在复水后快速恢复[10]。继续干旱25 d后,中度干旱的大黄幼苗,表现出比干旱10 d更强的复水恢复能力。复水后,其叶片Pn、Gs、CE、Tr、Ls、叶绿素b含量均表现出明显的补偿效应,说明第1次干旱能在一定程度上提高植物对二次干旱的抵抗能力和复水恢复能力[30]。同样的,前期干旱能够缓解再干旱对玉米叶片光合功能的伤害,遭受第2次干旱后,其光合参数Pn、Gs及生长速率显著升高[31]。然而,继续干旱40 d后大黄叶片被完全破坏,复水后Pn、Gs、CE、Tr、叶绿素含量依然显著低于CK(P<0.05)。这有可能是由于长期干旱严重抑制了叶片的光合能力和叶绿素合成速率,复水也无法弥补长期干旱对光合器官及叶绿体结构的损伤[10]。
3.3 药用大黄幼苗叶片叶绿素荧光参数和OJIP曲线对干旱复水的响应特征
由PSⅡ、PSI共同操控的原初光化学反应是光合作用的起始,经原初反应释放出的电子会在类囊体膜上沿电子载体定向传递,为生成植物必需的有机物提供同化力[16]。水分作为原初电子供体在这一系列反应中扮演重要角色,水分亏缺对光合系统功能、光合电子传递链和反应中心复合体的抑制作用会直接影响植物光合作用和叶绿素荧光,进而影响植物的生长发育[2]。

为了缓解干旱胁迫对电子传递链及PSⅡ受体侧的伤害,植物进化出一种自卫措施——光合系统热耗散机制抵御外界胁迫,通常用增加非光化学淬灭系数(NPQ)来反映[10]。本研究中干旱10,25 d的大黄叶片NPQ均随干旱时长、梯度增加呈上升趋势,表明叶片光合系统具有保护机制,能够将光合机构多余的能量转化为热能来抵御干旱胁迫对PSⅡ、类囊体系统及电子传递链的光损伤[3]。中、重度干旱40 d的大黄叶片NPQ大幅降低,可能是长期干旱或干旱程度过大,造成PSⅡ复合体遭受损伤过重,内部调控机制严重受损,光保护能力即无害消散过剩能量的能力下降,导致能量耗散的下调速度减缓所致[7]。
干旱后复水会缓解干旱胁迫对光合系统、电子传递链的抑制作用,植物会出现迅速生长、光合能力提高等补偿效果,这可能是植物抵御短期、周期性或不可预测的干旱的一种自卫方式[36-37],而复水的恢复程度和恢复速度则取决于干旱前条件的持续时间和严重程度[18]。本研究中干旱初期对大黄叶片造成的光伤害在复水后得到缓解,干旱10,25 d后复水,Fv/Fo、Fv/Fm均有显著回升(P<0.05),反应中心活性、量子产率参数、性能参数、J相、I相、Mo、ETR等均可恢复。各梯度tFm、J相、轻度干旱25 d的大黄叶片Fv/Fm、中度干旱25 d的NPQ及重度干旱25 d的Vi、Sm、δRo、φRo均产生显著的补偿效应(P<0.05),说明短期、轻度干旱对大黄幼苗PS Ⅱ受体侧、PS Ⅱ反应中心及光合电子传递链的伤害是可逆的,光合机构没有受到严重损伤,在复水后能够快速恢复[25]。相反,干旱40 d后复水,大部分荧光参数、量子产率参数与CK差异明显;OJIP曲线J相、I相依然显著高于CK(P<0.05),PIabs、PItotal也趋近于0,推测是长期干旱严重抑制了光系统活性,干旱胁迫造成了不可逆伤害,导致PS Ⅱ受体产生的极强光抑制,活性被严重破坏,电子传递无法正常运行[25]。
综上所述,干旱胁迫会抑制药用大黄光合作用,进而抑制其生长发育,短期干旱后复水能带来更好的补偿效应;二次干旱的大黄叶片表现出比初次干旱更强的抗旱性和复水恢复能力;长期干旱造成的光抑制和生长抑制完全破坏了光合系统,在复水后依然不能得到完全补偿。本研究结果为药用大黄在季节性、间歇性干旱的环境中的水分高效利用提供了理论依据,但是由于外界气候和土壤环境复杂多变,干旱天数及复水时间无法控制,植物自身应对逆境也有不同的耐受性和反应机制,仍然需要对此进行不断探索。

