细绿萍黑腐病病原菌鉴定及其生物学特性和防治药剂筛选
木扎帕尔·吐鲁洪,乌汉夫,侯 雨,初荧荧,刘 传,霍美竹,崔国文
(东北业大学动物科学技术学院,黑龙江 哈尔滨 150036)
细绿萍(AzollafiliculoidesLamk)是满江红科(Azollaceae)满江红属(Azolla)蕨类水生植物[1]。从德国引入我国,国内分布在长江流域各省,由于细绿萍的抗寒性好,在5℃时开始生长,在气温-8℃时,短期也不会发生冻害而死亡,因此在东北三省开始引种试验[2-3]。细绿萍亩产高且生长速度快,气温20℃时2-3天萍产量可翻倍,饲草的营养价值高,适口性好,可以不经过加工就作为饲料给家畜投喂。细绿萍具有巨大的市场潜力和产品竞争力,不仅可以在湖泊、沼泽、池塘等天然水面生长良好,也可以在屋前屋后等空旷场所的简易池塘中种植,不占用耕地,草量大,2亩水面的细绿萍产量可养殖100头猪,1亩水面可养殖200只鹅,并且可满足夏季4个月的草料需求。细绿萍营养价值丰富,产草量极高,在东北110~125天生长期内,鲜草产量可高达5.4×105~9.75×105kg·hm-2;干物质含量27.94%,粗蛋白14.14%,是猪、禽类和鱼等的优良饲草[4-5]。作为优良的饲草品种,具有固氮能力强且营养全面等特点,细绿萍中丰富的维生素和矿物质可以改善家禽的免疫力并促进生长发育,提高畜禽品质,增强抗病能力[6-9]。细绿萍在农业生产中可以作为优质绿肥,细绿萍可充分吸收水分和光照来增加土壤有机质来增加作物产量[10-11]。细绿萍不仅可以作为优质饲草,在水质净化上也起到良好的作用,对含有重金属的工业废水的净化能力很强,净化后的水可接近灌溉水的标准[12-13]。因此,细绿萍的饲用价值和生态学价值很高,开发潜力很大。随着细绿萍的广泛推广种植,导致病原微生物开始蔓延扩散,致使细绿萍出现发黑腐烂的病症,而明确引起细绿萍黑腐病的病原菌种类是防治该病害的关键。
本研究对细绿萍植株中分离获得的黑腐病病原菌--细极链格孢(Alternariatenuissima(Kunze) Wiltshire)进行分离鉴定、生物学特性和室内毒力测定的研究,以期为今后细绿萍黑腐病的诊断和防治提供一定的理论支撑。
1 材料与方法
1.1 供试材料
试验病原菌为本实验室2022年从黑龙江省哈尔滨市细绿萍培育田中染病的龙引细绿萍中经组织分离并纯化所得,回接植物为东北农业大学培育的龙引细绿萍。
1.2 病原菌的分离与纯化
在实验室条件下,采用常规组织分离法进行病原菌的分离[14]。将采集到的细绿萍孢子病样用蒸馏水冲洗干净,自然晾干。在超净工作台上,用手术刀切取病健交界处的组织块,并将其置于75%乙醇中浸泡消毒30 s,再将其放入0.1%的升汞溶液中2 min,用无菌水漂洗3次后,放置在已灭菌的滤纸上,待样品表面水分自然晾干,最后将样品放在pH值为7.0的PDA培养基中,25℃条件下避光培养3-5 d。待组织块长出菌落后,采用单胞分离法进行纯化培养[15],并将纯化后的分离物接种于PDA斜面上培养好后4℃保存备用。
1.3 病原菌的致病性测定与再分离
将病原菌在PDA培养基上25℃暗培养7 d后,根据资料所描述的方法配制孢子悬浮液备用[16]。称取25 g细绿萍装入容器中,水和孢子悬浮液以9∶1的混合,对照组加入同等量的无菌水,25℃保湿培养7 d期间观察并记录细绿萍发病情况。对于回接后的具有明显病症的区域进行致病菌分离,再次纯化培养,观察并记录再次分离的菌株和初始菌株之间的差异,完成柯赫式氏法则验证。
1.4 病原菌形态学鉴定
将病原菌在PDA培养基上恒温25℃培养7 d后,观察其菌落长势情况,菌落大小和颜色,在光学显微镜下观察菌丝形态,分生孢子的大小、形态特征和着生方式,参照文献[17-20]确定病原菌种类。
1.5 病原菌的分子生物鉴定
将病原菌接种在PDA培养基上,在恒温培养箱中25℃培养7 d后,刮取菌落中约150 mg的菌丝,采用NuClean Plant Genomic DNA Kit试剂盒说明书提取病原菌DNA,以提取的DNA作为PCR模板,分别用ITS、EF-1α和Histone H3三种通用引物(引物见表1)对提取的DNA进行PCR扩增。PCR扩增产物经1.0%琼脂糖检测后由生工生物工程(上海)股份有限公司测序,测序结果通过Blast在NCBI数据库中比对,进行同源比对。

表1 病原菌的ITS,EF-1α和HIS H3基因的PCR扩增引物Table 1 PCR primers for amplifying ITS,EF-1α and Histone H3 genes of the pathogen
1.6 病原菌的生物学特性的研究
1.6.1不同温度、光照及pH值对菌丝生长和产孢量的影响 将病原菌置于25℃恒温培养7 d后,使用直径5 mm的无菌打孔器在菌落边缘打取若干个菌饼,接种于以下不同条件下的PDA培养基上培养:温度条件设置为5,10,15,20,25,30,35,40℃共8个温度梯度恒温暗培养;光照条件设置为全天光照(Light,L)、全天黑暗(Dark,D)、半天光照和半天黑暗(12L/12D)共3种处理25℃恒温暗培养;使用pH计和配置好的1% NaOH和1% HCl母液,将PDA培养基的pH值分别调至4,5,6,7,8,9,10,11 共8个梯度25℃恒温暗培养,以上每种处理条件设置3个重复,7 d后采用十字交叉法对菌落直径进行测量,并利用血球计数板计算产孢量,每组重复3次。
1.6.2不同培养基对菌丝生长及产孢量的影响 供试培养基为水琼脂培养基(WA),马铃薯葡萄糖琼脂培养基(PDA),马铃薯蔗糖琼脂培养基(PSA),查比克培养基(CDA),燕麦培养基(OMA),玉米粉培养基(CMA)[21]。使用直径5 mm的无菌打孔器在培养7 d的病原菌菌落边缘打取若干个菌饼,并将菌饼分别转接到供试的几种培养基平板中央,每种培养基设置3个重复,25℃条件下按暗培养7 d。按照上文描述的方法测定并计算病原菌的生长速率和产孢量。
1.6.3不同碳源对菌丝生长及产孢量的影响 以CDA培养基为基础培养基,分别用相同质量的葡萄糖、麦芽糖、可溶性淀粉、羟基纤维素钠、丙三醇、和D-甘露醇代替其中的蔗糖,配成不同碳源的培养基,以不加蔗糖培养基作为缺碳对照。按照上文描述的方法测定并计算病原菌的生长速率和产孢量。
1.6.4不同氮源对菌丝生长及产孢量的影响 以CDA培养基作为基础培养基,分别用相同质量的硫酸胺、胰蛋白胨、牛肉膏、磷酸二氢铵、酵母浸膏、尿素代替其中的硝酸钾,配成不同氮源的培养基,以不加硝酸钾培养基作为缺氮对照。按照上文描述的方法测定并计算病原菌的生长速率和产孢量。
1.7 病原菌室内药剂毒力测定
采用菌丝生长速率法[22]对5种药剂进行室内毒力测定。将药剂按照浓度稀释配置,详细浓度见表2。5种药剂分别稀释成5个不同浓度梯度,将其放入到灭菌处理完毕融化的PDA培养基中,调制成药剂比1∶9的带药培养基,混匀倒入培养皿中,待其冷却后用5 mm打孔器在事先准备好的致病菌培养皿上打取若干菌饼,每个带药培养皿中央放置1块菌饼,重复5次,以不加药剂的培养基作为对照。放置在25℃的恒温培养箱中培养7 d后,采用十字交叉法测量菌落直径大小,计算药剂对病菌的抑制情况。

表2 5种杀菌剂的浓度Table 2 Concentrations of five fungicides
1.8 数据分析
试验数据采用SPSS 22.0和Excel 2016进行统计分析及作图,对试验数据进行邓肯氏新复极差法进行差异显著性分析,并以平均值±标准差表示。
2 结果与分析
2.1 细绿萍黑腐病病原菌分离和致病性检测
在细绿萍养殖田中调查发现,与健康孢子相比(图1A),发病初期细绿萍孢子由黄褐色变成黑褐色,呈点状分布,逐步向周边蔓延(图1B)。随着细绿萍孢子不断被侵染,大范围细绿萍逐渐开始病变,最后使植株腐烂发臭,一部分孢子黄化干枯(图1C),从而致使整株死亡,使得细绿萍失去饲用和经济价值。通过常规组织分离法对30份发病细绿萍黑腐病样进行分离并纯化,得到10个形态一致的菌落,纯化培养后的分离物合编号为XLP1-XLP10,将代表菌株XLP1接种于活体细绿萍孢子7 d后,观察到细绿萍孢子发黑,其中还伴随着部分菌丝包裹细绿萍孢子,发病症状显著(图1D~1F)。但与田间发病症状有所区别,这可能是因为实验环境与田间环境之间差别造成的。对活体回接后的发病病样再次分离后,获得的菌落形态与XLP1一致,经过柯赫氏法则可以确定菌株XLP1为细绿萍黑腐病的病原菌。

图1 田间和实验室条件下细绿萍黑腐病的症状Fig.1 Symptoms of Azolla filiculoides black rot under field and laboratory conditions注:图A,D表示健康孢子;图B,C表示田间黑腐病症状;图E,F表示致病性检验症状Note:Panel A and D,health spore;Panel B and C,symptoms of the black rot in the field;Panel E and F,pathogenicity verification symptoms
2.2 病原菌的形态学鉴定
将菌株XLP1在PDA培养基上培养7 d后即可长满全皿,菌落正面最初为灰白色,具有丰富的棉状气生菌丝,然后变为深灰色,菌落底部呈现棕灰色(图2A)。利用光学显微镜观察形态特征,分生孢子通常是呈倒棒状至倒梨状或椭圆形,有1~6个横隔和0~3个纵隔,横隔较厚,顶端有一个短喙。分生孢子淡褐色,呈链状,长度测量值为11.7至46.3×5.5至15.1 μm(n=50)(图2B~2C)。根据Yu等[23]对链格孢菌属的形态描述,并结合菌株的形态学鉴定结果,初步确定菌株XLP1为链格孢菌属(A.tenuissima)真菌。

图2 菌落的形态特征,菌丝和分离株的分生孢子Fig.2 Morphological characteristics of the colony,hyphae and conidia of the isolates注:A,菌落;B,分生孢子;C,菌丝Note:Panel A,Colony;Panel B,Conidia;Panel C,Hyphae
2.3 病原菌的分子生物学特征
从获得的10个分离株中挑选有代表性的3个菌株进行系统发育分析(XLP1-XLP3)。将3个DNA片段(ITS,EF-1α和Histone H3)结合基因比对数据建立多基因联合系统发育分析(图3)。每个分离物的三个PCR片段的序列保存在GenBank中,其中ITS基因序列与细极链格孢(登录号:MF405157)同源性达到100%(登录号:OQ474944,OQ474911,OQ474912),EF-1α基因序列与细极链格孢(登录号:ON237475)同源性达到99%(登录号:OQ538182,OQ538187,OQ5381 86),Histone H3基因序列与细极链格孢(登录号:ON352101)同源性达到100%(登录号:OQ538 183,OQ538185,OQ538184)且在系统发育树上聚在一起。因此,结合形态特征将这3个菌株鉴定为细极链格孢。

图3 基于ITS,EF-1α和Histone H3序列的3个分离株的联合基因系统发育关系Fig.3 Combined gene phylogenetic relationships of three isolates of Alternaria tenuissima based on ITS,EF-1α and Histone H3 sequences
2.4 生物学特性
2.4.1温度对病原菌菌落直径和产孢量的影响 不同温度条件下菌株XLP1的菌落直径和产孢量如图4所示。在不同温度条件下,菌株XLP1菌落直径和产孢量均有显著差异(P<0.05)。最适菌丝生长温度为25℃,培养7 d后菌落平均直径达到89.33 mm,当温度为40℃时几乎不生长,而在低温条件下依然能较好的生长。温度条件在20℃~30℃时,可产生较多孢子,产孢的最适温度为25℃,培养7 d后每毫升培养基上产孢量为6.50×105。
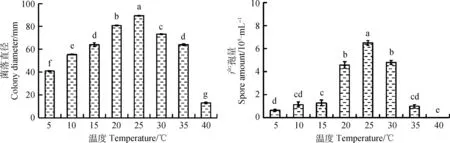
图4 不同温度对XLP1菌丝生长和产孢量的影响Fig.4 Effect of different temperatures on mycelial growth and sporulation of XLP1注:不同小写字母表示不同处理间差异显著(P<0.05),下同Note:Different lowercase letters within the same panel indicate a significant difference between different temperature treatments at the 0.05 level,the same as below
2.4.2光照对病原菌菌落直径和产孢量的影响 不同光照条件下菌株XLP1的菌落直径和产孢量如图5所示。在不同温度条件下,菌株XLP1菌落直径和产孢量均有显著差异(P<0.05)。全黑暗的条件更有利于菌丝的生长和产孢,全黑暗培养7 d后菌落直径可达74.17 mm,每毫升培养基上产孢量为6.25×105。而在全光照培养条件下每毫升培养基上产孢量最少,为3.50×105。
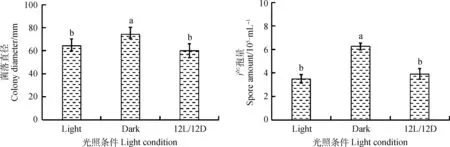
图5 不同光照条件对XLP1菌丝生长和产孢量的影响Fig.5 Effect of different light conditions on mycelial growth and sporulation of XLP1
2.4.3pH对病原菌菌落直径和产孢量的影响 不同培养基pH条件下菌株XLP1的菌落直径和产孢量如图6所示。在pH值为3~11的培养基上,菌株XLP1的菌丝均可生长,最适宜菌丝生长和产孢的培养基pH值均为6~8。当培养基pH值为7时,每毫升培养基上产孢量最高,可到达6.24×105。而总体来看偏酸或偏碱环境下病原菌都能生长。
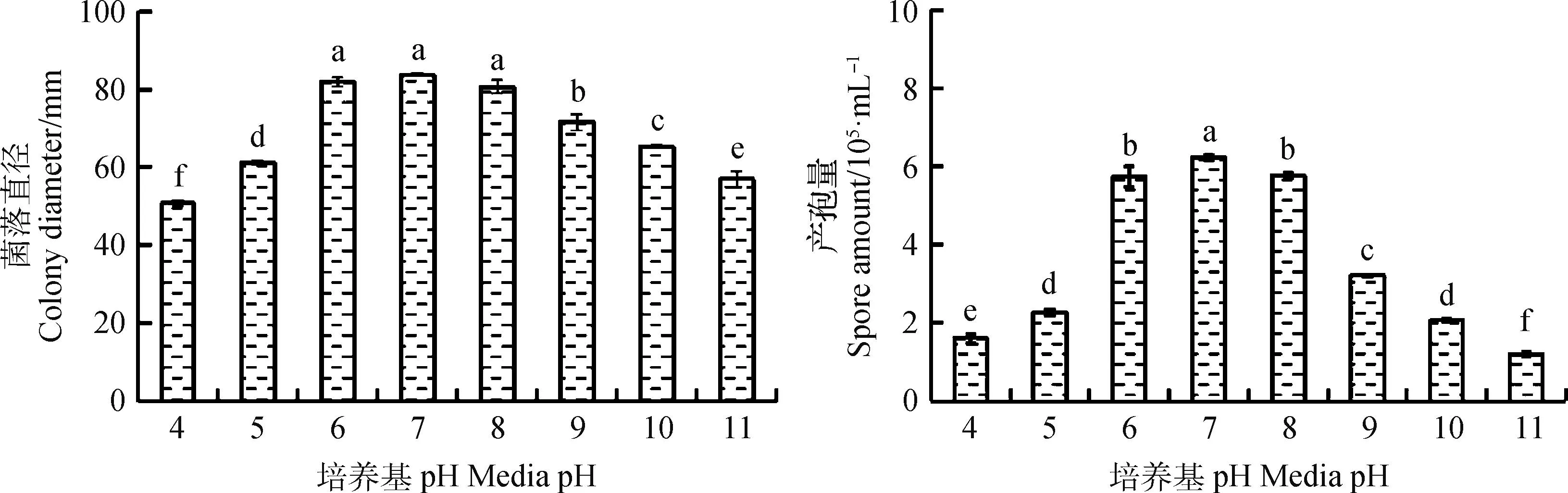
图6 不同pH条件对XLP1菌丝生长和产孢量的影响Fig.6 Effect of different pH conditions on mycelial growth and sporulation of XLP1
2.4.4培养基对病原菌菌落直径和产孢量的影响 不同培养基上菌株XLP1的菌落直径和产孢量分别如图7所示。菌株XLP1在6种供试培养基上均可生长,不同种类的培养基对菌株XLP1菌落直径和产孢量均有显著差异。病原菌菌丝在WA和PSA培养基上生长速度较慢,其中在WA培养基中菌丝最稀疏,在PDA,CDA,OMA和CMA培养基上生长速度相对较快,其中在CMA培养基上生长速度最快,培养7 d后菌落平均直径可达88.67 mm。病原菌在PSA培养基上产孢量最大,培养7 d后每毫升培养基上产孢量可达9.06×105,在WA培养基上产孢量较低。因此,可以推测既没有碳源,也没有氮源的情况下病原菌菌丝无法生长,且几乎不产孢。

图7 不同培养基对XLP1菌丝生长和产孢量的影响Fig.7 Effect of different media on mycelial growth and sporulation of XLP1
2.4.5碳源对病原菌菌落直径和产孢量的影响 不同碳源条件下菌株XLP1的菌落直径和产孢量如图8所示。7种碳源对菌株XLP1的菌落直径和产孢量的影响存在显著差异。以丙三醇作为碳源时,病原菌菌丝的生长速度最快,培养7 d后菌落平均直径可以达到70.33 mm,而以羟基纤维素钠为碳源的培养基上菌丝生长最慢,菌落平均直径为47.33 mm。以甘露醇作为碳源时,病原菌的产孢量最大,培养7 d后每毫升培养基上产孢量为6.83×105,而以可溶性淀粉为碳源的每毫升培养基上产孢量最少,为1.71×105。

图8 不同碳源对XLP1菌丝生长及产孢量的影响Fig.8 Effect of different carbon sources on mycelial growth and sporulation of XLP1注:C1,蔗糖;C2,麦芽糖;C3,葡萄糖;C4,羟基纤维素钠;C5,可溶性淀粉;C6,甘油;C7,甘露醇;C8,对照Note:C1,Saccharose;C2,Maltose;C3,Glucose;C4,Sodium hydroxycellulose;C5,Soluble starch;C6,Glycerol;C7,Mannitol;C8,CK
2.4.6氮源对病原菌菌落直径和产孢量的影响 不同氮源条件下菌株XLP1的菌落直径和产孢量如图9所示。7种氮源对菌株XLP1的菌落直径和产孢量的影响存在显著差异。以硝酸钾作为氮源时,病原菌菌丝的生长速度最快,培养7 d后菌落平均直径可以达到89.83 mm,而以硫酸铵为氮源的培养基上菌丝生长最慢,菌落平均直径为9.67 mm。以酵母浸膏作为氮源时,病原菌的产孢量最大,培养7 d后每毫升培养基上产孢量为3.84×105,而以磷酸二氢铵为氮源的每毫升培养基上产孢量最少,为0.57×105。

图9 不同氮源对XLP1菌丝生长和产孢量的影响Fig.9 Effect of different nitrogen sources on mycelial growth and sporulation of XLP1注:N1,硝酸钾;N2,硫酸铵;N3,牛肉提取物;N4,尿素;N5,磷酸二氢铵;N6,酵母提取物;N7,蛋白胨;N8,对照Note:N1,Potassium nitrate;N2,Ammonium sulphate;N3,Beef extract;N4,Urea;N5,Ammonium dihydrogen phosphate;N6,Yeast extract;N7,Peptone;N8,CK
2.5 杀菌剂对细极链格孢(A. tenuissima)菌丝生长的影响
由表3可知,5种杀菌剂对引起黑龙江省细绿萍黑腐病的细极链格孢株的菌丝生长均表现出抑制作用,但不同药剂间的抑制作用有所区别。其中32.5% 苯甲·嘧菌酯的抑制作用最强,EC50值为0.001 2 μg·mL-1;30% 吡唑醚菌酯、30% 唑醚·戊唑醇和30% 噁霉灵次之,EC50值分别为 0.611 5,0.337 1和0.678 0 μg·mL-1;最后是50% 多菌灵,EC50值为4.187 0 μg·mL-1,抑制作用最弱。

表3 5种杀菌剂对链格孢菌(XLP1)菌丝生长的抑制效果Table 3 Inhibitive effect of 5 fungicides on mycelial growth of Alternaria tenuissima (XLP1) 单位:μg·mL-1
3 讨论
目前,关于细绿萍病害的报道相对较少,在国外已报到的引起满江红属致病菌主要以立枯丝核菌(Rhizoctoniasolani)为主,在印度、伊朗和韩国引起黑腐病、褐斑病和褐腐病。除此之外核盘菌(Sclerotiniasclerotiorum)和产黄镰孢菌(Fusariumthapsinum)也可引起满江红属病害,导致萍产量下降[24-28]。而在国内关于细绿萍病害的研究较少,李铁成[29]描述了细绿萍腐霉病的发病症状,并提出了防治细绿萍腐霉病的防治建议,但未鉴定病原菌种类及筛选防治杀菌剂。本研究利用形态学结合分子生物学的方法鉴定出引起细绿萍黑腐病的链格孢属病原真菌细极链格孢(A.tenuissima),这也是在国内首次报道。
目前,国内外有较多关于细极链格孢侵染而引起植物病害的研究报道,例如:能引起枣[30]和柿子[31]的黑腐病;魔芋(Amorphophallusbulbifer)[32]、刺五加(Acanthopanaxseuticosus)[33]、太子参(Pseudostellariaheterophylla)[34]等多种植物的叶斑病。在不同植物中提取的病原菌,其生物学特性也有所区别,细极链格孢的生长和繁殖受外界多种环境因素的影响较大,其中最重要的是温度、pH和碳源、氮源等营养物质。本研究表明引起细绿萍黑腐病的细极链格孢菌丝生长最适温度均为25℃,这与张建强等[35-36]研究结果一致。尚晓静等[37]认为,细极链格孢在15℃时产孢量最高。而本研究中,细极链格孢在25℃时产孢量达到最高,表明细绿萍黑腐病病菌孢子耐高温能力可能有所提升。不同寄主来源的细极链格孢菌株具有不同的酸碱适应范围,尚晓静等[37]在研究树莓细极链格孢的生物学特性时发现,菌丝最适生长pH值为11.0。赵晓霞等[30]报道赞皇枣细极链格孢在pH值10.0时产孢量最大。而在本研究中细绿萍细极链格孢的最适菌丝生长和产孢pH值为均为7.0。这表明细绿萍细极链格孢具有较宽的适应范围,能在强酸强碱环境条件下活跃生长,这与孟婷婷等[36]报道的结果一致。细极链格孢可以利用多种碳源、氮源,但在不同寄主上的最适碳源和氮源不同,枸杞细极链格孢能较好的利用甘露醇[38],在氮源的选择上能较好的利用硝酸钾,这与本研究的结果一致,细极链格孢菌丝生长表现为对有机氮和硝态氮的有效利用更好,而对铵态氮的利用效率低。而树莓细极链格孢的最适碳源、氮源分别为麦芽糖和半胱氨酸[36],芹菜细极链格孢的最适生长碳源为玉米粉[35],与本研究结果不同。造成这种差异的原因可能与病原菌的寄主和地理来源不同有关,且与研究人员所选择的碳源和氮源不同相关。
目前没有对细绿萍黑腐病防治的报道,通过我们对细极链格孢室内毒力测定结果表明,供试5种杀菌剂均具有较好的抑制效果,其中32.5%苯甲·嘧菌酯抑菌活性最强。袁慧君[39]对梨黑斑病致病菌链格孢(A.tenuissima)的研究发现,苯甲·嘧菌酯的抑菌效果最好;杨瑾等[40]在研究常见农药对丹参茎基腐病病原菌细极链格孢抑菌效果时发现,吡唑醚菌酯和戊唑醇的抑制菌丝生长的效果最好。张建强等[41]筛选针对芹菜叶斑病病原菌细极链格孢药剂发现,甲霜灵对细极链格孢菌丝和孢子的抑制效果都是最好的。以上结果均与本试验结果一致。我们建议苯甲·嘧菌酯作为防治细极链格孢的首选药剂,为了防治长期使用单一药剂导致病原菌产生抗性,其余药剂可以作为备选交替使用,对该病害的田间化学防治效果需要进行进一步验证。
4 结论
本文通过采集典型发病地的病样进行病原菌的分离并鉴定,确定引起细绿萍黑腐病的病原菌为黑霉科链格孢属的细极链格孢(A.tenuissima)。研究结果表明,利于细极链格孢菌菌丝生长的条件:全黑暗条件、25℃、培养pH 7.0、丙三醇碳源、硝酸钾氮源。利于细极链格孢菌菌丝产孢的条件:全黑暗条件、25℃、培养基pH 7.0、甘露醇碳源、酵母浸膏氮源。在CMA培养基上细极链格孢菌菌丝生长速度较快,在PSA培养基上产孢量最大。细极链格孢菌在多种培养基上均可以生长、产孢,可利用多种碳源、氮源,对温度的适应性较好,能够适应不同的酸碱环境。防治细绿萍黑腐病可选用苯甲·嘧菌酯,而吡唑醚菌酯、唑醚·戊唑醇和噁霉灵作为备选药剂。

