面部婴儿纤维瘤病诊治1例病例报道
孙露瑄 周福亭 王立山 张 政 张祖训
作者单位:261053 山东第二医科大学口腔医学院(孙露瑄、张政、张祖训);潍坊市人民医院口腔颌面外科(周福亭、王立山)
婴儿纤维瘤病(infantile fibromatosis, IFM)由Stout 于1954 年首次证实和描述为独立性疾病[1],是一种罕见的非转移性但有局部侵袭性的成纤维母细胞增生性疾病,属于中间性肿瘤。IFM 多发生在头颈部、肩部、上臂、大腿,其中以头颈部的舌、下颌和乳突部多见,发生于鼻部者罕见,伴有局部浸润和破坏[2]。切除不彻底会复发,但不转移。其发病率约为0.02%~0.04%[3],目前发病原因及机制尚不清楚,故诊断和治疗仍然是临床医生所面临的挑战。本文对1例IFM患者的诊治报道如下。
一、病例资料
患儿,男性,10 个月,2022 年9 月16 日因“左侧面部肿物20 天”就诊于潍坊市人民医院口腔颌面外科。患儿家长述20 天前发现患儿左侧鼻旁一肿物,约“花生米”大小,无疼痛、瘙痒等不适症状(图1),未行任何治疗,来诊。
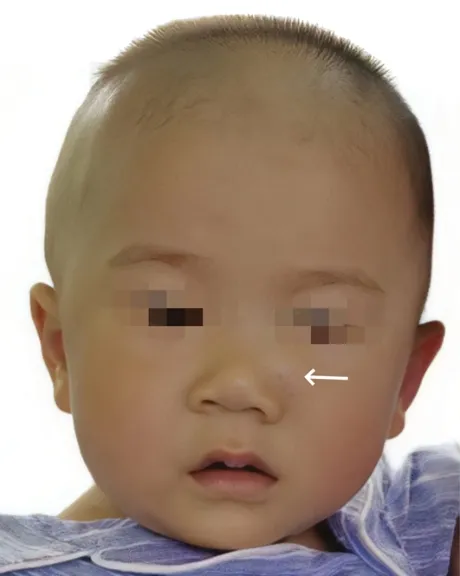
图1 术前肿物照片
专科检查:患儿左侧鼻翼至鼻根部见圆形隆起,可扪及一肿物,约2.0 cm×1.5 cm×1.0 cm,质韧,有弹性,边界清,表面皮肤颜色正常,活动度较差,双侧颏下、颌下及颈部未触及肿大淋巴结。患儿足月顺产,既往体健,家族史和系统检查无特殊。
辅助检查:局部体表肿物彩超检查报告示左侧鼻翼低回声包块,纤维瘤不除外。鼻骨CT平扫检查示左侧上颌骨鼻骨根部见一类圆形软组织密度影,密度较均匀,CT 值约25HU 左右,最大横截面积约1.5 cm×1.0 cm,边界清晰,邻近骨质结构受压变薄呈蛋壳样改变,同侧鼻泪管受阻,邻近鼻窦内未见明显异常。诊断意见:左侧上颌骨局部膨胀性骨质破坏,考虑良性病变,骨囊肿?(图2),初步诊断为:左侧面部脂肪瘤?
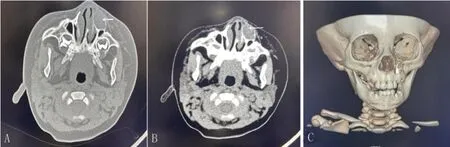
图2 A、B:术前见肿物为类圆形软组织密度影,密度均匀,边界清晰;C:局部骨质结构受压破坏
治疗:因肿物位置偏上,且CT 显示伴有局部骨质破坏,不能明确肿物性质,为保证完整摘除肿瘤,术前与患儿家属沟通手术切口方案,患儿家属最终选择行口外切口切除,交代相关手术风险后于2022年9月19日进行手术治疗。术中于鼻面沟处沿皮肤皮纹方向行纵行切口,见肿物位于肌层深面,肿物表面光滑,无明显包膜,质地较韧,边界较清,肿物下方骨面光滑呈圆坑状(图3),将肿物完整摘除后用可吸收缝线行皮内缝合,肿物进行病理检查。患儿术后愈合良好,住院1 周后出院。截至2023 年8 月6日,患儿术后10 个月原发部位未见复发及转移,无其他不适症状。
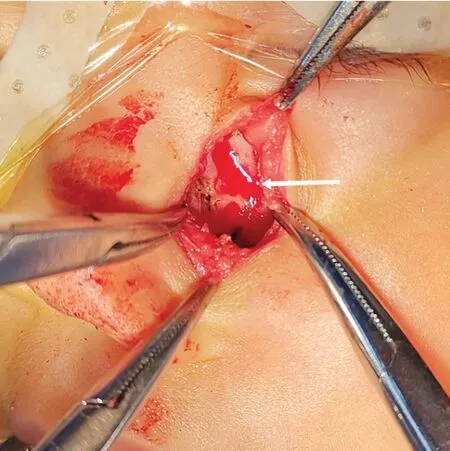
图3 术中肿物摘除后见局部骨质破坏
病理检查:
肉眼可见:灰白结节1枚,体积2.0 cm×1.5 cm×1.5 cm,切面灰白、质中,表面覆囊壁样组织,面积2.2 cm×1.5 cm,壁厚0.1cm(图4)。
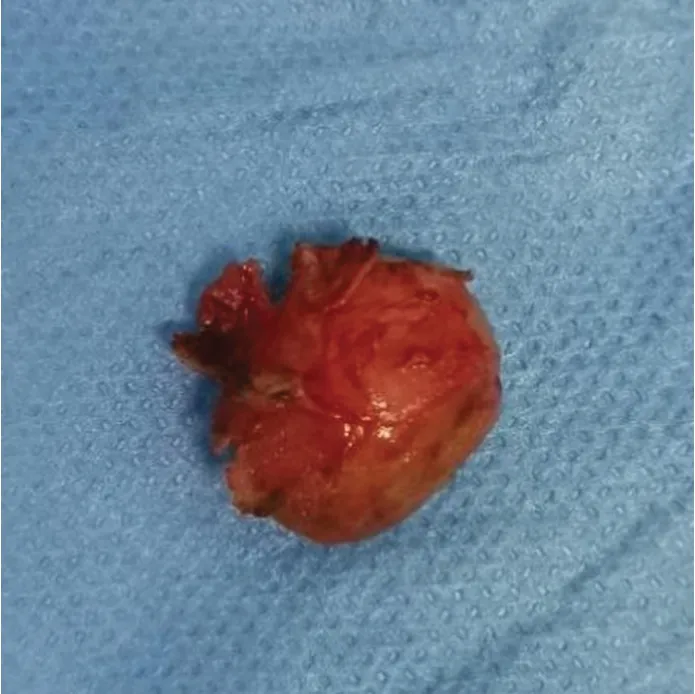
图4 肿物完整摘除后照片
病理检查结果显示:(左侧面部肿物)结合免疫组化及FISH 检测结果符合婴儿纤维瘤病,局部累及周围骨组织,体积2.0 cm×1.5 cm×1.5 cm(图5)。免疫组化结果:Beta-catenin(细胞核及浆+),Calponin(部分+),vimentin(+),S-100(-),CD34(血管+),SOX10(-),stat6(-),SMA(-),CD68(-),Ki-67(index 5%)(图6)。
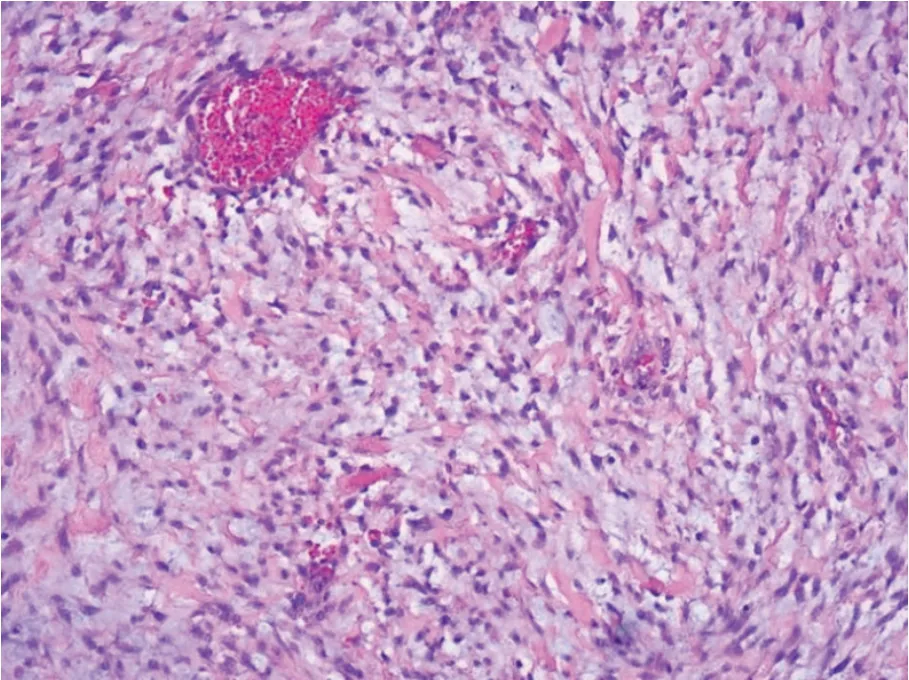
图5 肿瘤细胞由小卵圆形及短梭形细胞组成,间质内含较多的黏液样物质,红染的胶原散在分布于间质内(HE×200)
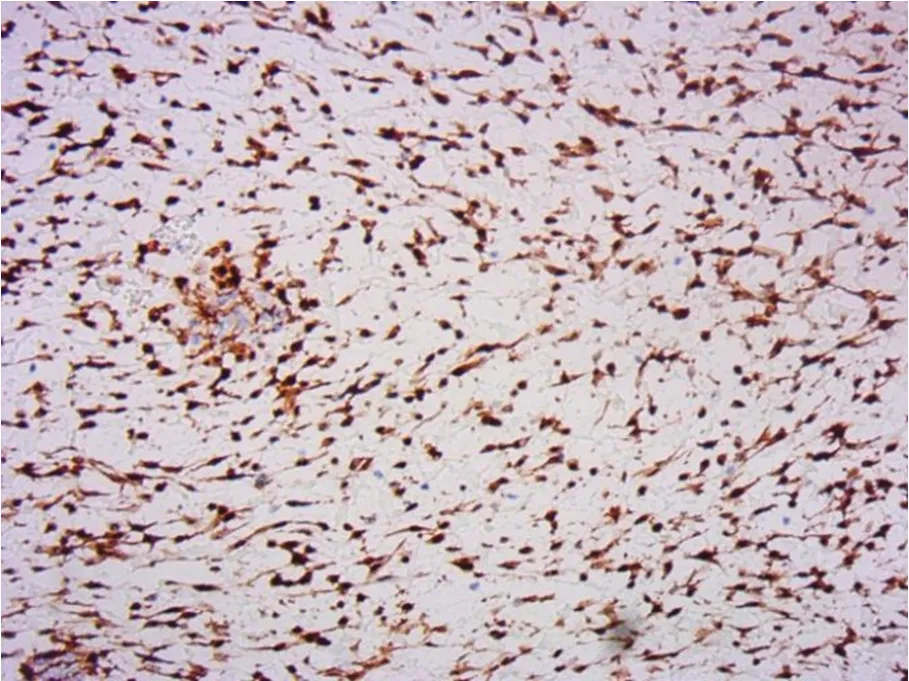
图6 Beta-catenin细胞核及浆阳性(HIC×200)
FISH 检测结果:USP6 断裂信号比值为12%,小于阈值15%,提示USP6 未发生断裂,排除结节性筋膜炎可能。
最终病理诊断为:婴儿纤维瘤病。
二、讨论
1.病因
婴儿纤维瘤病(IFM)多数发病均在8 岁以前,2岁以内婴幼儿多见,也有报道为先天性IFM 病例[3],男性略多见。目前发病原因尚不清楚,Janahi 认为可能是由雌激素水平改变或药物引起的[4],Flacke则认为其可能与创伤有关系[5],或者是与遗传因素有关,家族性腺瘤性息肉病患者此病发生率较高[6],但目前均尚未有确切证据证实。
2.临床表现
IFM 多数起源于骨骼肌,特别是头部和颈部的肌肉(34%)、肩膀和上臂(32%)、躯干(18%)和大腿(16%)[7]。其中在头颈部,舌、下颌骨、上颌骨尤为好发。口腔、鼻腔和鼻窦的原发性受累率较低,但有文献中报道头颈部病变浸润更迅速、更广泛,发生于口腔、鼻腔和鼻窦等部位更具破坏性和致死率[8]。IFM临床表现为生长较为迅速的侵袭性肿块,通常固定在皮下肌肉或骨骼。发展过程分为局部、多灶性或弥漫性,浸润扩散范围可远超其肿块生长边缘[4],侵及周围肌肉组织,并可围绕血管、神经生长,从而根据肿瘤大小及生长位置,导致压痛、触痛和功能障碍。如侵及关节囊时会导致挛缩及活动受限,肿瘤位置位于重要脏器时会造成生命危险,曾有文献报道1 例胸腔巨大婴儿纤维瘤病,侵犯胸腔、颈部及腋窝,手术难度及风险大大提高[9]。IFM 生长速度在发病初期较快,后续生长速度会逐步减慢,可能生长停滞[10],甚至可能自发缩小[11]。
3.辅助检查
在辅助检查方面,IFM 在过往病例报道中多采用彩超、CT 及MRI 为检查手段。但Kingston[12]分析对比多个病例后发现MRI可作为IFM 评估预后的首选影像检查方法。IFM 彩超多表现为均匀和低回声,CT 多表现为较为均匀软组织肿块,呈膨胀性生长,推挤周围结构[13],注射碘造影剂后明显,但增强程度各不相同,大多数病灶表现为不均匀的造影剂吸收,多用来帮助确定骨破坏程度[12]。两者均无明显特征性表现,但是IFM 的MRI 成像信号特征具有相对特征性,可以反映细胞、组织含量的差异,以纤维母细胞成分为主的区域,T2WI 为稍高信号,以纤维细胞和胶原纤维成分为主的区域,T2WI为中等信号[6]。Skapek[14]等发现术前化疗患者肿瘤细胞减少,胶原蛋白含量增加。IFM 组织学改变伴随着MRI成像信号的改变,通过MRI 连续成像可以评估肿瘤大小及组成的变化,对评估疾病预后也起到一定参考作用,对临床诊断及指导外科手术治疗具有重要意义。在本病例中由于对IFM 的临床诊断经验不足,患儿术前仅拍摄彩超及CT,后续患儿复查时作者会进一步拍摄MRI来进行评估预后。
4.组织病理
在组织病理学上,IFM 大体而言,肿瘤为质地较韧、边界不清、灰白色瘢痕样实性组织,直径为1~10 cm,无包膜,附带部分受累的肌肉和皮下脂肪。显微镜下,IFM 形态学变化很大,反映了成纤维细胞的不同分化阶段。最常见的类型是弥漫型,瘤细胞形态介于原始间叶细胞和成纤维细胞之间,常侵及邻近肌肉组织,多数病例可找到残留的肌纤维和脂肪组织,称为侵袭性婴儿纤维瘤病,很难与婴儿纤维肉瘤区分。另一种由束状排列的较成熟的梭形成纤维细胞组成,类似于成年型的韧带样纤维瘤病[15]。本病例符合前者。IFM 中,免疫组织化学检查结果中瘤细胞不同程度表达α-SMA、MSA、calponin、desmin 和Beta-catenin,通常不表达S-100 蛋白和CD34[16]。
5.鉴别诊断
IFM 通常需要与以下疾病相鉴别:①婴儿纤维肉瘤(Infantile fibrosarcoma, IFS):为IFM 最重要的鉴别诊断,多发生于出生后第一年,约1/3为先天性,主要发生于下肢远端,为生长迅速的无痛性肿块,可复发,极少转移,预后较佳[17]。二者肿瘤细胞均呈梭形,侵犯周围软组织并伴有淋巴细胞浸润,但IFM 细胞密度较低,无异型性,核分裂象少见,罕见出血、坏死。遗传学检测IFS 会出现染色体易位改变,免疫组化瘤细胞主要表达vimentin[18]。②婴幼儿肌纤维瘤/肌纤维瘤病(infantile myofibromatosis, IM):隐形常染色体疾病[19],发生于皮肤、软组织或骨的孤立性或多发性结节状病变,可伴有内脏受累,多见于2 岁以内婴儿,60%为先天性,有家族性发病史。IM 由肌成纤维细胞排列成短束状或者旋涡状结构,常形成肌样旋涡或结节,中心常伴坏死及血管外皮瘤样结构[20]。③婴儿纤维性错构瘤(fiberoushamartoma of infancy, FHI)表现为真皮深层或皮下的孤立性结节,质地较坚实,但部分皮损与其下的筋膜或肌肉粘连而固定,也可表现为明显突出皮面的斑块,由原始间叶细胞和肌成纤维细胞条束和成熟脂肪组织组成特征性“器官”样结构[21]。IFM 有时也需与脂肪瘤、血管瘤、胚胎性横纹肌肉瘤及神经纤维瘤等鉴别。
6.治疗
目前对于IFM 患者的治疗,仍然缺乏明确的治疗指南或者专家共识,各病例报道中提出的治疗方案均以手术扩大切除为主,如果切缘为阳性会导致复发率升高[22]。当肿瘤因位于重要的解剖结构处或处于病变晚期而无法切除时,建议使用化疗和放疗等辅助治疗[3]。Skapek[14]报道过安全有效的化疗方案,几乎没有急性毒性或晚期效应,可以有效地控制无法切除的肿瘤生长或在术前缩小肿瘤体积,但是单独化疗不能治愈,需同时结合整体广泛切除。放疗一般应用于无法手术的患者[23],对切除病变后的复发控制可能也有效。但是放疗和化疗均对婴儿的生长发育会造成一定的影响,所以并不作为常规的治疗方法。本病例由于临床医生对此疾病认识不足,未进行术中快速病理,这将对今后临床工作提出警示。
7.预后
IFM 属于中间性肿瘤,不发生远处转移,但具有侵袭性,不易切净,且继续以进行性浸润的方式生长,故局部复发率高。据Wilkins 报道,头颈部的IFM 浸润速度更快,范围更广,复发率更高,这可能与手术治疗时头颈部复杂的解剖结构相关[24]。Masson[25]也曾做过统计,发现头颈部IFM 患者的复发率为70%,而其他部位的病变复发率仅为50%。复发的风险不是由组织学特征决定的,而是由病变的解剖位置、患者的年龄和治疗方式决定的。Pontes[3]和唐艳[16]在影响预后因素方面观点较为一致,认为手术切除术后边缘状况是唯一有参考意义的预后指标。约50%的肿瘤在局部广泛切除后复发,而不完全切除后的复发率为90%。Ruparelia[22]和Mannan[2]都认为术后第一年复发率最高,但Faulkner[26]等人报道,在术后复发病例中,5%的患者在初次切除后1 年内复发,而90%的患者在3 年内复发,文献报道复发病例中,术后最长复发时间为第5 年。所以由于IFM 进展迅速,复发率高,必须对患者进行定期临床检查及MRI扫描。本病例截至术后10个月无明确复发迹象。
综上,IFM 为一种侵袭性强,局部易复发但不发生转移的中间性肿瘤,发病率低,好发于头颈部、肩部及四肢等,其临床表现无明显特异性,临床上确切诊断局限在术后病理检查,目前手术广泛完整切除为该病首选治疗方法。IFM 预后主要取决手术切缘状况,术后可定期通过MRI 等检查手段追踪复发情况。
IFM 作为临床上一种较为罕见的疾病,国内外对其发病机制、病理表现、治疗方法及预后等问题至今仍缺乏全面的认知,需要收集更多的病例进一步研究,通过对本例患儿的病例分析,加强对该病的了解和认识,帮助临床医生进行更加有效的诊断和治疗。

